24 квітня, 2021
Постковідний синдром: ренесанс карнітину?
 Пандемія, спричинена SARS-CoV‑2, що вже понад рік триває на планеті, стала чи не найсерйознішим викликом для економіки та систем охорони здоров’я всіх без винятку країн земної кулі. Вже через досить нетривалий час після початку поширення пандемії стало очевидним, що SARS-CoV‑2 є не виключно тропним до респіраторної системи вірусом, а збудником, що зумовлює захворювання з погано прогнозованим перебігом і складним патогенезом, який характеризується посиленою імунною відповіддю, гіперкоагуляцією, мультизапальним процесом і мультиорганним ураженням.
Пандемія, спричинена SARS-CoV‑2, що вже понад рік триває на планеті, стала чи не найсерйознішим викликом для економіки та систем охорони здоров’я всіх без винятку країн земної кулі. Вже через досить нетривалий час після початку поширення пандемії стало очевидним, що SARS-CoV‑2 є не виключно тропним до респіраторної системи вірусом, а збудником, що зумовлює захворювання з погано прогнозованим перебігом і складним патогенезом, який характеризується посиленою імунною відповіддю, гіперкоагуляцією, мультизапальним процесом і мультиорганним ураженням.
Хоча більшість людей із COVID‑19 одужують і повертаються до нормального стану здоров’я, в суттєвої кількості пацієнтів можуть спостерігатися різноманітні симптоми, що тривають тижнями чи навіть місяцями після одужання від гострої стадії хвороби. Повідомлення про рецидиви симптоматики коронавірусної інфекції в пацієнтів, які значно впливають не тільки на їхню працездатність, а й навіть на виконання звичних соціальних і побутових функцій після перенесеної гострої фази, почали з’являтися ще навесні 2020 року; це спричинило інтенсивну дискусію в науковому медичному середовищі відносно причин цього феномена (досі невизначених) і шляхів його стратифікації. Наразі, за даними статистики Великої Британії, зафіксовано, що приблизно в 1 з 5 респондентів, які мали позитивний результат на COVID‑19 і одужали з лабораторним підтвердженням, симптоми залишаються впродовж 5 тиж або довше, а в 1 з 10 респондентів симптоми тривали впродовж 12 тиж або довше. У багатьох джерелах відзначається, що симптоматика після перенесеної COVID‑19 характеризується системністю проявів із залученням серцево-судинної, нервової, дихальної, шлунково-кишкової, сечовидільної та інших систем, є різноманітною, багатовимірною, непередбачуваною й циклічною з епізодичним хвилеподібним перебігом.
За допомогою серії досліджень, проведених у Франції, Данії та Швейцарії, було продемонстровано, що 30-54% пацієнтів, які перехворіли з легким перебігом гострої COVID‑19, продовжували відчувати постійну симптоматику впродовж 2-4 міс після одужання, з яких 50-76% доповідали про виникнення нової симптоматики, котру не відчували в гострій фазі, а 9% хворих характеризували цю симптоматику як дуже тяжку чи виснажливу. У жовтні 2020 року хворобливий стан після перенесеної COVID‑19 був внесений до Міжнародної класифікації хвороб (МКХ‑10) під кодом U09.9 у формулюванні «стан після COVID‑19 (post COVID‑19 condition)». Цей додатковий код використовується для статистичного запису більш раннього епізоду COVID‑19 (підтвердженого чи ймовірного), що впливає на стан здоров’я, в людини, котра більше не хворіє на COVID‑19.
Аналіз накопиченого на сьогодні масиву фактичних даних щодо перебігу коронавірусної інфекції дав світовому науковому медичному товариству змогу вже в грудні 2020 року визначитися з термінологією, виокремити клінічні форми довготривалої COVID‑19 і розробити перші науково обґрунтовані рекомендації з ведення таких пацієнтів. Національний інститут охорони здоров’я (NICE), Шотландська мережа міжвишівських настанов (SIGN) і Королівська колегія лікарів загальної практики (RCGP) Великої Британії розробили документ «Швидка настанова COVID‑19: управління довгостроковими наслідками COVID‑19», де вперше офіційно була запропонована базова термінологія.
У клінічній настанові розрізняють:
- гостру COVID‑19, ознаки та симптоми якої тривають упродовж 4 тиж;
- тривалу (чи довгу) COVID‑19 (long COVID) – термін, який зазвичай використовується для опису ознак і симптомів, які продовжуються чи розвиваються після гострої COVID‑19.
Тривала COVID‑19 включає постійний симптоматичний COVID‑19 (симптоматика триває від 4 до 12 тиж) і постковідний синдром – симптоми розвиваються під час або після гострого захворювання, наявні понад 12 тиж і не можуть бути поясненими альтернативними діагнозами. Саме цей пункт має набути чіткого розуміння лікарями-інтерністами під час установлення такого діагнозу, адже базовий рівень здоров’я кожного пацієнта є унікальним, а можливі причини продовженої симптоматики можуть бути найрізноманітнішими: розвиток ранніх і пізніх ускладнень гострої коронавірусної інфекції (міокардити, перикардити, енцефаліти, фіброз легень тощо), загострення хронічних захворювань, дебют нових захворювань за наявності схильності до них або реалізації факторів ризику, медикаментозні ураження органів тощо. Отже, діагноз постковідного синдрому встановлюється за підтвердженої відсутності цих альтернативних причин.
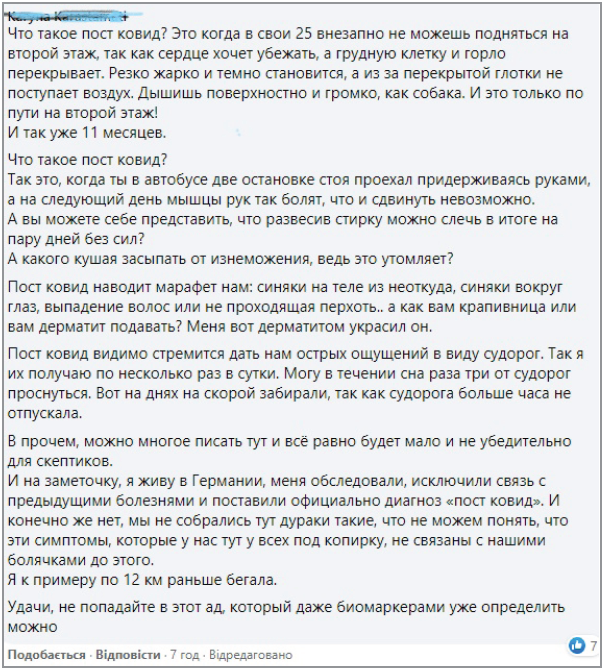
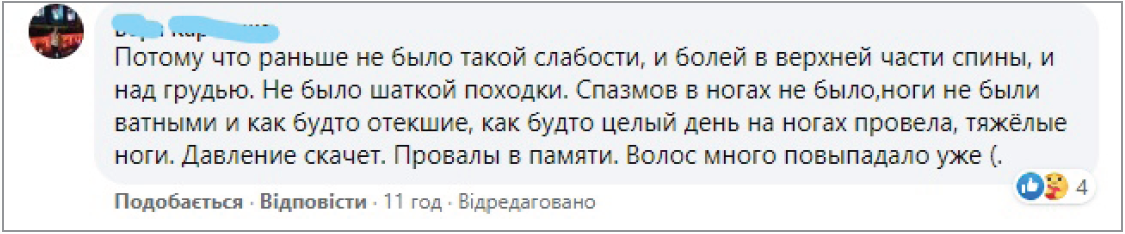
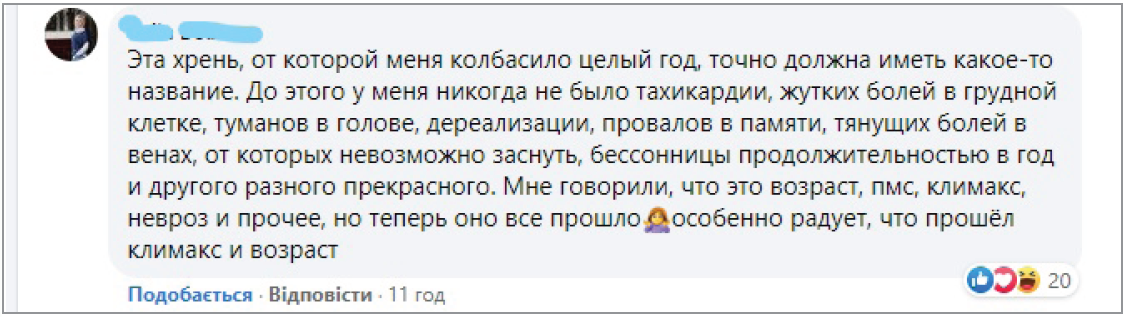
Достеменно наразі зафіксовано лише те, що тривалість й інтенсивність симптоматики парадоксально не залежать від тяжкості форми перенесеної гострої COVID‑19, симптоми дуже варіабельні, можуть зникати, а потім хвилеподібно повторюватися, спалахувати негайно чи розтягуватися на декілька діб, змінювати один одного чи з’являтися та тривати в різних комбінаціях, тобто вони непередбачувані, непослідовні та різноманітні. Крім того, визнається, що найстійкішими та найчастішими серед зазначених симптомів є втома, задишка та неврологічні симптоми – «мозковий туман» і порушення сну.
Визнаючи, що доказова база стосовно ведення й медикаментозного лікування пацієнтів із тривалою COVID‑19 є досі вкрай обмеженою, в клінічній настанові NICE, SIGN і RCGP запропоновано лише загальні підходи до медичного менеджменту таких пацієнтів з акцентом на мультидисциплінарний підхід і соціальну підтримку; рекомендовано проводити цим пацієнтам фізичну реабілітацію та когнітивну терапію.
Отже, наразі констатується складність нової проблеми, що постала перед медичними системами всіх країн, вирішувати котру доведеться в умовах доведеної медичної інформації (обмеженої відповідно до незначного часу для проведення якісних досліджень), цінність якої змінюватиметься в міру виявлення нових фактів. Дійсно, надзвичайна різноманітність і непередбачуваність симптомів за тривалої COVID‑19 формально потребує традиційної для нашої країни поліпрагмазії, котра через очевидні причини є вкрай небажаною. Ймовірно, що ключ до вирішення цієї проблеми лежить у площині знань про зміни метаболізму клітин, уражених SARS-CoV‑2, особливо враховуючи вже відомі факти, що люди з порушеною толерантністю до глюкози (діабетом 2 типу чи метаболічним синдромом) мають більший ризик розвитку як тяжчого перебігу гострої інфекції, так і виникнення її ускладнень.
Віруси – це внутрішньоклітинні паразити, що використовують метаболічні механізми господаря для задоволення своїх біосинтетичних потреб, зокрема для власної проліферації. Що стосується сімейства коронавірусів, то відомо, що всі вони використовують внутрішньоклітинні мембрани клітин хазяїна для утворення нових компартментів, відомих як подвійні мембранні везикули (ПМВ), для ампліфікації вірусного геному. ПМВ – мембранні структури, котрі містять не лише вірусні білки, а й певний набір викрадених біохімічних речовин; зокрема, коронавіруси мобілізують ліпіди й організовують унікальне ліпідне мікросередовище, оптимальне для власної реплікації. За допомогою серії нещодавніх досліджень доведено, що ключовим ферментом, який переробляє ліпіди хазяїна для підтримки життєдіяльності коронавірусів, є фермент цитозольної фосфоліпази A2α, який був тісно пов’язаний з утворенням ПМВ і реплікацією коронавірусів. Такі факти порушень ліпідного обміну були виявлені й під час попередніх досліджень метаболізму пацієнтів із SARS-CoV. Але ще важливішим є те, що в заражених клітинах відбувається не лише споживання ліпідів уражених вірусом клітин як будівного матеріалу. У нещодавніх дослідженнях метаболоміки пацієнтів із коронавірусною інфекцією було продемонстровано, що вірус буквально перепрограмовує клітини хазяїна на отримання енергії переважно шляхом анаеробного гліколізу, блокуючи аеробні шляхи окислення як глюкози, так і жирних кислот, порушуючи в такий спосіб мітохондріальне дихання; це, з одного боку, енергетично обкрадає уражену клітину, з іншого боку, – спричиняє реплікацію вірусу SARS-CoV‑2 та виробленню цитокінів.
Розглядаючи в такий спосіб через призму порушень енергетичного обміну різноманітність симптомів постковідного синдрому, найстійкішими та найвиснажливішими з яких визнаються знесилення, втома та задишка, високоймовірним стає те, що нормалізація ліпідного обміну, зокрема обміну жирних кислот, стає перспективним патогенетичним напрямом його лікування. У метаболомному дослідженні T. Thomas, D. Stefanoni та співавт. (2020) продемонстровано, що в усіх 33 пацієнтів із COVID‑19 спостерігалися однотипні порушення – збільшення рівнів практично всіх типів вільних жирних кислот паралельно зі зменшенням кількості всіх коротко- та середньоланцюгових ацилкарнітинів, необхідних для їхнього окисного метаболізму з утворенням АТФ, що дає змогу припустити можливу роль індукованого вірусом дефіциту карнітину як щонайменше одного з ключових чинників перебудови енергетичного метаболізму клітин хазяїна, а препарати L-карнітину розглянути як патогенетичні, зокрема при лікуванні постковідних станів. Варто зазначити, що порушення ліпідного обміну та зниження рівнів карнітинів спостерігалися й у метаболомному дослідженні пацієнтів навіть через 12 років після перенесеної пневмонії SARS – першого коронавірусного захворювання, з яким зіткнулося людство у 2002 році.
L-карнітин є умовно незамінною поживною речовиною, головним кофактором і регулятором метаболізму жирних кислот у міокарді, печінці та скелетних м’язах, єдиним носієм довголанцюгових жирних кислот у мітохондрії, де відбувається їхнє β-окислення; в умовах нормального кисневого забезпечення він переводить метаболізм клітин на окислення жирних кислот як найбільш енергоємного субстрату, а вже в умовах гіпоксії виводить токсичні метаболіти жирних кислот із мітохондрій, переводячи метаболізм клітини на окислення глюкози та здійснюючи в такий спосіб антигіпоксичну дію. Рівень карнітину в організмі забезпечується за рахунок ендогенного синтезу та надходження з їжею (найбільша його кількість міститься в червоному м’ясі та м’ясних субпродуктах); в організмі він синтезується переважно в печінці та нирках з амінокислот лізину та метіоніну за участю вітамінів групи В, а також іонів заліза, звідки в готовому вигляді транспортується до інших органів і тканин.
Пероральна та внутрішньовенна форми L-карнітину офіційно затверджені Управлінням із контролю якості продуктів харчування та лікарських засобів США (FDA) як протокольне лікування первинного та вторинних дефіцитів карнітину в результаті вроджених помилок метаболізму та в пацієнтів із кінцевою стадією ниркової недостатності, котрі потребують гемодіалізу. Клінічна ефективність цього препарату потужно вивчалася впродовж останніх десятиліть при різних патологіях; безсумнівною перевагою в аспекті постковідного синдрому можна вважати плейотропність клінічних ефектів L-карнітину, що дасть можливість керувати різноманітною симптоматикою за допомогою лише однієї молекули, уникаючи в такий спосіб небажаної поліпрагмазії. У рандомізованому подвійному сліпому плацебо-контрольованому двофазному дослідженні фізичної та психічної втоми, а також когнітивних функцій у 70 сицилійців віком 100-106 років була продемонстрована клінічна ефективність, безпечність і хороша переносимість дози 2 г/день, яку вони приймали впродовж 6 міс (із додатковим 6-місячним моніторингом). Добавки з L-карнітином зумовили покращення біохімічних показників ліпідного обміну, достовірне збільшення загальної м’язової маси, зменшення фізичної втоми після 6-хвилинного тесту на ходьбу, психічної втоми, ступеня тяжкості втоми, покращення показників оцінки повсякденного життя. Схожі результати надало інше рандомізоване контрольоване дослідження цих самих авторів, проведене за участю 96 пацієнтів молодшої вікової групи (74-88 років). Подвійне сліпе багатоцентрове дослідження (Rossini M., Di Munno O. et al., 2007), яке включило 102 пацієнтів із фіброміалгією різного генезу, довело, що прийом L-карнітину 1500 мг/добу впродовж 10 тиж спричинив статистично значуще (порівняно з групою контролю) покращення характеристик м’язово-скелетного болю та депресії. Рандомізоване плацебо-контрольоване дослідження (n=47) у тайванських пацієнтів з ІХС і щонайменше 50% стенозу однієї з основних коронарних артерій продемонструвало поліпшення біомаркерів окисного стресу, а також збільшення кількості антиоксидантних ферментів після 12 тиж прийому добавок із L-карнітином 500 мг 2 р/день. Ці дані базувалися на попередніх клінічних випробуваннях, які продемонстрували захисний ефект від вищих доз L-карнітину (щонайменше 2000 мг/добу) на серцевий обмін і функцію в пацієнтів з ішемічними захворюваннями міокарда. Серйозних побічних явищ не спостерігалося. На високому методологічному рівні був установлений і гепатопротекторний ефект карнітину в дозі 2 г/день. Так, у подвійному сліпому рандомізованому плацебо-контрольованому іранському дослідженні оцінювали потенційну користь додаткового перорального карнітину в запобіганні гепатотоксичності, спричиненої протитуберкульозними препаратами (n=182), доцільність якого була теоретично обґрунтована встановленими фактами значної поширеності дефіциту карнітину в пацієнтів із туберкульозом. Пацієнтам, які отримували схему протитуберкульозної терапії першого ряду за протоколом (ізоніазид, рифампін, етамбутол, піразинамід), рандомно призначали L-карнітин 2 г/день протягом 4 тиж або плацебо. Із 25% хворих, у яких розвинулися токсичні ураження печінки впродовж 2,5-річного періоду дослідження, лише 16,7% були в групі L-карнітину, тоді як 32,3% – у групі плацебо (p=0,049).
Відносно нещодавно була визнана додаткова роль карнітину в регуляції вуглеводного обміну та модуляції зв’язку між обмінами ЖК і вуглеводів: карнітин (а саме його похідний фермент – карнітин-О-ацетилтрансфераза) є своєрідним перемикачем окислення жирних кислот й окислення глюкози відповідно до енергетичних потреб клітин, що забезпечує їхню необхідну метаболічну гнучкість. Це підтверджується даними й рандомізованих клінічних досліджень: пацієнти з цукровим діабетом 2 типу, котрі отримували цю добавку, демонстрували вищий рівень поглинання глюкози в тканинах (аніж група плацебо), значніше та триваліше покращення показників маси тіла, індексу маси тіла, HbA1c, глюкози в плазмі натще, інсуліну в плазмі натще, ліпідів низької щільності, а метааналіз Ying Xu та співавт. (2017) засвідчив, що вираженість позитивних змін прямо корелювала з тривалістю лікування карнітином. В епілептології L-карнітин вважають стандартним антидотом при передозуванні препаратів вальпроєвої кислоти й основним засобом для корекції токсичної дії вальпроатів (гіперамоніємія, гепатотоксичність, психічні й когнітивні порушення). Відомо, що мозок людини в нормі містить високі концентрації ацетил-L-карнітину, що надає ацетильні фрагменти для синтезу нейромедіатора ацетилхоліну. Багатоцентрове рандомізоване подвійне сліпе плацебо-контрольоване клінічне дослідження ефективності ацетил-L-карнітину в пацієнтів із деменцією, пов’язаною з цереброваскулярною хворобою, проведене 2018 року в Південній Кореї, продемонструвало значне покращення показників когнітивної функції пацієнтів за Монреальською шкалою при 28-тижневому прийомі карнітину 1500 мг/добу за відсутності побічних реакцій. Проведене у 2015 році рандомізоване дослідження, котре охоплювало 65 жінок із фіброміалгією, продемонструвало, що доза L-карнітину 1500 мг/добу була ефективною й для купірування симптомів депресії. Чи не найкраще ефекти карнітину були досліджені при серцево-судинних хворобах. У 2013 році був здійснений метааналіз 13 контрольованих досліджень (n=3629) для визначення впливу L-карнітину на смертність, шлуночкові аритмії, стенокардію, серцеву недостатність і реінфаркт; зроблено висновок, що порівняно з плацебо чи контролем L-карнітин асоціюється зі зниженням смертності від усіх причин на 27%, зменшенням шлуночкових аритмій на 65% і зменшенням ангінозних симптомів у пацієнтів із гострим інфарктом міокарда на 40%.
Варто наголосити, що в аспекті коронавірусної інфекції критичним стає питання можливих негативних впливів використовуваних для її лікування препаратів на систему коагуляції. Дослідження H. Deguchi та співавт. (2015), що охопило 45 пацієнтів із венозними тромбоемболіями, виявило низькі рівні ацилкарнітинів у плазмі крові в пацієнтів із венозною тромбоемболією та продемонструвало, що ацилкарнітини мають антикоагулянтну активність, пов’язану зі здатністю зв’язувати й інгібувати фактор Ха.
Отже, при лікуванні пацієнтів із тривалою COVID‑19 L-карнітин у дозі 1000-1500 мг/добу можна розглядати як безпечний патогенетичний енергомодулювальний препарат, що має широкий спектр ефектів, які дадуть змогу керувати основними симптомами цього непередбачуваного та малодослідженого стану навіть як монотерапія.
В Україні зареєстрований лікарський засіб Тріметабол – пероральний розчин, який складається з DL-карнітину гідрохлориду та L-лізину гідрохлориду. 100 мл розчину містять 7,5 г DL-карнітину та 5,0 г L-лізину гідрохлориду, а отже, запропонована добова доза препарату міститься в складі 15-20 мл, які можуть бути розподілені на 2-3-кратний прийом. Наявність у розчині лізину (природного попередника для ендогенного синтезу діючої речовини карнітину) є перевагою цього засобу. Лізин – незамінна амінокислота, що не синтезується в організмі й обов’язково має надходити в достатній кількості з їжею. Ця амінокислота має одну з ключових ролей у протеїногенезі, еритропоезі, синтезі колагену та кісткової тканини.
У комплекті до флакона з розчином DД-карнітину та L-лізину також є окремий пакетик, який містить 350 мг ципрогептадину ацефілінату (метопіну) та найважливіші коферменти метаболізму ліпідів, білків і вуглеводів – вітаміни групи В: 600 мг піридоксину гідрохлориду (В6), 600 мг тіаміну гідрохлориду (В1), 20 мг ціанокобаламіну (В12). Ці добавки створюють додаткові можливості керування різнобарвною симптоматикою тривалої COVID‑19. Ципрогептадин (метопін) – широко відомий препарат, який стимулює апетит, тому найчастіше використовується в педіатрії в комплексному лікуванні дітей із недостатньою прибавкою маси тіла. Відомі й інші ефекти препарату, зокрема антигістаміновий (ципрогептадин є похідним піперидину, що належить до групи антигістамінних препаратів І покоління), антисеротоніновий (зумовлений неселективним блокувальним впливом) і М-холіноблокувальний; препарат чинить виражену спазмолітичну дію. Ці властивості зумовлюють його ефективність при захворюваннях біліарного та функціональних розладах шлунково-кишкового тракту як у дорослих, так і в дітей, які перебігають зі спастичним компонентом, зокрема при лікуванні хронічних закрепів. Отже, вміст саше доцільно додавати до основного розчину в разі домінування в пацієнтів із тривалою COVID‑19 симптомів функціонального розладу органів травлення та/або зниження апетиту, втрати ваги. Крім того, особливістю молекули ципрогептадину є ефективність у дозі 0,25-1,5 мг/кг/добу для профілактики появи та лікування мігренеподібних головних болів у підлітків і дітей, яка також може бути корисною за наявності цієї симптоматики в пацієнтів у постковідному періоді. Комбінований склад препарату Тріметабол дає суттєві можливості індивідуалізувати терапію пацієнтів із тривалою COVID‑19 з урахуванням різноманітності симптоматики та потреб базового рівня здоров’я.
Отже, беручи до уваги численні мультимодальні ефекти препарату Тріметабол, можна широко рекомендувати його для лікування такого виснажливого стану з непередбачуваною й різноманітною клінічною картиною, як тривала COVID‑19.
Медична газета «Здоров’я України 21 сторіччя» № 6 (499), 2021 р.