18 лютого, 2022
Пацієнт з артеріальною гіпертензією, цукровим діабетом і полінейропатією: в пошуках істини
 13-14 грудня в режимі онлайн минула науково-практична конференція «Кардіологічний пацієнт із коморбідністю та супутньою патологією: погляд експертів різних спеціальностей», у межах якої було представлено чимало цікавих і водночас непростих випадків діагностичного пошуку та вибору лікування пацієнтів із поєднаними захворюваннями. Керівник відділу клінічної діабетології ДУ «Інститут ендокринології та обміну речовин ім. В. П. Комісаренка НАМН України» (м. Київ), доктор медичних наук Любов Костянтинівна Соколова та лікар-невролог поліклінічного відділення ДУ «ННЦ «Інститут кардіології ім. М. Д. Стражеска» НАМН України» (м. Київ), кандидат медичних наук Іванна Леонідівна Ревенько розглянули клінічний випадок розвитку тетрапарезу в пацієнтки з цукровим діабетом (ЦД) 2 типу й артеріальною гіпертензією.
13-14 грудня в режимі онлайн минула науково-практична конференція «Кардіологічний пацієнт із коморбідністю та супутньою патологією: погляд експертів різних спеціальностей», у межах якої було представлено чимало цікавих і водночас непростих випадків діагностичного пошуку та вибору лікування пацієнтів із поєднаними захворюваннями. Керівник відділу клінічної діабетології ДУ «Інститут ендокринології та обміну речовин ім. В. П. Комісаренка НАМН України» (м. Київ), доктор медичних наук Любов Костянтинівна Соколова та лікар-невролог поліклінічного відділення ДУ «ННЦ «Інститут кардіології ім. М. Д. Стражеска» НАМН України» (м. Київ), кандидат медичних наук Іванна Леонідівна Ревенько розглянули клінічний випадок розвитку тетрапарезу в пацієнтки з цукровим діабетом (ЦД) 2 типу й артеріальною гіпертензією.
Пацієнтка С. 63 років, лікар, звернулася в клініку зі скаргами на виражену слабкість переважно в нижніх кінцівках, захитування та невпевненість під час ходьби, неможливість самостійно піднятися сходами. Також її турбували задишка при ходьбі, сухість у роті та відчуття спраги, підвищення артеріального тиску (АТ) до 170/90 мм рт. ст.
Анамнестичні дані
2010 р. – гіпертонічна хвороба.
2012 р. – ЦД 2 типу. Приймала глібенкламід, але рівень глюкози крові не контролювала.
2018 р. – змішаний зоб, еутиреоз.
2021 р. – за місяць до звернення в клініку стан пацієнтки став погіршуватися: поступово почала наростати слабкість у ногах, а згодом і руках. Через кілька тижнів вона вже не могла самостійно підійматися сходами. Протягом місяця схудла на 8 кг.
Попередній діагноз
Гіпертонічна хвороба ІІ стадії, ступінь 3. Гіпертензивне серце. Ішемічна хвороба серця, дифузний кардіосклероз, серцева недостатність ІІА. ЦД 2 типу середньої тяжкості, стан декомпенсації. Діабетична полінейропатія (ДПН) нижніх кінцівок. Змішаний зоб, еутиреоз.
Слабкість у кінцівках була розцінена як прояв ДПН. До госпіталізації пацієнтка приймала лізиноприл (нерегулярно), ацетилсаліцилову кислоту 75 мг/добу (нерегулярно), метформін 500 мг/добу.
Результати обстеження
Індекс маси тіла: 28,3 кг/м2.
Окружність талії: 96 см.
АТ офісний: 167/95 мм рт. ст.
Електрокардіографія (ЕКГ): ритм синусовий, регулярний, ознаки гіпертрофії лівого шлуночка, частота серцевих скорочень (ЧСС) – 74 уд./хв.
Ехокардіографія: аортосклероз; фіброз мітрального й аортального клапанів; концентрична гіпертрофія лівого шлуночка; систолічна функція лівого шлуночка задовільна.
Добовий моніторинг ЕКГ: синусовий ритм із ЧСС 59-72-90 уд./хв. Порушень провідності не виявлено.
Неврологічний статус
Вищі когнітивні функції не порушені. Черепно-мозкові нерви без патології. Тетрапарез, зниження м’язової сили в ногах – 3 бали, в руках – 4 бали. Сухожильні рефлекси з верхніх кінцівок різко знижені, а з нижніх кінцівок – майже відсутні. Гіпотрофія м’язів переважно в проксимальних відділах кінцівок. Симптом Говерса позитивний. Сенситивна атаксія. Зниження больової та значне зниження вібраційної чутливості в нижніх кінцівках. Описана симптоматика не відповідала класичній картині ДПН.
Лабораторні дані
Калій: 4,7 ммоль/л.
Натрій: 137 ммоль/л.
Глюкоза крові: 15,4 ммоль/л.
Холестерин загальний: 6,3 ммоль/л.
Холестерин ліпопротеїнів низької щільності: 4,12 ммоль/л.
Холестерин ліпопротеїнів високої щільності: 1,39 ммоль/л.
Тригліцериди: 1,71 ммоль/л.
Креатинін: 84 мкмоль/л.
Швидкість клубочкової фільтрації: 68 мл/хв.
Білірубін: 16 мкмоль/л.
АЛТ: 19 ОД/л.
АСТ: 10 ОД/л.
Глікований гемоглобін: 13,7%.
Креатинфосфокіназа: 50 Од/л.
Коагулограма: норма.
Антитіла до гангліозидів (IgG/lgM): низький титр автоантитіл до специфічного антигену. Результати не дають змоги зробити однозначний висновок про наявність демієлізувального захворювання.
Антитіла до SARS-CoV‑2: IgM – 0,25 МО/мл, IgG – 6,1 МО/мл.
Пацієнтка була впевнена, що не хворіла на COVID‑19. За тиждень до початку симптоматики відзначалися незначні респіраторні прояви, але ПЛР‑тест на SARS-CoV‑2 на той час виявився негативним. Утім, під час перебування в стаціонарі було виявлено антитіла до SARS-CoV‑2, що свідчить про перенесене в легкій формі захворювання.
Для виключення тетрапарезу центрального генезу було виконано відповідні візуалізаційні обстеження.
MPT головного мозку: картина характерна для поодиноких дрібновогнищевих змін (церебральна мікроангіопатія).
МРТ хребта: дегенеративно-дистрофічний процес хребта, протрузії міжхребцевих дисків, спондилоартроз у поперековому відділі хребта.
Для виключення можливого паранеопластичного процесу було виконано мультиспіральну комп’ютерну томографію органів грудної, черевної порожнин, малого таза з контрастуванням. Виявлено утворення правої частки щитоподібної залози (кіста?). Калькульозний холецистит. Конкременти лівої нирки.
Електронейроміографія (ЕНМГ)
Зміни свідчили про наявність сенсорно-моторної полінейропатії нижніх кінцівок аксонально-демієлінізувального характеру (за типом синдрому Гієна – Барре, враховуючи висхідний характер рухових порушень). Отже, результати ЕНМГ вказували на можливий синдром Гієна – Барре.
Консультативний висновок
Зважаючи на наявність ЦД та результати ЕНМГ, потрібно диференціювати ДПН і запальну демієлінізувальну полінейропатію (синдром Гієна – Барре).
Синдром Гієна – Барре є гострим автоімунним ураженням периферичної нервової системи, що швидко прогресує та виявляється у вигляді парестезій кінцівок, м’язової слабкості та/або периферичних паралічів. Зазвичай виникає через 1-3 тиж після перенесеного інфекційного захворювання, вакцинації, оперативного втручання, переохолодження, стресу. У 30% випадків причину встановити не вдається. Основними тригерами виступають вірус Епштейна – Барр, Mycoplasma pneumoniae, Campylobacter jejuni, цитомегаловірус, SARS-CoV‑2.
Синдром Гієна – Барре, асоційований із SARS-CoV‑2, зумовлений нейротропними властивостями вірусу. SARS-CoV‑2 здатен уражати центральну та периферичну нервові системи за рахунок як прямого впливу, так і автоімунної відповіді. Антигенна схожість оболонки вірусу зі структурними елементами нервів (мієлінова оболонка, аксон) зумовлює імунну відповідь за типом молекулярної мімікрії. Утворюються противірусні антитіла (АNТІ-GМ1), які здатні атакувати елементи нейрона.
Критерії діагнозу синдрому Гієна – Барре:
- двобічна периферична м’язова слабкість і гіпо-/арефлексія;
- монофазний характер перебігу з періодом прогресування від 12 год до 28 діб із подальшим плато;
- типова нейрофізіологічна картина захворювання;
- зміни ліквору: підвищення вмісту білка, цитоз >50 мононуклеарних клітин в 1 мкл;
- виключення інших причин.
У цієї пацієнтки симптоматика наростала протягом 4 тиж, після чого стан стабілізувався. Варто відзначити досить швидке наростання симптоматики, що не характерно для ДПН. На думку про синдром Гієна – Барре також наштовхувала перенесена COVID‑19, про що свідчить наявність антитіл проти вірусу SARS-CoV‑2.
Діагноз уточнений
Синдром Гієна – Барре (гостра запальна демієлінізувальна полінейропатія), тетрапарез, атаксія, порушення ходи. Гіпертонічна хвороба II стадії, ступінь 3. Гіпертензивне серце. Ішемічна хвороба серця, дифузний кардіосклероз, серцева недостатність ІІА. ЦД 2 типу середньої тяжкості, стан декомпенсації. ДПН нижніх кінцівок. Змішаний зоб, еутиреоз.
Скорегована терапія:
- валсартан/амлодипін (Діфорс) 160/5 мг/добу;
- розувастатин (Клівас) 10 мг увечері;
- бісопролол (Конкор) 2,5 мг/добу;
- глімепірид 4 мг;
- метформін (Глюкофаж) 1000 мг 2 р/добу;
- дапагліфлозин 10 мг 1 р/добу;
- бенфотіамін 1 таблетка на добу;
- тіоктова кислота (Тіокт Q10) 800 мг/добу;
- плазмаферез 40 мл/кг № 5.
Обґрунтування терапії
Доведену ефективність у лікуванні синдрому Гієна – Барре мають високооб’ємний плазмаферез і високодозова внутрішньовенна імунотерапія з використанням імуноглобуліну людини класу G. Кортикостероїди при гострій запальній демієлінізувальній нейропатії неефективні. Тому пацієнтці було вирішено призначити плазмаферез.
До складу продукту Тіокт Q10 входить тіоктова кислота (800 мг), ацетил-L‑карнітин (500 мг), коензим Q10 (25 мг), які забезпечують синергічний позитивний вплив на метаболізм і стан нервових волокон.
Добре відомо, що тіоктова кислота входить до стандартів лікування пацієнтів із ДПН. Однак згодом виявилося, що вона має універсальні нейропротекторні властивості, які зумовлюють її ефективність у лікуванні нейропатій і аксонально-демієлінізувальних захворювань будь-якого генезу.
На сьогодні доведено, що тіоктова кислота зменшує перекисне окислення ліпідів у периферичних нервах, покращує ендоневральний кровоток, збільшує швидкість проведення нервового імпульсу, сприяє утилізації глюкози в м’язах, відновлює температурну, вібраційну та больову чутливість, знижує вираженість больового синдрому.
Ацетил-L‑карнітин стимулює синтез нейромедіаторів, активізує використання жирів для покращення енергетичного забезпечення нейронів, покращує роботу імунної системи, активує виведення токсинів з організму.
Своєю чергою, коензим Q10 покращує ендотеліальну функцію, стимулює периферичну циркуляцію.
Пацієнти, які приймають препарати тіоктової кислоти, часто скаржаться на гастроінтестинальні розлади внаслідок подразнення слизової оболонки шлунка, що зменшує прихильність до лікування та погіршує його ефективність. Цього недоліку позбавлений Тіокт Q10, до складу якого входить запатентована форма тіоктової кислоти контрольованого вивільнення.
Проміжні результати лікування
Приблизно через тиждень від початку скорегованої терапії пацієнтка відчула певне покращення. Збільшилася м’язова сила, з’явилася впевненість під час ходьби. На тлі лікування нормалізувалися рівні АТ і холестерину. Проте досягти компенсації глікемічних показників так і не вдалося, у зв’язку з чим пацієнтку було направлено на консультацію до ендокринолога.
Консультація ендокринолога
Відомо, що з 2012 р. пацієнтка хворіє на ЦД 2 типу. Протягом 10 років приймала глібенкламід, глікемію не контролювала.
За останній місяць хвора схудла на 8 кг. Можливою причиною різкої втрати ваги є декомпенсація ЦД. Не слід забувати про можливий негативний вплив SARS-CoV‑2 на перебіг діабету. Відомо, що цей вірус здатний уражати β-клітини підшлункової залози з наступним розвитком автоімунного процесу. На виражену декомпенсацію захворювання вказують і лабораторні показники: глюкоза крові – 15,4 ммоль/л, глікований гемоглобін – 13,7%.
При госпіталізації було встановлено діагноз ЦД 2 типу середньої тяжкості, стан декомпенсації; ДПН нижніх кінцівок. Пацієнтка отримувала метформін у дозі 500 мг/добу. Це занадто низька доза метформіну, яка в дорослих пацієнтів для тривалого лікування взагалі не має використовуватися. 500 мг метформіну призначають лише для стартової терапії, щоб оцінити переносимість препарату. Якщо відсутні розлади з боку шлунково-кишкового тракту, дозу потрібно збільшити до ефективної. У більшості випадків це 2000 мг/добу.
Зважаючи на вираженість декомпенсації діабету, можна припустити, що лише пероральна цукрознижувальна терапія не дасть змоги забезпечити потрібного ефекту. У цьому випадку варто призначити тимчасову (або навіть постійну) ін’єкційну терапію.
Найперше пацієнтці було призначено Глюкофаж XR – метформін пролонгованого вивільнення, що приймається лише 1 р/добу. Як ін’єкційну цукрознижувальну терапію було запропоновано фіксовану комбінацію аналога інсуліну тривалої дії з агоністом рецепторів глюкагоноподібного пептиду‑1 (арГПП‑1).
Враховуючи тривалість діабету та виражену декомпенсацію захворювання, в пацієнтки відзначається ДПН. Це описовий термін клінічного або субклінічного ураження нервової системи, яке розвивається на тлі ЦД при виключенні інших причин розвитку периферичної нейропатії; виявляється симптомами з боку соматичної та/або вегетативної нервової системи (San Antonio Consensus Statement, 1988, BООЗ). Для підтвердження діагнозу ДПН потрібно обов’язково виключити інші причини полінейропатії.
Диференційна діагностика ДПН
Алкогольна полінейропатія. Біохімічний аналіз крові. Ультрасонографія органів черевної порожнини. Наявність алкогольної дистрофії печінки, інших проявів із боку нервової системи: алкогольна енцефалопатія/мієлопатія/полірадикулонейропатія.
Полінейропатія за автоімунних захворювань. Імунологічні дослідження крові. Автоімунні захворювання в анамнезі. Клініко-лабораторні ознаки цих захворювань.
Полінейропатія за дефіциту вітаміну В12. Визначення рівня вітаміну В12 у крові. Низька концентрація цього вітаміну в сироватці. Можливе поєднання з макроцитарною мегалобластною анемією.
Полінейропатія за інших метаболічних порушень (гіпотиреоз, гіпертиреоз, ожиріння). Аналіз крові на гормони щитоподібної залози. Ультразвукове дослідження (УЗД) щитоподібної залози. Клініко-лабораторно-інструментальні ознаки цих захворювань.
Паранеопластичні синдроми. Результати інструментальних досліджень, які вказують на наявність онкологічного процесу.
Запальні демієлінізувальні полінейропатії (поствакцинальні, після перенесеної гострої інфекції). ЕНМГ. Аналіз ліквору. Біопсія n. suralis.
Спадкові полінейропатії. Дослідження в лабораторіях молекулярно-генетичного профілю. ЕНМГ. Сімейний анамнез. Клініко-лабораторні ознаки того чи іншого спадкового захворювання.
Полінейропатії за екзогенних інтоксикацій (свинець, миш’як, фосфор та ін.). Аналізи крові та сечі на наявність токсичних речовин. Клініко-лабораторні ознаки тієї чи іншої інтоксикації.
Полінейропатії за ендогенних інтоксикацій (хронічна печінкова/ниркова недостатність). Біохімічні аналізи крові та сечі. УЗД та/або МРТ органів черевної порожнини й нирок. Клініко-лабораторно-інструментальні ознаки хронічної печінкової/ниркової недостатності.
Полінейропатія при інфекціях (сифіліс, лепра, ВІЛ, бруцельоз, герпес, дифтерія та ін.). Аналіз крові на наявність певних інфекцій. Клініко-лабораторні ознаки тієї чи іншої інфекції.
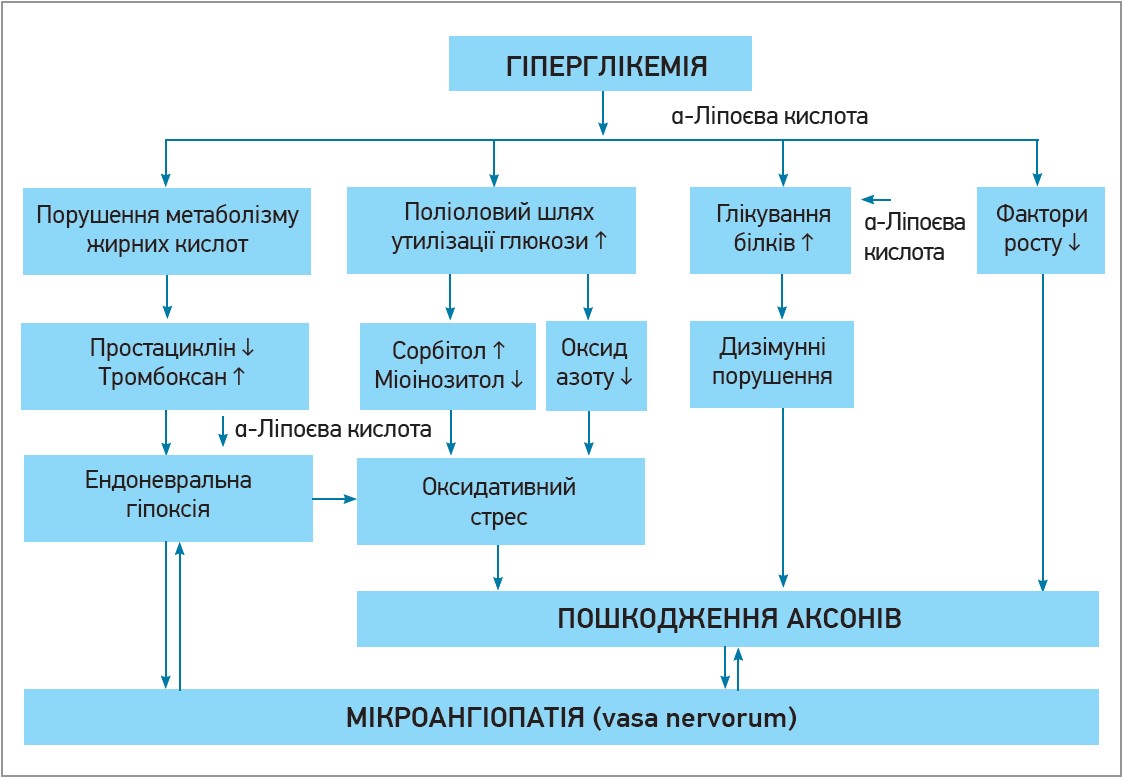
У разі ДПН тригером патологічного процесу в нервових волокнах є гіперглікемія, що призводить до глікування білків, розвитку оксидативного стресу, порушення обміну жирних кислот. Надалі розвиваються гіпоксія, цитотоксичність, порушення структури та функції нейронів, нейрональний апоптоз. Важливу роль у розвитку ДПН відіграють оклюзія та порушення кровотоку у vasa nervorum – судинах, що оточують нерв і забезпечують кровопостачання нервових волокон. На всі перелічені ланки патогенезу ДПН впливає тіоктова (α-ліпоєва) кислота (рис. 1).
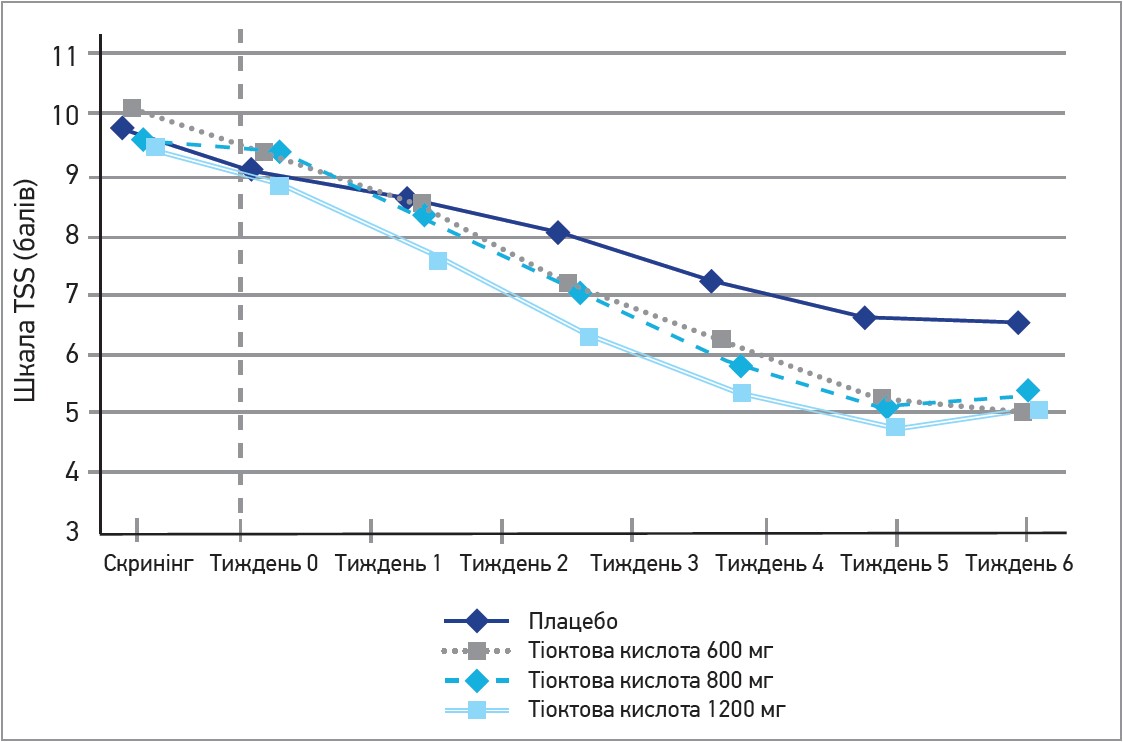
Ефект тіоктової кислоти є дозозалежним. Згідно з результатами дослідження SYNDEY II, між дозою тіоктової кислоти та зменшенням симптомів ДПН існує пряма залежність. Збільшення дози забезпечувало швидший і вираженіший регрес симптомів ДПН, оцінених за шкалою неврологічних симптомів TSS (рис. 2).
Рис. 2. Тіоктова кислота при ДПН
Важливо тривалий час підтримувати досить високий рівень тіоктової кислоти в плазмі крові. Запатентована форма контрольованого вивільнення α-ліпоєвої кислоти, що міститься в Тіокт Q10, дає змогу підтримувати стабільно високу концентрацію активної речовини протягом 8 год, що забезпечує виражений терапевтичний ефект.
Корекція терапії
- валсартан/амлодипін (Діфорс) 160/5 мг/добу;
- розувастатин (Клівас) 10 мг увечері;
- бісопролол (Конкор) 2,5 мг/добу;
- метформін (Глюкофаж ХR) 2000 мг увечері;
- дапагліфлозин 10 мг 1 р/добу;
- фіксована комбінація арГПП‑1 й аналога інсуліну тривалої дії;
- тіоктова кислота (Тіокт Q10) 800 мг/добу;
- бенфотіамін 1 таблетка на добу.
На тлі призначеного лікування стан пацієнтки покращився. Простежується подальша позитивна динаміка. Нині хвора перебуває під наглядом невролога.
Підготував В’ячеслав Килимчук
UA-TIOK-PUB-022022-041