2 березня, 2023
Гідросмін сповільнює прогресування атеросклерозу на тлі цукрового діабету
Атеросклероз і серцево-судинні захворювання є основними причинами смертності серед пацієнтів із цукровим діабетом (ЦД) [1, 2]. Хронічне запалення, окислювальний стрес і ендотеліальна дисфункція є взаємопов’язаними явищами в патогенезі діабетичного атеросклерозу. Активація цих процесів додатково посилює вазоконстрикцію, залучення запальних клітин, їхню диференціацію та проліферацію, що в підсумку призводить до прогресування й дестабілізації атеромних бляшок. Тому триває пошук додаткових засобів терапії, які здатні впливати на ці процеси. З’являється дедалі більше доказів того, що рослинні флавоноїди виявляють антиоксидантну та протизапальну дії.
Гідросмін – флавоноїд, що демонструє вазопротекторні й венотонічні властивості та має клінічні показання для симптоматичного лікування хронічної венозної недостатності. Систематичні огляди, проведені Кокранівською бібліотекою, американськими та європейськими клінічними товариствами із судинної хірургії, підтвердили ефективність і безпеку гідросміну як перорального флеботонічного препарату [3-5]. А нещодавно було встановлено, що гідросмін здатний стабілізувати перебіг атеросклерозу на тлі ЦД.
Нове дослідження іспанських науковців мало на меті доклінічну оцінку вазопротекторної активності гідросміну на моделях діабету [6]. Експерименти проводили на мишах зі стрептозотоцин-індукованим ЦД 1 типу, схильних до атеросклерозу й позбавлених гена аполіпопротеїну E (ApoE). Ця модель поєднує хронічну гіперглікемію та гіперліпідемію, що призводить до прискореного розвитку діабету й атеросклерозу, подібних до патології в людей [7]. У ході серії експериментів було встановлено, що гідросмін запобігав розвитку атеросклерозу та частково усував ознаки нестабільності бляшок, запалення й окислювального стресу в діабетичних мишей. Лікування гідросміном підвищило рівень виживання мишей зі стрептозотоцин-індукованим діабетом на 15%. Наприкінці дослідження миші, які отримували гідросмін, показали статистично значуще зниження рівнів тригліцеридів і загального холестерину порівняно з тваринами, які не отримували лікування.
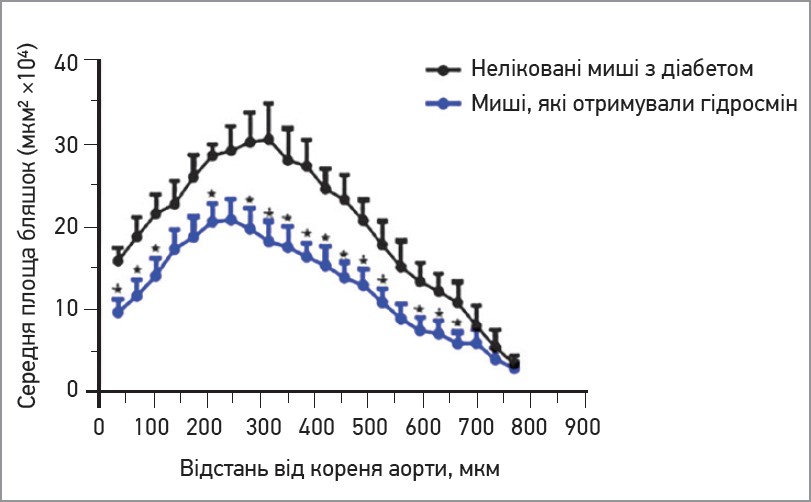
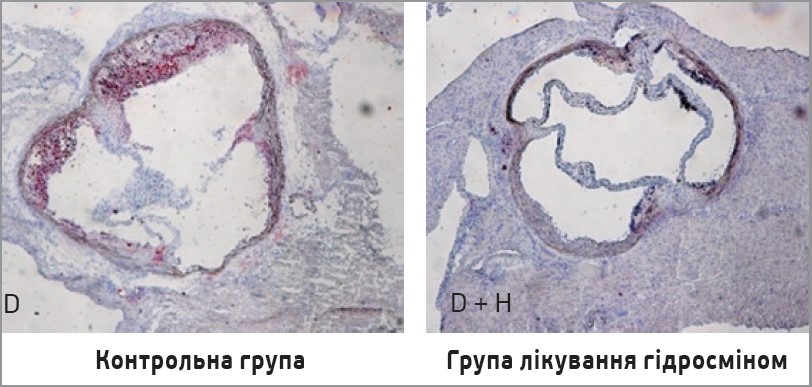
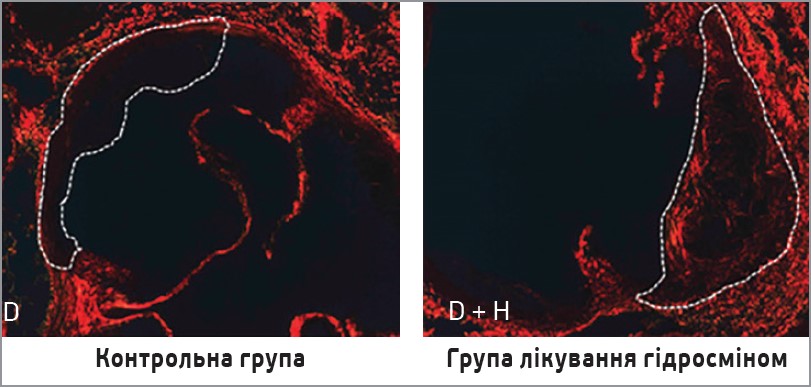
Особливу увагу привертають результати гістологічних аналізів, які продемонстрували зниження прогресування атеросклерозу в групі гідросміну. Морфометричний аналіз серійних зрізів кореня аорти показав, що лікування гідросміном помітно зменшувало поширення атеросклеротичного ураження вздовж аорти (рис. 1). Середня максимальна площа ураження зменшилася в групі гідросміну на 38±8% порівняно з нелікованими тваринами (різниця значуща при p=0,0168). Також спостерігали захисну дію гідросміну на гістологічні ознаки стабільності бляшок. Порівняно з атеросклеротичними ураженнями в групі, що не отримувала лікування, в мишей, які отримували гідросмін, спостерігалося менше відкладення ліпідів (рис. 2) і вищий уміст колагену (рис. 3). Як наслідок значно вищим стало співвідношення колагену до ліпідів: 201±33% збільшення порівняно з групою без лікування (p=0,0376).
Крім того, в мишей, які не отримували лікування, приблизно 40% бляшок були класифіковані за системою Stary як прогресивні (ступінь G4), і лише 14% були ранніми бляшками (ступені G1-G2). Натомість у групі лікування гідросміном бляшки були переважно ступеня G2-G3 (72%), тоді як лише 9% відповідали поширеній стадії атеросклерозу.
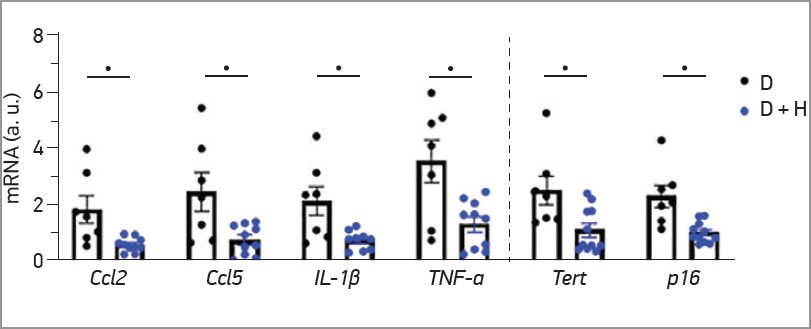
У подальших експериментах досліджували вплив гідросміну на запалення бляшок, клітинне старіння й окислювальний стрес. Атеросклеротичні ураження мишей, які отримували гідросмін, продемонстрували знижений уміст CD68+ макрофагів (31±6% зниження порівняно з групою без лікування, p=0,0026) і CD3+ Т‑лімфоцитів (30±5% зниження, p=0,0145). Крім того, ПЛР‑аналіз у режимі реального часу виявив зниження експресії запальних хемокінів (CCL2 та CCL5) і цитокінів (IL‑1β та TNF) у зразках аорти мишей, які отримували лікування, таким чином підтверджуючи протизапальний ефект гідросміну. Водночас гідросмін послаблював експресію p16, маркера передчасного старіння, індукованого запаленням і окисним стресом, а також TERT, субодиниці теломерази, що активується під час атерогенезу та відкриває прямий шлях до експресії прозапальних генів (рис. 4).
Рис. 1. Кількісне порівняння поширеності атеросклерозу по ходу аорти: в групі лікування гідросміном кількість уражень менша в усіх ділянках
Рис. 2. Зрізи кореня аорти (забарвлення ORO/гематоксиліном, збільшення ×100). Лікування гідросміном зменшує відкладення ліпідів у стінці аорти діабетичних мишей
Рис. 3. Зрізи кореня аорти з контрастуванням колагенових волокон (забарвлення сиріусом червоним, збільшення ×200). Лікування гідросміном збільшує вміст колагену в стінці аорти діабетичних мишей
Рис. 4. ПЛР-аналіз експресії генів прозапальних цитокінів (CCL2, CCL5, IL-1β, TNF-α) та генів старіння (TERT, p16) у зрізах аорти мишей
Результати, отримані in vivo, були доповнені серією експериментів in vitro на культурах гладкоком’язових клітин судин та ендотеліоцитів – ключових ефекторних клітин у судинній дисфункції, які модулюють судинний тонус, окисно-відновний баланс і запальну відповідь на патологічні стани, включаючи діабет.
У першому досліді гладком’язові клітини миші були піддані дії високої концентрації глюкози (30 ммоль/л) у спробі імітувати діабетичне середовище. Попередня обробка клітин гідросміном залежно від дози знижувала експресію хемокінів, цитокінів і прооксидантних генів, індукованих гіперглікемією, та чинила протилежний вплив на антиоксидантні гени. У наступній серії експериментів було показано, що гідросмін дозо- та часозалежно стимулює активність синтази оксиду азоту (NOS) і вивільнення NO в ендотеліальних клітинах людини, покращуючи таким чином функцію ендотелію.
Цінність отриманих результатів
Робота Jiménez-Castilla та співавт. є першим дослідженням, у якому ретельно оцінено на відповідних доклінічних моделях вплив гідросміну на судинну дисфункцію, пов’язану з гіперглікемією. Показано, що флавоноїд гідросмін чинить вазопротекторну дію при діабетичній ангіопатії за експериментальними даними, покращуючи функцію ендотелію та зменшуючи утворення атеросклеротичних бляшок. В основі цих ефектів лежать активація вивільнення eNOS і NO, пригнічення запального, окислювального стресу та шляхів клітинного старіння, а також індукція антиоксидантної відповіді.
Сприятливий вплив гідросміну на атеросклеротичні ураження був дуже помітним і гістологічно підтвердженим. Лікування гідросміном істотно зменшило розмір, ступінь і склад атеромних бляшок. Особливий інтерес викликав вплив гідросміну на гістологічні показники стабільності бляшок, зокрема зменшення відкладення ліпідів і підвищення вмісту колагену. Крім того, оцінка за класифікацією Stary підтвердила, що миші, які отримували гідросмін, мали менш серйозні атеросклеротичні ураження (ступінь G4), ніж миші з діабетом без лікування.
Деформованість еритроцитів і в’язкість крові є двома гемореологічними показниками, котрі впливають на тканинну перфузію. Незважаючи на геометричні характеристики кровоносних судин, гемореологічні властивості можуть також відігравати значну роль у кровопостачанні як за фізіологічних, так і за патологічних станів, впливаючи на достатню оксигенацію тканин. З цієї причини препарати, які збільшують деформованість еритроцитів та/або зменшують в’язкість крові, можуть бути корисними терапевтичними опціями в разі, якщо тканинний кровоток є нижчим від норми.
Зокрема, раніше було показано здатність гідросміну покращувати реологічні властивості крові. За даними подвійного сліпого плацебо-контрольованого клінічного дослідження [9] за участю пацієнтів із хронічними серцево-судинними захворюваннями, терапія гідросміном у дозі 400 мг 3 рази на день упродовж 6 тиж сприяла статистично значущому зменшенню часу фільтрації крові, що вказує на підвищену здатність еритроцитів до деформації. Також відзначалося зменшення в’язкості крові, яке хоча й не досягло статистичної значущості в загальній групі пацієнтів, але було найбільшим у підгрупі з найвираженішими порушеннями гемореології до лікування. Ці ефекти зумовлюють поліпшення кровотоку та перфузії тканин у пацієнтів із коморбідністю серцево-судинних захворювань і діабету.
Вочевидь, для оцінки ефективності вазопротекторної терапії потрібні подальші дослідження, проте гідросмін уже сьогодні демонструє потенціал як супутня терапія хронічних макросудинних ускладнень діабету шляхом зниження залишкового серцево-судинного ризику.
Список літератури знаходиться в редакції.
Підготував Ігор Петренко
Медична газета «Здоров’я України 21 сторіччя» № 1-2 (537-538), 2023 р.