21 червня, 2023
Нові потенційні антикоагулянти на основі інгібіторів фактора згортання XIa
Система гемостазу людини еволюціонувала так, щоб підтримувати кров у рідкому стані у фізіологічних умовах та швидко реагувати на ушкодження судин. Однак за деяких патологічних станів може статися порушення цього процесу, а саме оклюзія судини (утворення непрохідності через тромб), що зумовлює тромбоемболію. Тромбоз виникає як в артеріальних, так і у венозних судинах. Це сприяє розвитку інфаркту, ішемічного інсульту та тромбозу глибоких вен. Тромбоемболічні захворювання – серйозна медична проблема та причина кожної четвертої смерті в світі.
Антикоагулянти є основними лікарськими засобами для профілактики та/або лікування тромботичних розладів. Протягом >100 років після їх винайдення увага дослідників була зосереджена на оптимізації їхньої антитромботичної ефективності при мінімальному ризику кровотечі. Наразі клініцисти можуть сподіватися на значну кількість антикоагулянтів – від першого нефракціонованого гепарину, відкритого ще в 1916 році.
Інші антикоагулянти, як-от антагоністи вітаміну К (наприклад, варфарин), як антикоагулянтна терапія використовуються протягом 50 років. Хоча ці препарати демонструють ефективність у всьому спектрі клінічних проявів, вони збільшують ризик великих кровотеч, при цьому необхідний постійний моніторинг для підтримки ефекту препарату у вузькому терапевтичному вікні. У 2005 році Hirsh і співавт. [1] представили характеристики ідеального антикоагулянту, який повинен мати високий індекс «ефективність – безпека» та передбачувану відповідь на дозу введення, що виключало б необхідність у лабораторному контролі. Саме тому через певні обмеження під час використання антагоністів вітаміну К як пероральної антикоагулянтної терапії їх поступово почали замінювати пероральними антикоагулянтами прямої дії, а саме прямими інгібіторами факторів IIa та Ха. Ці лікарські засоби мають аналогічну ефективність, але із кращим профілем безпеки, відсутністю рутинного моніторингу та дуже обмеженою інтерференцією. Однак підвищений ризик кровотечі зберігається навіть при застосуванні цих пероральних антикоагулянтів нового покоління в деяких груп пацієнтів, а також у хворих, які потребують подвійної або потрійної антитромботичної терапії, чи під час операцій з високим ризиком кровотечі [2, 3].
Усі доступні нині класичні чи нові антикоагулянти забезпечують захист від тромбів, проте вони одночасно підвищують ризик кровотеч. Кожен клінічно використовуваний антикоагулянт пов’язаний зі значними несприятливими наслідками (кровотеча). Отже, необхідна розробка «безпечних» антикоагулянтів, ефективних у профілактиці та лікуванні тромботичних захворювань, але пов’язаних із мінімальним ризиком кровотечі.
Останніми роками дослідницьку роботу зосереджено на новому класі антикоагулянтів, спрямованих на контактну (внутрішній шлях) систему згортання крові з метою максимально підвищити безпеку за рахунок зниження ризику кровотеч під час терапії. Фактор XI виявився ідеальною мішенню. Відкриття того, що люди зі спадковим дефіцитом фактора XI мають відносно незначну схильність до кровотеч і значно захищені від деяких тромботичних захворювань, зумовив підвищений інтерес до фактора XI/XIa як мішені для нових антикоагулянтних препаратів [4].
Потенційна роль FXI у тромбозі виявлена завдяки щасливому випадку. У 2008 році було продемонстровано, що люди зі зниженим рівнем FXI мають значно нижчий ризик розвитку інсульту, ніж населення загалом. Контактна система згортання крові багато років ігнорувалася дослідниками, адже за спадкового дефіциту факторів FXII, FXI, високомолекулярного кініногену, прекалікреїну кровотеча була обумовлена лише легким геморагічним діатезом, тому контактна система значною мірою розглядалася як in vitro-феномен. Відродження інтересу до цієї системи обумовлено виявленням і подальшою ідентифікацією поліфосфатів та нуклеїнових кислот, що зустрічаються в природі, як потенційних фізіологічних активаторів контактної системи, а також доказом того, що ця система є важливою для стабілізації / зростання тромбу. За допомогою численних випробувань на моделях тварин установлено, що контактна система згортання є важливішою для тромбоутворення, ніж для гемостазу. Отже, інгібітори FXIa потенційно можуть бути антикоагулянтними препаратами, які не спричинять порушення системи гемостазу [5]. Це було підтверджено експериментальними даними з інгібіторами FXIa та клінічними спостереженнями за пацієнтами із вродженим дефіцитом FXI.
З огляду на те що FXI впливає лише на одну частину каскаду коагуляції (внутрішній шлях), дослідники висунули таку гіпотезу: інгібування або FXI, або його активованої форми (FXIa) може бути перспективним способом запобігання утворенню шкідливих тромбів (які зумовлюють інсульт чи серцевий напад) при збереженні належної функції згортання крові (наприклад, після травми), отже, не збільшує ризику кровотечі.
Структура та функції фактора XI
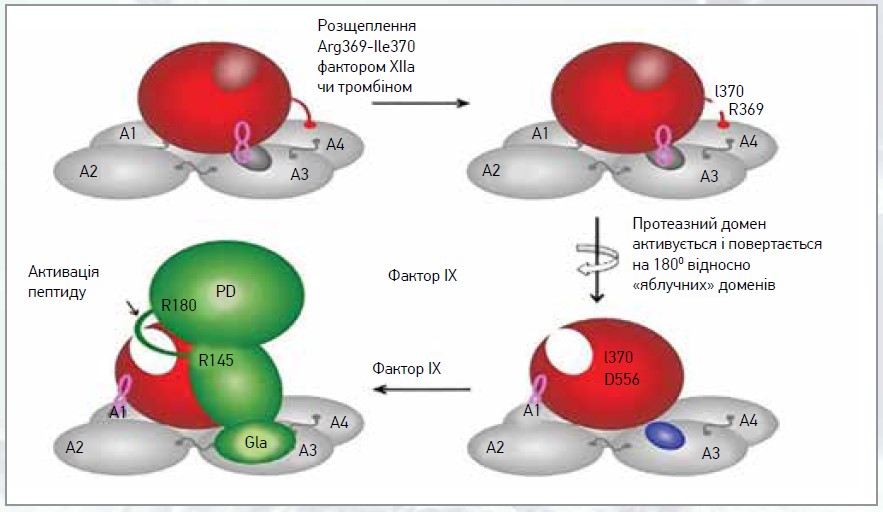
Фактор XI уперше виявлено в сім’ї, де основною клінічною особливістю була легка чи помірна кровотеча після видалення зуба [6]. Надалі це захворювання отримало назву гемофілії С (хвороба Розенталя). Людський FXIa є гомодимером дисульфіду серинової протеази. Має молекулярну масу 160 кДа, концентрацію в плазмі ≈30 нМ і синтезується здебільшого в гепатоцитах разом із протромбіном і фактором XII. Із протеаз, необхідних для нормального утворення тромбіну під час гемостазу, FXIa функціонально та структурно є унікальним з огляду на декілька факторів. Фермент не потребує вітамін-К‑залежної посттрансляційної модифікації для нормального функціонування; його активність не істотно впливає на ліпіди, що містять фосфатидилсерин. FXI є частиною внутрішнього шляху згортання крові та наявний у кровообігу як зимоген; має важливу роль у генерації утворення тромбіну, інгібуючи фібринолітичну систему після початку коагуляції [7]. Фактор XI може активуватися не лише активованим FXII (FXIIa), а й тромбіном у вигляді позитивного зворотного зв’язку. Отже, FXI сприяє виробленню тромбіну, а також посилює коагуляційний каскад. Він має структуру, гомологічну прекалікреїну (58% ідентичність із прекалікреїном плазми людини), але без залишків γ-карбоксиглутамату [8]. N‑кінець кожної субодиниці містить 4 «яблучні» домени (A1-A4). «Яблучні» домени являють собою декілька сайтів зв’язування для основних макромолекул, включаючи тромбін (A1-домен), високомолекулярний кініноген (домени А1/А2), GPIb тромбоцитів (домен А3) та FXIIa (домен А4). С‑кінець є трипсин-каталітичним доменом [9, 10]. Структурна особливість і цілісність FXI є важливими саме для тромбозу (не для гемостазу). Конкретний механізм дії та значення FXI у тромбогенезі наразі остаточно не встановлені. Потрібні додаткові дослідження для аналізу механізму дії FXI при тромбозі. Такі активатори, як FXIIa і тромбін, можуть спричинити розщеплення сайту Arg369-Ile370, що зумовлює конформаційну зміну, а саме перетворення FXI на активну форму FXIa [11, 12] (рис. 1).
Рис. 1. Механізм активації фактора FXI та перетворення його на активну форму FXIa
Спадкова недостатність FXI – найчастіша причина зниження його рівня. Ген FXI у людини розташований на довгому плечі хромосоми 4. Мутації можуть спричинити структурні зміни мономерів FXI, послабити в такий спосіб утворення димера та порушити секрецію FXI [13]. Мутації у залишках, що зв’язуються з лігандами, як-от тромбін, високомолекулярний кініноген, гепарин, FIX, GP1b тромбоцитів, також можуть впливати на функцію каталітичної ділянки FXIa. Крім того, тяжкі захворювання печінки [14] та автоімунні захворювання, як-от системний червоний вовчак [15], мембранопроліферативний гломерулонефрит [16], сприяють зниженню рівня FXI.
Незважаючи на дефіцит FXI, більшість хворих на гемофілію C (1:100 000 випадків у популяції) мають нічим не виражену клінічну картину та значні індивідуальні відмінності, які зазвичай проявляються під час травми чи хірургічних операцій. Ці пацієнти не такі схильні до спонтанних кровотеч або кровотечі в суглобах, як при гемофілії А або В. Хворі, в котрих спостерігається дефіцит FXI, є схильнішими до кровотеч після травм ясен, придаткових пазух носа, сечового міхура, ендометрію та інших тканин із високою ендогенною фібринолітичною активністю.
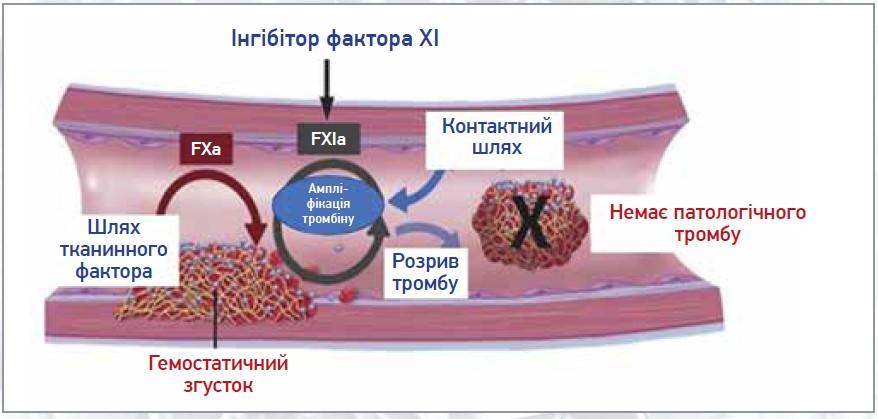
Отже, частота та тяжкість кровотечі, спричиненої недостатністю FXI, є низькими. Це дозволяє припустити, що клінічне пригнічення активності FXI матиме низький ризик тяжких кровотеч і високий рівень клінічної безпеки (рис. 2).
Рис. 2. Здатність інгібіторів фактора XI знижувати утворення патологічного тромбу зі збереженням гемостазу
Далі буде.
Медична газета «Здоров’я України 21 сторіччя» № 9 (545), 2023 р.