29 грудня, 2021
Пошук причини емболічного інсульту
За даними Всесвітньої організації охорони здоров’я, інсульт посідає третє місце в структурі захворюваності населення і складає 10% смертей у всьому світі. Провідна етіологія патології – це закупорювання судини емболом, джерело якого насамперед залежить від вікової групи пацієнтів. У 20-30 років основними причинами емболії є дисекція і тромбофілія, у 30-60 – ранній атеросклероз та набуті структурні хвороби серця, а після 60 – фібриляція передсердь (ФП), онкопатологія. Невчасне виявлення джерела емболу в пацієнта після інсульту різко підвищує ризик виникнення в нього повторного нападу. Саме тому під час конференції «Дні аритмології в Києві» невролог ДУ «Інститут серця Міністерства охорони здоров’я України» (м. Київ), кандидат медичних наук Василь Васильович Бабенко в своїй доповіді продемонстрував основні механізми появи емболічного інсульту та сучасні алгоритми їхнього менеджменту.
На сьогодні виокремлюють 7 дамоклових мечів, або потенційних джерел, емболії:
- атеросклеротичні бляшки (АБ);
- клапанна патологія серця;
- відкрите овальне вікно;
- апередсердна кардіопатія;
- невиявлена (німа) ФП;
- дисфункція лівого шлуночка (ЛШ);
- онкопатологія.
Переважаючими підтипами ішемічного інсульту (ІІ) є атеротромботичний (25%), лакунарний (25%) та кардіоемболічний (20%). У 5% випадків причина гострого порушення мозкового кровообігу (ГПМК) – артеріїти, мігрені й інші специфічні судинні хвороби. Однак останнім часом збільшується частка криптогенного інсульту, діагноз якого ставиться в 25% випадків, тобто в чверті пацієнтів не виявляють причину, яка могла б пояснити розвиток ГПМК. Серед криптогенних ІІ левову частку займає інсульт із невизначеним джерелом емболії, або ESUS‑інсульт, виникнення якого насамперед пов’язують з німою формою ФП, невиявленим атеросклерозом та онкопатологією.
Сучасне уявлення про механізм появи емболічного інсульту при серцево-судинних захворюваннях (ССЗ) вкладений у концепцію передсердної кардіоміопатії, згідно з якою основні фактори ризику ССЗ (вік, стать, артеріальна гіпертензія, ожиріння, цукровий діабет, запалення, оксидативний стрес) сприяють розвитку серцево-судинної дисфункції, передсердної міопатії, що характеризується ендотеліальною дисфункцією, гіперкоагуляцією, електричним моделюванням серця та порушенням гемодинаміки. Це, своєю чергою, безпосередньо або опосередковано (через розвиток ФП) сприяє виникненню джерела емболу та розвитку кардіоемболічного інсульту. За статистичними даними, в 65% постінсультних пацієнтів виявляється передсердна кардіоміопатія, ⅔ з яких мають ФП.
ФП – це найпотужніший предиктор інсульту, за наявності якого ризик ГПМК збільшується в 5 разів, а ризик летального наслідку – до 50%. Рандомізовані клінічні дослідження EMBRANCE та CRYSTAL AF продемонстрували, що в більшості випадків причиною криптогенного інсульту є німа форма ФП, яку не змогли діагностувати.
? Як можна передбачити ймовірність появи ФП?
Із 2019 року користуються шкалою C2HEST, яка визначає поширеність ФП у загальній популяції; вона в 2020 році була внесена до рекомендацій для довготривалого моніторингу ризику хвороби. Згідно із цією шкалою, наявність кожного фактора ризику ФП оцінюється від 1 до 2 балів. Наприклад:
Сoronary artery disease or Chronic obstructive pulmonary disease (ІХС або ХОЗЛ) – 1 бал;
Hypertension (артеріальна гіпертензія) – 1 бал;
Еlderly (вік >75 років) – 2 бали;
Systolic heart failure (ХСН зі зниженою фракцією викиду) – 2 бали;
Thyroid disease (тиреотоксикоз) – 1 бал.
J. G. Li та співавт. у своїй роботі виявили сильний кореляційний зв’язок між ризиком ФП і набраними пацієнтами балами за шкалою C2HEST: за результату до 2 балів ризик виникнення ФП не є вищим, ніж у загальній популяції, але якщо пацієнт набирає 2-3 бали, ризик ФП збільшується в 2,3 раза, за результату ≥4 балів – у 5 разів.
Окрім шкали C2HEST, існують ще декілька індикаторів високої імовірності наявної ФП у пацієнта, наприклад, клінічні характеристики хворого (похилий вік і наявність факторів кардіоваскулярного ризику) та підвищення рівнів біомаркерів серцевої недостатності, зокрема, підвищення концентрації BNP >100 пг/мл або NT‑proBNP >400 пг/мл. На користь ФП також свідчать ознаки передсердної кардіоміопатії та/або дисфункції ЛШ:
- діаметр ЛП >46 мм;
- гіпертрофія ЛШ;
- фракція викиду ЛШ <35%;
- >480 зареєстрованих суправентрикулярних екстрасистолій за 24 год, нестійкий пароксизм надшлуночкової тахікардії >20 ударів.
? Як довго шукати ФП?
У дослідженні AF-SCREEN International Collaboration учені продемонстрували, що мінімальна тривалість пошуку ФП після інсульту має бути 72 год, а при наявності багатьох факторів ризику моніторинг може тривати протягом 30 днів.
Дослідження ASSERT довело, що під час тривалого моніторингу наявність коротких субклінічних пароксизмів ФП виявлялася в 5 разів частіше, ніж напади тривалістю >24 год, проте лише останні асоціюються з ризиком виникнення повторного інсульту та потребують терапевтичного втручання.
Дослідження NAVIGATE ESUS і RE-SPECT ESUS порівнювали ефективність прямих оральних антикоагулянтів (ПОАК) у пацієнтів із криптогенним інсультом (порівняно з аспірином). Незважаючи на те що гіпотеза ефективнішого застосування ПОАК у пацієнтів з ESUS‑інсультом не була підтверджена, обидва дослідження виявили зниження ризику повторного інсульту після призначення ПОАК за наявності передсердної кардіоміопатії. Окрім того, субаналіз NAVIGATE ESUS серед пацієнтів зі структурно зміненим ЛП (≥46 мм) виявив нижчий ризик появи ІІ в хворих, які приймали ривароксабан (1,7%), ніж у пацієнтів, котрим призначили аспірин (6,5%), а RE-SPECT ESUS виявило статистично значиму ефективність прийому дабігатрану в пацієнтів віком >75 років і в хворих із хронічною хворобою нирок в анамнезі (ШКФ 30-50 мл/хв).
Інше джерело емболії, якому не приділяється належної уваги, – це супракардіальний атеросклероз. АБ на боці інфаркту наявні в 40% пацієнтів із кардіоемболічним інсультом. За даними статистики, найчастіше емболічний інсульт з’являється при екстракраніальній каротидній локалізації АБ (40% випадків) та атеросклерозі дуги аорти (29% випадків). Рідше захворювання спостерігається за комплексної атероми (8%), утворення бляшок в інтракраніальній каротидній ділянці (13%) і хребтовій артерії (4%).
При атеросклерозі дуги аорти виникнення і відрив емболу спостерігаються переважно в її проксимальній, дистальній та низхідній частинах, що пов’язано з високим тиском у судині й ретроградним рухом крові в діастолу, який сприяє дестабілізації АБ, її відриву та потраплянню до судин, що відходять від дуги аорти (найчастіше в лівий каротидний басейн) під час наступної систоли.
Основними інструментальними методами діагностики атеросклерозу є КТ та ангіографія, яка, на відміну від інших методів, візуалізує не лише локалізацію АБ, а й вираженість атероматозу та ступінь стенозу артерії. У сучасній практиці для визначення ризику відриву бляшки використовують МРТ, яка дозволяє оцінити наявність крововиливу в ділянці бляшки, об’єм ліпідного некротичного ядра, вираженість неоваскуляризації, наявність виразкувань та ступінь витонченості фіброзної капсули.
Наступне джерело емболів – злоякісні новоутворення, які, за даними різних публікацій, виявляються в половині випадків ESUS‑інсульту. Справа в тому, що деякі злоякісні пухлини (незалежно від їхнього розміру) порушують реологічні властивості крові та схильні до раннього відриву метастазів, що й стає причиною закупорювання судин; малі розміри і відсутність яскравої клінічної симптоматики значно ускладнюють їхню діагностику. Основні захворювання, які мають кореляційний зв’язок із розвитком емболічного інсульту, – аденокарцинома легень, що є його причиною в 70% випадків, пухлини підшлункової залози, простати, яєчників, нирок, молочної залози, шлунка та кишечнику.
На наявність онкології може наштовхнути анамнез пацієнта (невмотивоване зниження маси тіла, тромбоемболія в анамнезі), об’єктивне обстеження та підвищення рівнів D‑димеру, С‑реактивного білка і фібриногену в крові, а для підтвердження діагнозу використовують лабораторні (виявлення онкомаркерів у сироватці крові) й інструментальні (КТ, МРТ, ПЕТ, ендоскопія) дослідження.
Нерідко розвиток ГПМК провокують пухлини головного мозку не тільки через метастазування і коагулопатію, а й через здавлювання прилеглих структур, зокрема судин, а також синдром обкрадання, коли за рахунок високого ангіогенезу в пухлині суміжні ділянки не отримують необхідного кровопостачання. На наявність раку головного мозку можуть наштовхнути такі дані:
- поступовий розвиток неврологічного дефіциту;
- енцефалопатія;
- розсіяні вогнища в різних судинних басейнах і прилеглих зонах на МРТ.
? Коли розпочинати лікування антикоагулянтами після ІІ?
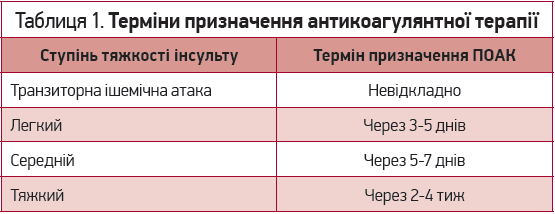
У клінічній практиці популярним є підхід, що має назву «правило Дінера», яке було запропоноване професором Хансом Крістофом Дінером і внесено до настанов Європейського товариства кардіологів (ESC, 2018). Згідно з ним, час початку антикоагулянтної терапії залежить від тяжкості ГПМК, що продемонстровано в таблиці 1.
Однак останні дослідження свідчать про те, що саме ранній початок лікування пов’язаний з кращим прогнозом пацієнта; раннє призначення ПОАК знижує ризик повторного інсульту на 7,7% на рік, але ця теорія наразі потребує детальнішого наукового підґрунтя.
? Який ПОАК краще обрати для вторинної профілактики?
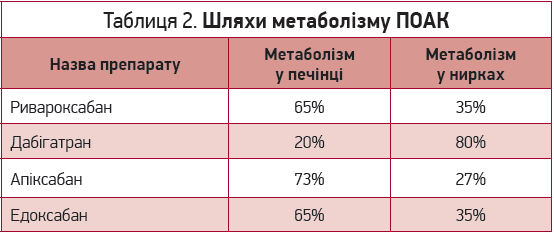
Насамперед варто звертати увагу на фармакокінетику препаратів і коморбідні патології пацієнта (особливо з боку печінки та нирок). З огляду на це препаратами вибору є ривароксабан, дабігатран, апіксабан та едоксабан, шляхи метаболізму яких наведено в таблиці 2.
Все ширшого застосування в лікарській практиці набуває апіксабан через його високий профіль безпеки та кращу ефективність порівняно з іншими ПОАК (зокрема, з ривароксабаном і дабігатраном). Окрім того, дослідження AVERROES виявило, що апіксабан знижує ризик повторного інсульту та розвиток емболів на 71% порівняно з аспірином, при цьому обидва препарати мають однаково високий профіль безпеки. Дослідження ARISTOTLE, яке аналізувало дані 3436 постінсультних пацієнтів, продемонструвало, що порівняно з варфарином прийом апіксабану на 24% знижував ризик повторного інсульту та системної емболії, внутрішньочерепного крововиливу – на 63%, великих кровотеч – на 27%, ризик смертності – на 11%.
Наостанок Василь Васильович підкреслив, що вчасне виявлення причини інсульту та механізму його появи дозволить у ранні строки підібрати правильну тактику вторинної профілактики, яка максимально зможе покращити прогноз пацієнтів.
Підготував Євгеній Ботаневич