23 січня, 2021
Антибактеріальна терапія позагоспітальної пневмонії у 2020 році: шляхи подолання антибіотикорезистентності
III Міжнародний конгрес Antibiotic Resistance STOP! цьогоріч відбувся в онлайн-форматі 14-15 листопада під час Всесвітнього тижня належного застосування антибіотиків (АБ). Конгрес об’єднав фахівців для обговорення проблеми зниження ефективності АБ і пошуку нових підходів у боротьбі з АБ-резистентністю (АБР). Учасники мали змогу прослухати доповіді провідних експертів із різних країн щодо цього питання з метою підвищення компетентності та покращення результатів для пацієнта.
 Доцент кафедри фтизіатрії та пульмонології Національної медичної академії післядипломної освіти ім. П. Л. Шупика (м. Київ), кандидат медичних наук Людмила Володимирівна Юдіна привернула увагу слухачів надзвичайно актуальною доповіддю «Антибактеріальна терапія позагоспітальної пневмонії у 2020 році: шляхи подолання АБР».
Доцент кафедри фтизіатрії та пульмонології Національної медичної академії післядипломної освіти ім. П. Л. Шупика (м. Київ), кандидат медичних наук Людмила Володимирівна Юдіна привернула увагу слухачів надзвичайно актуальною доповіддю «Антибактеріальна терапія позагоспітальної пневмонії у 2020 році: шляхи подолання АБР».
Доповідачка нагадала, що ще в 1945 році винахідник пеніциліну Александер Флемінг говорив про загрозу розвитку АБР, стверджуючи, що людина, котра безвідповідально використовує пеніцилін, несе моральну відповідальність за смерть іншої людини, котра стане жертвою інфекції, спричиненої пеніцилінорезистентним патогеном. У 2000 році в доповіді експертів Всесвітньої організації охорони здоров’я (ВООЗ) зазначалася така думка: наші прадіди жили без АБ; може статися так, що без них також житимуть і наші правнуки. АБР – властивість мікроорганізмів зберігати життєздатність за такої концентрації АБ, за якої було відзначено загибель більшості штамів цього виду чи інших видів. Мікроорганізм вважають резистентним до АБ, якщо він має механізми резистентності до цього препарату, а при лікуванні інфекцій, спричинених цим збудником, відсутній клінічний ефект навіть на тлі застосування максимальних терапевтичних доз АБ.
З огляду на те, що респіраторні інфекції – одні з найпоширеніших у світі, зростання резистентності до АБ є провісником кризи лікування цієї патології. Повідомляється також про наростання резистентності збудників багатьох інших інфекційних захворювань: вірусу імунодефіциту людини, сальмонел (до 90% резистентності до триметоприму/сульфаметоксазолу, наявність мультирезистентних штамів), мікобактерій туберкульозу (висока поширеність мультирезистентних штамів), малярійного плазмодія (резистентність до хлорохіну у 81 з 92 проаналізованих країн).
Людство вже зараз має втрати внаслідок АБР. За даними Центрів із контролю та профілактики хвороб США (CDC), не менш як 2 млн осіб щороку інфікуються бактеріями, стійкими до АБ (≈23 тис. з них помирають). Що стосується фінансових збитків, то додаткові витрати на лікування інфекцій, спричинених АБР патогенами, лише в Європі становлять 1,5 млрд євро на рік. Якщо наявна тенденція до поширення АБР зберігатиметься, цей феномен до 2050 року стане причиною загибелі 10 млн людей на рік. Для порівняння: кількість смертей від раку становитиме 8,2 млн, цукрового діабету – 1,5 млн, унаслідок травм у разі дорожньо-транспортних пригод – 1,2 млн. Сумарні витрати на лікування інфекційних процесів, спричинених стійкими до АБ мікроорганізмами, за 2016-2050 роки сягнуть 100 трлн дол. США.
Основними причинами АБР є надмірне призначення АБ в амбулаторній практиці, некероване використання цефалоспоринів і фторхінолонів, поява нових видів β-лактамаз, безпідставне застосування АБ з антипсевдомонадною активністю, неправильне дозування та занадто короткий курс АБ-терапії, застосування АБ у рослинництві, тваринництві та птахівництві. Немає сумнівів у тому, що в розв’язанні проблеми АБР має взяти участь кожен лікар.
Людмила Володимирівна проілюструвала свій виступ клінічним випадком пацієнтки К., 34 роки, котра хворіє на бронхіальну астму (БА). Лікується нерегулярно, вагітна (21-й тиждень). Після вірусної інфекції температура тіла підвищилася до 37,8 °C, з’явився кашель із виділенням гнійного мокротиння. Було діагностовано гострий бронхіт бактеріального генезу на тлі персистентної (не повністю контрольованої) БА. Для АБ-терапії обрано спіраміцин (по 1 таблетці, або 3 млн МО, 2 р/добу протягом 5 днів), оскільки при бактеріальному загостренні БА доцільно розпочинати лікування з макролідів. Тривалі спостереження підтверджують, що спіраміцин можна безпечно призначати в разі вагітності.
Через 6 років ця пацієнтка знову звернулася до лікаря зі скаргами на тривалий кашель, біль і пирхоту в горлі, підвищення температури тіла до 37,7 °C, біль у м’язах і великих суглобах, нудоту, діарею, різку слабкість. Перкуторно визначається вкорочення легеневого звуку справа в ділянці між лопатками, поодинокі сухі хрипи. Захворіла тиждень тому під час перебування на морі; було гаряче, в кімнаті весь час працював кондиціонер. Приймала азитроміцин 3 міс тому по 0,5 г/добу протягом 6 днів, потім через 2 тиж – ще 6 днів. У пацієнтки з’явився (та згодом посилився) кашель (особливо вночі), спостерігалися утруднене дихання, свист у грудях. Хвора звернулася по медичну допомогу за місцем відпочинку. Було проведено рентгенографію органів грудної клітки та встановлено діагноз «Гострий ларинготрахеїт. Позагоспітальна пневмонія верхньої частки правої легені. Перша клінічна група». Пацієнтці призначили захищений цефалоспорин ІІІ покоління 1,0 г 2 р/добу внутрішньом’язово впродовж 10 днів. Це призначення не відповідає клінічній ситуації.
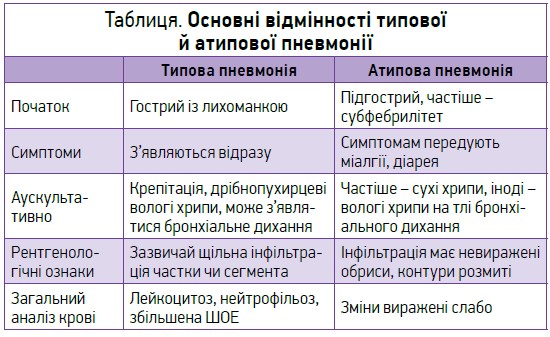 Навіть якщо лікар не може точно визначити патоген у разі позагоспітальної пневмонії, за клінічною картиною можна розрізнити типову й атипову пневмонію (табл.).
Навіть якщо лікар не може точно визначити патоген у разі позагоспітальної пневмонії, за клінічною картиною можна розрізнити типову й атипову пневмонію (табл.).
Клінічна картина позагоспітальної пневмонії цієї пацієнтки відповідає ознакам атипової пневмонії, тому доцільно призначати макроліди, доксициклін або нові фторхінолони (левофлоксацин, моксифлоксацин). За відсутності клінічних або епідеміологічних даних, які вказують на атипову пневмонію, призначають амоксицилін чи амоксицилін/клавуланат. Другою лінією терапії в осіб молодого віку без супутніх захворювань є макроліди чи доксициклін, а в осіб похилого віку із супутніми захворюваннями – фторхінолони ІІІ-IV покоління чи цефдиторен.
Належну АБ-терапію слід призначати за критеріями SMART: S (standard, відповідає національним стандартам лікування), M (mind, ураховується найімовірніший і найнебезпечніший збудник), A (adequate, передбачаються адекватне дозування та кратність прийому), R (resistance, враховуються місцеві дані щодо резистентності), T (time, характеризується своєчасним початком та оптимальною тривалістю курсу лікування).
Програма досліджень SOAR (Survey of Antibiotic Resistance), присвячена вивченню АБР основних респіраторних патогенів, показала, що стійкість пневмокока до азитроміцину в Україні становить 16,0%. У південних регіонах США частота цієї резистентності є ще вищою й сягає 30,9-43,2%. Загалом у США резистентність Streptococcus pneumoniae до макролідів ледь сягала 10% у 1995 році, проте паралельно з виходом на ринок азитроміцину та зростанням його продажів ця резистентність почала збільшуватися, сягнувши 20% наприкінці 1990-х років і 30% – у ранні 2000-ні роки. Аналогічну тенденцію відзначили також і фінські науковці: збільшення стійкості S. pneumoniae до макролідів було пов’язане з недоцільним використанням цієї групи АБ, зокрема азитроміцину. Для запобігання подальшому зростанню такої резистентності слід уникати некоректного застосування макролідів.
Повертаючись до описаного клінічного випадку, доповідачка нагадала, що пацієнтам із БА доцільно призначати макроліди, фторхінолони та доксициклін (якщо раніше хворий рідко застосовував цей препарат). Варто зауважити, що тетрациклінам властива низка несприятливих побічних ефектів із боку шлунково-кишкового тракту (біль або дискомфорт у животі, нудота, блювання, діарея), центральної нервової системи (запаморочення, нестійкість), печінки (прояви гепатотоксичності), шкірних покривів (фотосенсибілізація). Нерідко спостерігаються й алергічні реакції (перехресні до всіх тетрациклінів): висипання, кропив’янка, набряк Квінке, анафілактичний шок. Отже, в цьому випадку доцільно віддати перевагу макроліду, але пацієнтка 3 міс тому вже приймала азитроміцин.
Стійкість мікроорганізмів до макролідів у понад 90% випадків визначається двома механізмами: виробленням ферменту метилази (модифікація мішені) й активним виведенням АБ з мікробної клітини (ефлюкс). У штамів S. pneumoniae та S. pyogenes частіше спостерігається останній механізм. На відміну від 14- й 15-членних макролідів азитроміцину та кларитроміцину 16-членний макролід спіраміцин не «виштовхується» з клітини, а резистентність до нього є менш вираженою, ніж до інших макролідів. Спіраміцин активний щодо 75% штамів S. pyogenes і S. pneumoniae, котрі резистентні до 14- та 15-членних макролідів. Для описаної в клінічному випадку пацієнтки особливо важливо те, що спіраміцин активний і проти атипових патогенів: Mycoplasma pneumoniae, Chlamydophila pneumoniae, Legionella pneumophila. Натомість амоксицилін, амоксицилін/клавуланат, цефуроксим і цефтріаксон на ці бактерії не діють.
За умови призначення неадекватної АБ-терапії вона може виявитися неефективною. Критеріями неефективності АБ-терапії є збереження чи посилення лихоманки та клінічної симптоматики через 72 год після початку лікування, поява чи збереження нестабільності гемодинаміки, розвиток або посилення дихальної недостатності, виникнення необхідності в штучній вентиляції легень, негативна рентгенологічна динаміка.
Оскільки призначений описаній вище пацієнтці β-лактам виявився неефективним, було рекомендовано спіраміцин по 1 таблетці (3 млн МО) 2 р/добу протягом 7 днів. Застосування спіраміцину дало змогу успішно вилікувати пневмонію.
Перевагою спіраміцину є здатність створювати високі внутрішньоклітинні та позаклітинні концентрації у вогнищі інфекції на тривалий період часу. На відміну від 14-членних макролідів спіраміцин здатен зв’язуватися не з одним, а відразу з трьома доменами 50S субодиниці рибосоми (тобто міцніше), що забезпечує триваліший антибактеріальний ефект, а неміцне зв’язування з білками плазми дає спіраміцину можливість добре проникати в тканини організму. Концентрація спіраміцину в тканинах (легені – 45 мг/кг, мигдалики – 29,5 мг/кг, інфікована слизова оболонка приносових пазух – 21,5 мг/кг) у кілька разів перевищує МПК90 для більшості збудників респіраторних інфекцій. Спіраміцину властивий своєрідний парадокс: його висока клінічна ефективність не відповідає помірній активності in vitro. За даними звіту ВООЗ (2016), щороку спіраміцин приймають ≈8 млн пацієнтів. Варто зазначити, що рівень резистентності S. pneumoniae до спіраміцину є досить низьким (у межах 4,5%).
Для подолання проблеми АБР у 2019 році було складено Загальносвітовий договір щодо цього питання, метою котрого є створення системи глобального контролю боротьби з АБР. У цьому документі стверджується, що спосіб використання АБ у світі потрібно змінити. Безумовно, АБ є одним з основних інструментів сучасної медицини, проте дедалі більше бактерій виробляють стійкість до них. За оцінками експертів, стійкі до АБ бактерії вже вбивають ≈700 тис. осіб на рік; цей показник стабільно зростає.
Що може зробити кожен практичний лікар для подолання проблеми АБР?
- Призначати АБ винятково за показаннями, пам’ятаючи про те, що при вірусних інфекціях вони є неефективними.
- Обирати АБ відповідно до клінічної ситуації.
- Переконувати пацієнтів повністю завершувати курс терапії та не застосовувати АБ на свій розсуд.
- Комбінувати кілька АБ лише за обґрунтованої потреби.
- Дотримуватися практичних рекомендацій, заснованих на даних доказової медицини.
- Зважати на тенденції регіональної АБР при емпіричному призначенні АБ.
Доповідачка завершила свій виступ такими висновками:
- для вирішення проблеми АБР необхідне раціональне призначення АБ з урахуванням індивідуальних особливостей пацієнта;
- макроліди можуть бути запропоновані за підозри на атипову природу захворювання як альтернативні препарати в разі відсутності ефекту від препаратів вибору, при непереносимості β-лактамів;
- за відсутності ефекту від 14- та 15-членних макролідів (кларитроміцин, азитроміцин) можливе застосування 16-членних представників цього класу (наприклад, спіраміцину), оскільки для цього препарату рідко існує ефлюкс-механізм резистентності, а загальна стійкість мікроорганізмів до нього є нижчою, ніж до інших макролідів.
Підготувала Лариса Стрільчук
Медична газета «Здоров’я України 21 сторіччя» № 24 (493), 2020 р.



