12 вересня, 2021
Кашель та респіраторні захворювання в умовах пандемії COVID-19: місце мукоактивної терапії
 Гострі респіраторні захворювання (ГРЗ) верхніх і нижніх дихальних шляхів посідають перше місце в структурі первинної захворюваності останні 15 років, щорічний пік якої обумовлений сезонним розповсюдженням вірусних інфекцій. Пандемія COVID‑19 загострила соціоекономічний тягар, зумовлений збільшенням частоти та тривалості тимчасової непрацездатності в Україні та світі. Кашель залишається основною скаргою пацієнтів з маніфестацією ГРЗ, які звертаються по медичну допомогу до лікаря первинної ланки чи пульмонолога. Крім того, у зв’язку з поширенням коронавірусної інфекції пацієнтам з кашлем необхідно чітко верифікувати його етіологію, відповідно до якої призначається персоніфікована терапія.
Гострі респіраторні захворювання (ГРЗ) верхніх і нижніх дихальних шляхів посідають перше місце в структурі первинної захворюваності останні 15 років, щорічний пік якої обумовлений сезонним розповсюдженням вірусних інфекцій. Пандемія COVID‑19 загострила соціоекономічний тягар, зумовлений збільшенням частоти та тривалості тимчасової непрацездатності в Україні та світі. Кашель залишається основною скаргою пацієнтів з маніфестацією ГРЗ, які звертаються по медичну допомогу до лікаря первинної ланки чи пульмонолога. Крім того, у зв’язку з поширенням коронавірусної інфекції пацієнтам з кашлем необхідно чітко верифікувати його етіологію, відповідно до якої призначається персоніфікована терапія.
Нещодавно за сприяння Національної академії медичних наук України, ДУ «Національний інститут фтизіатрії і пульмонології ім. Ф. Г. Яновського» фахівці первинної ланки та спеціалізованої допомоги мали можливість долучитися до національного обговорення проблем, пов’язаних з інфекцією COVID‑19, та перспектив щодо їхнього вирішення.
Проблематику вчасної етіоверифікації та ефективного фармацевтичного менеджменту кашлю в умовах пандемії висвітлив у своїй доповіді доцент кафедри загальної практики – сімейної медицини Харківської медичної академії післядипломної освіти, кандидат медичних наук Геннадій Іванович Кочуєв.
Основним меседжем доповіді стало визначення ролі та місця мукоактивної терапії при маніфестації респіраторних захворювань, асоційованих з кашлем, в розпалі пандемії COVID‑19.
Загальновідомо, що кашель є ключовим дренажним механізмом респіраторного тракту. З іншого боку, кашель – чинник, який сприяє поширенню інфекції, що неможливо не враховувати в умовах аерозольного шляху розповсюдження SARS-CoV‑2.
Основним пусковим тригером кашльового рефлексу, який часто недооцінюється, є порушення фізіологічних параметрів діяльності мукоциліарного кліренсу (МКЦ), що зумовлює зниження його ефективності та розвиток мукоциліарної недостатності. Евакуаторна функція МКЦ обумовлена коливальними рухами миготливого епітелію слизової, у структурі якого війчасті клітини переважають над келихоподібними. Останні – продуценти ринобронхіального секрету, який складається із двох шарів: внутрішнього рідкого золю, що покриває війки миготливого епітелію, та зовнішнього компактнішого гелю. Співвідношення цих двох шарів – 3:1. Золь забезпечує локальний імунітет (MALT – Mucosal Associated Limphoid Tissues) завдяки вмісту біологічно активних речовин і секреторних імуноглобулінів А та G. Важливим біологічним ефектом IgA є здатність запобігати реплікації вірусів і пригнічувати адгезію низки бактерій до клітин респіраторного епітелію та перешкоджати масивному мікробному заселенню слизових, знижуючи ризик респіраторної інфекції. Завдяки мукоціліарному транспорту мікроорганізми ринобронхіального секрету рухаются зі швидкістю 10 клітин слизової оболонки за 1 с, що зводить час контакту до 0,1 с та ускладнює інвазію вірусів і бактерій в епітелій. Завдяки скоординованим рухам війчастих клітин і правильному співвідношенню фаз гель/золь забезпечується робота мукоциліарного апарату – провідного чинника захисту респіраторного тракту.
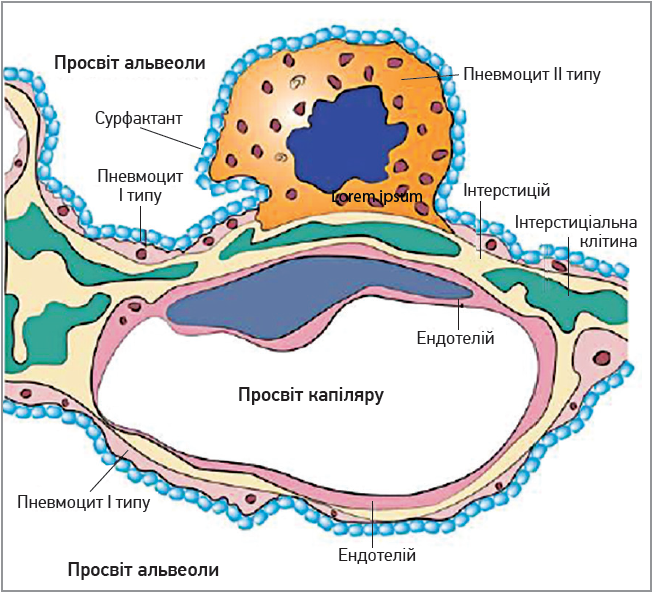
Сурфактант вистилає внутрішню поверхню альвеол, знижуючи поверхневий натяг альвеол, і запобігає їхньому спадінню наприкінці експіраторної фази; складається здебільшого із фосфоліпідів і 4 поверхнево активних протеїнів – SP (surfactant protein) A, B, C, D. Функції протеїнів сурфактанта SP-A та SP-D пов’язані із захистом легень завдяки агрегації різних мікроорганізмів, фагоцитозу макрофагами та моноцитами. SP-A та SP-D також регулюють продукцію прозапальних цитокінів.
SP-В та SP-С сприяють правильному заповненню сурфактантом альвеол і забезпечують біофізичні механізми функціонування легень. Дефіцит SP-В супроводжується проявами легеневої недостатності, а дефіцит SP-С сприяє розвитку інтерстиціальної пневмонії.
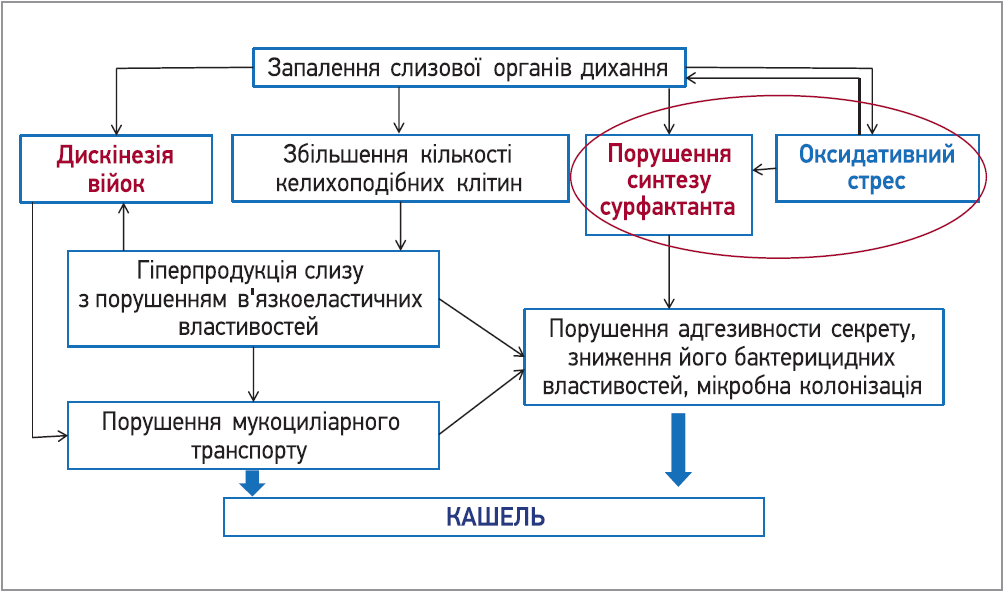
При інфікуванні вірусами чи бактеріями під дією медіаторів запалення порушується МЦК: потовщується гель-фаза, зменшується золь-фаза, війки миготливого епітелію рухаються повільніше, можуть навіть зупинитися. Мукоциліарна недостатність створює умови для інвазії та колонізації збудників на слизовій оболонці. Дуже важливе значення мають оксидативний стрес та порушення синтезу сурфактанта (рис. 1). Ці чинники також мають дуже важливе значення в умовах пандемії COVID‑19.
Сьогодні актуально нагадати, що сурфактант синтезується пневмоцитами ІІ типу (рис. 2), тропність до яких має SARS-CoV‑2.
Рис. 1. Механізми виникнення кашлю
Рис. 2. Синтез сурфактанта
З огляду на механізми патогенезу кашлю застосування мукоактивної терапії є абсолютно обґрунтованим, адже дає змогу лікарю керувати кашлем шляхом зміни якісних і кількісних характеристик бронхіального секрету. Мукоактивні препарати за механізмом дії розподіляють на мукокінетики, муколітики, мукорегулятори та стимулятори МКЦ. Мукокінетики впливають на реологічні властивості переважного золевого компонента бронхіального секрету (об’єм, щільність, рухливість), тоді як муколітики модулюють характеристики гелевого компонента (щільність, еластичність, адгезивність).
Сьогодні фахівцям усіх галузей медицини доступний інструмент, що дозволяє оцінити ефективність та безпечність будь-якого методу лікування, – принцип доказової медицини. Відповідно до численних метааналізів з доказовості мукоактивних препаратів, до групи А відносять ацетилцистеїн, до групи В – амброксол, до групи D – фітопрепарати.
Ацетилцистеїн – тіоловмісний препарат, муколітична дія якого реалізується в просвіті бронхів завдяки наявності в його молекулі сульфгідрильних SH‑груп, що розривають дисульфідні зв’язки верхнього шару мокротиння (гель-фазу), зменшуючи її в’язкість. Ацетилцистеїн здійснює пряму (за рахунок тіолових груп) і непряму (за рахунок активації синтезу глутатіону) виражену антиоксидантну дію. Ацетилцистеїн інактивує практично всі різновидності вільних радикалів, у тому числі найбільш реакційноздатні форми. Крім того, препарат має здатність уповільнювати деструкцію легеневої тканини, запобігає розвитку ускладнень та хронізації легеневого процесу. Такі плейотропні ефекти ацетилцистеїну набувають кардинального значення в умовах тяжкого респіраторного дистрес-синдрому, асоційованого з COVID‑19.
Амброксол стимулює секреторну активність серозних клітин слизової дихальних шляхів, відновлює більш рідку золь-фазу, від стану якої залежить рухова активність війок. Мукокінетична дія амброксолу забезпечується завдяки посиленню діяльності миготливого епітелію котрий порушується та зменшується на 21,3% під впливом TNF і прозапальних цитокінів. Протизапальний ефект амброксолу пояснюється збільшенням на тлі його прийому легеневих макрофагів, пригніченням прозапальних цитокінів (IL‑1, IL‑4, IL‑13, TNF) та супресією активності фосфоліпази А2. Дуже важлива дія амброксолу – стимуляція вироблення сурфактанта в альвеолярних пневмоцитах ІІ типу. При вірусній інфекції амброксол посилює утворення сурфактанта в 1,5-1,7 разу. Протеїн А сурфактанта безпосередньо взаємодіє з гемаглютиніном вірусу і нейтралізує його. Амброксол запезпечує мукозальний місцевий імунітет слизових дихальних шляхів за рахунок підвищення продукції секреторного IgA в 10 разів і IgM в 1,2 разу від початкового рівня.
Комбінація ацетилцистеїну й амброксолу (ПульмоБриз®, Movi Health) є патогенетично обґрунтованою, оскільки відновлює складові мукоциліарного кліренсу завдяки взаємодоповненню та синергії основних і плейотропних ефектів, що забезпечує подолання запалення й інтоксикації при гострих респіраторних інфекціях.
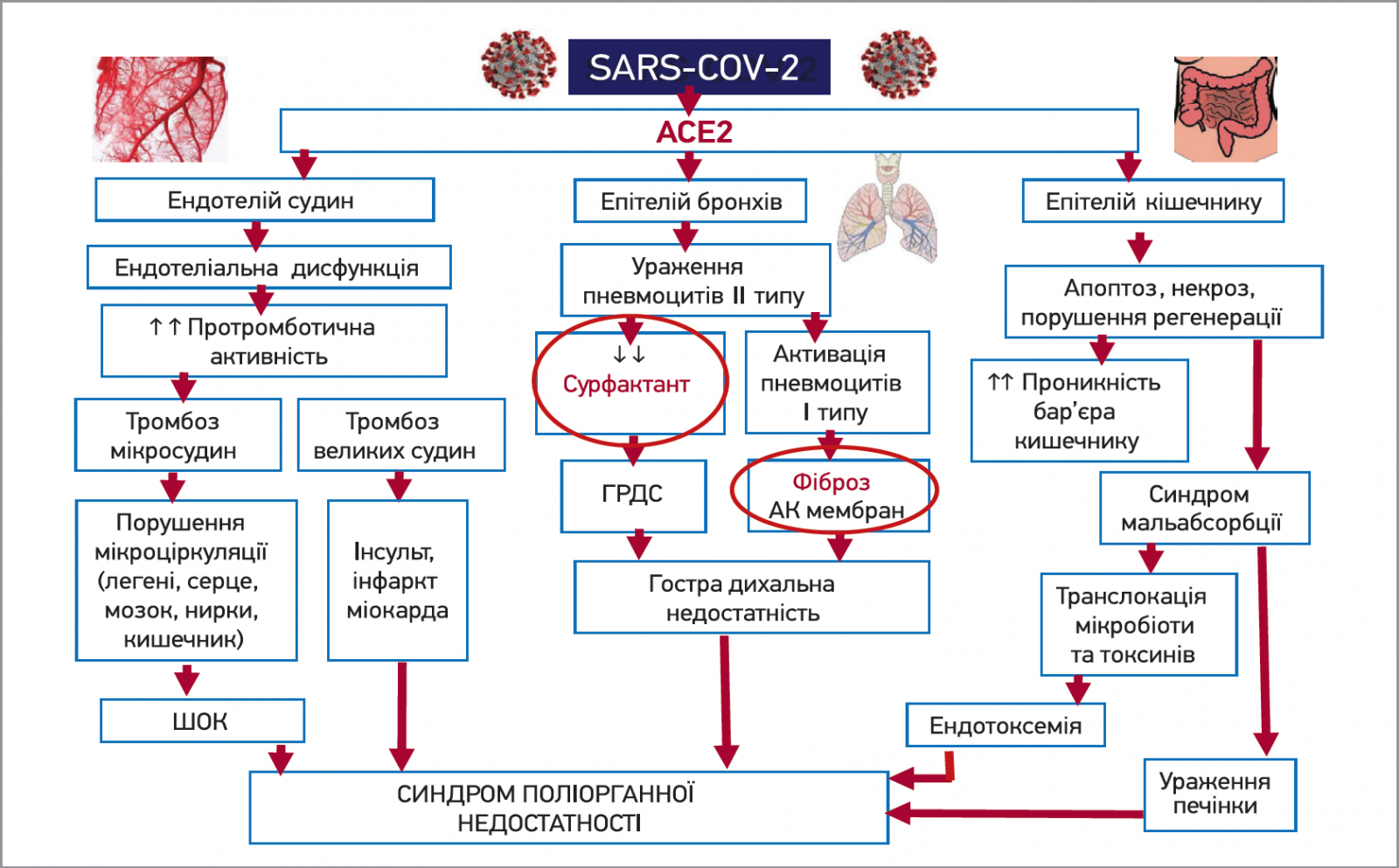
Ще в 1958 р. нобелівський лауреат з фізіології та медицини Д. Ледерберг підкреслив: «Єдине, що насправді погрожує пануванню людини на планеті, є вірус». Сьогодні його слова підтверджені нашими коронавірусними реаліями. Щодня завдяки сумлінній праці науковців усього світу з’являється нова інформація щодо генетичних особливостей, епідеміологічних характеристик і патогенетичних ланок SARS-CoV‑2 (рис. 3). Останні дані свідчать про здатність коронавірусу стимулювати ген АСЕ2, що кодує рецептор, який використовується для вірусної інвазії, шляхом активізації синтезу інтерферону – провідної протекторної системи організму людини, що фактично надає нові портали для SARS-CoV‑2-пенетрації. Крім легеневої тканини, високу експресію АСЕ2 виявлено в серці, кишечнику, нирках, ендотелії та сечовому міхурі. Ці дані наголошують на забороні застосування препаратів інтерферону на ранніх етапах коронавірусної хвороби.
Рис. 3. Патогенетичні ланки SARS-CoV-2
Ураження SARS-CoV‑2 альвеолоцитів ІІ типу знижує синтез сурфактанта, крім того, активізує альвеолоцити 1 типу, стимулюючи фібротичні процеси в альвеолокапілярній мембрані.
Амброксол та ацетилцистеїн належать до препаратів для надання медичної допомоги пацієнтам із COVID‑19.
Наразі є так звана теорія брадикінінового шторму. Висока концентрація брадикініну зумовлює розширення судин із подальшою гіпотонією, порушення ритму серця, а також підвищення судинної проникності, що призводить до більшої міграції імунних клітин і посилення запалення. Брадикінін підсилює синтез гіалуронової кислоти (в тому числі в легенях), що спричиняє накопичення гідрогелю в альвеолах, котре, своєю чергою, порушує газообмін у капілярах та альвеолах. Брадикініновий шторм призводить до підвищення проникності гематоенцефалічного бар’єра, що може лежати в основі неврологічної симптоматики в пацієнтів із COVID-19.
Тож вірус не лише уражає легені, а й викликає запальні процеси в ендотелії судин, що призводить до порушення мікроциркуляції. Уражаються ендотеліоцити альвеолярно-капілярного сегмента легень. Виникає набряк інтерстицію, посилюються фібротичні процеси в альвеолокапілярній мембрані. Ураження ендотелію судин цитокінами, а також в результаті активності брадикініну зумовлює розвиток системного «тліючого» запалення. Хронічне запалення супроводжуються гіперкоагуляцією, підвищенням рівня фібриногену, зниженням процесів фібринолізу й антикоагуляції. Виникає загроза легеневого фіброзу. Ензимотерапія сератіопептидазою виявляє достовірний фібринолітичний ефект за рахунок блокади інгібіторів плазміну, таким чином посилюючи власну фібринолітичну активність плазміну. А за рахунок гідролізу брадикініну, гістаміну та серотоніну має протизапальний та протинабряковий ефекти, знижує проникність судинної стінки та покращує мікроциркуляцію. Часто при лікуванні вірусно-бактеріальної інфекції виникає необхідність підвищити проникність антибіотиків і посилити їхню активність за рахунок руйнування біоплівок і пригнічення їх утворення. Для цього призначається препарат Мовіназа® (Movi Health) по 20 мг 2 рази на добу. Завдяки особливій технології виробництва таблетка препарату Мовіназа® має спеціальний подвійний захист і систему контрольованної доставки лікарської речовини, що забезпечує доставку сератіопептидази у відділи тонкого кишечнику та ферментативну активність у повному обсязі. До того ж таблетка не містить лактози. Тож протеолітичний фермент сератіопептидаза виявляє достовірний протизапальний, протинабряковий і фібринолітичний ефекти та покращує фармакотерапевтичну біодоступність базисних препаратів, завдяки чому має високий потенціал щодо застосування як ад’ювантна терапія COVID-19.
Підготувала Світлана Семенчук