26 грудня, 2022
Ефективність застосування цефдиніру в складі ступінчастої антибіотикотерапії позалікарняної пневмонії у дітей
 Пневмонія – це гостре респіраторне захворювання переважно бактеріальної етіології, що характеризується ураженням легень у вигляді запального процесу альвеол, проявляється клінічно дихальною недостатністю, рентгенологічно – наявністю інфільтративних змін у легенях [6]. Пневмонія є основною причиною госпіталізації дитячого населення та одним із найпоширеніших показань до призначення антибактеріальної терапії. Незважаючи на сучасні методи лікування, ця хвороба залишається основною причиною смерті дітей віком до 5 років, спричиняючи ≈1 млн смертей у всьому світі щороку [12]. Показник летальності від пневмонії серед дитячого населення нашої країни в середньому становить 13,1 випадку на 10 тис. [11, 13].
Пневмонія – це гостре респіраторне захворювання переважно бактеріальної етіології, що характеризується ураженням легень у вигляді запального процесу альвеол, проявляється клінічно дихальною недостатністю, рентгенологічно – наявністю інфільтративних змін у легенях [6]. Пневмонія є основною причиною госпіталізації дитячого населення та одним із найпоширеніших показань до призначення антибактеріальної терапії. Незважаючи на сучасні методи лікування, ця хвороба залишається основною причиною смерті дітей віком до 5 років, спричиняючи ≈1 млн смертей у всьому світі щороку [12]. Показник летальності від пневмонії серед дитячого населення нашої країни в середньому становить 13,1 випадку на 10 тис. [11, 13].
! На сьогоднішній день спостерігається підвищення стійкості мікроорганізмів, які є причиною розвитку пневмонії, до антибактеріальних препаратів, а поява резистентності до кількох лікарських засобів у хворих з пневмоніями ускладнює терапію та може сприяти розвитку тяжкого перебігу й ускладнень [2].
Основні клінічні ознаки пневмонії базуються на виявленні дихального дистрес-синдрому на тлі загальної інтоксикації, лихоманки, катаральних проявів (кашель). Дихальний дистрес-синдром діагностується при наявності задишки, участі в диханні допоміжної мускулатури, акроціанозу. Під час перкуторного дослідження виявляється локальне вкорочення перкуторного тону, при аускультації – жорстке чи бронхіальне дихання, крепітація, локальні, асиметричні вологі дрібнопухирчасті хрипи. Наявність запального процесу в легеневій тканині підтверджується виявленням легеневих інфільтратів за даними променевих методів дослідження (рентгенографія чи комп’ютерна томографія органів грудної порожнини) [15]. Результати рентгенографії надають важливі дані для остаточного діагнозу та класифікаційних критеріїв. Лабораторні ознаки у вигляді лейкоцитозу, нейтрофільозу, паличкоядерного зсуву формули крові, підвищення швидкості осідання еритроцитів (ШОЕ), підвищення рівня С‑реактивного білка (СРБ) допомагають діагностиці пневмонії та встановленню тяжкості її перебігу [4].
Основними детермінантами результатів надання медичної допомоги в разі пневмонії є вплив економічних, соціальних факторів, рівня надання медичної допомоги, широке впровадження антибіотикотерапії у клінічній практиці [9]. Ще в 2013 році Всесвітня організація охорони здоров’я (ВООЗ) і ЮНІСЕФ запустили Інтегрований глобальний план дій щодо пневмонії та діареї (GAPPD), щоб зменшити величезний тягар смертності від пневмонії й діареї серед дітей. GAPPD була першою глобальною структурою, яка встановила національні цілі попередження смертності від пневмонії, спрямовані на прискорення контролю над захворюванням за допомогою поєднання профілактики та лікування пневмонії у дітей з такими заходами:
- захищати дітей від пневмонії, включаючи сприяння винятково грудному вигодовуванню та адекватному прикорму;
- запобігання пневмонії за допомогою щеплень, миття рук із милом, зменшення забруднення повітря в домогосподарствах, профілактика ВІЛ і профілактика триметопримом/сульфаметоксазолом для ВІЛ‑інфікованих та контактних дітей;
- лікувати пневмонію, зосереджуючись на тому, щоб кожна хвора дитина мала доступ до належної допомоги – або від медичного працівника на рівні громади, або в медичному закладі, якщо хвороба тяжка, а також могла отримати необхідні антибіотики й кисень.
Терапія при захворюванні на пневмонію проводиться згідно з міжнародними рекомендаціями, настановами, протоколом лікування дітей з пневмонією, затвердженим Міністерством охорони здоров’я (МОЗ) України [3, 7, 15].
! Згідно із класифікаційними критеріями, якщо запальне ураження легень діагностується в домашніх умовах або протягом 48 год після надходження до стаціонару, пневмонія вважається позалікарняною [14].
Ці критерії дуже важливі, тому що позалікарняна пневмонія має свої пріоритети в етіологічній структурі, а отже, і в стратегії лікування. Етіологія позалікарняної пневмонії може відрізнятися серед пацієнтів залежно від стану здоров’я дитини до захворювання, місця проживання, навколишнього середовища, різноманітних контактів [4, 5], але клінічні симптоми розвитку пневмонії залишаються схожими.
Найчастіший збудник бактеріальної позалікарняної пневмонії у дітей – Streptococcus pneumoniae, другий за поширеністю – Haemophilus influenzae типу b (Hib) [9]. Тому рекомендації щодо антибіотиків і діагностичного тестування ґрунтуються на знанні того, що саме обмежена кількість збудників є причиною більшості випадків захворювання. Отже, для більшості пацієнтів із позалікарняною пневмонією емпірична антимікробна терапія, спрямована на пріоритетний етіологічний чинник, є економічно ефективною, а показники одужання – високими.
Клінічні рекомендації, міжнародні настанови, стратегія лікування в нашій країні (наказ МОЗ України від 02 серпня 2022 року № 1380) спрямовані на те, щоб виключити певні групи пацієнтів із ризиком розвитку позалікарняної пневмонії з етіологічною причиною мікроорганізмів, які не піддаються ефективному лікуванню за допомогою стандартних антимікробних рекомендацій. Окрім того, існують групи ризику хворих, для яких слід ураховувати можливість альтернативних збудників. Ретельний анамнез для визначення потенційної експозиції разом зі знанням супутніх захворювань та інших факторів ризику дозволяє проникливому клініцисту розширити диференційну діагностику і бути готовим до відсутності позитивної динаміки при призначенні стартової терапії. Це, своєю чергою, впливає на вибір емпіричної антимікробної терапії та селективного діагностичного тестування [1, 6].
Відповідно до останніх аналізів і досліджень підкреслюється, що незалежно від дози антибіотика та тривалості його введення в разі отримання стартової антимікробної терапії приблизно кожній восьмій дитині треба призначати інший антибіотик за відсутності клінічного покращення [3]. Пацієнти з позалікарняною пневмонією, у яких не вдається стабілізувати чи клінічно покращити стан через 24-48 год, повинні пройти повторний огляд, приділяючи особливу увагу незвичним причинам пневмонії, що не лікуються стандартною терапією.
Метою нашого дослідження стало вивчення ефективності та безпечності використання препарату цефдинір (Родинір) у складі ступінчастої антибіотикотерапії у дітей з позалікарняною пневмонією.
Матеріали та методи
Під нашим спостереженням із вересня 2021 року по вересень 2022 року в педіатричному та інфекційному відділеннях (для лікування ГРВІ та їхніх ускладнень) КНП КМКДЛ № 1 знаходилися 29 дітей, хворих на позалікарняну пневмонію. Середній вік хворих склав 8,37±0,78 року (від 5 до 11 років). Хлопчиків було 14 (48,27%), дівчаток – 15 (51,73%).
Діти на початку захворювання мали такі симптоми: лихоманка, гострий риніт, кашель. На тлі стійкої лихоманки на 3-4-й день з’являлися симптоми респіраторного дистрес-синдрому (задишка, кашель, у 86,2% почали прослуховуватися специфічні хрипи в легенях), у зв’язку із чим відповідно до клінічних рекомендацій дітям були призначені антибактеріальні препарати із групи напівсинтетичних пеніцилінів, але через 24-48 год стан хворих не мав позитивної динаміки, вони були скеровані до стаціонару для подальшого обстеження та оптимізації терапії.
Середній термін до госпіталізації після появи перших симптомів гострого респіраторного захворювання становив 4,7±0,34 доби. Під час надходження до стаціонару у хворих проводилися збирання скарг, аналіз анамнезу хвороби, фізикальне обстеження, рентгенологічне дослідження, лабораторні обстеження.
З огляду на те що діти при призначенні напівсинтетичних пеніцилінів не мали позитивної динаміки перебігу захворювання, дітям проводили посів мокротиння на флору з аналізом її чутливості до антибактеріальних препаратів.
Лабораторні дослідження включали загальний аналіз крові, загальний аналіз сечі, визначення рівня СРБ, рівня загального білка крові. Діагноз позалікарняної пневмонії було встановлено після рентгенологічного обстеження хворих із висновком спеціаліста променевої діагностики про наявність змін у легенях запального характеру.
На основі результатів проведених обстежень та результатів рентгенографії органів грудної клітки (виявлення вогнищевих чи сегментарних інфільтративних тіней у легенях) хворим встановлено такі клінічні діагнози: позалікарняна вогнищева пневмонія – 17 (58,62%), позалікарняна сегментарна пневмонія – 12 (41,38%). Тяжкість стану пацієнтів була обумовлена переважно інтоксикаційним синдромом, лихоманкою, дихальною недостатністю з явищами гіпоксії. Ступінь тяжкості хвороби в усіх випадках був середнім. Дихальна недостатність, за даними фізикального обстеження, мала місце у 100% дітей. З них у 21 (72,41%) пацієнта вона була першого ступеня, у 8 (27,58%) – другого. Перебіг хвороби в усіх випадках був неускладненим.
! З метою обґрунтування раціонального використання антибіотиків нами досліджено та порівняно терапевтичний ефект ступінчастої терапії з використанням цефалоспорину ІІІ покоління парентерального введення з переходом на пероральний спосіб введення.
Стартово всім хворим призначався цефалоспорин ІІІ покоління (цефтріаксон) парентерально в дозі 90 мг/кг/добу. Через 48-72 год проводилася повторна оцінка клінічних показників хворих, наявність побічних ефектів лікування. У всіх дітей через 48-72 год із початку терапії спостерігалися позитивна динаміка перебігу хвороби у вигляді зниження максимальної добової температури тіла до субфебрильної, зменшення проявів інтоксикації. На основі відповідності динаміки перебігу пневмонії критеріям повного ефекту від антибіотикотерапії згідно із Протоколом лікування дітей з пневмонією МОЗ України [15] всім хворим на 4-5-й день лікування відмінили парентеральне введення антибактеріального препарату та призначили цефдинір (Родинір) перорально відповідно до інструкції для медичного застосування препарату в дозі 7 мг/кг маси тіла 1 р/12 год. Загальний курс антибіотикотерапії становив 10-14 діб.
! Для лікування дітей з масою тіла до 43 кг Родинір випускається у формі порошку для приготування суспензії 100 мл, завдяки чому флакона було достатньо для проведення 10-денного курсу лікування. В дітей з масою тіла від 43 кг ми використовували капсули Родиніру по 300 мг, які пацієнти приймали 2 р/добу.
Під час прийняття рішення про переведення з парентерального введення антибактеріального препарату на пероральний для проведення ступінчастої терапії ми користувалися такими міркуваннями: цефдинір (Родинір) є напівсинтетичним цефалоспориновим пероральним антибіотиком широкого спектра дії III покоління. Як і інші антибіотики групи цефалоспоринів, цефдинір чинить бактерицидну дію щодо чутливих мікроорганізмів завдяки пригніченню синтезу клітинної стінки. Діюча основа є стійкою до дії багатьох β-лактамаз. Цефдинір має широкий спектр дії проти багатьох грампозитивних та грамнегативних аеробних організмів, зокрема Streptococcus pneumoniae, Staphylococcus aureus, Streptococcus pyogenes, Hemophilus spp., швидко всмоктується із шлунковокишкового тракту (середній час до досягнення пікової концентрації у плазмі крові – 3 год) і майже повністю виводиться через нирки в незмінному вигляді. Кінцевий період напіввиведення цефдиніру становить 1,5 год. Слід зазначити, що у вітчизняній літературі дослідженню клінічної ефективності цефдиніру присвячені поодинокі дослідження [1].
! Цефдинір рекомендований Американською академією педіатрії (Nelson’s Pediatric Antimicrobial Therapy, 2021) для лікування пневмонії насамперед за підозри на Haemophilus influenzae, а також при алергії на пеніцилін, ампіцилін або амоксицилін. Також цефдинір наявний у міжнародних рекомендаціях з лікування гострого середнього отиту, гострого бактеріального синуситу, а для лікування стрептококового фарингіту Управлінням з контролю за якістю продуктів харчування та лікарських засобів (FDA) схвалено 5-денний курс лікування цефдиніром. Його ефективність і безпека підтверджені численними клінічними дослідженнями.
В нашому дослідженні 11 дітям при надходженні до стаціонару у зв’язку з виразним інтоксикаційним синдромом була призначена інфузійна терапія сольовими розчинами протягом 2-3 діб. Додатково призначалися антипіретики, проводилася інгаляційна, муколітична терапія синтетичними муколітиками. Після консультації лікаря відновної терапії дітям призначалися масаж, інгаляційна терапія, електропроцедури.
Всім дітям проводилася оцінка ефективності лікування за допомогою фізикального та повторного лабораторного обстеження на 5-10-й день з початку терапії.
Також ми ретроспективно проаналізували тривалість лікування 18 дітей з гострою позалікарняною пневмонією, які впродовж 10-14 діб отримували цефалоспорин ІІІ покоління парентерально відповідно до віку. Вони склали групу порівняння.
Отримані дані були статистично оброблені з використанням пакету прикладних програм Excel 2007.
Результати
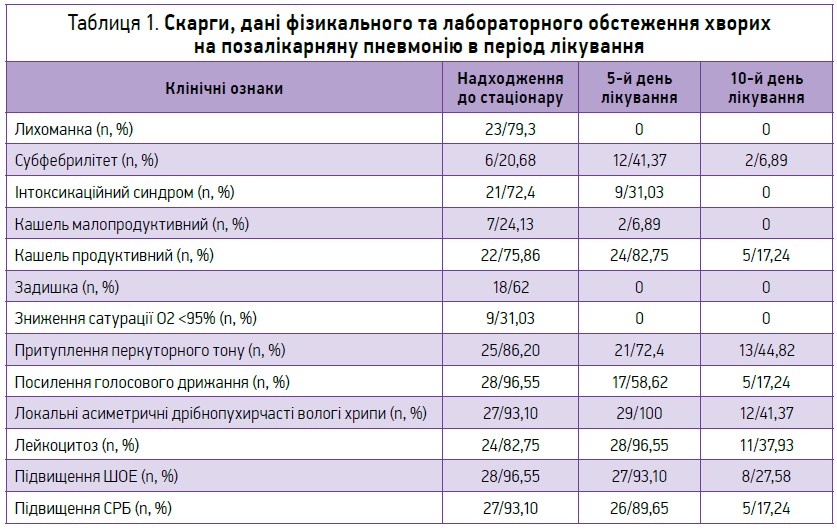
Частота скарг, дані фізикального й лабораторного обстеження хворих на позалікарняну пневмонію, які отримували ступінчасту терапію антибактеріальними препаратами, при госпіталізації та повторному обстеженні через 5 і 10 днів терапії наведено в таблиці 1.
При аналізі наявності в хворих предикторів гострої пневмонії були виявлені зміни стандартних показників. Усі хворі на момент госпіталізації скаржилися на наявність кашлю (який був продуктивним у 75,86% випадків, малопродуктивним/непродуктивним – у 24,13%), а також на лихоманку (в 79,3% випадків – фебрильна, в 20,68% – субфебрильна). 72,4% пацієнтів мали інтоксикаційний синдром різного ступеня, 86,20% – локальні зміни під час фізикального обстеження у вигляді притуплення перкуторного тону за перкусії легень, 96,55% – підсилене голосове дрижання, у 93,10% виявлені зміни у вигляді крепітації та/або локальних асиметричних вологих дрібнопухирчастих хрипів на тлі жорсткого дихання при аускультації легень, у 93,10% був підвищеним СРБ (до +/++). У переважної більшості дітей під час лабораторного обстеження виявлено лейкоцитоз (82,75%) та підвищення ШОЕ (96,55%).
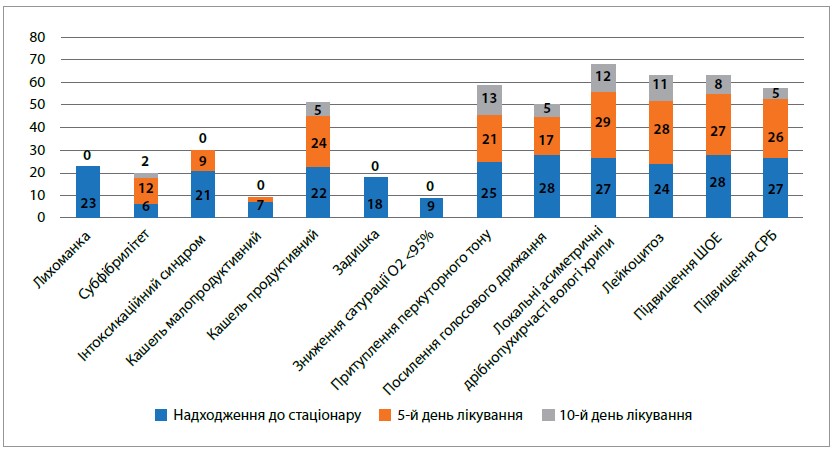
! У процесі лікування на тлі позитивної динаміки при заміні парентерального цефалоспорину ІІІ покоління на пероральний антибактеріальний препарат цефдинір (Родинір) спостерігалася позитивна динаміка стану хворих дітей (рис.).
Рис. Дані клінічного обстеження залежно від терміну лікування
З огляду на наведені дані більшість скарг і симптомів, як-от лихоманка, інтоксикаційний синдром, явища дихальної недостатності, локальні зміни при фізикальному обстеженні легень та відхилення в лабораторних показниках (крім підвищення ШОЕ) при повторних обстеженнях, достовірно зменшилися. Продуктивний кашель (17,24%) та наявність локальних хрипів при аускультації легень мали місце у 41,37% пацієнтів, зустрічалися достовірно рідше порівняно з обстеженням під час госпіталізації (р<0,01) і були розцінені як залишкові явища в періоді реконвалесценції. У 8 (27,58%) дітей під час повторного обстеження на 10-й день захворювання зберігалося підвищення ШОЕ, проте під впливом терапії у цих хворих вона зменшилася із середнього показника 38,92±0,21 мм/год до 17,16±0,03 мм/год. Аналізуючи показники ШОЕ як запальний процес, нормалізацію інших лабораторних показників і даних фізикального обстеження в зазначених пацієнтів, ми розцінили ці результати як залишкові явища, що не потребують додаткових терапевтичних заходів. У трьох випадках у дітей з несприятливим алергічним анамнезом спостерігався незначний висип, розцінений як антибіотикоасоційована алергічна реакція на антибіотик, що вводився парентерально, але при переведенні на пероральний прийом препарату Родинір у жодному випадку побічних явищ лікування нами не було виявлено.
Аналізуючи мікрофлору, висіяну з мокротиння дітей після нетривалого прийому напівсинтетичних пеніцилінів в амбулаторних умовах, була виділена як грампозитивна (27,58%), так і грамнегативна флора (34,48%). В 37,93% посівів виділення мікрофлори не спостерігалося.
Серед грампозитивних мікроорганізмів із найбільшою частотою висівалися Streptococcus рneumoniae (24,13%), Streptococcus pyogenes (6,89%), Staphylococcus aureus (6,89%). Із грамнегативних бактерій частіше зустрічалися Hemophilus influenzae (31,03%), Moraxella сatarrhalis (6,89%). В кількох випадках мікрофлора була поєднана.
Вивчення чутливості мікроорганізмів до антибіотиків показало високий ступінь чутливості до цефалоспоринів ІІІ поколіннях (94,4%), а це свідчило про те, що перехід на цефалоспорин ІІІ покоління після призначення напівсинтетичних пеніцилінів у групі дітей, у яких не спостерігалася позитивна клінічна динаміка на тлі стартового введення антибактеріального препарату, був виправданим.
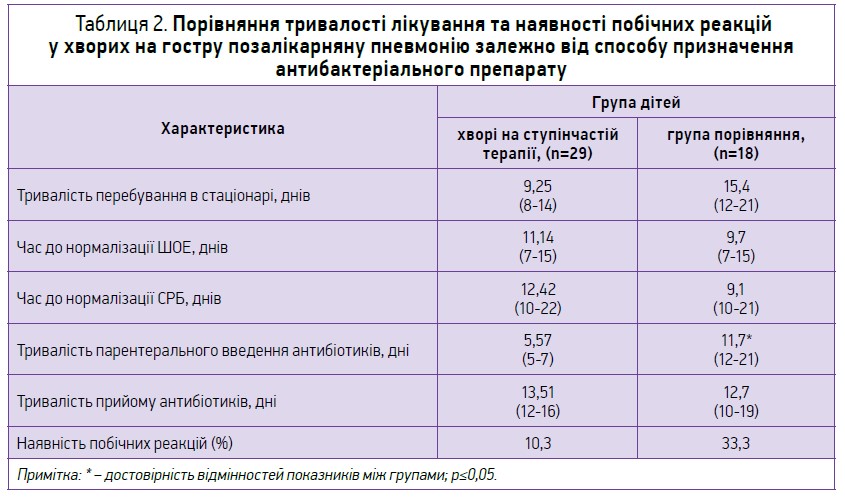
Порівняння тривалості лікування дітей, які отримували цефалоспорини ІІІ покоління парентерально впродовж усього лікування та при ступінчастій терапії, наведено в таблиці 2.
! З огляду на наведені дані діти, які отримували ступінчасту терапію, перебували в стаціонарі в середньому на 2 дні менше за рахунок рекомендацій продовжити антибактеріальну терапію в амбулаторних умовах, ніж пацієнти, котрі отримували антибактеріальний препарат парентерально.
А ось час нормалізації ШОЕ та СРБ був відносно швидшим у групі дітей з парентеральним методом призначення антибактеріального препарату, хоча достовірної різниці між показниками виявлено не було. За рахунок зовнішнього онлайн-контакту ми провели контроль тривалості прийому антибактеріального препарату в амбулаторних умовах під наглядом сімейного лікаря або педіатра. Різниці в загальній тривалості прийому антибактеріального препарату виявлено не було.
Обговорення результатів
Оцінка результатів стратегії лікування гострої позалікарняної пневмонії у дітей методом ступінчастої терапії з переведенням на 4-5-ту добу з парентерального введення антибактеріального препарату (цефалоспорину ІІІ покоління) на пероральний препарат Родинір (цефалоспорин ІІІ покоління) і стандартним парентеральним введенням є ретропроспективним аналізом клініко-лабораторних й інструментальних даних 47 дітей, госпіталізованих з документально підтвердженим діагнозом різного ступеня тяжкості за відсутності супутніх захворювань. Результати проведеного дослідження продемонстрували, що використання методу ступінчастої антибактеріальної терапії надає можливість зменшити термін лікування в умовах стаціонару, отже, й витрати на медичне обслуговування, а за потреби можливо продовжити лікування, в т. ч. і відновне в амбулаторних умовах. Отримані результати можуть потенційно спонукати клініцистів до раннього переходу від парентеральної антибактеріальної терапії до перорального її продовження.
Необхідно відмітити той факт, що більшість дітей (89,66%) позитивно поставилися до зміни форми введення антибактеріального препарату, а це сприяло покращенню самопочуття, підвищенню рухової активності; 79,31% схвалили органолептичні властивості перорального антибактеріального препарату.
Наше дослідження співпадає з результатами аналізу й даними Y. Li та співавт. (2017), які повідомили, що при призначенні високих доз внутрішньовенних антибіотиків доцільним є перехід на пероральний прийом антибактеріальних препаратів, а скорочення курсу парентерального способу введення на >1 тиж не має істотного впливу на прогноз [8].
Обмеження нашого дослідження – малий розмір вибірки, що свідчить про необхідність продовження відповідного випробування.
Висновки
Пероральну форму цефалоспорину ІІІ покоління (Родинір), що має дві форми випуску (порошок для приготування оральної суспензії та капсули), доцільно призначати в разі позалікарняної пневмонії у дітей за використання ступінчастої антибактеріальної терапії.
Застосування методу ступінчастої антибактеріальної терапії надає можливість зменшити термін лікування в умовах стаціонару та витрати на медичне обслуговування, а за потреби можна продовжити лікування, в т. ч. відновне в амбулаторних умовах.
Дослідження показало високий ступінь безпечності препарату Родинір; побічні та алергічні реакції при його використанні не спостерігалися.
Список літератури знаходиться в редакції.
Медична газета «Здоров’я України 21 сторіччя» № 15-16 (532-533), 2022 р.