21 листопада, 2023
Псевдоексфоліативна та пігментна глаукома: епідеміологія, механізми розвитку, сучасні підходи до діагностики і лікування
Глаукома – це гетерогенна група прогресувальних захворювань, які спричиняють незворотну сліпоту. Синдроми псевдоексфоліації (ПЕКС) та дисперсії пігменту є поширеними причинами вторинної глаукоми. Відповідні відкладення можуть перешкоджати роботі трабекулярної сітки, що зумовлює утруднення відтоку водянистої вологи (ВВ), очну гіпертензію та нейропатію зорового нерва.
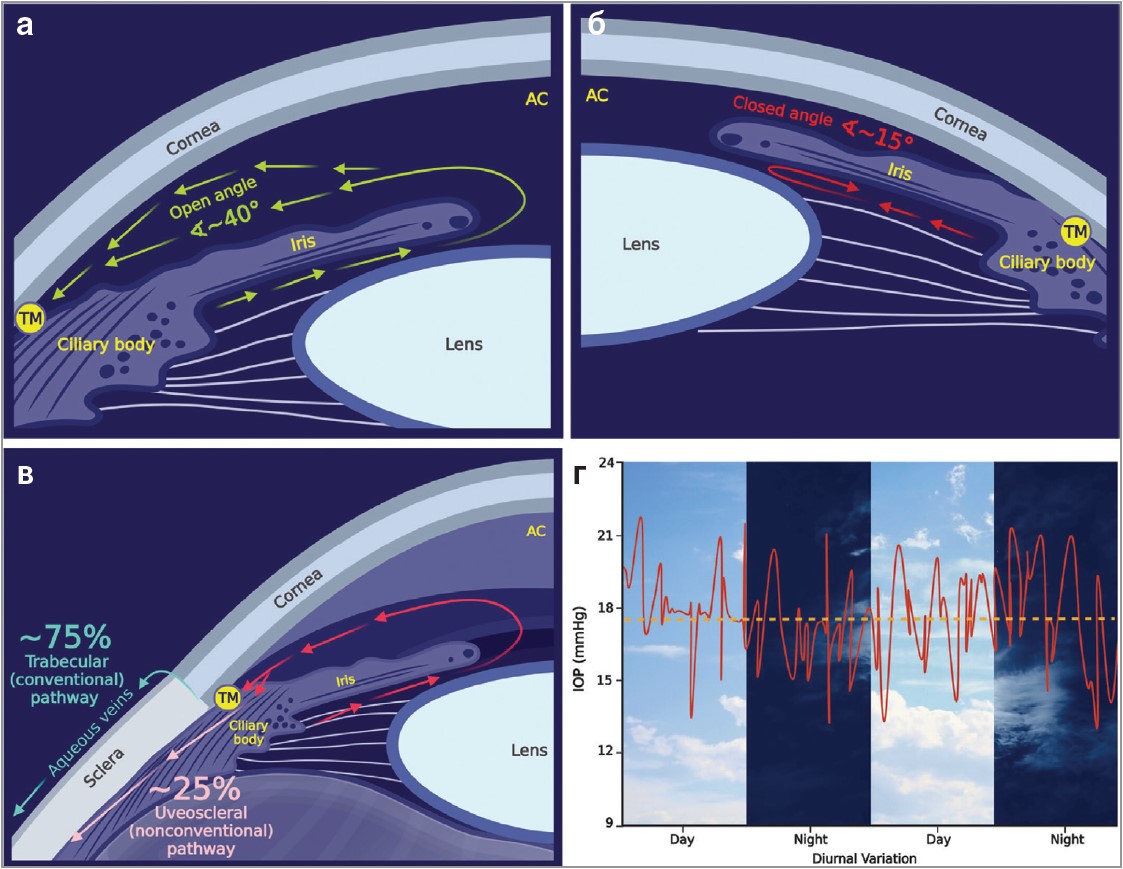
Глаукому класифікують за формою іридокорнеального кута: відкритокутова (рис. 1а) чи закритокутова (рис. 1б), а також за етіологією: первинна та вторинна. Утворений на перетині райдужки і рогівки кут містить трабекулярну сітку (ТС) – складну, фенестровану структуру, яка слугує дренажною системою для ВВ. ВВ – це прозора рідина, яка активно виробляється циліарними відростками, а також заповнює передню порожнину ока (рис. 1в). ВВ живить рогівку, кришталик і ТС. Рівень ВВ допомагає підтримувати гомеостаз внутрішньоочного тиску (ВОТ). Неадекватне виділення ВВ зумовлює підвищення ВОТ, що спричиняє ушкодження зорового нерва та прогресувальну втрату зору. Спочатку глаукома демонструє великі коливання ВОТ протягом 24-годинного періоду.
Рис. 1. Анатомічний кут, потік ВВ і добові коливання ВОТ
Примітки: а) відкритий іридокорнеальний кут. Анатомічний кут (<40°) між райдужкою та рогівкою дозволяє ВВ, що продукується циліарним тілом, витікати з ока через ТС; б) закритий іридокорнеальний кут. Зміщення райдужки і кришталика зумовлює закриття іридокорнеального кута (<15 або менше), що перешкоджає адекватному відтоку ВВ через ТС; в) фізіологічні шляхи відтоку ВВ. Трабекулярний шлях дренує 75-90% ВВ через ТС і водянисті вени. Увеосклеральний шлях відводить 10-25% ВВ через зіницю та склеру. Обидва шляхи відтоку розташовані під іридокорнеальним кутом; г) значні коливання ВОТ на ранній стадії глаукоми.
Сornea – рогівка; open angle – відкритий кут; iris – райдужка; ciliary body – циліарне тіло; lens – кришталик; TM – трабекулярна сітка; АС – передня камера; closed angle – закритий кут; trabecular pathway – трабекулярний шлях; aqueous veins – водянисті вени; sclera – склера; uveoscleral pathway – увеосклеральний шлях; IOP (mmHg) – ВОТ (мм рт. ст.); day – день; night – ніч; diurnal variation – добові зміни.
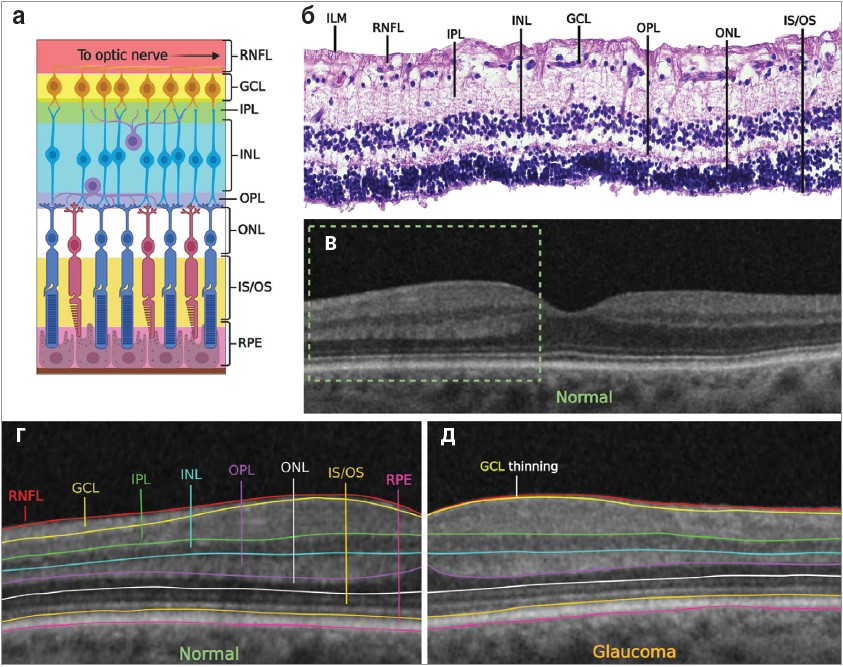
Тривала очна гіпертензія згубно впливає на здоров’я гангліозних клітин сітківки (ГКС), які є спеціалізованими нейронами, що передають зорову інформацію від сітківки до мозку (рис. 2). Аксони ГКС проходять через головку зорового нерва, простягаються до латерального генікулярного ядра в головному мозку. Неінвазивна оптична когерентна томографія (ОКТ) може показати прогресувальне витончення нейроретинальної оболонки, збільшення чашки зорового нерва, що відображає втрату аксонів ГКС, підтримувальної глії, кровоносних судин. Прогнозується, що на кожен 1 мм рт. ст. підвищення середнього ВОТ прогресування глаукоми збільшується на ≈13%.
Рис. 2. Шари сітківки, їхнє зображення, ідентифікація на гістології, ОКТ, порівняння між нормою і глаукомою
Примітки: а) схематичне зображення шарів сітківки – зверху вниз: шар нервових волокон сітківки (RNFL), шар гангліозних клітин (GCL), шар внутрішнього сплетіння (IPL), внутрішній ядерний шар (INL), шар зовнішнього сплетіння (OPL), зовнішній ядерний шар (ONL), внутрішній і зовнішній сегменти фоторецепторів (IS/OS), пігментний епітелій сітківки (RPE); б) гістологічний зріз шарів сітківки, забарвлених гематоксиліном і еозином здорового ока; в) нормальний макулярний ОКТ-знімок. Зеленим кольором позначено ділянку, описану на рисунку 2г; г) зблизька нормальний макулярний ОКТ-знімок з окресленням шарів сітківки; д) макулярна ОКТ пацієнта із глаукомою, що демонструє значне витончення GCL.
To optic nerve – до зорового нерва; GCL thinming – стоншення шару гангліонарних клітин.
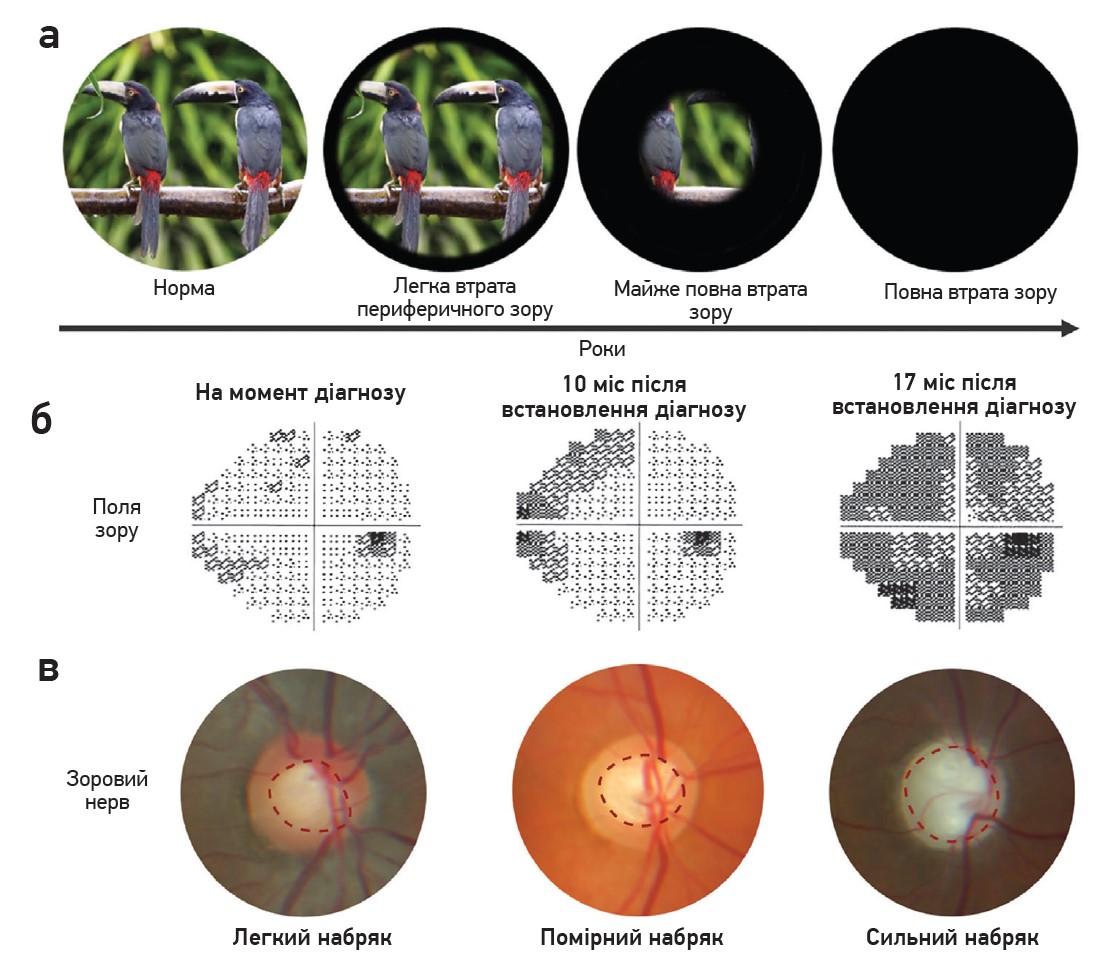
Зазвичай спочатку страждає периферійний зір, але без лікування може бути втрачений увесь зір (рис. 3а). ВОТ залишається єдиним відомим фактором ризику глаукоми, який можна модифікувати. Клінічний діагноз глаукоми базується на прогресувальній втраті гостроти зору на статичних периметричних картах (рис. 3б), блідості та западанні зорового нерва (рис. 3в), підвищенні ВОТ (рис. 3г).
Рис. 3. Втрата зору та клінічні характеристики при глаукомі
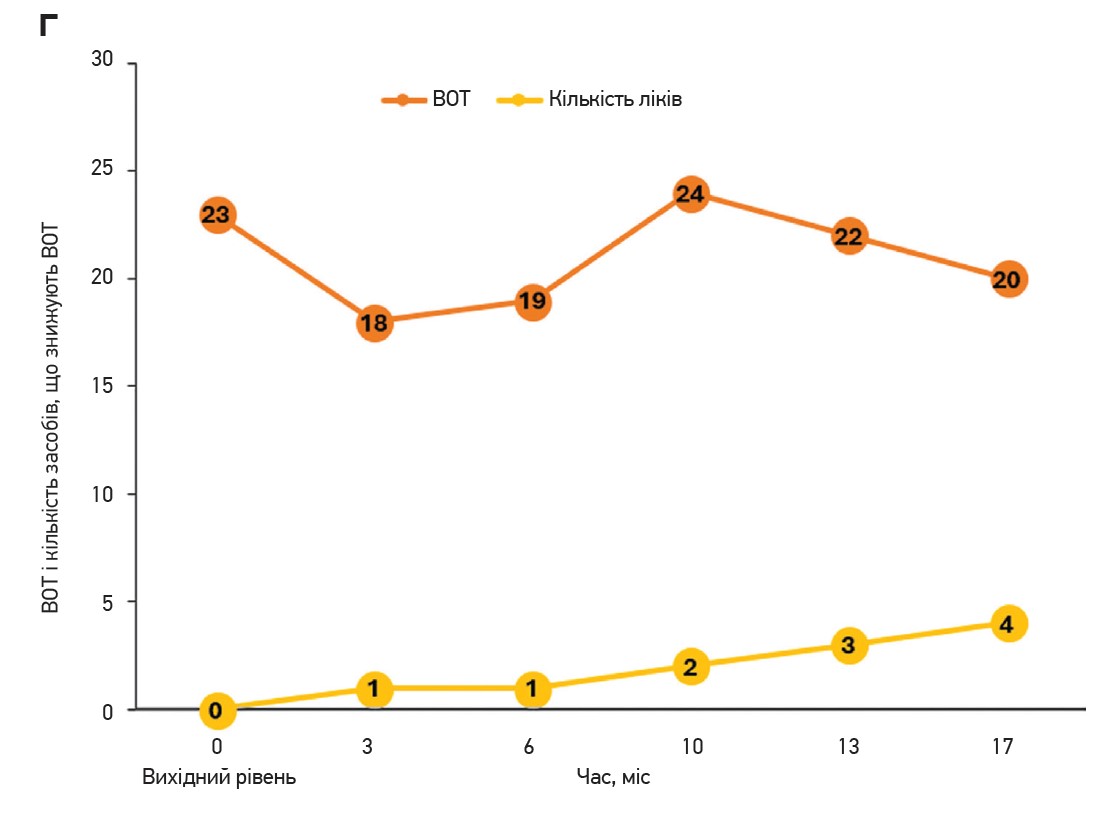
Примітки: а) прогресувальна втрата периферичного зору з роками. На початковому етапі можуть не спостерігатися жодні зміни зору. Спочатку страждає периферійний зір. У міру прогресування глаукоми та за відсутності належного лікування може бути втрачений увесь зір; б) тести статичної периметрії за глаукоми в різні моменти часу. Сірі / чорні ділянки – це дефекти поля зору; в) головка зорового нерва на різних стадіях захворювання. Головка зорового нерва (або диск зорового нерва) – місце, де аксони ГКС залишають око, формують зоровий нерв. Втрата аксонів і клітинних тіл ГКС зумовлює набряк диска зорового нерва (червона пунктирна лінія). Збільшення співвідношення чашки до диска (>0,5) є ознакою глаукоми; г) збільшення співвідношення чашки до диска із часом спричиняє погіршення контролю ВОТ. Продемонстровано вимірювання ВОТ пацієнта (помаранчевий колір) і кількість препаратів для зниження ВОТ, які він приймає (жовтий колір) із плином часу. Незважаючи на прийом декількох препаратів, ВОТ може залишатися вище чи на рівні верхньої межі норми (загальноприйнятий діапазон становить 10-21 мм рт. ст.).
Коли етіологія глаукоми є ідіопатичною, її називають первинною, а якщо вона виникає унаслідок інших захворювань, то вважається вторинною.
Найпоширеніша причина вторинної глаукоми – синдром ПЕКС, що є віковим захворюванням сполучної тканини, яке включає відкладення пухкого фібрилярного псевдоексфоліативного матеріалу (ПЕМ) у позаклітинному матриксі (ПКМ) різних органів, включаючи око (рис. 4а).
В оці ПЕМ можна виявити в структурах переднього сегмента та кон’юнктиві. ПЕМ і вивільнений пігмент райдужки, що є ознакою ПЕКС, можуть накопичуватися на ТС, збільшувати опір відтоку ВВ (рис. 4б). Згодом ВОТ підвищується і поступово зумовлює глаукоматозну нейропатію зорового нерва. Цей патологічний процес називається псевдоексфоліативною глаукомою (ПЕКСГ). Порівняно з найпоширенішим типом глаукоми, первинною відкритокутовою глаукомою (ПВКГ) ПЕКСГ має гірший прогноз і характеризується швидким прогресуванням, вищим ВОТ, гіршою відповіддю на медикаментозне лікування. Крім того, ПЕКС підвищує ризик розвитку катаракти, ускладнень за її екстракції, оклюзії вен сітківки та підвивиху кришталика.
Синдром дисперсії пігменту (СДП) – ще одна поширена причина вторинної глаукоми. СПД зазвичай уражає молодих, короткозорих і чоловіків. Успадкування СДП є багатофакторним, повідомляється про сімейні та спорадичні випадки. Сімейні випадки демонструють автосомно-домінантне успадкування. При СДП аномальний іридорогівковий контакт, спричинений фізіологічним рухом зіниць й акомодацією, ушкоджує клітини пігментного епітелію райдужної оболонки та вивільняє пігмент. Пігментний матеріал виділяється із задньої поверхні райдужки, а потім може поширюватися всією передньою камерою (ПК). Гранули пігменту можуть осідати в ТС, ушкоджувати навколишні клітини, збільшувати опір відтоку ВВ. Пігментна глаукома (ПГ) виникає, коли очна гіпертензія, спричинена СДП, зумовлює глаукомну нейропатію зорового нерва. На відміну від ПЕКС, СДП регресує з віком, імовірно, через вікові зміни акомодації та товщини кришталика.
Псевдоексфоліативна глаукома
Епідеміологія
Ймовірність розвитку ПЕКС зростає з віком; ця закономірність спостерігається в багатьох дослідженнях.
Країни з нижчими температурами в літній і зимовий сезони мають тенденцію до підвищеної поширеності ПЕКС. Сонячний вплив, особливо відбитий від поверхонь, як-от сніг або вода, збільшує ризик розвитку ПЕКС. Особи, які в середньому більше часу проводять на свіжому повітрі та зазнають впливу ультрафіолетового (УФ) світла протягом життя, є чутливішими до ПЕКС. Більша висота над рівнем моря асоціюється з підвищеним ризиком розвитку ПЕКС. Дієтичні фактори також відіграють певну роль у розвитку ПЕКС. Підвищений рівень гомоцистеїну, який може бути наслідком дефіциту вітамінів В6, В12 або фолатів, пов’язаний з підвищеним ризиком розвитку ПЕКС. Установлено, що підвищене споживання фолатів знижує ризик розвитку ПЕКСГ. Окрім того, вживання значної кількості кави та чаю збільшує поширеність ПЕКС, імовірно, через підвищення рівня гомоцистеїну.
Діагностика
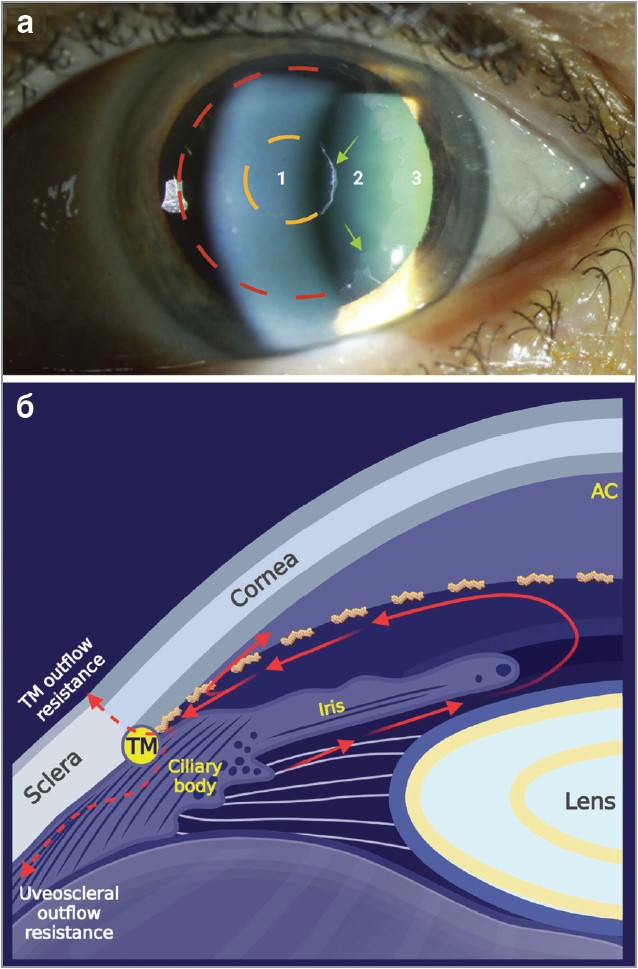
ПЕКС можна діагностувати на основі анамнезу, розширення зіниць та дослідження за допомогою ковзної лампи. Підозра на ПЕКС потребує проведення гоніоскопії, тонометрії, тестування поля зору й оцінки нервових волокон сітківки за допомогою ОКТ. ПЕКС є асиметричним, двобічним розладом, який може проявлятися однобічно, якщо ПЕМ розподілено нерівномірно. Двобічна форма зазвичай спостерігається в пацієнтів старшого віку з вищими ВОТ і частотою глаукоми порівняно із хворими з однобічною формою. Однобічні прояви із часом стають двобічними. Під час огляду в передньому відрізку ока часто видно біло-сірі гранульовані відкладення. Характерною ознакою ПЕКС є втрата пігменту з ділянки сфінктера райдужки. Розширення зіниці має важливе значення для оцінки розподілу ПЕМ на передній капсулі кришталика. При розширенні зіниці на передній капсулі кришталика видно 3 зони, окреслені ПЕМ: гомогенна центральна, що відображає діаметр зіниці до розширення (може бути відсутня), чітка проміжна, а також зерниста периферійна зона з радіальною смугастістю (рис. 4а).
Пацієнти з ПЕКС можуть мати погане розширення зіниць через фіброзні, ішемічні та атрофічні зміни в райдужці внаслідок відкладень ПЕМ. Під час гоніоскопії можна побачити хвилясте відкладення пігменту перед лінією Швальбе (т. зв. лінію Сампаолезі). ТС демонструє підвищену плямисту пігментацію (рис. 4б).
Рис. 4. Репрезентативна клінічна картина та патофізіологія псевдоексфоліативної глаукоми
Примітки:
а) ПЕМ у вигляді характерного «бичачого ока» на передній капсулі кришталика; ідентифікується як білі відкладення (зелені стрілки) під час дослідження в лампі ковзання. При розширенні видно 3 зони: центральна, що відображає діаметр зіниці до розширення (пунктирна жовта лінія); чітка проміжна; зерниста периферична зона з радіальною смугастістю (пунктирна червона лінія);
б) підвищений опір відтоку в ПЕКС. Плямисті відкладення ПЕМ в іридокорнеальному куті спричиняють неадекватний відтік ВВ через ТС та увеосклеральний шлях.
TM – трабекулярна сітка; TM outflow resistance – опір відтоку трабекулярної сітки; AC – передня камера; cornea – рогівка; sclera – склера; iris – райдужка; lens – кришталик; ciliary body – циліарне тіло; uveoscleral outflow resistance – увеосклеральний опір відтоку.
Патогенез
ПЕМ – рушійна сила складного процесу захворювання ПЕКС/ПЕКСГ. Внутрішньоочно фібрили ПЕМ утворюються капсулою кришталика, циліарним тілом, райдужною оболонкою, ендотелієм рогівки та ТС.
ПЕМ – це високоглікозильований, зшитий і ферментативно стійкий глікопротеїн / протеоглікановий комплекс. Білкове ядро ПЕМ складається з таких компонентів базальної мембрани (БМ): фібрилін‑1, еластин, ламінін і фібронектин, а також активних ферментів, як-от матриксні металопротеїнази (ММП), кластерин, лізилоксидаза-подібна 1 (LOXL1). ПЕМ стійкий до ферментативної деградації більшістю ферментів, включаючи колагеназу, трипсин, пепсин і папаїн.
Дослідження генетичних асоціацій (GWAS) виявили численні генетичні локуси, пов’язані з ПЕКС і ПЕКСГ, з яких LOXL1 має найсильніший генетичний ефект у різних популяціях. LOXL1 не асоціюється із жодною іншою формою глаукоми, крім ПЕКСГ.
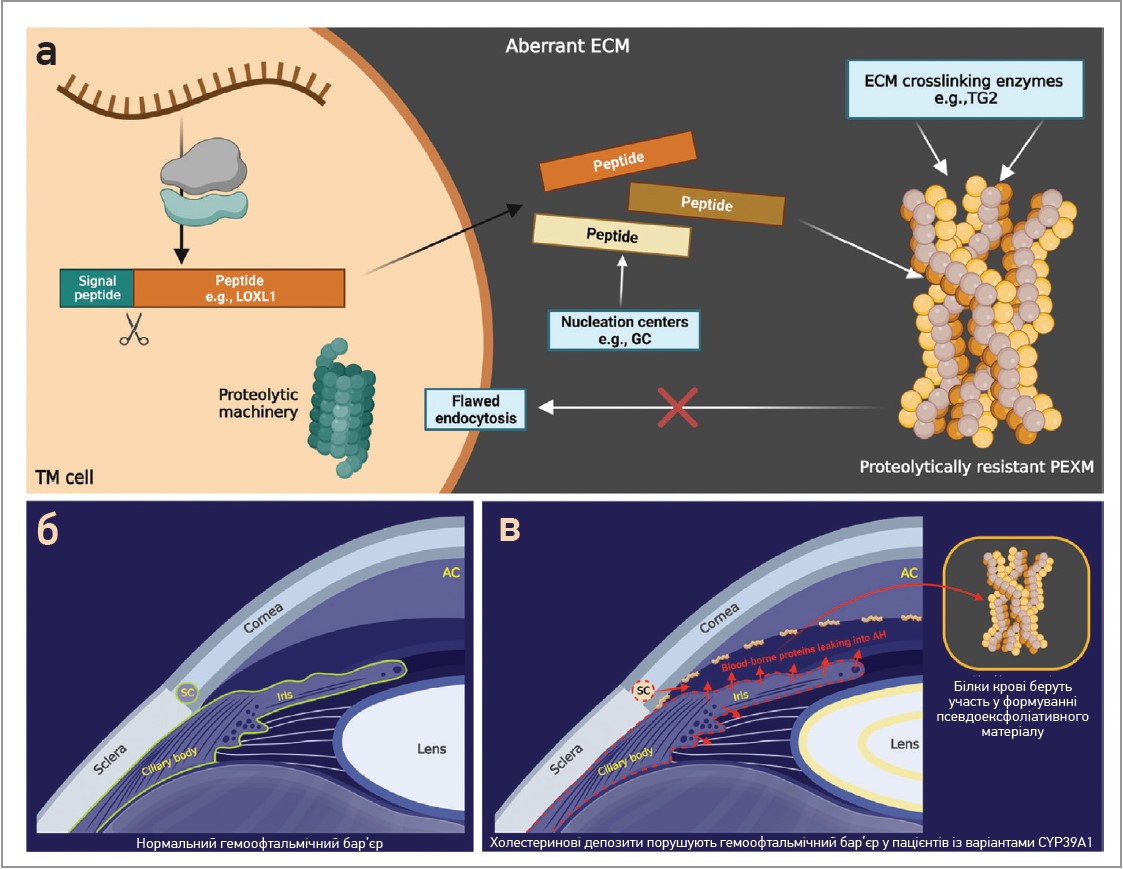
Наявність одного лише варіанта LOXL1 не спричиняє захворювання. Значна частка неуражених осіб є носієм мутації LOXL1. Стресові фактори навколишнього середовища відіграють ключову роль у патогенезі ПЕКС. Складна взаємодія численних молекулярних елементів спричиняє утворення протеолітично стійкого продукту (рис. 5а).
Рис. 5. Запропонований механізм утворення ПЕМ
Примітки: a) ПЕКС-асоційовані пептиди (наприклад, LOXL1) синтезуються клітиною ТС і виводяться в ПКМ. Центри нуклеації, як-от GC, забезпечують оптимальне середовище для агрегації пептидів. Регульовані ферменти зшивання, як-от TG2, каталізують ковалентні зв’язки між цими пептидами, що спричиняє утворення стабільного продукту. Аберантний ПКМ через дисбаланс MMP до TIMP (не показано) перешкоджає ефективному видаленню компонентів ПЕМ. Порушення ендоцитозу не дозволяє клітині повторно поглинати ПЕМ для деградації; б) нормальний водно-кров’яний бар’єр. Водно-кров’яний бар’єр (зелений) складається з непігментованих епітеліальних клітин війок, епітеліальних та ендотеліальних клітин райдужної оболонки, ендотеліальних клітин судин райдужної оболонки й ендотеліальних клітин внутрішньої стінки каналу Шлемма; в) аберантний водно-кров’яний бар’єр (пунктирна червона лінія) в пацієнтів із варіантами втрати функції CYP39A1. Аномально метаболізований холестерин накопичується в непігментованих клітинах циліарного епітелію, порушуючи водно-кров’яний бар’єр. Білки, що переносяться кров’ю, просочуються до ВВ і беруть участь у формуванні ПЕМ.
Aberrant EC – аномальний ПЗМ; ECM crosslinking enzymes – ферменти зшивання ПКМ (наприклад, TG2); nucleation centers – центри нуклеації; proteolytic machinery – протеолітичний механізм; flawed endocytosis – порушений ендоцитоз; TM cell – клітина трабекулярної сітки; proteolytically resistant PEXM – протеолітично резистентний псевдоексфоліативний матеріал; сornea – рогівка; open angle – відкритий кут; iris – райдужка; ciliary body – циліарне тіло; lens – кришталик; TM – трабекулярна сітка; АС – передня камера; SC – шлеммів канал.
ММП та їхні інгібітори беруть участь у протеолізі матриксу ТС і є критично важливими в регуляції, а також підтримці відтоку ВВ. При ПЕКС активність ММП є зниженою, тоді як активність тканинного інгібітора ММП‑2 (ТІМП‑2) – первинного інгібітора ММП – помітно підвищена. Складний дисбаланс між ММП і ТІМП спричиняє порушення регуляції ПКМ. Слід зазначити, що аналоги простагландинів збільшують увеосклеральний відтік за рахунок зміни співвідношення ММП і ТІМП у ТС, тому вони є ефективними препаратами першої лінії за ПЕКСГ.
Пігментна глаукома
Епідеміологія
ПГ – найпоширеніша нетравматична причина глаукоми. З моменту встановлення діагнозу ризик прогресування СДП до ПГ становить 10% через 5 років і 15% через 15 років. У латиноамериканському дослідженні СДП перейшов у ПГ у 37,5% вибірки населення через 50,7 міс.
СДП уражає як чоловіків, так і жінок, але з незначним переважанням чоловіків, особливо з міопією. Однак ПГ значно частіше зустрічається в чоловіків (78-93% випадків); ≈60-80% хворих із СДП і ПГ мають міопію.
В середньому вік установлення діагнозу ПГ коливається між 40 і 50 роками. Особи з обтяженим сімейним анамнезом щодо глаукоми мають вищий ризик розвитку СДП, але це не впливає на прогноз.
Діагностика
Класична діагностична тріада ПГ включає радіальні дефекти освітлення райдужки (ДОР), веретено Крукенберга та/або сильну пігментацію ТС. ДОР – це проміжки в райдужці внаслідок виділення пігменту, який дозволяє світлу проходити крізь них. За наявності цих ознак може бути проведена подальша оцінка за допомогою ультразвукової біомікроскопії та ОКТ переднього сегмента. Задній вигин райдужки та іридозонулярний контакт характерні для ультразвукової біомікроскопії у разі СДП. Найбільш помітні у світлих очах; ДОР при СДП / ПГ розташовані у вигляді спиць і зазвичай спостерігаються інфероназально. Порівняно з «поїденими міллю» перизіничними ДОР при ПЕКС / ПЕКСГ, ДОР за СПД / ПГ є середньо-периферійними. Асиметричні ДОР можуть спричинити анізокорію (або неоднаковий розмір зіниць) через ушкодження м’язів, що розширюють райдужку. Крім того, в пацієнтів із СДП також можуть спостерігатися гостра світлобоязнь, затуманення зору, почервоніння та біль в очах, що імітує гострий передній увеїт.
ТС при ПГ сильно пігментована. Може бути уражена вся ТС, хоча нижній сегмент зазвичай є більш пігментованим. Порівняно із плямистою ТС за ПЕКСГ (рис. 4б), ТС при ПГ є гомогенною. Відкладення пігменту також може відбуватися на лінії Швальбе, утворюючи тонку темну лінію, схожу на лінію Сампаолезі за ПЕКСГ. ВОТ у разі ПГ зазвичай підвищений і може ще більше підвищуватися під час епізодів виділення пігменту.
Патогенез
СДП характеризується аномальним іридолентикулярним контактом, який руйнує клітини ПЕР, вивільняє гранули меланіну. Під час прогресування захворювання втрачається весь шар ПЕР.
Пігмент меланін, що виділяється при СДП, діє як поглинач вільних радикалів і зв’язує токсичні катіони. Меланін (як і ПЕМ за ПЕКС) є стійким до ферментативної деградації.
Мелатонін може бути корисним за СДП/ПГ і ПЕКС/ПЕКСГ. Хоча мелатонін широко відомий у регуляції циркадних ритмів, він насамперед діє як поглинач вільних радикалів і антиоксидант широкого спектра дії. Каскад поглинання вільних радикалів мелатоніном є високоефективним навіть за низьких концентрацій.
Мелатонін може відігравати додаткову роль у регуляції ВОТ та очному гомеостазі. Як і шишкоподібна залоза, очні структури беруть участь у синтезі мелатоніну в добовій варіації. У нормальних очах ВОТ коливається на 3-5 мм рт. ст. відповідно до циркадного ритму; на це коливання здатен впливати мелатонін.
Лікування
Місцеві аналоги простагландинів (наприклад, біматопрост, латанопрост, травопрост) є широко використовуваними засобами для зниження ВОТ за глаукоми. Ці препарати змінюють співвідношення MMPs до TIMPs у ТС, циліарному тілі та склеральних фібробластах, збільшуючи увеосклеральний відтік.
Зазвичай лікування очними краплями – перший вибір для зниження ВОТ при глаукомі. Через потужну ефективність зниження ВОТ, дуже низьку кількість побічних реакцій в організмі та зручність прийому аналоги простагландинів є препаратами першого вибору. Травопрост був одним із перших випущених БАК-вмісних аналогів простагландину. Згодом розроблено версію препарату без БАК. Деякі дослідження продемонстрували відсутність істотної різниці в ефекті зниження ВОТ між очними краплями, що містять і які не містять БАК [1].
Під час спостереження в пацієнтів із глаукомою перевіряють ВОТ, щоб підтвердити ефективність очних крапель, а також перевіряють поле зору, аби підтвердити наявність чи відсутність прогресування дефекту поля зору [1].
У дослідженні K. Inoue, M. Iwasa та співавт. проспективно оцінювали зміни ВОТ і прогресування дефектів поля зору протягом 3-річного періоду монотерапії очними краплями травопросту, які не містять БАК, у пацієнтів із глаукомою нормального напруження. У цьому випробуванні ВОТ знизився на 2,9±2,0 мм рт. ст., а швидкість зниження ВОТ становила 19,8±17,8% після 3 років лікування очними краплями травопросту без БАК. Результати можуть бути нижчими в дослідженнях, які включали суб’єктів з очною гіпертензією, відкритокутовою глаукомою, ПГ і ПЕКСГ, однак може не спостерігатися суттєвої різниці, якщо суб’єкти мають глаукому нормального напруження. Причиною цього є те, що в цьому випробуванні ВОТ був нижчим до лікування (16,8±2,6 мм рт. ст.), ніж у пацієнтів з очною гіпертензією, відкритокутовою глаукомою, ПГ або ПЕКСГ (24,3-27,4 мм рт. ст.). Не виявлено значної різниці порівняно із хворими, котрі мали глаукому нормального напруження (14,79-15,0 мм рт. ст.). Результати цього дослідження показали, що немає суттєвої різниці в ефекті зниження ВОТ протягом тривалого періоду між очними краплями травопросту, що не містять і які містять БАК [1].
Відомо, що зниження ВОТ і показник швидкості зниження ВОТ за тривалого застосування (>6 міс) монотерапії очних крапель травопросту, що містять БАК, становили 2,5-9,3 мм рт. ст. і 16,1-36,6% відповідно. Для досліджень, у яких суб’єкти мали очну гіпертензію, відкритокутову глаукому, ПГ або ПЕКСГ, зниження ВОТ становило 6,3-9,3 мм рт. ст., що є високим показником [2-7].
У випробуванні S. Parmaksiz, N. Yuksel і співавт. порівнювали ефект зниження ВОТ і безпечність латанопросту, травопросту, що вводяться щовечора, а також фіксованої комбінації дорзоламід + тимолол (ДТ), яка вводиться 2 р/день за ПЕКСГ [7]. Це рандомізоване проспективне контрольоване дослідження було проведено за участю 50 пацієнтів із ПЕКСГ.
Хворих розподілили до однієї з 3 груп:
1) травопрост 0,004%;
2) фіксована комбінація дорзоламід 2% + тимолол 0,5%
або
3) латанопрост 0,005% протягом 6 міс.
На початковому етапі та через 0,5, а також 1-6 міс терапії вимірювали ВОТ (о 08:00, 10:00, 16:00 год), артеріальний тиск, частоту пульсу, проводили офтальмологічне обстеження. Побічні ефекти реєстрували під час кожного візиту.
Результати продемонстрували, що ДТ є ефективнішим у зниженні ВОТ, ніж латанопрост і травопрост. Латанопрост і травопрост мали схожі очні гіпотензивні ефекти в пацієнтів із ПЕКСГ. Усі 3 препарати добре переносилися.
Ефективність і безпека латанопросту (порівняно із травопростом) у пацієнтів з ексфоліативною глаукомою оцінювалися в дослідженні A.G. Konstas, V.P. Kozobolis і співавт. [8].
Було проведено перспективне контрольоване перехресне порівняння за участю 40 пацієнтів з ексфоліативною глаукомою. Продемонстровано, що латанопрост і травопрост значно знижують 24-годинний ВОТ порівняно з початковим рівнем за ексфоліативної глаукоми, але травопрост демонстрував вищу гіпотензивну ефективність у другій половині дня.
В рандомізованому багатоцентровому обсерваційному дослідженні, проведеному A.M. Solish, P.T. DeLucca та співавт., взяли участь 492 пацієнти з очною гіпертензією, ПВКГ, ексфоліативною глаукомою та ПГ. Мета дослідження – порівняти ефект зниження ВОТ, переносимість і показники, про які повідомляють хворі, фіксованої комбінації дорзоламіду/тимололу й одночасного застосування бримонідину, а також тимололу через 3 міс.
Ефект зниження ВОТ, фіксованої комбінації дорзоламіду/тимололу та супутнього прийому бримонідину й тимололу виявився зіставним у 3 із 4 виміряних моментів часу. Показники, про які повідомляли хворі, а також частота побічних ефектів в обох групах лікування були схожими [9].
Застосування мелатоніну й аналогів мелатоніну перорально чи місцево значно знижує ВОТ як у нормотензивних, так і в гіпертензивних очах. Крім того, пероральний прийом мелатоніну перед операцією з видалення катаракти під місцевою анестезією зумовлював анксіоліз, посилення аналгезії та зниження ВОТ. Виявлено, що мелатонін значно знижує експресію β2-адренергічних рецепторів і одночасно підвищує експресію α2A-рецепторів. β2- та α2-адренергічні рецептори в циліарному епітелії регулюють продукцію ВВ. Мелатонін вивчався в комбінації з іншими засобами для зниження ВОТ, як-от бримонідин, дорзоламід, тимолол; було показано, що вони потенціюють гіпотензивний ефект цих препаратів. Мелатонін та його аналоги можуть застосовуватися як монотерапія або в комбінації з іншими фармакологічними засобами. За ПЕКС/ПЕКСГ, коли різні екологічні ушкодження індукують синтез компонентів ПЕМ, центрів нуклеації та зшивальних ферментів, здатність мелатоніну ефективно знешкоджувати АФК, а також знижувати ВОТ робить його потенційно корисним втручанням.
Висновки
Патогенез ПЕКСГ і ПГ є багатофакторним. Утворення ПЕМ – основний рушійний фактор розвитку ПЕКС/ПЕКСГ. Специфічні екологічні стресори, як-от УФ-випромінювання, сприяють синтезу ПЕКС-асоційованих пептидів. Коли пептиди секретуються із клітин переднього сегмента, складна взаємодія молекулярних елементів спричиняє утворення зшитого, ферментативно стійкого глікопротеїнового / протеогліканового комплексу ПЕМ. Аномальний метаболізм холестерину може порушувати водно-кров’яний бар’єр, дозволяючи білкам крові брати участь у формуванні ПЕМ.
СДП характеризується аномальним іридолентикулярним контактом, який руйнує клітини ПЕР, а також вивільняє гранули меланіну. Меланогенез у меланоцитах райдужки та ПЕР є аберантним за СДП. Цитотоксичні проміжні продукти меланогенезу витікають з меланосом, спричиняючи загибель клітин меланоцитів і ПЕР. Меланін та проміжні продукти його синтезу переповнюють ТС, що зрештою зумовлює резистентність до відтоку ВВ і ПГ. Спрямований вплив на меланогенез може потенційно знизити ризик розвитку ПГ.
Травопрост може бути рекомендований при ПГ і ПЕКСГ. У дослідженні травопрост демонстрував більшу гіпотензивну ефективність у другій половині дня порівняно з латанопростом.
Фіксована комбінація дорзоламід/тимолол застосовується за обидвох форм глаукоми; при ПЕКСГ продемонструвала більшу ефективність у зниженні ВОТ, ніж латанопрост і травопрост.
Мелатонін – потужний пригнічувач меланогенезу, антиоксидант і гіпотензивний засіб. Ця тріада терапевтичних ефектів робить мелатонін цінним засобом для лікування СДП/ПГ. З огляду на його властивості поглинати АФК і знижувати ВОТ мелатонін може бути ефективним допоміжним засобом для лікування ПЕКС/ПЕКСГ.
Довідка «ЗУ»
На вітчизняному фармацевтичному ринку травопрост представлений препаратом Травінор, дорзоламід/тимолол – препаратом Дорзітім (АТ «Київський вітамінний завод»).
Кожен із цих протиглаукомних засобів за рахунок різних механізмів ефективно знижує ВОТ. Травінор збільшує відтік внутрішньоочної рідини трабекулярною сіткою й увеосклеральним шляхом. Зниження ВОТ розпочинається приблизно через 2 год після застосування препарату, а максимальний ефект досягається через 12 год. Значне зниження ВОТ при застосуванні одноразової дози може зберігатися понад 24 год. Перевагою Травінору є його здатність покращувати кровопостачання диска зорового нерва за рахунок посилення припливу крові.
Дорзітім зменшує секрецію внутрішньоочної рідини завдяки потужній блокаді карбоангідрази II (дорзоламід) і неселективному інгібуванню β-адренергічних рецепторів (тимолол). Поєднана дія двох компонентів забезпечує суттєвіше зниження ВОТ, ніж монотерапія кожним із них. При цьому Дорзітім знижує ВОТ без розвитку характерних для міотичних засобів побічних ефектів, таких як нічна сліпота, спазм акомодації, звуження зіниці.
Важливо пам’ятати, що при використанні декількох місцевих офтальмологічних засобів інтервал між їх застосуванням має становити не менше ніж 5 хв. Висока якість, зручний режим прийому, відмінний профіль безпеки, економічна доступність роблять Травінор і Дорзітім оптимальними засобами як для монотерапії, так і для комбінованого лікування глаукоми.
За матеріалами: Mueller A., Lam I., Kishor K. et al. Secondary glaucoma: Toward interventions based on molecular underpinnings.
First published: 05 September 2023, https://doi.org/10.1002/wsbm.1628.
Список літератури знаходиться в редакції.
Підготувала Олена Костюк
Медична газета «Здоров’я України 21 сторіччя» № 19 (555), 2023 р