Бактеріальна коінфекція в пацієнтів із COVID-19: поширеність, діагностика, протимікробна терапія
У світі продовжує лютувати наймасштабніша вірусна пандемія в історії людства, спричинена новим коронавірусом SARS-CoV-2, яка за неповних 15 міс забрала понад 2,7 млн людських життів (WHO, 2021). Вторинна бактеріальна інфекція (найчастіше пневмонія) може ускладнювати перебіг тяжких респіраторних вірусних інфекцій, що потребує своєчасної діагностики й антибактеріальної терапії (Rice T. et al., 2012; Klein E. et al., 2016). Феномен супер- або коінфекції описаний під час епідемій грипу та при попередніх спалахах коронавірусних інфекцій – SARS і MERS (Zheng et al., 2003; Assiri et al., 2013). Що стосується інфекції SARS-CoV, то за легкого перебігу частота БКІ становила 20%, сягаючи 70% в осіб, які потребували інвазивної вентиляції (Zheng Z. et al., 2003).
Поширеність і характеристики БКІ в пацієнтів, інфікованих SARS-CoV‑2, недостатньо вивчені та доволі неоднозначні, але певна частка смертності при COVID‑19 зумовлена вторинними інфекціями (Lansbury L. et al., 2020; Contou D. et al., 2020). За даними багатоцентрового ретроспективного дослідження, проведеного в США, поширеність БКІ на момент госпіталізації у хворих на COVID‑19 становила 1,2% (Karaba S. M. et al., 2020). Ретроспективні обсерваційні дослідження, проведені в Нью-Йорку та Барселоні, вказують дещо вищі показники – 3,6% (152 з 4267 пацієнтів) та 7,2% (72 з 989 пацієнтів) відповідно (Nori P. et al., 2021; Garcia-Vidal С. et al., 2021). Натомість ретроспективне дослідження, проведене неподалік від Парижа, виявило БКІ у 28% (26/92) пацієнтів із тяжким перебігом COVID‑19, які потребували інтенсивної терапії (Contou D. et al., 2020).
На вищу частоту БКІ за тяжкого перебігу COVID‑19 вказує низка інших досліджень. Зокрема, в Ухані частота БКІ в пацієнтів із тяжким перебігом сягала 25,5% порівняно з 1,8% в осіб із легким перебігом, p<0,001 (Zhang G. et al., 2020). В Італії серед 16 654 пацієнтів із найтяжчим перебігом, які померли, БКІ підтверджено в 11% (Palmieri L. et al., 2020). Нещодавно проведений метааналіз, який включав 30 досліджень, свідчить, що 7% госпіталізованих пацієнтів мали БКІ, але у відділеннях інтенсивної терапії цей показник сягав 14% (Lansbury L. et al., 2020).
Потенційні збудники БКІ при COVID‑19
Більшість із виявлених збудників БКІ при COVID‑19 належать до патогенів із групи ESKAPE, відомих своєю стійкістю до багатьох антибіотиків (Nori P. et al., 2021). У Нью-Йорку найчастішими патогенами були Staphylococcus aureus (чутливий або резистентний до метициліну), Pseudomonas aeruginosa, Klebsiella pneumoniae, Escherichia coli й Enterobacter spp. (Nori P. et al., 2020). За даними метааналізу L. Lansbury та співавт. (2020), перше місце серед бактеріальних патогенів у хворих на COVID‑19 посідала Mycoplasma pneumoniae; приблизно вчетверо рідше (але майже з однаковою частотою) траплялися Pseudomonas aeruginosa, Haemophilus influenzae, Klebsiella pneumoniae та бактерії роду Enterobacter.
Діагностика БКІ при COVID‑19: виклики та рішення
Незважаючи на меншу поширеність БКІ порівняно з іншими вірусними епідеміями, саме ця пандемія створила унікальну проблему діагностики вторинних інфекцій. У зв’язку зі значними економічними витратами, величезною кількістю пацієнтів, перевантаженням відділень і лікарів, а також із метою мінімізації процедур генерування аерозолів доволі обмежено проводяться посіви мокротиння та крові, а також інвазивні діагностичні процедури (бронхоскопія).
Клінічна підозра на бактеріальну пневмонію при COVID‑19 також є проблематичною через феномен перекриття багатьох загальних і респіраторних симптомів – гарячка, слабкість, кашель, задишка. Проте при COVID‑19 дихальна недостатність погіршується поступово впродовж першого тижня (аж до залежності від кисню чи потреби в інвазивній вентиляції легень). У таких випадках імовірність приєднання вторинної бактеріальної флори доволі низька; антибіотики призначати не слід (Goldstein E. et al., 2020; Chen X. et al., 2020).
Якщо після початкової фази прогресивного покращення, що триває декілька днів, раптово з’являються ознаки гострої дихальної недостатності чи гостра декомпенсація та/або спостерігаються ознаки сепсису, існує висока ймовірність приєднання БКІ у формі негоспітальної чи госпітальної пневмонії або позалегеневої нозокоміальної інфекції з урахуванням її можливих джерел, як-от венозні чи сечові катетери. За цих умов емпіричне призначення антибактеріальніх препаратів (АБП) відповідно до рекомендацій є обґрунтованим; їхня відміна можлива тільки після виключення БКІ чи встановлення альтернативного діагнозу. Для критично хворих осіб, госпіталізованих із тяжкою дихальною недостатністю, важливим є емпіричне лікування з усіх можливих причин (Goldstein E. et al., 2020; Chen X. et al., 2020).
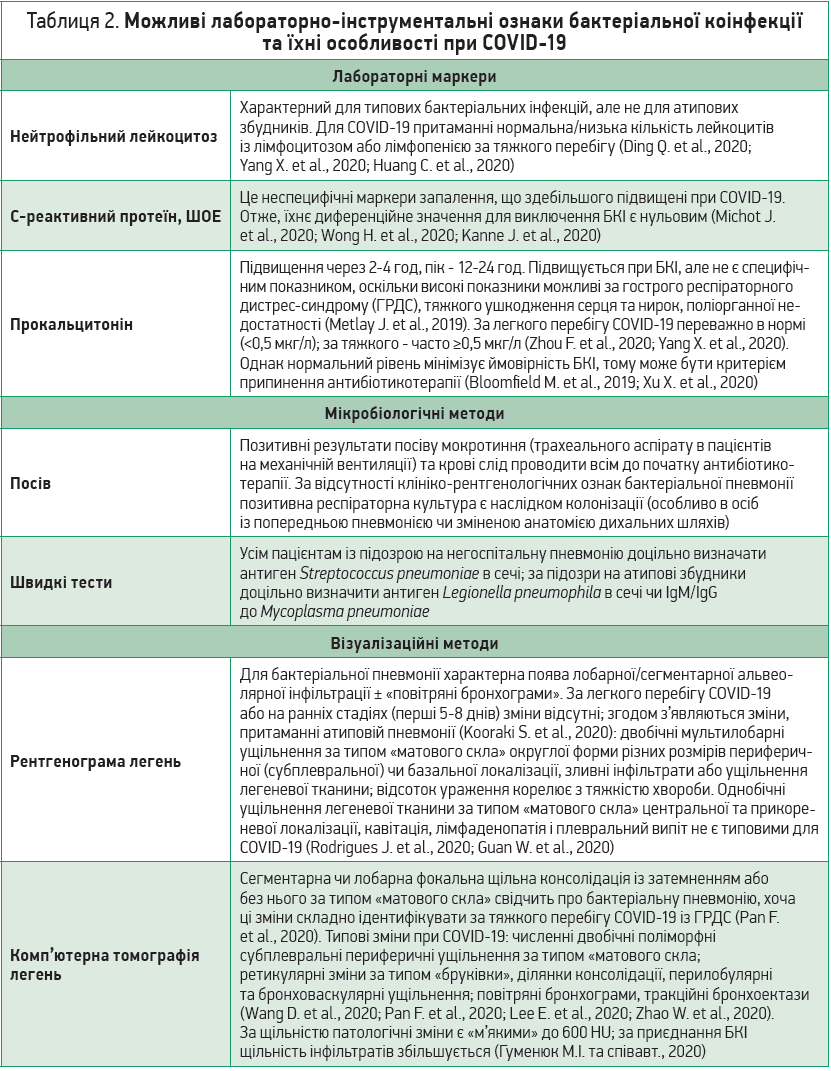
Доказові ознаки вторинної бактеріальної пневмонії при COVID‑19, критерії сепсису та септичного шоку підсумовано в таблиці 1. Ознаки, що можна виявити під час додаткових досліджень, і труднощі, пов’язані з COVID‑19, наведено в таблиці 2.
Слід зазначити, що діагноз вторинної пневмонії є особливо проблематичним у пацієнтів із ГРДС, адже візуалізаційні дослідження не диференціюють ураження легень, зумовлене синдромом активації прозапальних цитокінів, притаманним COVID‑19, від ушкодження, спричиненого бактеріальними патогенами (Azoulay E. et al., 2020; Goldstein E. et al., 2020). Підозра на БКІ посилюється за підвищення прокальцитоніну, що пояснюється високими концентраціями інтерлейкіну (ІЛ)-1β, фактора некрозу пухлини-α (ФНП‑α) й ІЛ‑6. Натомість ФНП‑γ, який утворюється при вірусній інфекції, пригнічує синтез прокальцитоніну. Отже, дуже високі рівні прокальцитоніну чи їхнє динамічне збільшення частіше свідчить про БКІ (Lippi G., Plebani M., 2020). Вирішальне значення має мікробіологічна діагностика (особливо посів мокротиння), але забір матеріалу від пацієнтів, інфікованих SARS-CoV‑2, підвищує ризик інфікування медичних працівників і лаборантів, оскільки поширення інфекції можливе не лише повітряно-крапельним шляхом, а й через прямий контакт із контамінованими вірусом аерозолями (Peng X. et al., 2020; Xu R. et al., 2020), а отримання результатів посіву та чутливості збудника до антибіотиків потребує часу.
Додатковими викликами є застосування кортикостероїдів та інгібіторів ІЛ‑6 за тяжкого перебігу при COVID‑19. Імуносупресивна дія кортикостероїдів є добре відомою. Що стосується інгібіторів ІЛ‑6, то в пацієнтів, які приймають тоцилізумаб, описана відсутність реакції гострофазових показників у відповідь на вторинну бактеріальну інфекцію (Bari S. F. et al., 2013; Yamamoto K. et al., 2015; Vanderbeke L. et al., 2018); його тривале застосування при ревматологічних хворобах підвищує ризик серйозних бактеріальних інфекцій (Nguyen M. T. et al., 2013; Calderón-Goercke M. et al., 2019). Однак невідомо, чи спостерігається аналогічний ефект у разі застосовування 1-2 доз препарату (як це рекомендовано при COVID‑19).
Антибактеріальна терапія
За даними більшості джерел, мікробіологічно підтверджена БКІ з’являється менш ніж у 5% пацієнтів із COVID‑19, проте від 50 до 98% хворих отримують АБП (Lansbury L. et al., 2020; Vaughn V. M. et al., 2020; Garcia-Vidal C. et al., 2020; Langford B. J. et al., 2020; Hughes S. et al., 2020). Хоча антибіотики не впливають на SARS-CoV‑2, їх часто з різних причин призначають як ПЛР‑позитивним пацієнтам, так і особам із підозрою на COVID‑19. Недоцільне застосування АБП спричиняє дедалі більше занепокоєння серед учених і лікарів, оскільки може зумовити розвиток бактеріальної резистентності й інфекції Clostridioides difficile (Cheng L. S.-K. et al., 2020).
З іншого боку, поява БКІ все ж можлива, особливо за умови тяжкого перебігу COVID‑19, що посилює системне запалення й тяжкість хвороби, негативно впливає на прогноз і щонайменше у 2,5 раза підвищує ризик смерті (Lim Y. K. et al., 2019; Tan L. et al., 2020; Martins-Filho P.R. et al., 2020). В останньому протоколі Міністерства охорони здоров’я (МОЗ) України рекомендовано призначати антибактеріальну терапію лише за підозри на БКІ за середньотяжкого та тяжкого перебігу COVID‑19. Емпірична терапія має бути ефективною проти всіх можливих патогенів на підставі клінічного діагнозу (наприклад, негоспітальна чи госпітальна пневмонія), епідеміологічних даних і регіональних даних щодо бактеріальної резистентності. Пацієнтам у тяжкому стані рекомендовано розпочинати емпіричну протимікробну терапію з урахуванням усіх імовірних збудників упродовж 1 год від установлення сепсису та протягом 4 год від установлення діагнозу бактеріальної пневмонії. Ефективність АБП потрібно оцінювати щодня для своєчасного прийняття рішення про деескалацію та перехід із внутрішньовенного на пероральний шлях уведення. Тривалість емпіричної протимікробної терапії має бути настільки короткою, наскільки це можливо; зазвичай 3-5 діб із подальшим призначенням цілеспрямованої антибактеріальної терапії після отримання результатів бактеріологічного дослідження (наказ МОЗ України № 2116 від 17.09.2020). Визначення рівня прокальцитоніну на початку лікування та через 24-48 год може бути корисним маркером деескалації антибіотиків (Campbell L. et al., 2011). Якщо через 48 год джерело мікроорганізмів не ідентифіковане, рівень прокальцитоніну <0,5 мкг/л або на ≥80% нижчий від пікової концентрації, АБП доцільно відмінити (Xu X. et al., 2020).
Для емпіричного лікування позалікарняної (середньотяжкого, тяжкого перебігу) та нозокоміальної пневмонії рекомендовано застосовувати цефалоспорини III покоління, а також респіраторні фторхінолони. За тяжких інфекцій можна розглянути призначення комбінації зазначених класів АБП (наказ МОЗ України № 2116 від 17.09.2020). На вітчизняному ринку зазначені класи представлені препаратами Сорцеф® (цефіксим) і Тімоксі® (моксифлоксацин) виробництва компанії «Алкалоїд АД-Скоп’є» (Республіка Македонія).
Цефіксим має хороший профіль безпеки, що вкрай важливо при COVID‑19 з огляду на ймовірність поліорганного ураження та значного порушення функції елімінаційних органів. Бактерицидна дія цефіксиму зумовлена пригніченням синтезу клітинної мембрани бактерій у процесі реплікації. Цефіксим ефективний щодо більшості патогенів БКІ, які часто трапляються при COVID‑19, зокрема Streptococcus pneumoniae, Haemophilus influenzae, Moraxella catarrhalis, Enterobacter spp., Klebsiella spp. і Escherichia coli. Цефіксим має зручний спосіб застосування – 1 або 2 р/добу незалежно від прийому їжі.
Моксифлоксацин – це респіраторний фторхінолон IV покоління з бактерицидною дією, зумовленою пригніченням топоізомераз II та IV, які беруть участь у реплікації, транскрипції та синтезі бактеріальної ДНК (Correia S. et al., 2017). Завдяки великому об’єму розподілу та значній проникності він є високоефективним in vivo, добре накопичується в тканинах і клітинах-мішенях (слизова оболонка бронхів, бронхіальний секрет, альвеолярні макрофаги) в концентраціях, які значно перевищують мінімально пригнічувальні рівні та концентрацію в плазмі крові. Саме ця властивість зумовлює високий рівень ерадикації внутрішньоклітинних атипових збудників, які часто спричиняють БКІ у хворих на COVID‑19 (Lansbury L. et al., 2020). Іншою особливістю є активність проти 97% усіх відомих анаеробів. Завдяки здатності інгібувати обидві топоізомерази деякі бактерії залишаються чутливими до моксифлоксацину за умови резистентності до інших хінолонів. Суттєвою перевагою моксифлоксацину є висока ефективність щодо бактерій, стійких до β-лактамних і макролідних АБП, оскільки механізми резистентності до зазначених класів не впливають на резистентність до моксифлоксацину. Наприклад, активність моксифлоксацину щодо Staphylococcus aureus, Haemophilus influenzae є набагато вищою, ніж в амоксициліну, гентаміцину, ванкоміцину й інших фторхінолонів. Моксифлоксацин демонструє сприятливий профіль безпеки та переносимості, частота побічних явищ після його призначення в дозі 400 мг/день не відрізнялася від такої антибіотиків порівняння.
Нещодавнє дослідження in silico продемонструвало здатність моксифлоксацину зв’язуватися з основною протеазою SARS-CoV‑2 (Mpro), що свідчить про можливість пригнічення реплікації вірусу. Здатність до зв’язування з активним центром Mpro виявилася сильнішою, ніж у хлорохіну та нелфінавіру – антиретровірусного засобу з класу інгібіторів протеаз (Marciniec K. et al., 2020). Моксифлоксацин демонструє імуномодулювальні властивості, що може зменшувати запальну відповідь і пригнічення прозапальних цитокінів – ІЛ‑6 і ФНП (Choi J. H. et al., 2003).
Отже, незважаючи на відносно низьку поширеність БКІ в пацієнтів із легким перебігом COVID‑19, її частота зростає за тяжких і критичних форм коронавірусної інфекції, суттєво погіршуючи прогноз. Значний перехрест клінічних і лабораторно-рентгенологічних ознак COVID‑19 і БКІ часто створює діагностичні труднощі. За підозри на БКІ слід призначити антибактеріальну терапію. Як препарати для емпіричної терапії запропоновано цефалоспорини ІІІ покоління та респіраторні фторхінолони. На вітчизняному ринку гідними представниками цих класів є Сорцеф® (цефіксим) і Тімоксі® (моксифлоксацин) виробництва європейської компанії «Алкалоїд АД-Скоп’є».
Підготувала Ольга Королюк
Медична газета «Здоров’я України 21 сторіччя» № 6 (499), 2021 р.
СТАТТІ ЗА ТЕМОЮ Терапія та сімейна медицина
Поліпіл (polypill) – фіксована комбінація декількох препаратів в одній капсулі, що має вирішити одразу декілька терапевтичних завдань і водночас спростити режим прийому ліків. Найчастіше поліпіли використовують для лікування та профілактики серцево-судинних захворювань, при цьому вони спрямовані на такі ключові модифіковані фактори ризику, як артеріальна гіпертензія, гіперліпідемія та посилена агрегація тромбоцитів. Нині терапевтичні стратегії на основі фіксованих комбінацій препаратів є надзвичайно актуальними, оскільки, незважаючи на наявність ефективних лікарських препаратів, контроль кардіоваскулярного ризику залишається недостатнім насамперед через низьку прихильність та обмежений доступ до лікування. ...
Збудник COVID‑19, SARS-CoV‑2, з яким людство вперше стикнулося у 2019 р., поширився по всьому світу, заразивши мільйони людей. Сьогодні, через тягар війни та економічної нестабільності, тема COVID‑19 не сприймається так гостро, як ще кілька років тому, хоча насправді вона не втратила своєї актуальності. Саме сучасному стану проблеми COVID‑19 у світі та в Україні була присвячена доповідь директора ДУ «Інститут ендокринології та обміну речовин імені В.П. Комісаренка НАМН України», академіка Національної академії медичних наук України, члена-кореспондента НАН України, віце-президента НАМН України, президента Асоціації ендокринологів України, професора Миколи Дмитровича Тронька під час першого у 2024 р. засідання науково-освітнього проєкту «Школа ендокринолога», яке відбулося 20-24 лютого. ...
Йод є необхідним для життя ссавців компонентом гормонів щитоподібної залози (ЩЗ). В огляді йдеться про важливі наукові відкриття і досягнення в галузі харчування, пов’язані з профілактикою йододефіцитних захворювань (ЙДЗ) у США і в усьому світі, з акцентом на минуле століття (рис. 1). Огляд присвячено сторіччю заснування Американської тиреоїдної асоціації (ATA). ...
Серцево-судинні захворювання (ССЗ) (ішемічна хвороба серця [ІХС], захворювання судин головного мозку, ревматична хвороба серця та інші) протягом багатьох десятиліть є основною причиною смертності населення у світі. Перебіг цих захворювань ускладнюється перенесеною корона вірусною хворобою (COVID‑19). Нині ця проблема є особливо актуальною в Україні в умовах повномасштабного вторгнення рф, оскільки вплив хронічного стресу призводить до зростання захворюваності на ССЗ. У такій ситуації поряд із «протокольною терапією» слід приділити увагу застосуванню біорегуляційного підходу, спрямованого на відновлення саморегуляції, імунного статусу, гармонізації функціонування всіх органів і систем людини. ...