5 лютого, 2023
«Гнатишаківські читання»: мультидисциплінарний підхід у комбінованому лікуванні раку яєчників
За матеріалами конференції
Незважаючи на розвиток сучасної медицини, рак яєчника (РЯ) залишається однією з найсерйозніших проблем сучасної онкогінекології, посідаючи третє місце у структурі онкопатології репродуктивної системи. Проблема ведення хворих на РЯ пов’язана з дуже низькою виживаністю хворих цієї групи. Смертність внаслідок РЯ перевищує смертність від усіх інших онкогінекологічних захворювань, разом узятих, посідаючи п’яте місце серед причин смерті жінок. Веденню пацієнтів із РЯ була присвячена Всеукраїнська науково-практична конференція з міжнародною участю «Гнатишаківські читання», яка відбулася 9 грудня 2022 року.
 Академік Академії вищої школи України, професор кафедри онкології і радіології факультету післядипломної освіти Львівського національного медичного університету імені Данила Галицького, доктор медичних наук, професор Борис Тарасович Білинський представив меморіальну доповідь про життя та професійний шлях професора Анатолія Івановича Гнатишака, пам’яті якого був присвячений захід.
Академік Академії вищої школи України, професор кафедри онкології і радіології факультету післядипломної освіти Львівського національного медичного університету імені Данила Галицького, доктор медичних наук, професор Борис Тарасович Білинський представив меморіальну доповідь про життя та професійний шлях професора Анатолія Івановича Гнатишака, пам’яті якого був присвячений захід.
– Анатолій Гнатишак народився 20 лютого 1917 р. на Лемківщині у родині греко-католицького священика. У 1935 р. закінчив Перемишльську гімназію і вступив до медичного факультету Львівського університету, в якому успішно навчався з 1935 по 1941 р. Звичайно, початок Другої світової війни вніс значні корективи у життя А.І. Гнатишака: після закінчення Львівського університету він працював ординатором у хірургічному відділенні Львівської залізничної лікарні (1941-1943). У 1944 р. переїхав до Німеччини, працював у лікарні в Ольбернгау. У жовтні 1945-го повернувся до Львова, був ординатором у клініці дитячої хірургії, а з 1946 р. – асистентом кафедри загальної хірургії. Важливою віхою його життєвого шляху була зустріч і багаторічна співпраця з видатним онкологом, професором Г.П. Ковтуновичем, адже саме вона сприяла тому, що А.І. Гнатишак присвятив своє життя хірургії й онкології.
За своє професійне життя А.І. Гнатишак опублікував понад 150 наукових робіт, серед яких 7 монографій. Підготував 40 кандидатів і 10 докторів медичних наук. Був засновником кафедри онкології та співзасновником (із проф. Г.П. Ковтуновичем) Львівської онкологічної школи. Протягом 20 років був заступником Республіканського товариства онкологів (нині – Українське науково-медичне товариство онкологів), учасником і організатором кількох з’їздів онкологів. Також був активним громадським діячем, зокрема на культурній ниві лемків: брав участь у роботі крайового товариства «Лемківщина» та Фундації дослідження Лемківщини у Львові.
 Експерт МОЗ України за спеціальністю «Онкологія», завідувач кафедри онкології ДЗ «Запорізька медична академія післядипломної освіти МОЗ України», доктор медичних наук, професор Олексій Олексійович Ковальов представив доповідь «Комплексне геномне профілювання як основа персоналізованої терапії РЯ».
Експерт МОЗ України за спеціальністю «Онкологія», завідувач кафедри онкології ДЗ «Запорізька медична академія післядипломної освіти МОЗ України», доктор медичних наук, професор Олексій Олексійович Ковальов представив доповідь «Комплексне геномне профілювання як основа персоналізованої терапії РЯ».
– Перші згадки про РЯ пов’язані з Ефраїмом Мак-Доуеллом, який 13 грудня 1809 р. провів першу в світі оваріотомію [1]. Нині, через 200 років після першої згадки про РЯ, розвиток сучасної медицини дозволяє розглядати пухлинні клітини через фокус геному, транскриптому, протеому, метаболому, ліпідому, епігеному та мікробіому [2]. Секвенування не окремих екзонів, а всього геному за межами кодуючих ділянок дало змогу виділити такі підтипи РЯ: 4 транскрипційні підтипи, 3 підтипи мікроРНК та 4 підтипи метилювання промоторів. Згідно з молекулярною класифікацією РЯ виділяють імунореактивний, диференційований, проліферативний і мезенхімальний підтипи. Окремі серозні пухлини також можуть мати декілька молекулярних підтипів [3].
Проте молекулярна класифікація і розподіл пухлин залежно від молекулярного підтипу лише мінімально впливає на вибір хіміотерапії при РЯ. Відповідно до сучасних рекомендацій, при епітеліальному РЯ стандартом є терапія на основі препаратів платини. Стандарт лікування платинорезистентного раку наразі відсутній. Молекулярно-спрямована терапія передбачає визначену наявність однієї чи кількох драйверних мутацій, тоді як вибір таргетної терапії ґрунтується на припущенні, що ці геномні зміни є «діючими» [4].
 Голова комітету з освіти Європейського товариства онкогінекології (ESGO; м. Рим, Італія), професор Анна Фаготті зупинилася на сучасних стандартах первинної циторедуктивної хірургії (cytoreductive surgery – CRS), фокусуючи увагу на значенні малоінвазивної хірургії при лікуванні РЯ на пізній стадії.
Голова комітету з освіти Європейського товариства онкогінекології (ESGO; м. Рим, Італія), професор Анна Фаготті зупинилася на сучасних стандартах первинної циторедуктивної хірургії (cytoreductive surgery – CRS), фокусуючи увагу на значенні малоінвазивної хірургії при лікуванні РЯ на пізній стадії.
– Сучасні дані підтверджують ефективність малоінвазивної хірургії як на ранніх, так і на пізніх стадіях РЯ. Відповідно до сучасних рекомендацій Національної онкологічної мережі США (NCCN, 2022), лапароскопічна хірургія показана хворим на пізніх стадіях РЯ. Ця рекомендація ґрунтується власне на тому факті, що залишкова пухлина є найважливішим прогностичним фактором у пацієнток з РЯ. При цьому ефективність малоінвазивного методу буде залежати від трьох змінних: досвід і кваліфікація хірурга, заклад охорони здоров’я, де проводиться операція, різноманітні характеристики пацієнта, а також самого захворювання. І якщо детально зупинитися на всіх факторах, які впливають на результат лікування, то перші три є змінними.
Так, першим з чотирьох факторів є освіта хірурга. Наразі відомо, що пацієнтки, прооперовані високоспеціалізованими гінекологами-онкологами, мають кращі показники виживаності порівняно з тими, які були прооперовані загальними хірургами. Такі ж дані наявні і стосовно високоспеціалізованих центрів охорони здоров’я порівняно зі звичайними лікарнями. Третій фактор включає характеристики самої пацієнтки. За сучасними протоколами, ведення онкохворих потребує якісної оцінки їх загального стану. Однією із ключових характеристик хворої, яка має підтверджену асоціацію з виживаністю у післяопераційному періоді, є вік. Наявна значна кількість досліджень, результати яких свідчать, що пацієнтки старшого віку зазвичай мають вищу частоту залишкової пухлини, але характеризуються меншим балом за оцінкою складності оперативного втручанням [5]. Інші фактори, які обов’язково оцінюють перед проведенням оперативного втручання, є наявність/відсутність хронічних захворювань, а також функціональні показники, що стосуються повсякденного життя хворої.
Таким чином, всі пацієнтки потребують належного обстеження мультидисциплінарною командою фахівців у відповідному акредитованому спеціалізованому закладі системи охорони здоров’я.
 Керівник науково-дослідного відділення онкогінекології Національного інституту раку МОЗ України (м. Київ), президент ГО «Всеукраїнська асоціація гінекологічних онкологів», доктор медичних наук, професор Валентин Станіславович Свінціцький розповів про стандартні хірургічні процедури у хворих на занедбаний РЯ.
Керівник науково-дослідного відділення онкогінекології Національного інституту раку МОЗ України (м. Київ), президент ГО «Всеукраїнська асоціація гінекологічних онкологів», доктор медичних наук, професор Валентин Станіславович Свінціцький розповів про стандартні хірургічні процедури у хворих на занедбаний РЯ.
– Відповідно до сучасних даних, Україна сьогодні лідирує щодо частоти захворюваності на РЯ та смертності внаслідок цього захворювання як у Європі, так і у світі. Статистичні дані за 2020-2021 рр. свідчать, що смертність внаслідок РЯ становить 23,2%, іншими словами, кожна четверта пацієнтка з РЯ помирає протягом 12 міс після встановлення діагнозу. Ці дані є критичними, оскільки РЯ характеризується хронічним рецидивуючим і досить повільним перебігом.
У 2017 р. опубліковані рекомендації Європейського товариства медичної онкології (ESMO) та ESGO щодо ведення хворих з РЯ, згідно з якими відбір пацієнток для проведення CRS чи неоад’ювантної хіміотерапії (НАХТ) слід виконувати в спеціалізованих центрах на основі мультидисциплінарного підходу [6]. При цьому CRS з повним видаленням пухлини є найважливішим прогностичним фактором у пацієнток із поширеним РЯ, а також головною метою хірургічного лікування. За можливості показане хірургічне втручання з повним видаленням пухлини (враховуючи поширеність процесу та загальний стан хворої), виконання первинної CRS рекомендовано лапаротомним доступом.
Дискусія щодо застосування первинної CRS або НАХТ ведеться вже багато років. І хоча в доробку світової медичної спільноти наявна значна кількість досліджень, у яких порівнювали ефективність одного методу з іншим, дискусії з приводу терапії РЯ тривають і досі [7-9]. У 2020 р. Y.A. Lyons та співавт. визначили, що застосування CRS характеризується кращими віддаленими результатами, ніж НАХТ [10].
 Якості життя хворих на РЯ після персоналізованого використання CRS та хіміотерапії була присвячена доповідь професора кафедри променевої діагностики, терапії, радіаційної медицини і онкології Одеського національного медичного університету, доктора медичних наук Андрія Ігорьовича Рибіна.
Якості життя хворих на РЯ після персоналізованого використання CRS та хіміотерапії була присвячена доповідь професора кафедри променевої діагностики, терапії, радіаційної медицини і онкології Одеського національного медичного університету, доктора медичних наук Андрія Ігорьовича Рибіна.
– РЯ залишається одним із найпоширеніших злоякісних новоутворень жіночої репродуктивної системи. Щорічно у світі реєструють понад 300 тис. нових випадків РЯ. Проблемою ведення хворих цієї групи є дуже висока смертність. Смертність внаслідок РЯ щорічно сягає 100 тис. випадків, випереджаючи таку внаслідок раку тіла та шийки матки. При цьому летальність на першому році після встановлення діагнозу становить 35%, а загальна п’ятирічна виживаність не досягає і 40%.
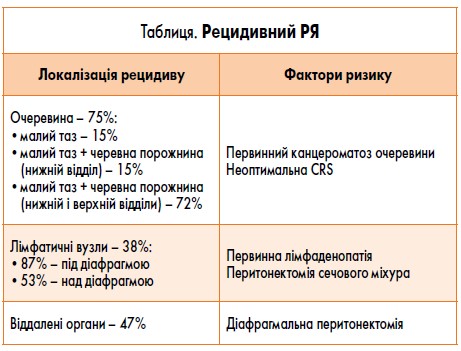
На сьогодні ключовою проблемою ведення хворих на РЯ є ризик його імплантаційного метастазування. Зокрема, основною локалізацією метастазування є очеревина, призводячи до канцероматозу очеревини, що і зумовлює основні клінічні прояви захворювання та є головною причиною ускладнень і смертності внаслідок РЯ (табл.) [11]. Клінічні симптоми канцероматозу очеревини включають пухлинний асцит, виражений тазовий/абдомінальний больовий синдром, ішемію та обструкцію кишечника, сечоводів, перфорацію порожнистих органів, а також такі симптоми, як збільшення розмірів живота, диспареунія і диспепсія.
 Комбінованому лікуванню рецидивного РЯ присвятив доповідь директор дослідницької групи перитонеального карциноматозу, завідувач відділення загальної та онкологічної хірургії в Centre Hospitalier Lyon-Sud (м. Ліон, Франція), доктор медичних наук Olivier Glehen.
Комбінованому лікуванню рецидивного РЯ присвятив доповідь директор дослідницької групи перитонеального карциноматозу, завідувач відділення загальної та онкологічної хірургії в Centre Hospitalier Lyon-Sud (м. Ліон, Франція), доктор медичних наук Olivier Glehen.
– Справді, основною локалізацією метастазування РЯ є очеревина, далі йдуть лімфатичні вузли та інші, більш віддалені органи, у тому числі кишечник. Перш ніж говорити про ведення рецидивного РЯ, важливо його умовно класифікувати на три групи. Перша група включає платинорезистентний РЯ, друга – платиночутливий РЯ, а третя група – рецидиви РЯ після множинної хіміотерапії. Звичайно, кожна з груп РЯ характеризується певними особливостями ведення та стратегіями лікування.
Сьогодні наявні докази ефективності застосування CRS як при первинному РЯ, так і при його рецидивах [12]. При цьому основною метою CRS є повнота циторедукції (completeness of cytoreduction – CC) 0 – макроскопічні резидуальні пухлинні вогнища на очеревині після CRS відсутні. За результатами європейського дослідження DEKSTOP, медіана загальної виживаності у групі CC-0 становить 45,2%, тоді як у групі СС-1 цей показник не досягає і 20% [18]. Тобто результати дослідження DEKSTOP засвідчили, що оперативне втручання при рецидиві РЯ доречне лише тоді, коли є можливість провести повну CRS. Після того були розроблені критерії AGO, що включають прогностичні фактори, які необхідно оцінити для відбору пацієнток, котрим показане виконання вторинної CRS. До них належать загальний стан за шкалою ECOG 0 балів, відсутність залишкової пухлини після первинної циторедукції або I/II стадія за FIGO, а також асцит не більше 500 мл.
У 2020 р. були опубліковані результати дослідження AGO-OVAR DESKTOP III, відповідно до яких вторинна CRS може мати високу клінічну ефективність у хворих із платиночутливим серозним рецидивуючим РЯ, у котрих прогнозується висока ймовірність повної резекції (n=408). Порівняно з неповною повна резекція збільшувала медіану загальної виживаності на 33,1 міс та знижувала ризик смерті на 60% [13].
 Проблему збереження фертильності у жінок з пограничними пухлинами яєчників висвітлила завідувачка відділення репродуктології клініки «Альтернатива» (м. Львів), кандидат медичних наук Любов Олегівна Михайлишин.
Проблему збереження фертильності у жінок з пограничними пухлинами яєчників висвітлила завідувачка відділення репродуктології клініки «Альтернатива» (м. Львів), кандидат медичних наук Любов Олегівна Михайлишин.
– У 2020 р. було презентовано настанови Європейської асоціації репродуктивної медицини (ESHRE) щодо можливості збереження фертильності у жінок з пограничними пухлинами яєчників [14]. Наразі у світі широко використовують всього п’ять методів збереження фертильності: оваріальна біопсія, оваріальна стимуляція, технологія in vitro Maturation (IVM), оваріальна транспозиція та використання агоністів гонадотропін-рилізинг-гормона (ГнРГ). Кожен із п’яти методів збереження фертильності має свої переваги та недоліки. Так, застосування агоністів ГнРГ знижує ризик передчасної оваріальної недостатності при хіміотерапії, проте їх не слід використовувати замість інших, більш ефективних варіантів збереження фертильності, оскільки застосування цих засобів не забезпечує високої результативності щодо збереження репродуктивної функції [15-17]. Оваріальна транспозиція також не належить до високоефективних методів збереження фертильності.
Технологія IVM – новий підхід до збереження фертильності, який передбачає дозрівання яйцеклітин поза організмом. Цей метод можна розглядати як клінічно підтверджений варіант у стратегії збереження фертильності в онкохворих, у яких неможлива стимуляція яєчників. Однак ефективність програм IVM є нижчою, ніж традиційне екстракорпоральне запліднення з отриманням зрілих овоцитів [18]. Ключові етапи IVM:
- Незрілі овоцити можна отримати з тканини яєчника після операції чи аспірувати з антральних фолікулів яєчника в будь-який час менструального циклу, без проведення жодної оваріальної стимуляції.
- Аспірація проводиться трансвагінально під місцевою або загальною анестезією.
- Після отримання незрілих овоцитів на стадії gv в умовах лабораторії протягом 24-48 год проводиться їх дорощення в спеціальних середовищах до стадії МІІ (зрілі).
- Зрілі овоцити обробляють кріопротекторами, кріоконсервують методом вітрифікації та зберігають при температурі -196 °С.
Проте ці методи не набули широкого застосування у репродуктології. Так, відповідно до даних J. Donnez et al. (2017), з 2004 р. і по сьогодні у результаті кріоконсервації яєчникової тканини народилося всього 140 дітей у всьому світі [19]. Сучасні дані щодо частоти застосування різних методів збереження фертильності свідчать, що найбільшого поширення набула кріоконсервація овоцитів або ембріонів, тоді як інші методи менш поширені [20]. Враховуючи неідеальність усіх методів, у світі активно проводиться низка досліджень, спрямованих на розробку нових методів збереження фертильності у пацієнток онкологічного профілю, зокрема застосування таргетованих нанокапсул хіміотерапевтичного агента, використання протекторів і створення нових препаратів із нижчою гонадотоксичністю.
Список літератури знаходиться в редакції.
Підготувала Анна Хиць
Тематичний номер «Акушерство. Гінекологія. Репродуктологія» № 5 (51) 2022 р.