2 лютого, 2021
Ріалтріс – новий комбінований назальний спрей для лікування алергічного риніту
.jpg) Алергічний риніт (АР) являє собою опосередковане імуноглобулінами класу E запальне захворювання слизової оболонки носової порожнини, тригерами котрого є алергени, що містяться в повітрі (Hossenbaccus L. et al., 2020). АР притаманний суттєвий несприятливий вплив на сон, працездатність і здатність до навчання; його небезпека зумовлена ще й тим, що це захворювання часто асоціюється з атопічним дерматитом, харчовою алергією та бронхіальною астмою. Цей процес називається атопічним маршем (Bantz S. et al., 2014). Залежно від географічного регіону поширеність АР становить 10-40% (Asher M. et al., 2006). У зв’язку зі значною поширеністю та хронічним перебігом АР є загальносвітовою медичною проблемою, що супроводжується значними фінансовими витратами (Seidman M. et al., 2015; Rotiroti G., Scadding G., 2016).
Алергічний риніт (АР) являє собою опосередковане імуноглобулінами класу E запальне захворювання слизової оболонки носової порожнини, тригерами котрого є алергени, що містяться в повітрі (Hossenbaccus L. et al., 2020). АР притаманний суттєвий несприятливий вплив на сон, працездатність і здатність до навчання; його небезпека зумовлена ще й тим, що це захворювання часто асоціюється з атопічним дерматитом, харчовою алергією та бронхіальною астмою. Цей процес називається атопічним маршем (Bantz S. et al., 2014). Залежно від географічного регіону поширеність АР становить 10-40% (Asher M. et al., 2006). У зв’язку зі значною поширеністю та хронічним перебігом АР є загальносвітовою медичною проблемою, що супроводжується значними фінансовими витратами (Seidman M. et al., 2015; Rotiroti G., Scadding G., 2016).
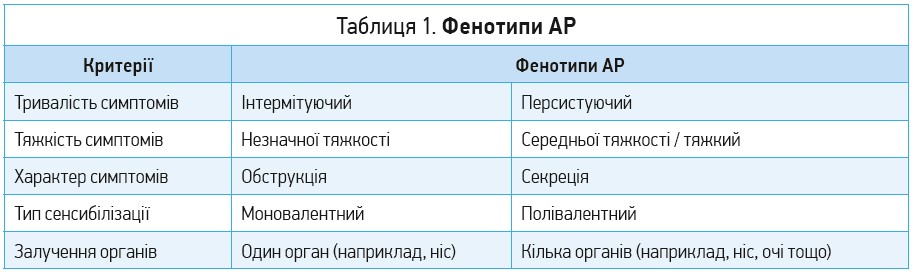
До симптомів АР належать нежить, закладеність носа, чхання, очні симптоми (кон’юнктивіт) тощо. На основі клінічних критеріїв АР можна класифікувати на різні фенотипи (табл. 1) (Sybilski A., 2018).
Під час пандемії коронавірусної хвороби (COVID‑19) лікарям слід бути особливо уважними, оскільки деякі її симптоми збігаються із симптомами АР (рис. 1).
 Рис. 1. Клінічна симптоматика АР і COVID-19 (National Center for Immunization and Respiratory Diseases, 2020)
Рис. 1. Клінічна симптоматика АР і COVID-19 (National Center for Immunization and Respiratory Diseases, 2020)
АР класифікують на сезонний (САР) і цілорічний (ЦАР) (Brozek J. et al., 2017). Провідні тригери САР – алергени зовнішнього середовища (насамперед пилок рослин). Натомість ЦАР зазвичай провокують алергени приміщень (кліщі домашнього пилу, пліснява, алергени комах (насамперед тарганів), лупа домашніх тварин) (Bousquet J. et al., 2001). Класифікації АР на сезонний і цілорічний властива певна суперечливість, оскільки симптоми ЦАР можуть виявлятися періодично, а не щодня протягом усього року, а також навпаки – мінімальне персистуюче запалення слизової, що спостерігається за САР, спричиняє появу симптомів навіть за відсутності сезонного впливу пилку. Крім того, особи із САР і сенсибілізацією до пилку кількох різних рослин можуть мати тривалі загострення протягом двох-трьох пір року, а в пацієнтів із ЦАР можуть спостерігатися тривалі ремісії та періодичні рецидиви. Оскільки це ускладнює діагностику, за ініціативи Allergic Rhinitis and its Impact on Asthma (ARIA) було запропоновано інший метод класифікації АР на основі тривалості й особливостей рецидивування (Bousquet J. et al., 2005). Так, інтермітуючий АР (ІАР) характеризується симптомами, що з’являються менш ніж у 4 дні на тиждень або впродовж менш ніж 4 послідовних тижнів. Своєю чергою, за персистуючого АР (ПАР) симптоми з’являються частіше ніж у 4 дні на тиждень протягом 4 послідовних тижнів. Отже, терміни САР та ІАР, а також ЦАР і ПАР не є синонімічними; будь-яку з цих класифікацій слід використовувати окремо, без ототожнення наведених вище пар термінів (Bousquet J. et al., 2005; Van Hoecke H. et al., 2006; Todo-Bom A. et al., 2007).
Діагностика АР має включати ретельний збір анамнезу, фізикальне обстеження та проведення шкірних тестів для підтвердження алергії (Small P. et al., 2018). Під час збору анамнезу слід оцінити ступінь вираженості симптомів, їхній зв’язок із впливом алергенів, уживання ліків та ефективність назальних деконгестантів, сімейний анамнез алергічних хвороб (Brozek J. et al., 2017; Small P. et al., 2018; Dykewicz M., Hamilos D., 2010; Wang D., 2005). При фізикальному обстеженні потрібно звернути увагу на набряк слизової оболонки носа, наявність поліпів і постназального стікання. Важливе значення мають також непрямі ознаки АР: темні кола під очима, дихання ротом, часте прочищання горла, поперечна зморшка на переніссі. Під час огляду шкіри й аускультації легень можна виявити ознаки інших атопічних хвороб: екземи та бронхіальної астми (Hossenbaccus L. et al., 2020).
Хоча анамнез хвороби та фізикальне обстеження мають велике значення, патогномонічні ознаки АР відсутні (Hossenbaccus L. et al., 2020). Основні діагностичні обстеження за АР – шкірні прик-тести, що є швидкими, недорогими та мінімально інвазивними (Small P. et al., 2018; Dykewicz M., Hamilos D., 2010).
Лабораторні методи дослідження також відіграють важливу роль у специфічній діагностиці АР. Оскільки в основі розвитку АР лежить IgE-залежний (негайний) тип алергічної реакції, то для виявлення причинно-значимих алергенів застосовують імуноферментний і хемілюмінесцентний аналізи, радіоалергосорбентний й імунофлуоресцентний тести, прямий і непрямий базофільні тести.
При обранні лікування АР слід приймати рішення спільно з пацієнтом, урахувавши його побажання й індивідуальні особливості. Перед початком лікування слід надати хворим інформацію щодо зменшення або усунення впливу алергенів (Dykewicz M. S., Hamilos D. L., 2010). Із цією метою доцільно тримати закритими вікна, щоб уникнути потрапляння до житлових приміщень пилку, підтримувати вологість <40% для зменшення ймовірності розростання плісняви та пилових кліщів, застосовувати пилососи з HEPA‑фільтрами, котрі дають змогу усунути з повітря лупу домашніх тварин (Small P. et al., 2018; Hossenbaccus L. et al., 2020).
Якщо симптоми зберігаються, незважаючи на проведені заходи, слід розпочинати фармакотерапію. Відповідно до наявних рекомендацій і результатів клінічних досліджень застосування комбінації інтраназальних кортикостероїдів (ІнКС) й інтраназальних антигістамінних препаратів (ІнАГП) у пацієнтів із помірнотяжким і тяжким САР має перевагу над монотерапією (Ratner P. et al., 2008). У спільних рекомендаціях Американської академії отоларингології, хірургії голови та шиї й Американської академії сімейних лікарів (оновлено у 2020 р.) зазначено, що комбінація ІнКС й ІнАГП є найефективнішим комбінованим лікуванням для хворих на АР, які не досягають бажаного клінічного результату за допомогою монотерапії (American Academy of Family Physicians, 2020). У рекомендаціях ARIA з лікування АР (2020) зазначено, що ІнКС мають бути першою лінією терапії такого стану, а також наголошено, що сполучення ІнКС й ІнАГП має клінічні переваги над монотерапією ІнКС; водночас у рекомендаціях зауважено, що ця комбінація реалізує свій ефект уже через кілька хвилин після вживання (Bousquet J. et al., 2020). На думку експертів ARIA, вибір між монотерапією ІнКС і лікуванням фіксованою комбінацією ІнКС й ІнАГП слід робити на основі уподобань пацієнта, доступності цих препаратів, а також їхньої вартості. На початку лікування (перші 2 тиж) комбінація ІнКС й ІнАГП може забезпечити швидше усунення симптомів, аніж монотерапія ІнКС, тому деякі пацієнти віддають перевагу комбінованому лікуванню (Brozek J. et al., 2017).
Препарат Ріалтріс (фіксована комбінація олопатадину гідрохлориду 665 мкг і мометазону фуроату 25 мкг, «Гленмарк Фармасьютикалз Лтд.») являє собою назальний спрей, який містить ІнКС й ІнАГП і показаний для симптоматичного лікування САР у пацієнтів віком понад 12 років. За даними від 23 грудня 2020 р., Ріалтріс уже представлено чи буде представлено найближчим часом у 33 країнах Європи.
ІнКС мометазон та ІнАГП олопатадин є добре вивченими препаратами, що застосовуються в лікуванні АР.
Гістологічні дослідження продемонстрували, що мометазон зменшує еозинофільну інфільтрацію слизової оболонки носа порівняно з плацебо, а також експресію фактора росту ендотелію судин С (Sivam A. et al., 2010; Kujundzic M. et al., 2013). Подвійне сліпе рандомізоване контрольоване дослідження T. Yamada та співавт. (2012) виявило, що вже протягом 14 днів застосування інтраназальний мометазон здатен зменшувати вираженість назальних симптомів риніту, покращувати якість життя, чинити сприятливий вплив на сон (за Епвортською шкалою сонливості) в пацієнтів із ЦАР. За допомогою метааналізу M. Penagos і співавт. (2008), який містив дані 2998 пацієнтів, з’ясовано, що застосування назального спрею мометазону фуроату асоціювалося з достовірним зменшенням оцінки за загальною шкалою симптомів із боку носа (Total Nasal Symptom Score, TNSS) загалом, а також окремо за такими параметрами, як закладеність носа, нежить, чхання, свербіж носа. Відзначалася також достовірна перевага мометазону над плацебо в зниженні екстраназальної симптоматики АР. Частка пацієнтів, у яких спостерігалися побічні явища, в групах мометазону та плацебо була однаковою. Інший метааналіз 10 рандомізованих контрольованих досліджень (n=3132), проведений L. Bielory та співавт. (2011), довів сприятливий вплив інтраназального спрею мометазону на всі очні симптоми САР і ЦАР (свербіж і печіння, сльозотеча, почервоніння). Мометазон також виявився ефективним у пацієнтів із коморбідним перебігом ПАР та інтермітуючою бронхіальною астмою, оскільки знижував сумарний тягар клінічної симптоматики (Baiardini I. et al., 2010).
Своєю чергою, олопатадин являє собою високоефективний ІнАГП, який продемонстрував безсумнівну перевагу над плацебо в зменшенні симптомів АР і покращенні якості життя (Meltzer E. O. et al., 2011; Berger W. E. et al., 2009; Kaliner M. A. et al., 2009). Швидкість покращення клінічного стану на тлі застосування інтраназального спрею олопатадину перевищувала аналогічний показник у разі застосування флутиказону (Kaliner M. A. et al., 2009). Хоча в алгоритмах ARIA фігурує комбінація ІнКС з азеластином, безпосереднє порівняння олопатадину й азеластину не виявило достовірних відмінностей у симптоматичному ефекті (Shah S. et al., 2009; Meltzer E. et al., 2008; Pipkom P. et al., 2008), а одне з них навіть підтвердило перевагу олопатадину: менш виражений неприємний присмак після нанесення спрею. Смак і запах олопатадину більше сподобався 54,1 та 32,1% пацієнтів, а азеластину – 27,5 та 11,9% відповідно. Імовірність тривалого застосування препарату (відповідно до вподобань пацієнтів) у групі олопатадину становила 60,9%, а в групі азеластину – 34,5% (Meltzer E. O. et al., 2008). Меншу частоту та нижчу інтенсивність гіркоти в роті на тлі застосування олопатадину порівняно з азеластином за однакової ефективності цих спреїв відзначили й інші автори (Shah S. R. et al., 2009). Такі дані обов’язково слід узяти до уваги, оскільки при хронічних захворюваннях прихильність до лікування має особливу важливість. Велике обсерваційне дослідження продемонструвало, що в ≈70% пацієнтів з АР спостерігалася незадовільна прихильність (Menditto E. et al., 2019).
Програма клінічних досліджень препарату Ріалтріс містила 4 дослідження, 3 з яких мали схожий дизайн (рандомізовані багатоцентрові подвійні сліпі дослідження з плацебо- й активним контролем). Пацієнтів цих досліджень було рандомізовано до груп Ріалтрісу, олопатадину, мометазону та плацебо. Застосування Ріалтрісу супроводжувалося достовірною перевагою над плацебо щодо зменшення оцінки за TNSS як за останні 12 год до оцінювання (рис. 2), так і на цей момент. Ріалтрісу була властива перевага за сумарною оцінкою, а також за окремою оцінкою кожного зі внесених до шкали симптомів: нежитю, закладеності носа, свербежу носа та чхання (Andrews C. P. et al., 2020; Gross G.N. et al., 2019; Hampel F. C. et al., 2019).
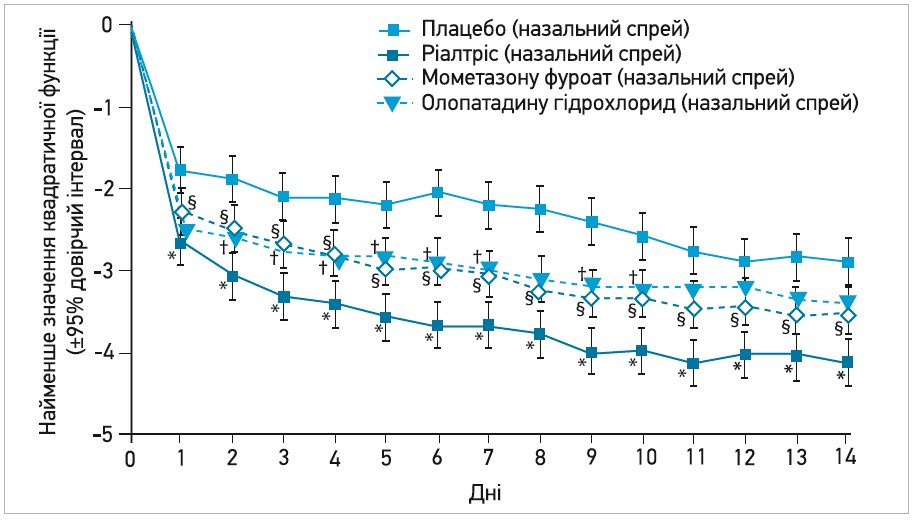 Рис. 2. Найменше значення квадратичної функції зміни від вихідного рівня ранкової та вечірньої оцінки за TNSS (дослідження GSP 301-304)
Рис. 2. Найменше значення квадратичної функції зміни від вихідного рівня ранкової та вечірньої оцінки за TNSS (дослідження GSP 301-304)
Примітка: † § * - достовірність відмінності порівняно з плацебо (р<0,05).
Узагальнений аналіз результатів цих 3 досліджень підтвердив достовірну перевагу лікування Ріалтрісом над плацебо та монотерапією олопатадином або мометазоном (Gross G. N. et al., 2019). Ріалтріс покращував оцінку за TNSS у кожен окремий день 2-тижневого періоду лікування. Початок дії препарату був швидким (визначався приблизно через 15 хв після застосування спрею), а ефект – стійким (відмінність в оцінці за TNSS між групами Ріалтрісу та плацебо спостерігалася й через 4 год після застосування) (Andrews C. et al., 2020; Gross G. et al., 2019; Hampel F. et al., 2019).
Крім покращення суб’єктивної оцінки назальних симптомів пацієнтом, станом на завершення лікування Ріалтріс достовірно покращував сумарну оцінку назальних симптомів лікарем (Physician-assessed Nasal Symptom Score) порівняно з плацебо. Достовірна відмінність визначалась як за сумарною оцінкою, так і за оцінкою кожного окремого компонента TNSS (нежить, закладеність носа, свербіж носа, чхання) (Andrews C. P. et al., 2020; Gross G.N. et al., 2019; Hampel F. C. et al., 2019).
Ріалтріс достовірно покращував контроль назальних симптомів риніту за результатом тесту оцінки контролю риніту (Rhinitis Control Assessment Test) порівняно з плацебо та монотерапією будь-яким із компонентів цієї комбінації (Gross G. N. et al., 2019; Hampel F. C. et al., 2019). Слід зазначити, що застосування олопатадину/мометазону (Ріалтрісу) також зменшувало сумарну оцінку очних симптомів за останні 12 год (Total Ocular Symptom Scores, TOSS) порівняно з вихідним рівнем. За даними узагальненого аналізу 3 основних клінічних досліджень Ріалтрісу, це зменшення достовірно перевищувало показник плацебо (Prenner B. et al., 2019). Покращення було зафіксовано при оцінці як ранкового, так і вечірнього показника очних симптомів на цей момент за TOSS, а також при оцінці кожного окремого очного симптому АР (свербіж або печіння очей, сльозотеча, почервоніння очей) (Gross G. N. et al., 2019; Hampel F. C. et al., 2019).
Суб’єктивна оцінка впливу САР на якість життя учасників досліджень до та після лікування проводилася за допомогою опитувальника для визначення якості життя при ринокон’юнктивіті (Rhinoconjunctivitis Quality of Life Questionnaire, RQLQ). Цей опитувальник містить 28 запитань із 7 доменів: активність, сон, симптоми АР, окрім симптомів із боку носа й ока, проблеми в повсякденному житті, назальні симптоми, очні симптоми, проблеми в емоційній сфері; оцінюється за системою «0» – порушення відсутні, «6» – максимальні порушення. У кожному з проведених досліджень препарат Ріалтріс знижував оцінку за RQLQ (порівняно з вихідним рівнем) вираженіше за плацебо (р<0,001) (Mohar D. et al., 2019).
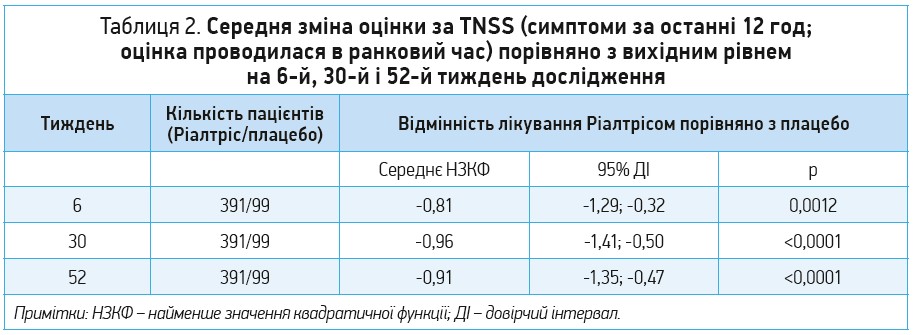
Четверте випробування Ріалтрісу, що відрізнялося від попередніх трьох, являло собою подвійне сліпе рандомізоване плацебо-контрольоване дослідження ефективності та безпеки цього препарату в осіб із ЦАР. Тривалість дослідження становила 52 тиж. Застосування Ріалтрісу супроводжувалося достовірно вираженішим зменшенням оцінки за TNSS (як щодо негайних симптомів, так і щодо симптомів за останні 12 год) порівняно з плацебо на 6-му, 30-му та 52-му тижні дослідження (табл. 2). Перевага олопатадину/мометазону не залежала від віку, статі й етнічної приналежності. Препарат екстреного порятунку (лоратадин) довелося застосовувати 35,6% учасників групи Ріалтрісу та 46,5% учасників групи плацебо (Segall N. et al., 2019).
Важливо, що переваги Ріалтрісу не зменшуються при тривалому регулярному застосуванні препарату; випадків тахіфілаксії не було зафіксовано навіть через 52 тиж користування цим медикаментом (Segall N. et al., 2019).
У проведених клінічних дослідженнях зафіксовано хорошу переносимість Ріалтрісу в дорослих і підлітків із САР і ЦАР; більшість побічних явищ характеризувалася незначною чи помірною тяжкістю (Andrews C. et al., 2020; Gross G. et al., 2019; Hampel F. et al., 2019; Segall N. et al., 2019). Узагальнений аналіз даних щодо безпеки з короткотривалих (14 днів) клінічних досліджень II та III фаз за участю пацієнтів із САР виявив, що побічні ефекти спостерігалися в 13,9% хворих групи олопатадину/мометазону, 13,2% осіб групи монотерапії олопатадином, 7,9% учасників групи монотерапії мометазоном і 9,5% пацієнтів групи плацебо. Найпоширенішими побічними явищами на тлі застосування Ріалтрісу були дисгевзія, носова кровотеча та відчуття дискомфорту в носовій порожнині. Тяжких побічних реакцій, пов’язаних із лікуванням, не було виявлено в жодному з досліджень клінічної програми (Andrews C. et al., 2020; Gross G. et al., 2019; Hampel F. et al., 2019). Профіль переносимості препарату за тривалого застосування (52 тиж) відповідав показникам короткотривалих досліджень. Загалом побічні явища спостерігалися в 51,7% пацієнтів, які отримували Ріалтріс. У групах плацебо з рН 3,7 та 7,0 цей показник становив 41,4 та 53,5% відповідно. Побічні явища, пов’язані з лікуванням, спостерігалися в 11,2% хворих групи олопатадину/мометазону й у 7,1 та 9,9% учасників груп плацебо з різним рН (Segall N. et al., 2019). Найчастішими побічними ефектами за тривалого застосування Ріалтрісу були інфекції верхніх дихальних шляхів, носові кровотечі, головний біль, відчуття дискомфорту в носовій порожнині, кашель тощо. Тяжких носових кровотеч не спостерігалося в жодній із груп; виразкування слизової оболонки порожнини носа також не відзначалося. У зв’язку з розвитком побічних явищ лікування припинили 3,8% хворих групи Ріалтрісу, 2,0% учасників групи плацебо з рН 3,7 та 3,0% учасників групи плацебо з рН 7,0 (Ryaltris prescribing information; Segall N. et al., 2019).
Отже, переваги Ріалтрісу в лікуванні АР:
- поєднання двох засобів першої лінії з різними механізмами дії в одному назальному спреї (фіксована комбінація);
- швидке усунення симптомів САР;
- ефективне довготривале полегшення назальних симптомів ЦАР;
- покращення якості життя пацієнтів;
- хороша переносимість, відсутність системних побічних ефектів застосування (Lamb Y. N., 2020).
Медична газета «Здоров’я України 21 сторіччя» № 1 (494), 2021 р.