3 липня, 2021
Вибір антигістамінного препарату при лікуванні алергічного риніту
 У ході Міжнародного форуму «Респіраторна медицина – виклики 2021», що відбувся 14-15 травня, було обговорено провідні проблеми сьогоднішньої пульмонології й алергології, зокрема лікування коронавірусної пневмонії, антибіотикорезистентність респіраторних патогенів і нюанси останніх рекомендацій фахових товариств. Захід зібрав велику кількість оториноларингологів, пульмонологів, сімейних лікарів, терапевтів, педіатрів і лікарів інших спеціальностей, які цікавляться цими питаннями.
У ході Міжнародного форуму «Респіраторна медицина – виклики 2021», що відбувся 14-15 травня, було обговорено провідні проблеми сьогоднішньої пульмонології й алергології, зокрема лікування коронавірусної пневмонії, антибіотикорезистентність респіраторних патогенів і нюанси останніх рекомендацій фахових товариств. Захід зібрав велику кількість оториноларингологів, пульмонологів, сімейних лікарів, терапевтів, педіатрів і лікарів інших спеціальностей, які цікавляться цими питаннями.
Віцепрезидентка ГО «Асоціація алергологів України», доктор медичних наук Інна Володимирівна Гогунська (ДУ «Інститут отоларингології ім. О. С. Коломійченка НАМН України», м. Київ) нагадала слухачам, що зростання поширеності алергічних захворювань у промислово розвинених країнах триває вже понад 50 років. Наразі на алергічний риніт (АР) страждає 10-30% населення, а довічна поширеність кропив’янки перевищує 20%. Навіть серед дітей шкільного віку сенсибілізація до одного чи більше алергенів наближається до 40-50%.
Згідно з рекомендаціями ARIA, першим етапом терапії АР і хронічної кропив’янки виступають антигістамінні препарати (АГП). У світі доступно понад 45 АГП, які становлять найбільший клас препаратів, що застосовується в лікуванні алергічних захворювань. Механізм дії АГП пов’язаний із взаємодією з рецепторами медіатора алергічних реакцій негайного типу – гістаміну. З часу першого опису фізіологічної та патологічної дій гістаміну минуло вже понад 100 років, а від початку клінічного застосування АГП – більш як 70 років, отож можна сказати, що натепер АГП відмінно вивчені. Н1-АГП діють як зворотні агоністи, котрі об’єднують і стабілізують неактивну конформацію Н1-рецепторів, зміщуючи рівновагу в бік неактивного стану. Протягом більш ніж 50 років ці препарати описували як антагоністи чи блокатори Н1-рецепторів, але ці застарілі терміни не відображають істинний механізм дії зазначених засобів.
АГП поділяють на покоління: препарати I покоління ще називають «старими» та «седативними», а препарати II покоління – «неседативними». Перевагу варто віддавати АГП II покоління, оскільки їм притаманні кращі показники співвідношення ефективність/безпека, ніж для АГП I покоління. Крім того, в АГП II покоління відсутні антихолінергічні та седативні побічні ефекти. Такі відмінності пов’язані з тим, що препарати I покоління вільно проникають крізь гематоенцефалічний бар’єр і з’єднуються з Н1-рецепторами, розташованими на постсинаптичних мембранах гістамінергічних нейронів усієї центральної нервової системи. З АГП I покоління пов’язана низка ризиків. Зокрема, ці препарати зменшують тривалість фази швидкого сну, погіршують навчання та знижують ефективність роботи, мають кардіотоксичну дію, асоціюються з дорожньо-транспортними пригодами та нещасними випадками в цивільній авіації, а також із самогубствами в дітей і дорослих, випадками смерті немовлят або дітей раннього віку внаслідок ненавмисного передозування (Church M. K. et al., 2010). Відповідно до позиційного документа GA(2)LEN, рекомендовано обмежити безрецептурний продаж АГП I покоління та їх самостійне застосування для лікування алергічних захворювань, особливо зважаючи на те що препарати II покоління характеризуються кращим співвідношенням користь/ризик і широко доступні за конкурентними цінами.
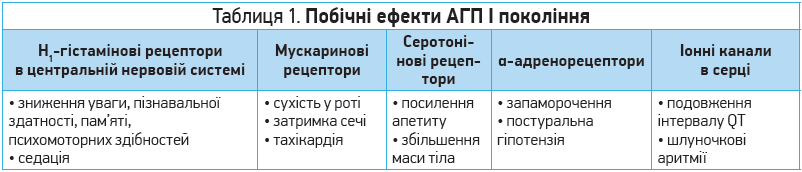
Побічні ефекти Н1-АГП I покоління можуть бути різними; це залежить від виду рецепторів, через які реалізується побічна дія (табл. 1).
Натомість АГП II покоління практично не проникають крізь гематоенцефалічний бар’єр, що було підтверджено за допомогою позитронно-емісійної томографії. Завдяки цьому візуалізаційному методу було встановлено новий стандарт АГП і визначено, що окупація цими препаратами Н1-рецепторів центральної нервової системи (H1RO) може бути безпосередньо пов’язана з функціями останньої, передусім із седацією, сонливістю та порушенням працездатності. Важливість H1RO як показника неседативних властивостей АГП було визнано консенсусною групою з питань АГП нового покоління (CONGA).
Як уже було сказано, для вимірювання H1RO використовується позитронно-емісійна томографія з міченим доксепіном. На основі визначеного показника всі АГП поділяють на неседативні (<20%), менш седативні (20-50%) та седативні (>50%). Серед неседативних АГП H1RO біластину перорально й олопатадину в очних краплях становить близько 0, а отже, ці АГП можна віднести до препаратів, які не проникають у центральну нервову систему (Kawauchi H. et al., 2019). Натомість для таких широко застосовуваних препаратів, як лоратадин і дезлоратадин, цей показник є вищим і становить 6,47±10,50% після перорального прийому 5 мг дезлоратадину та 13,80±7,00% після перорального прийому 10 мг лоратадину (Nakamura T. et al., 2019).
Деякі речовини, в тому числі АГП II покоління, потрапляють до центральної нервової системи через мозковий кровообіг і пасивно переносяться в ендотелій – частину гематоенцефалічного бар’єра. Утім, оскільки вони є субстратами Р-глікопротеїну, то активно ретроградно транспортуються до мозкового кровообігу, тому з Н1-рецепторами мозку зв’язується лише мінімальна кількість діючої речовини. Коли ж препарати не є субстратами Р-глікопротеїну, як-от АГП I покоління, вони не видаляються з мозку й тісно зв’язуються з відповідними рецепторами (Kawauchi H. et al., 2019; Ciado P. et al., 2010). Проте рівень впливу Р-глікопротеїну на проникнення препаратів у мозок залежить від хімічної структури молекули. На процес проникнення молекул медикаменту крізь гематоенцефалічний бар’єр впливають гідрофобність, молекулярна маса, електричний заряд, взаємодія з ферментами цитохрому Р450, наявність енантіомерів тощо. Наприклад, деякі лікарські засоби з низькою молекулярною масою (<400 Да) можуть проникати крізь гематоенцефалічний бар’єр за допомогою пасивної дифузії. При збільшенні молекулярної маси молекули з 300 до 450 Да проникнення в мозок зменшується в 100 разів (Pardridge W. M. et al., 2012). Молекулярні маси основних АГП є такими: дезлоратадин – 310,8 Да, левоцетиризин – 388,9 Да, біластин – 463,6 Да. Отже, молекулярна маса біластину є найбільшою, що додатково запобігає проникненню крізь гематоенцефалічний бар’єр.
Показники H1RO неседативних, менш седативних і седативних АГП певною мірою пропорційні їхній концентрації в плазмі крові: наростання вмісту препарату асоціюється з підвищенням здатності до проникнення крізь гематоенцефалічний бар’єр. Однак це не стосується біластину, який не проникає в мозок: його H1RO стало є наближеним до 0.
Слід зауважити, що седативним АГП притаманні залишкові ефекти. На прикладі дифенгідраміну та кетотифену було доведено, що період напіврозпаду препаратів у мозку приблизно в 5 разів більший, аніж у плазмі. Крім того, седативні АГП впливають на циркадний цикл сну та бадьорості, причому сонливість і порушення працездатності проявляються на наступний день як післядія (Yanai K. et al., 2016; Church M. et al., 2010).
Дослідження B. F. Marple та співавт. (2007) виявило, що майже третина пацієнтів не повністю задоволена призначеними їм ліками для терапії АР. Із них 55% бажали би, щоб полегшення стану тривало довше, а 44% – щоб покращення наставало швидше. Майже 2/3 респондентів зацікавлені в тому, щоб отримати призначення нового лікарського засобу для терапії АР, а 26% учасників дослідження постійно пробують нові препарати, щоби знайти найефективніші. Тобто можна сказати, що проблема оптимального лікування хворих на АР дотепер не розв’язана.
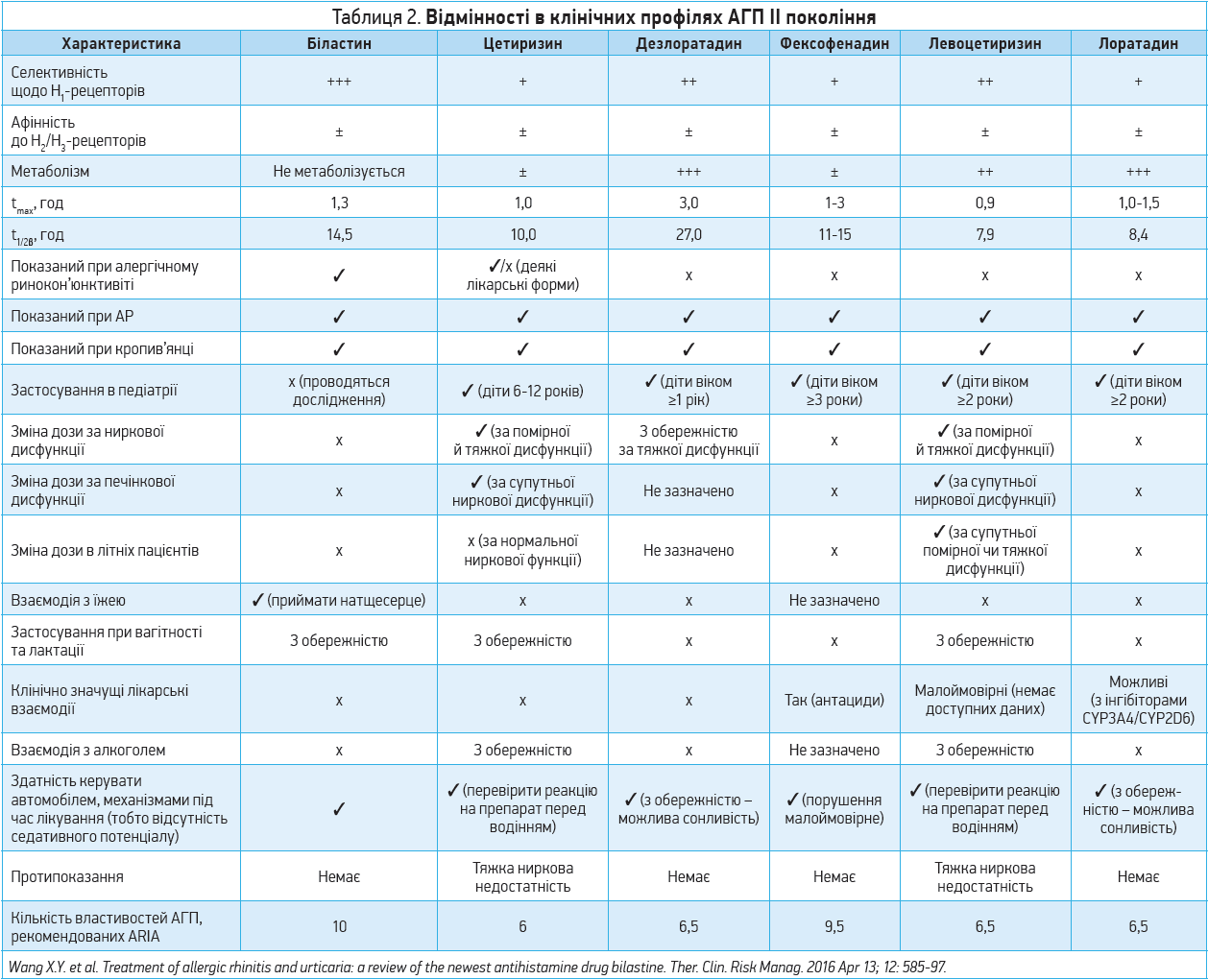
Молекула біластину, створена 2010 року, є найновішою молекулою АГП II покоління. Перевагами біластину порівняно з іншими АГП II покоління є найвища селективність стосовно Н1-рецепторів, можливість застосування при алергічному ринокон’юнктивіті, відсутність метаболізації в організмі, потреби в корекції дози в осіб із печінковою та нирковою недостатністю й у літніх людей, клінічно значущих міжлікарських взаємодій і взаємодії з алкоголем, а також впливу на здатність керувати автомобілем. Загалом біластину притаманно 10 властивостей, рекомендованих ARIA для оптимального АГП. Для прикладу: цетиризин має лише 6 таких властивостей, а лоратадин, дезлоратадин і левоцетиризин – по 6,5 (табл. 2) (Wang X. Y. et al., 2016).
Це робить біластин препаратом вибору для лікування пацієнтів з алергічними захворюваннями. За висновком експертів ARIA, завдяки фармакологічним особливостям, високій ефективності та безпеці, фармакодинамічним характеристикам біластин відповідає рекомендованим критеріям EAACI/ARIA для лікарських засобів, які застосовуються для лікування АР (Bousquet J. et al., 2012).
Отже, вибір оптимального АГП II покоління залежить від багатьох факторів, зокрема від співвідношення безпеки й ефективності, впливу на психомоторні функції, здатності чинити седативну дію. Результати досліджень показують, що біластин є найкращим вибором у зв’язку з відмінними характеристиками: високою ефективністю та безпекою, відсутністю седативної дії.
Підготувала Лариса Стрільчук
Медична газета «Здоров’я України 21 сторіччя» № 10 (503), 2021 р.