23 квітня, 2024
Алгоритм діагностики та лікування пацієнта з алергічним ринітом
Розбір клінічного випадку
 Зростання поширеності алергічних захворювань у промислово розвинених країнах триває вже понад 50 років. Наразі на алергічний риніт (АР) страждає 10-30% населення, поширеність кропив’янки протягом життя перевищує 20%. Серед дітей шкільного віку сенсибілізація щонайменше до одного алергену наближається до 40-50%.
Зростання поширеності алергічних захворювань у промислово розвинених країнах триває вже понад 50 років. Наразі на алергічний риніт (АР) страждає 10-30% населення, поширеність кропив’янки протягом життя перевищує 20%. Серед дітей шкільного віку сенсибілізація щонайменше до одного алергену наближається до 40-50%.
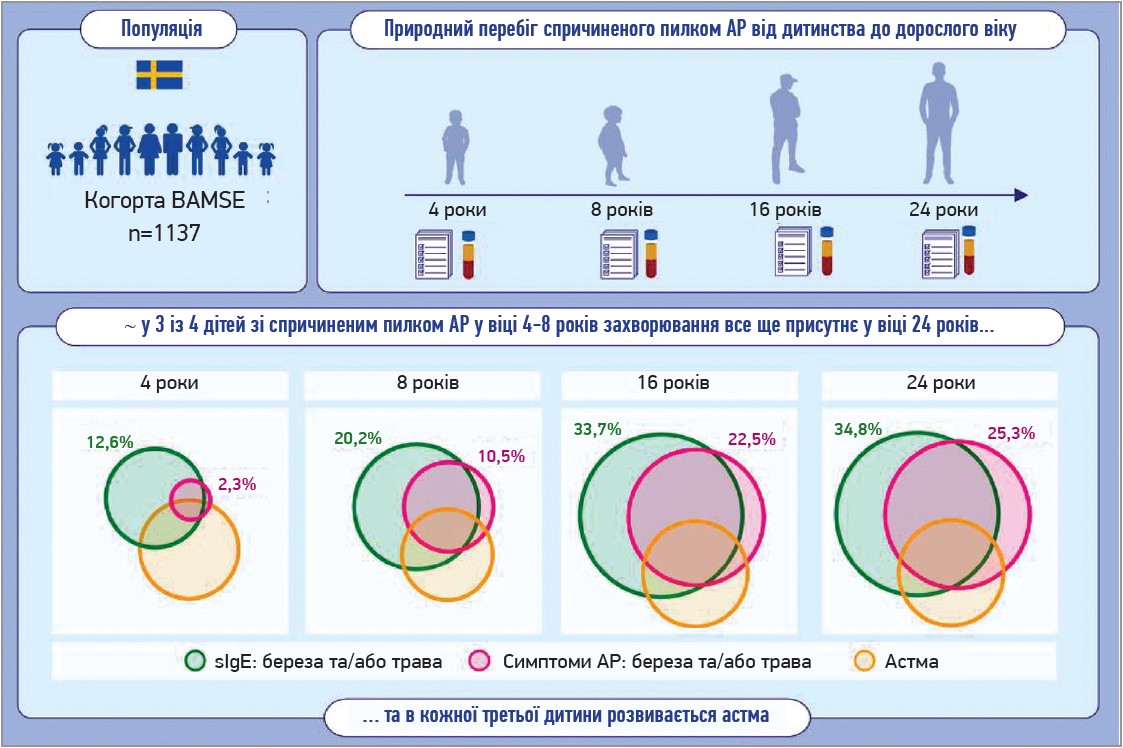
Щорічно зростає кількість полісенсибілізованих пацієнтів. За останніми оцінками, полісенсибілізація присутня у понад 80% хворих на АР, і загальновідомо, що ця категорія пацієнтів має більш виражені клінічні прояви та погіршення якості життя. У шведському дослідженні було продемонстровано, що приблизно 75% дітей з АР через полісенсибілізацію до пилку у віці 4 або 8 років мали стійкий АР до 24 років, а в 30% розвивалася бронхіальна астма (рис. 1). При цьому ймовірність персистенції АР була високою навіть при низьких рівнях пилковоспецифічного IgE.
Рис. 1. Еволюція АР у дітей та підлітків (адаптовано з: Lindqvist, Magnus et al., 2024)
АР часто пов’язаний з офтальмологічними симптомами, як-от сльозотеча і свербіж очей (88% пацієнтів), запалення (78%), почервоніння (75%), набряк (72%) та відчуття печіння (65%) (Bousqet J. et al., 2008; Bielory L., 2000; Dupuis P. et al., 2020). Ці прояви значно погіршують працездатність і якість життя пацієнтів, тож їх дуже важливо контролювати.
Не викликає сумнівів, що АР несприятливо впливає на якість життя, зокрема сприяє появі розладів сну, депресії, дратівливості, зниженню продуктивності. Крім того, АР часто супроводжується коморбідними станами, як-от астма, середній отит, обструктивне апное уві сні, алергічний кон’юнктивіт, синусит. У певної частки хворих АР може зумовлювати ускладнення; саме після виявлення останніх оториноларингологом пацієнт уперше потрапляє до алерголога. Наслідки несвоєчасно виявленого та нелікованого АР можуть бути дуже серйозними, тому такі випадки потребують активного лікування.
Клінічний випадок
Пацієнтка віком 30 років, скаржиться на прояви АР протягом усього весняно-літнього періоду. З анамнезу відомо, що від народження до підліткового віку її непокоїли симптоми атопічного дерматиту, у шкільному віці діагностували сезонний АР. Під час вживання горіхів і фруктів (лісовий горіх, волоський горіх, яблука) виникає свербіж у роті, під час контакту з котами – свербіж очей, нежить, кашель. Сімейний анамнез: у дідуся – бронхіальна астма, у мами – поліноз.
Оскільки пацієнтка раніше не обстежувалася, а також з огляду на можливу полісенсибілізацію та харчову алергію призначене додаткове дослідження – мультикомпонентна алергодіагностика. Загальний IgE становив 2310 кОд/л.
Кількісний аналіз виявив сенсибілізацію до таких алергенів: жито посівне (Sec c_pollen E) 16,79, очерет звичайний (Phr c E) 32,91, пажитниця багаторічна (Lol p 1 M) 45,98, паспалум (Pas n Е) 41,09, тимофіївка лучна (Phl p 1 M) 48,83, береза повисла (Bet v 1 M) 51,53, вільха чорна (Aln g 1 M) 40,46, ліщина (Cor a_pollen E) 32,04, амброзія полинолиста (Amb a E) 37,51, Alternaria alternata (Alt a 1 M) 50,61, кіт (Fel d 1 M) 49,55, собака (Can f 1 M) 22,10. Сенсибілізація до білків PR‑10 (береза, бук, вільха, ліщина, фундук, яблуко) свідчила про наявність орального алергічного синдрому (PFAS).
Встановлено діагноз: персистуючий алергічний риніт. Сенсибілізація до пилку злаків, дерев, бур’янів, пліснявих грибів, загострення. Харчова алергія, оральний алергічний синдром (фундук, яблуко).
Рекомендовано елімінаційну дієту, базисну терапію АР: антигістамінний препарат ІІ покоління (АГП-ІІ) біластин та інтраназальний кортикостероїд (ІНКС) протягом усього сезону цвітіння. АСІТ у холодний період року.
Обговорення
Лікування АР включає елімінацію причинного алергену (варто пам’ятати, що на клінічне поліпшення слід очікувати через тривалий час після елімінації алергенів), фармакологічне лікування та підшкірну чи сублінгвальну алергенспецифічну терапію (АСІТ). З огляду на полісенсибілізацію, високий рівень загального IgE, відсутність контролю симптомів астми АСІТ пацієнтці на даному етапі не показана.
Експертна група ARIA (2019) на основі оцінки пацієнтів за допомогою візуальної аналогової шкали (ВАШ; від 0 до 10 балів) розробила алгоритм вибору фармакологічного лікування АР і переходу на крок угору або вниз залежно від контролю симптомів (табл. 1). За допомогою ВАШ оцінюють вараженість назальних та очних симптомів АР за останні 24 год від 0 (симптоми не турбували) до 10 балів (симптоми дуже турбували). Оцінка ≥5 балів вказує на неконтрольований АР.
|
Таблиця 1. Препарати для step up / step down терапії в пацієнтів із АР |
|
|
Лікування |
Препарати |
|
Т 1 |
Неседативні Н1-АГП (перорально, інтраназально або кон’юнктивально), антагоністи лейкотрієнових рецепторів або кромони (інтраназально або конк’юнктивально) |
|
Т 2 |
ІНКС |
|
Т 3 |
ІНКС + азеластин інтраназально |
|
Т 4 |
Перорально кортикостероїди коротким курсом і додаткове лікування |
|
Т 5 |
Розглянути доцільність направлення пацієнта до вузького спеціаліста та проведення АСІТ |
Дослідження свідчать, що третина пацієнтів з АР незадоволені отримуваною терапією. З них 44% хотіли б швидшого полегшення симптомів, а 55% – тривалішої дії препарату. Близько 2/3 хворих цікавляться найновішими засобами для лікування алергії, які, можливо, були б ефективнішими і добре переносились, а 26% пацієнтів шукають «свій» препарат, постійно змінюючи медикаменти без рекомендацій лікаря. Запорукою високої задоволеності пацієнтів лікуванням, а отже, й довготривалого комплаєнсу є правильний вибір препарату – із найбільш сприятливим клінічним профілем (табл. 2). Як видно з таблиці, біластин має найбільше властивостей «ідеального» АГП-ІІ за визначенням ARIA; крім того, він єдиний серед АГП-ІІ безпосередньо показаний для лікування алергічного ринокон’юнктивіту.
Згідно з рекомендаціями ARIA, для лікування АР слід застосовувати тільки АГП-ІІ з огляду на їхній мінімальний вплив на гістамінові Н1-рецептори в центральній нервовій системі (ЦНС).
H1-рецептори представлені в усьому організмі, зокрема в головному мозку та периферичних органах, як-от гладка мускулатура бронхів, кров’яні судини, шкіра і слизові оболонки. Залежно від місця вивільнення гістаміну його активність та ефекти можуть бути дуже різними й органоспецифічними (рис. 2).
Рис. 2. Органоспецифічність біологічної активності гістаміну
Седативні властивості АГП (сонливість, зниження працездатності та ін.) зумовлені пригніченням функцій центральних гістамінових нейронів. Тіла останніх локалізовані в туберомамілярному ядрі гіпоталамуса, а їхні нервові волокна поширюються до спинного мозку, утворюючи моноамінергічну нервову систему. У збудженому стані гістамінові нейрони дуже чутливі для гістаміну, який у разі вивільнення активує функцію кори головного мозку або безпосередньо через H1- і H2-рецептори, або шляхом збудження ацетилхолінових і норадреналінових нейронів у стовбурі мозку, ацетилхолінових нейронів у безіменній речовині та глутамінових нейронів у гіпоталамусі. Активація гістаміновими нейронами кори головного мозку тісно пов’язана з підтриманням стану збудження, посиленням когнітивних функцій і пригніченням апетиту.
Отже, щоб АГП проявили седативні властивості, їм необхідно проникнути в головний мозок і зв’язатися з Н1-рецепторами. Показником седативного потенціалу є зайнятість H1-рецепторів головного мозку (H1RO). Для вимірювання цього показника використали позитронно-емісійну томографію (ПЕТ) із міченим доксепіном. На рисунку 3 зображено H1RO для різних АГП; якщо H1RO не перевищувала 20%, під час одночасного виконання тесту когнітивної функції не спостерігали погіршення, а отже, такий препарат можна класифікувати як неседативний.
Рис. 3. Зайнятість гістамінових H1‑рецепторів головного мозку (середній відсоток ± стандартне відхилення) антигістамінними препаратами (адаптовано з: Kawauchi H. et al., 2019)
З-поміж АГП, що належать до неседативної групи, H1RO біластину (20 мг) та олопатадину (очні краплі) становить близько 0%. Відповідно, ці лікарські засоби можна віднести до препаратів, що «не проникають у ЦНС».
Варто наголосити, що біластин вигідно вирізняється й з-поміж інших АГП-ІІ, які мають здатність нехай незначного, але проникнення крізь ГЕБ. Так, у дезлоратадину та лоратадину, які належать до АГП-ІІ, H1RO дорівнює 10% і 7% відповідно, що стає причиною седативного ефекту і сонливості при їх застосуванні. Це має неабияке значення в разі необхідності призначення подвійної дози препарату для досягнення швидкого ефекту або купірування тяжких проявів захворювання.
Різний ступінь проникнення крізь ГЕБ і зайнятість Н1-рецепторів у різних препаратів АГП залежать від низки факторів. Деякі АГП‑ІІ потрапляють до ЦНС мозковим кровообігом і пасивно переносяться в ендотелій ГЕБ. Однак, як субстрати P-глікопротеїну (P-gp), вони активно транспортуються ретроградно до мозкового кровообігу, і мінімальна кількість зв’язується з Н1-рецепторами в мозку. Коли препарати не є субстратами P-gp (наприклад, АГП-І), вони потрапляють у мозковий кровообіг, проникають крізь ГЕБ і не видаляються із ЦНС, тісно зв’язуючись із Н1-рецепторами в мозку, та спричиняють побічні дії. Проте рівень внеску P-gp у здатність проникнення препаратів у мозок відрізняється залежно від хімічної структури молекули. Крім цього, в процес проникнення речовини крізь ГЕБ залучені такі показники, як гідрофобність, молекулярна маса, електричний заряд і багато інших чинників, зокрема ферменти цитохрому P450, енантіомери та ін. Примітно, що в разі пасивної дифузії ступінь проникнення крізь ГЕБ тим вищий, чим нижча молекулярна маса.
Деякі лікарські засоби з молекулярною масою <400 Да можуть проникати крізь ГЕБ завдяки пасивній дифузії, що пояснює різний седативний потенціал в окремих представників АГП-ІІ. Так, молекулярна маса дезлоратадину становить 310 Да, лоратадину – 388 Да, біластину – 463 Да. При цьому треба зазначити, що за збільшення молекулярної маси до 450 Да проникнення крізь ГЕБ зменшується в 100 разів. Отже, біластин має найменший ступінь дифузії та ймовірність проникнення крізь ГЕБ порівняно з дезлоратадином і лоратадином. Це обов’язково треба враховувати під час вибору АГП для тривалого застосування, особливо за необхідності призначення вищих доз, коли препарат накопичується в ЦНС. Так, під час розгляду залишкових явищ АГП на прикладі дифенгідраміну (50 мг) і кетотифену (1 мг) було доведено, що період напіврозпаду цих речовин у головному мозку приблизно вп’ятеро довший, ніж у плазмі, і становить 30 і 45 год відповідно. Звідси залишкові ефекти і виражена седативна післядія: порушення циркадного циклу сну й неспання, сонливість, порушення працездатності та уваги.
Біластин також має сприятливі фармакологічні властивості, які мінімізують взаємодії з іншими ліками і дозволяють його призначати широкому колу пацієнтів. Так, переважна більшість застосованої дози біластину (приблизно 95%) виводиться в незмінному вигляді. Препарат не метаболізується ні в печінці (немає індукції або інгібування активності CYP450), ні в кишечнику (не задіюється CYP1A4 чи CYP3A4), немає потреби в корегувані дози в пацієнтів із печінковою чи нирковою недостатністю.
Відмінна переносимість біластину (Ніксар®) була продемонстрована в рандомізованих контрольованих дослідженнях, а також в умовах реальної клінічної практики. Приміром, P. Kuna і співавт. (у багатоцентровому рандомізованому подвійному сліпому дослідженні порівнювали ефективність і безпеку біластину 20 мг 1 р/день, цетиризину 10 мг 1 р/день та плацебо в пацієнтів із сезонним АР (n=683). Після 14 днів терапії сонливість і втома значно підвищувалися в групі цетиризину, натомість у групі біластину частота цих небажаних ефектів була навіть нижчою порівняно з такою в групі плацебо. Біластин асоціювався із сонливістю на рівні плацебо (рис. 3). також у пацієнтів із цілоричним АР (рис. 4) (Brozer J.L. et al., 2010; Sastre J. et al., 2011).
Рис. 4. Частота сонливості в пацієнтів із цілорічним АР під час лікування біластином, цетиризином і плацебо
Отже, біластин (Ніксар®) – сучасний неседативний АГП, який ефективно усуває всі симптоми АР і дуже добре переноситься. Препарат характеризується швидким початком (протягом 1 год) і тривалим періодом дії. Дослідження показали, що молекула біластину має помірну або високу спорідненість і потужну активність щодо гістамінового H1-рецептора, а також незначну афінність до 30 інших рецепторів. Біластин швидко та ефективно абсорбується, зазнає незначного метаболізму і є субстратом для P-глікопротеїну, що обмежує його здатність проникати крізь ГЕБ. У рекомендованій дозі 20 мг біластин не чинить седативного ефекту, не посилює дії алкоголю чи лоразепаму, не погіршує фактичну здатність кермувати і не виявляє кардіотоксичності. Використання біластину в дозі 10 мг у дітей віком 2-11 років також підтвердило частоту побічних ефектів такого лікування на рівні з плацебо. Тривалість дії біластину, його ефективність і відсутність седативного впливу на центральну нервову систему роблять цей препарат особливо привабливим для клінічного використання. За висновком експертів ARIA, завдяки фармакологічним особливостям, ефективності, безпеці та фармакодинамічним властивостям біластин відповідає рекомендованим критеріям EAACI/ARIA для лікарських засобів, що застосовуються для лікування АР.
Довідка «ЗУ»
В Україні оригінальний біластин представлено компанією «Берлін-Хемі» під назвою Ніксар®. Таблетки 20 мг показані для симптоматичного лікування алергічного ринокон’юнктивіту (сезонного та цілорічного) й кропив’янки у дорослих і підлітків (віком понад 12 років). Нова лікарська форма – таблетки 10 мг, що диспергуються у ротовій порожнині, – має ті самі показання і застосовується в дітей віком 6-11 років із масою тіла не менше 20 кг. Ці таблетки швидко розчиняються у воді або слині, не містять барвників чи консервантів і мають приємний виноградний смак. Ніксар® призначають 1 раз на день за годину до або через 2 години після прийому їжі чи фруктового соку.
Медична газета «Здоров’я України 21 сторіччя» № 6 (567), 2024 р