16 квітня, 2020
Ельтромбопаг – ефективний і безпечний засіб для лікування хронічної тромбоцитопенії

 Імунна тромбоцитопенія – ізольоване зменшення кількості тромбоцитів <100×109/л за відсутності основної причини. Вона є найчастішою аутоімунною цитопенією у дітей. Більшість дітей з імунною тромбоцитопенією не має значущої геморагічної симптоматики та спонтанно одужує протягом 12 місяців після встановлення діагнозу. Проте можливий розвиток хронічної імунної тромбоцитопенії, що спостерігається у менше ніж 25% хворих, з виникненням значущої геморагічної симптоматики, яка потребує тривалої терапії, чи її ризику. Ідіопатична тромбоцитопенічна пурпура у дорослих характеризується підвищеною деструкцією тромбоцитів при їх субоптимальному синтезі. Терапевтичні опції включають ритуксимаб, агоністи рецепторів тромбопоетину та спленектомію [1].
Імунна тромбоцитопенія – ізольоване зменшення кількості тромбоцитів <100×109/л за відсутності основної причини. Вона є найчастішою аутоімунною цитопенією у дітей. Більшість дітей з імунною тромбоцитопенією не має значущої геморагічної симптоматики та спонтанно одужує протягом 12 місяців після встановлення діагнозу. Проте можливий розвиток хронічної імунної тромбоцитопенії, що спостерігається у менше ніж 25% хворих, з виникненням значущої геморагічної симптоматики, яка потребує тривалої терапії, чи її ризику. Ідіопатична тромбоцитопенічна пурпура у дорослих характеризується підвищеною деструкцією тромбоцитів при їх субоптимальному синтезі. Терапевтичні опції включають ритуксимаб, агоністи рецепторів тромбопоетину та спленектомію [1].
Ельтромбопаг – агоніст юкстамембранного домену рецепторів тромбопоетину, який активує сигнальні шляхи JAK/STAT, AKT, MAPK, що аналогічно до ефекту тромбопоетину. Проте за своєю структурою ельтромбопаг відрізняється від ендогенного тромбопоетину, це дозволяє йому неконкурентно зв’язуватися з рецептором через трансмембранний домен та ініціювати сигнальний каскад. У результаті це призводить до проліферації та диференціації мегакаріоцитів і, як насідок, – до продукції більшої кількості тромбоцитів [2].
Ефективність застосування ельтромбопагу вперше була оцінена у досліджені за участю дорослих пацієнтів з хронічною імунною тромбоцитопенією. J.B. Bussel та співавт. опублікували у 2007 р. результати дослідження NCT00102739, у якому показали ефективність та безпеку ельтромбопагу у хворих з рефрактерною хронічною імунною тромбоцитопенією. Препарат чинив дозозалежний ефект на збільшення кількості тромбоцитів при мінімальній частоті побічних явищ. Було відзначено зниження потреби у супровідній терапії та покращення якості життя пацієнтів [3]. Цей результат став підґрунтям для схвалення у 2008 р. Управлінням з контролю якості харчових продуктів і лікарських препаратів США ельтромбопагу для лікування дорослих з хронічною імунною тромбоцитопенією. Подальше вивчення використання ельтромбопагу в цієї категорії хворих у подвійному сліпому плацебо-контрольованому дослідженні ІІІ фази RAISE показало, що у 70-80% випадків ельтромбопаг сприяв збільшенню кількості тромбоцитів і зниженню частоти та тяжкості кровотеч [4].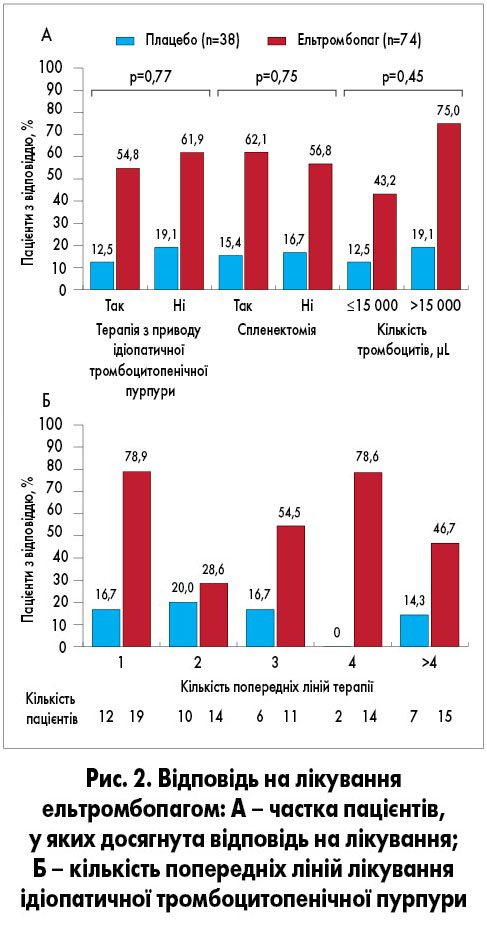
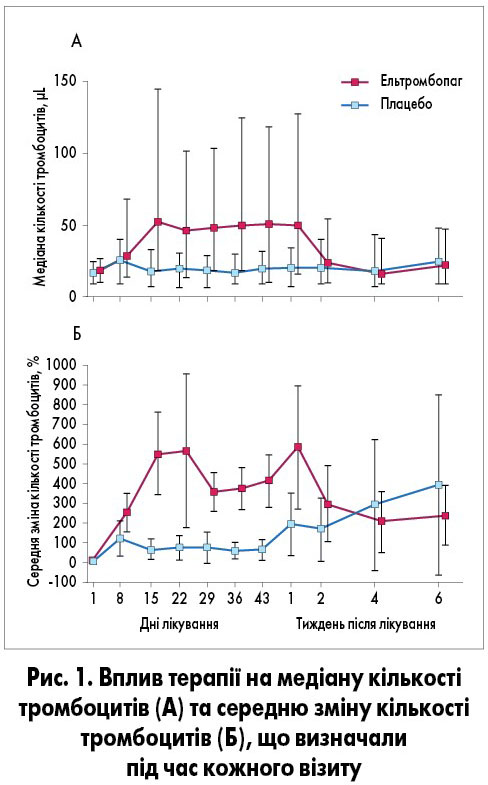
За даними J.B. Bussel та співавт. (2009), 18 пацієнтів не завершили участь у дослідженні у зв’язку зі збільшенням кількості тромбоцитів ≥200×109/л. Першочерговий результат – збільшення кількості тромбоцитів ≥50×109/л до 43-го дня дослідження – був досягнутий у 59% (n=43) хворих, які отримували ельтромбопаг, і 16% (n=6) хворих групи плацебо (відносний ризик – ВР – 9,61; 95% довірчий інтервал – ДІ – 3,31-27,86; p<0,0001). У пацієнтів, які отримували ельтромбопаг, зафіксовано значно вищу відповідь на лікування протягом усього дослідження (6 тижнів) порівняно з групою плацебо (ВР 8,79; 95% ДІ 3,54-21,86; p<0,0001). Медіана кількості тромбоцитів зростала до ≥53×109/л на 15-ту добу при застосуванні ельтромбопагу, цей ефект підтримувався протягом усіх 6 тижнів дослідження (рис. 1). На 43-й день медіана кількості тромбоцитів у хворих, у яких отримано відповідь на лікування ельтромбопагом (n=43), становила ≥144×109/л (IQR92,5-268,0). Зміна середньої частки приросту від базового показника при включенні у дослідження, проілюстрована на рисунку 1, свідчить про стійкий і виражений ефект ельтромбопагу порівняно з плацебо [3].
Через 1 тиждень після завершення лікування кількість тромбоцитів залишалася ≥50×109/л у 51% (n=31) хворих. Здебільшого кількість тромбоцитів поверталась до базових показників протягом 2 тижнів після припинення лікування (рис. 1). Відповідь на терапію ельтромбопагом відзначалася незалежно від віку, наявності іншої супровідної терапії, спленектомії в анамнезі чи базової кількості тромбоцитів <15×109/л (рис. 2) [3].
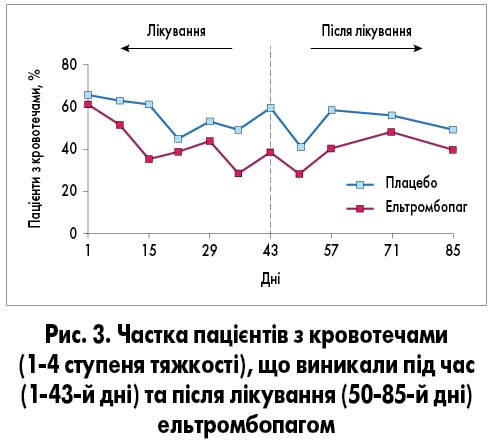
Значно менша частка пацієнтів, які отримували ельтромбопаг, мала геморагічні ускладнення протягом 43 днів дослідження порівняно з групою плацебо – 39 (n=20) проти 60% (n=18) відповідно (ВР 0,27; 95% ДІ 0,09‑0,88; p=0,029; рис. 3) [3].
 Частка хворих, у яких розвинулося щонайменше одне ускладнення протягом лікування, становила 59% (n=45) у групі ельтромбопагу та 37% (n=14) у групі плацебо. Найчастіше фіксували геморагічні ускладнення, головний біль і назофарингіт. Частота ускладнень 3-4 ступеня тяжкості та таких, які призвели до припинення участі у дослідженні, була однаковою в обох групах [3].
Частка хворих, у яких розвинулося щонайменше одне ускладнення протягом лікування, становила 59% (n=45) у групі ельтромбопагу та 37% (n=14) у групі плацебо. Найчастіше фіксували геморагічні ускладнення, головний біль і назофарингіт. Частота ускладнень 3-4 ступеня тяжкості та таких, які призвели до припинення участі у дослідженні, була однаковою в обох групах [3].
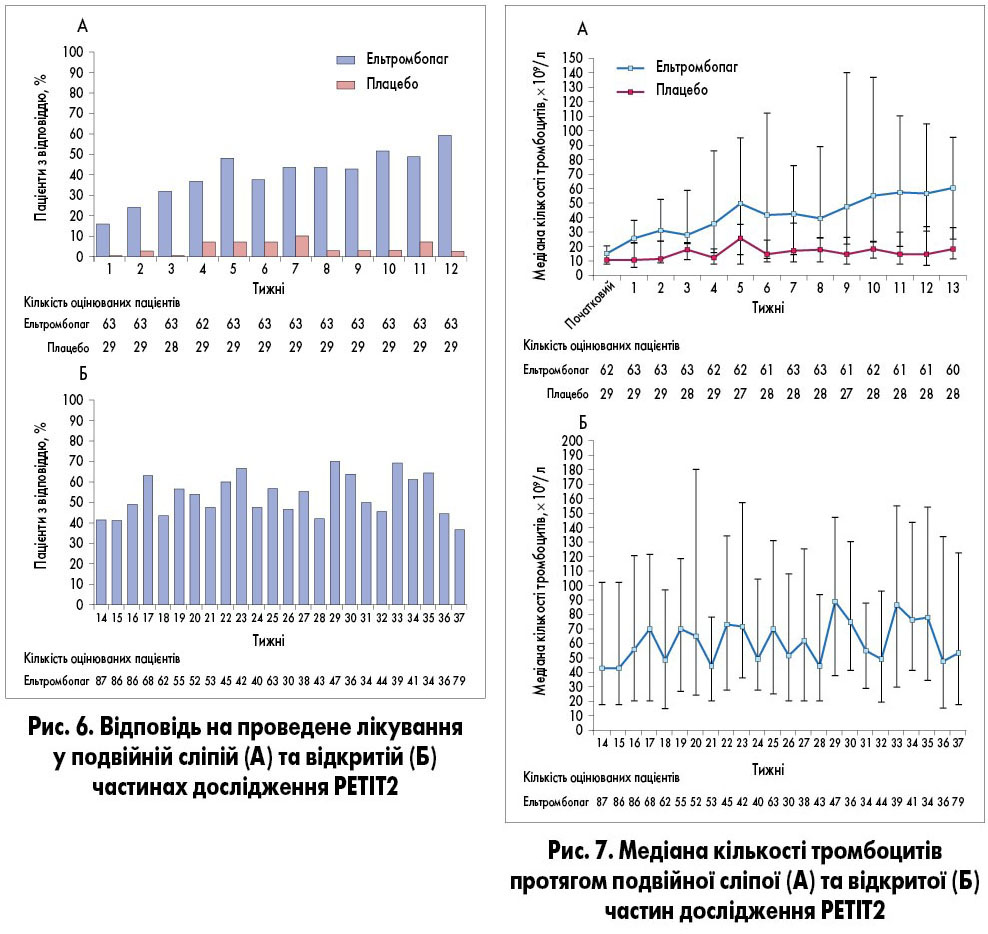
астосування ельтромбопагу у дітей з хронічною імунною тромбоцитопенією вивчали у рандомізованих багатоцентрових плацебо-контрольованих дослідженнях PETIT (NCT00908037) та PETIT2 (NCT01520909) [5, 6]. В основну групу увійшли хворі віком від 1 до 17 років з тривалістю хронічної імунної тромбоцитопенії 6 місяців і довше, кількістю тромбоцитів на момент включення <30×109/л та проведеною щонайменше однією лінією терапії.
 Дизайн дослідження ІІ/ІІІ фази PETIT (Eltrombopag in Pediatric Patientswith Thrombocytopenia from Chronic ITP) включав три частини та охоплював 22 центри 6 країн. У дослідження залучено невелику кількість хворих (n=15; по 5 пацієнтів у кожній віковій групі). Протягом 24 тижнів відбувався підбір дози препарату з наступним включенням ще 67 хворих у 7-тижневу рандомізовану подвійну сліпу плацебо-контрольовану частину дослідження, після якої терапію можна було продовжити загалом до 24 місяців [5].
Дизайн дослідження ІІ/ІІІ фази PETIT (Eltrombopag in Pediatric Patientswith Thrombocytopenia from Chronic ITP) включав три частини та охоплював 22 центри 6 країн. У дослідження залучено невелику кількість хворих (n=15; по 5 пацієнтів у кожній віковій групі). Протягом 24 тижнів відбувався підбір дози препарату з наступним включенням ще 67 хворих у 7-тижневу рандомізовану подвійну сліпу плацебо-контрольовану частину дослідження, після якої терапію можна було продовжити загалом до 24 місяців [5].
PETIT2 – дослідження ІІІ фази, яке складалося з двох частин і включало 38 центрів з 12 країн. Перша частина дослідження (рандомізована подвійна сліпа плацебо-контрольована) тривала 13 тижнів, друга частина – 24 тижні, протягом яких всі пацієнти отримували ельтромбопаг [6].
За результатами PETIT та PETIT2 застосування ельтромбопагу сприяло покращенню показників тромбоцитів у крові, зниженню вираженості геморагічної симптоматики, зменшенню потреби у супровідній терапії при хронічній та персистивній імунній тромбоцитопенії (табл.). Загалом ельтромбопаг характеризувався хорошою переносимістю та безпекою.
 Супутню терапію в дослідженні PETIT проводили у 27% (n=12) пацієнтів групи ельтромбопагу та 55% (n=12) групи плацебо. Так, імуноглобулін внутрішньовенно отримували 13% (n=6) учасників групи ельтромбопагу та 36% (n=8) групи плацебо, кортикостероїди – 9 (n=4) та 32% (n=7); анти-D-терапію – 7 (n=3) та 9% (n=2); вінкристин або вінбластин – 0 (n=0) та 5% (n=1) відповідно. У 78% (n=35) пацієнтів, які отримували ельтромбопаг у подвійній сліпій частині, необхідне було підвищення дози препарату (у 34% (n=22) ескалація дози відбувалась до максимально дозволеної – 75 мг/добу). Зниження дозування було показане 11% (n=5) учасників. Щонайменше одна модифікація дози була виконана у 89% (n=58) хворих, цей показник був зіставним у всіх вікових групах [5].
Супутню терапію в дослідженні PETIT проводили у 27% (n=12) пацієнтів групи ельтромбопагу та 55% (n=12) групи плацебо. Так, імуноглобулін внутрішньовенно отримували 13% (n=6) учасників групи ельтромбопагу та 36% (n=8) групи плацебо, кортикостероїди – 9 (n=4) та 32% (n=7); анти-D-терапію – 7 (n=3) та 9% (n=2); вінкристин або вінбластин – 0 (n=0) та 5% (n=1) відповідно. У 78% (n=35) пацієнтів, які отримували ельтромбопаг у подвійній сліпій частині, необхідне було підвищення дози препарату (у 34% (n=22) ескалація дози відбувалась до максимально дозволеної – 75 мг/добу). Зниження дозування було показане 11% (n=5) учасників. Щонайменше одна модифікація дози була виконана у 89% (n=58) хворих, цей показник був зіставним у всіх вікових групах [5].
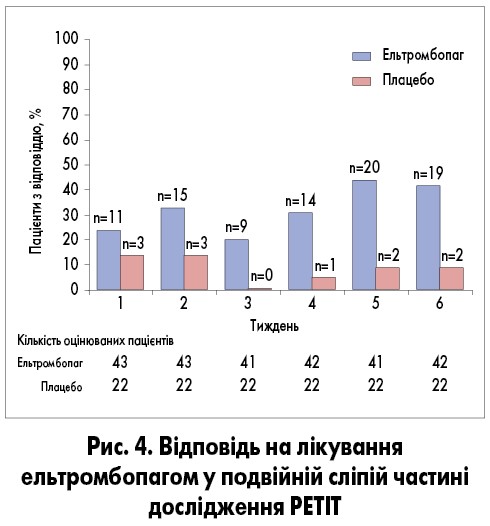
Кількість тромбоцитів починала зростати після одного тижня лікування ельтромбопагом. Принаймні однократне збільшення кількості тромбоцитів ≥50×109/л без призначення терапії порятунку протягом 1-6 тижнів спостереження було зафіксоване у 62% (n=28) хворих основної групи та у 32% (n=7) групи плацебо (ВР 4,31; 95% ДІ 1,39‑13,34; p=0,011). Зазначений ефект був однаково вираженим незалежно від віку. Частка хворих, у яких досягнуто відповідь на лікування ельтромбопагом, збільшувалася від початку лікування до 6-го тижня порівняно з тими, хто отримував плацебо (рис. 4). У відкритій частині дослідження тривалий ефект спостерігався тільки в групі ельтромбопагу (рис. 5) [5].
 Терапія порятунку знадобилась 6 (13%) хворим, які отримували ельтромбопаг, та 11 (50%) з групи плацебо (ВР 0,1; 95% ДІ 0,04-0,49; p=0,002). Клінічно значущі кровотечі (2-4 ступеня тяжкості) відмічались у 27% (n=12) пацієнтів основної групи та 59% (n=13) – контрольної (ВР 0,21; 95% ДІ 0,06-0,72; p=0,013). Епізоди кровотеч виявляли приблизно з однаковою частотою в обох групах при включенні пацієнтів у дослідження, проте на 7-му тижні цей показник був значно меншим у групі ельтромбопагу, ніж у групі плацебо (31 та 82% відповідно) [5].
Терапія порятунку знадобилась 6 (13%) хворим, які отримували ельтромбопаг, та 11 (50%) з групи плацебо (ВР 0,1; 95% ДІ 0,04-0,49; p=0,002). Клінічно значущі кровотечі (2-4 ступеня тяжкості) відмічались у 27% (n=12) пацієнтів основної групи та 59% (n=13) – контрольної (ВР 0,21; 95% ДІ 0,06-0,72; p=0,013). Епізоди кровотеч виявляли приблизно з однаковою частотою в обох групах при включенні пацієнтів у дослідження, проте на 7-му тижні цей показник був значно меншим у групі ельтромбопагу, ніж у групі плацебо (31 та 82% відповідно) [5].
Побічні явища, які були зафіксовані під час подвійної сліпої частини дослідження в групі ельтромбопагу, включали головний біль, інфекції верхніх дихальних шляхів та діарею. Побічні явища 3-4 ступеня тяжкості були задокументовані в 11% (n=5) хворих, які отримували ельтромбопаг, та у 19% (n=4) – плацебо. Випадків летальних ускладнень не було [5].
 Відкриту фазу дослідження PETIT завершили 57 хворих, дані шестимісячного спостереження були доступними у 51 випадку. Середньодобова доза була вищою порівняно з такою у попередньому подвійному сліпому дослідженні. Відмічено, що 81% пацієнтів (n=54; з 67 включених у дослідження) досягли щонайменше однократно кількості тромбоцитів ≥50×109/л, а в 43% (n=29) отримано тривалу відповідь (понад 12 з 24 тижнів проведеного лікування). Терапія порятунку застосована у 16 (24%) хворих. З 13 хворих, що брали участь у відкритій частині та окрім ельтромбопагу отримували супровідну терапію, у 23% (n=3) її дозу було знижено, а ще у 23% (n=3) – використання припинено. У 2 пацієнтів терапія ельтромбопагом була припинена через значне (більш ніж у 3 рази) збільшення рівня аланінамінотрансферази, після чого відмічено нормалізацію показників трансаміназ [5].
Відкриту фазу дослідження PETIT завершили 57 хворих, дані шестимісячного спостереження були доступними у 51 випадку. Середньодобова доза була вищою порівняно з такою у попередньому подвійному сліпому дослідженні. Відмічено, що 81% пацієнтів (n=54; з 67 включених у дослідження) досягли щонайменше однократно кількості тромбоцитів ≥50×109/л, а в 43% (n=29) отримано тривалу відповідь (понад 12 з 24 тижнів проведеного лікування). Терапія порятунку застосована у 16 (24%) хворих. З 13 хворих, що брали участь у відкритій частині та окрім ельтромбопагу отримували супровідну терапію, у 23% (n=3) її дозу було знижено, а ще у 23% (n=3) – використання припинено. У 2 пацієнтів терапія ельтромбопагом була припинена через значне (більш ніж у 3 рази) збільшення рівня аланінамінотрансферази, після чого відмічено нормалізацію показників трансаміназ [5].
У дослідження PETIT2 включили більше, ніж у PETIT, дітей з хронічною імунною тромбоцитопенією (рис. 2, 3). На початку дослідження 78% (n=72) пацієнтів отримували щонайменше два види лікування з приводу досліджуваної гематологічної патології. Щонайменше однократне збільшення кількості тромбоцитів ≥50×109/л без призначення терапії порятунку тривалістю ≥6 тижнів протягом 5-12-го тижня спостереження відмічено у 40% (n=25) хворих основної групи та у 3% (n=1) групи плацебо (ВР 18,0; 95% ДІ 2,3-140,9; p=0,0004). Цей ефект мав однакову вираженість у всіх вікових групах. У подвійній сліпій частині дослідження у значно більшої частки пацієнтів досягнуто відповіді на лікування ельтромбопагом порівняно з плацебо протягом 1-6-го тижня (ВР 8,3; 95% ДІ 2,7-25,1; p=0,00018) та 1-12-го тижня (ВР 11,7; 95% ДІ 4,0-34,5; p<0,0001; рис. 6) [6].
Середня максимальна тривалість відповіді на лікування протягом подвійної сліпої частини була значно більшою у групі ельтромбопагу, ніж плацебо (рис. 7). Частка пацієнтів, які потребували терапії порятунку, становила 19 (n=12) та 24% (n=7) відповідно (р=0,032). Протягом дослідження жодного випадку кровотеч 4 ступеня тяжкості не спостерігалось, кровотечі 3 ступеня тяжкості відмічені у 3 пацієнтів групи плацебо, а в групі ельтромбопагу відсутні [6].
У відкритій частині дослідження PETIT2 медіана кількості тромбоцитів ≥50×109/л спостерігалась протягом довшого часу. Щонайменше однократне досягнення показника ≥50×109/л протягом 24 тижнів відмічено у 80% (n=70) випадків. Призначення терапії порятунку знадобилось 13% (n=11) хворих. Випадки геморагічних ускладнень 3-4 ступеня тяжкості не відмічались. У 9 з 15 хворих, які отримували супровідну терапію на початку включення у відриту частину, зменшили дозу або припинили її застосування [6].
Побічні явища протягом подвійної сліпої частини відмічені у 81% (n=51) пацієнтів, які отримували ельтромбопаг, та у 72% (n=21) групи плацебо. Для основної групи більш характерними були назофарингіт, риніт, інфекції верхніх дихальних шляхів і кашель, для контрольної – носові кровотечі, біль у верхніх відділах живота, головний біль та нудота. Побічні явища 3-4 ступеня тяжкості зафіксовані у 5% (n=3) дітей, які отримували ельтромбопаг, та 28% (n=8) у групі плацебо. Найбільш характерним побічним явищем, що пов’язане з застосуванням досліджуваного препарату та спостерігалось у 8% (n=5) випадків, було підвищення рівня амінотрансфераз більш ніж у 3 рази (як і у дослідженні PETIT). У відкритій частині дослідження PETIT2 відмічено такі самі тенденції, як і в подвійній сліпій, побічні явища зафіксовані у 79% (n=69) хворих, з них 3-4 ступеня тяжкості – у 9% (n=8). Підвищення концентрації амінотрансфераз виявлено у 7% (n=6) хворих [6].
Висновки. Лікування хронічної тромбоцитопенії може включати застосування ельтромбопагу. Його ефективність та безпека доведена як у дорослих з ідіопатичною тромбоцитопенічною пурпурою, так і у дітей з персистивною чи хронічною імунною тромбоцитопенією. За даними https://clinicaltrials.gov, зараз у світі тривають 45 досліджень, які присвячені різним аспектам та показанням до застосування ельтромбопагу.
Література
- Kim T.O., Despotovic J., Lambert M.P. Eltrombopag for use in children with immune thrombocytopenia. Blood Adv. 2018 Feb 27; 2(4): 454-461.
- Kuter D.J. The biology of thrombopoietin and thrombopoietin receptor agonists. Int J Hematol. 2013; 98(1): 10-23.
- Bussel J.B., Cheng G., Saleh M.N. et al. Eltrombopag for thetreatment of chronic idiopathic thrombocytopenic purpura. N Engl J Med. 2007; 357(22): 2237-2247.
- Cheng G., Saleh M.N., Marcher C. et al. Eltrombopag for management of chronic immune thrombocytopenia (RAISE): a 6-month, randomised, phase 3 study. Lancet. 2011; 377(9763): 393-402.
- Bussel J.B., de Miguel P.G., Despotovic J.M. et al. Eltrombopag for thetreatment of children with persistent and chronic immune thrombocytopenia (PETIT): a randomised, multicentre, placebo-controlledstudy. Lancet Haematol. 2015; 2(8): e315-e325.
- Grainger J.D., Locatelli F., Chotsampancharoen T. et al. Eltrombopag for children with chronic immune thrombocytopenia (PETIT2): a randomised, multicentre, placebo-controlled trial. Lancet. 2015; 386(10004): 1649-1658.
Підготувала Олена Поступаленко
Тематичний номер «Онкологія. Гематологія. Хіміотерапія» № 1 (62), 2020 р.