12 червня, 2016
Эректильная дисфункция: рекомендации по диагностике и лечению

Руководство Европейской ассоциации урологов, 2015
Определение, эпидемиология и факторы риска
Нарушение эректильной функции является наиболее частой проблемой мужского сексуального здоровья. Эрекция представляет собой контролируемый гормонами нейрососудистый феномен. Во время эрекции происходит расширение артерий, расслабление гладких трабекулярных мышц и активация механизма корпоровенозной окклюзии.
Эректильная дисфункция (ЭД) определяется как постоянная неспособность достигать и поддерживать эрекцию, достаточную для проведения полового акта. ЭД может нарушить физическое и психическое здоровье и значительно повлиять на качество жизни пациентов и их партнеров.
В последние годы значительно расширилась доказательная база в отношении того, что ЭД может быть ранним проявлением заболевания коронарных артерий и периферических сосудов. Таким образом, ЭД должна рассматриваться не только как аспект качества жизни, но и как потенциальный предвестник кардиоваскулярного заболевания.
На основе анализа результатов эпидемиологических исследований учеными сделаны следующие выводы.
- Эрекция – контролируемый действием гормонов нейроваскулярный феномен (уровень доказательств [УД] 2b).
- ЭД распространена во всех странах мира (2b).
- Факторы риска возникновения ЭД те же, что и при кардиоваскулярных заболеваниях (2b).
- Изменение образа жизни (активные физические упражнения и снижение индекса массы тела) может улучшить эректильную функцию (1b).
- ЭД – симптом, а не заболевание. Некоторые пациенты могут быть недостаточно обследованы либо получать лечение по поводу заболеваний или состояний, вызывающих ЭД (4).
- ЭД часто возникает после радикальной простатэктомии (РПЭ), независимо от примененной хирургической техники (2b).
- ЭД часто развивается после дистанционной или контактной лучевой терапии (2b).
Диагностика эректильной дисфункции
Согласно данным рекомендациям диагностика должна проводиться с учетом патофизиологических механизмов, лежащих в основе расстройства сексуальной функции.
Первым шагом в оценке ЭД всегда является подробный сбор медицинского и сексуального анамнезов пациента и, по возможности, его партнеров. Часто во время первого визита привлечь к обследованию партнера не представляется возможным, поэтому следует попытаться сделать это во время второго посещения.
Патофизиология ЭД может быть васкулогенной, нейрогенной, анатомической, гормональной, медикаментозно-индуцированной (вызванной приемом медикаментов) и/или психогенной. Сбор всестороннего анамнеза может помочь выявить одно из многих соматических расстройств, ассоциированных с ЭД.
Патофизиология сексуальной дисфункции
Васкулогенная ЭД:
- кардиоваскулярные заболевания;
- артериальная гипертензия;
- сахарный диабет (СД);
- гиперлипидемия;
- курение;
- обширное хирургическое вмешательство (РПЭ) или лучевая терапия (область таза или забрюшинного пространства).
Нейрогенная ЭД:
Центральные причины:
- дегенеративные заболевания (рассеянный склероз, болезнь Паркинсона, множественная системная атрофия и т. п.);
- травма или заболевание спинного мозга;
- инсульт;
- опухоли центральной нервной системы.
Периферические причины:
- СД 1 и 2 типа;
- хроническая почечная недостаточность;
- полиневропатия;
- хирургическое вмешательство (область таза или забрюшинного пространства, колоректальной зоны, РПЭ).
Анатомическая, или структурная, ЭД:
- гипоспадия, эписпадия;
- микропенис;
- врожденное искривление пениса;
- болезнь Пейрони.
Гормональная ЭД:
- гипогонадизм;
- гиперпролактинемия;
- гипер- или гипотиреоз;
- гипер- или гипокортицизм (синдром Кушинга и т. п.).
Медикаментозно-индуцированная ЭД, при приеме:
- антигипертензивных препаратов (диуретики часто вызывают ЭД);
- антидепрессантов (ингибиторы обратного захвата серотонина, трициклические);
- антипсихотических средств (включая нейролептики);
- антиандрогенов (аналоги и антагонисты гонадотропин-рилизинг-гормона);
- наркотических веществ (алкоголь, героин, кокаин, марихуана, метадон).
Психогенная ЭД:
- генерализованный тип, например недостаток сексуального возбуждения и трудности при интимной близости;
- ситуационный тип, например, связанный с партнером, внешней обстановкой или стрессом.
Травматическая ЭД:
- перелом пениса.
Предложенный в руководстве минимальный диагностический алгоритм для больных, жалующихся на ЭД, включает:
1) сбор медицинского и сексуального анамнезов с использованием утвержденных опросников, например Международного индекса эректильной функции (International Index for Erectile Function, IIEF-EF), при котором необходимо:
– выявить сексуальные проблемы, помимо ЭД;
– определить соматические причины ЭД;
– идентифицировать обратимые факторы риска развития ЭД;
– оценить психосоциальный статус;
2) фокусированное физикальное обследование, направленное на определение:
– деформации пениса;
– заболеваний предстательной железы;
– признаков гипогонадизма;
– состояния сердечно-сосудистой и нервной систем;
3) лабораторное обследование:
– анализ крови с определением уровня глюкозы и липидного профиля (если таковой не проводился в течение последних 12 мес);
– определение концентрации общего тестостерона в утренней пробе, по показаниям – биодоступного или свободного тестостерона.
У пациентов, нуждающихся в лечении сексуальной дисфункции, высока вероятность развития кардиоваскулярного заболевания. В ходе эпидемиологических исследований установлено большое значение взаимосвязи кардиоваскулярных и метаболических факторов риска и сексуальной дисфункции как у мужчин, так и у женщин. Особое внимание обращается на то, что обследование при нарушении эректильной функции может улучшить выявляемость асимптомных сердечно-сосудистых расстройств у мужчин с СД. ЭД значительно повышает риск развития ишемической болезни сердца (ИБС), инсульта и увеличения показателя общей смертности, и это повышение, вероятно, не зависит от общепринятых факторов риска возникновения кардиоваскулярных заболеваний.
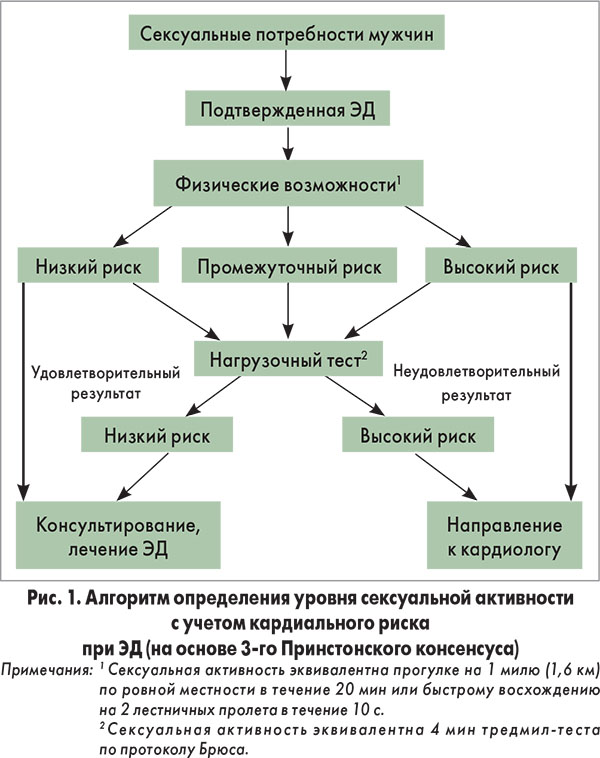
В зависимости от степени кардиоваскулярного риска пациенты с ЭД составляют три категории (табл. 1), которые учитываются при выборе лечебных мероприятий для инициации или возобновления сексуальной активности. Практикующие специалисты могут оценить риск сексуальной активности у большинства мужчин, исходя из уровня их толерантности к физической нагрузке, который определяется при сборе анамнеза.
Согласно степени кардиального риска определяется уровень сексуальной активности у лиц с ЭД (рис. 1). На основе оценки их физических возможностей устанавливается степень риска развития кардиальных осложнений. Так, у пациентов, относящихся к категориям низкого или промежуточного риска, проводится нагрузочный тест с использованием тредмила (беговой дорожки) по протоколу Брюса. Всех мужчин с высоким риском развития кардиальных осложнений направляют на консультацию к кардиологу. Пациентам группы низкого кардиального риска рекомендуют возобновить сексуальную активность и назначают лечение ЭД.
В категорию пациентов низкого риска авторы руководства включили мужчин, не имеющих значительного кардиального риска, связанного с сексуальной активностью. Под низким риском, как правило, подразумевается возможность без появления симптомов выполнять физические упражнения умеренной интенсивности, которая равна шести и более «метаболическим эквивалентам затраты энергии в спокойном состоянии» (MET). Согласно современным данным пациентам группы низкого риска не требуется исследование сердечной деятельности и диагностическая оценка перед инициацией/возобновлением половой активности или лечением сексуальной дисфункции.
Группа промежуточного или неопределенного риска состоит из пациентов с неясным состоянием сердечно-сосудистой системы или лиц, профиль риска которых требует обследования и диагностической оценки перед инициацией/возобновлением сексуальной функции. По результатам обследования эти пациенты могут быть перемещены в группу или высокого, или низкого риска. Некоторым из них может понадобиться консультация кардиолога, чтобы определить безопасность сексуальной активности для сердечной деятельности.
У лиц группы высокого риска состояние сердечно-сосудистой системы весьма тяжелое или нестабильное, и сексуальная активность может привести к значительному риску. Большинство мужчин этой категории страдают заболеваниями сердца умеренной или тяжелой степени. Такие пациенты должны быть направлены на кардиальное обследование и лечение. Сексуальную активность следует прекратить до стабилизации состояния сердца, которая достигается при лечении, либо до совместного заключения кардиолога и терапевта о безопасности возобновления половой жизни.
Большинство пациентов с ЭД можно лечить в учреждениях сексологической помощи, однако некоторым из них может потребоваться проведение специальных диагностических тестов.
Специальные тесты для диагностики ЭД
Ночная тумесценция и ригидность полового члена. Оценку тумесценции и ригидности пениса необходимо проводить в течение как минимум 2 ночей. На сохранность эректильного механизма указывает возникновение эрекции и ригидность пениса на уровне по меньшей мере 60%, сохраняющаяся в течение 10 мин и более.
Интракавернозный инъекционный тест. Интракавернозный инъекционный тест предоставляет ограниченную информацию о васкулярном статусе. Положительным результатом теста считается твердость эрекции (невозможность согнуть пенис), возникшая в течение 10 мин после интракавернозной инъекции и длящаяся 30 мин. Такой ответ указывает на функциональную (но не обязательно физиологичную) эрекцию, поскольку последняя может возникать и на фоне артериальной недостаточности и/или веноокклюзионной дисфункции. Положительный результат теста свидетельствует, что метод интракавернозной инъекции будет эффективным у этого пациента. Однако тест недостаточен для установления диагноза, и необходимо провести ультразвуковое дуплексное сканирование (допплерографию) сосудов полового члена.
Дуплексное ультразвуковое исследование (УЗИ) сосудов полового члена. Значения пиковой систолической скорости >30 см/с, конечной диастолической скорости <3 см/с, индекса резистентности >0,8 считаются нормальными показателями кровотока в сосудах пениса. При нормальных результатах допплерографии дальнейшее исследование сосудов не требуется.
Артериография и динамическая инфузионная кавернозометрия или кавернозография. Данное исследование необходимо проводить только тем лицам, которым планируется реконструктивное хирургическое вмешательство.
Оценка психического состояния
Пациенты с психическими расстройствами должны быть направлены к психиатру, который специализируется на диагностике и лечении ЭД. У молодых людей (до 40 лет) с длительной первичной ЭД обследование у психиатра может быть эффективно еще до проведения исследований на наличие органических поражений.
Аномалии полового члена
Мужчинам с ЭД вследствие аномалий строения пениса, например гипоспадии, врожденного искривления, болезни Пейрони, может понадобиться хирургическая коррекция.
Показания к проведению специфических диагностических тестов
- Первичная ЭД (не вызванная органическим заболеванием или психическим расстройством).
- Молодые пациенты с травмой таза или промежности в анамнезе, которым может помочь операция на сосудах.
- Пациенты с деформациями пениса, которым может потребоваться хирургическая коррекция, например при болезни Пейрони, врожденном искривлении.
- Пациенты со сложными психическими и психосексуальными нарушениями.
 Больные со сложными эндокринными расстройствами.
Больные со сложными эндокринными расстройствами.- Специфические тесты могут быть проведены по просьбе пациента или его партнера.
- Судебно-медицинские показания, например имплантация протеза пениса, сексуальное насилие.
Специфические диагностические тесты:
- ночная тумесценция и ригидность пениса с применением прибора Риджискан;
- обследование сосудов: интракавернозная инъекция вазоактивного препарата, дуплексное УЗИ (допплерография) сосудов пениса, динамическая инфузионная кавернозометрия и кавернозография, артериография внутренней срамной артерии;
- неврологическое обследование, например определение длительности бульбокавернозного рефлекса, исследование проводимости нервов;
- эндокринологическое обследование;
- специализированная психодиагностическая оценка.
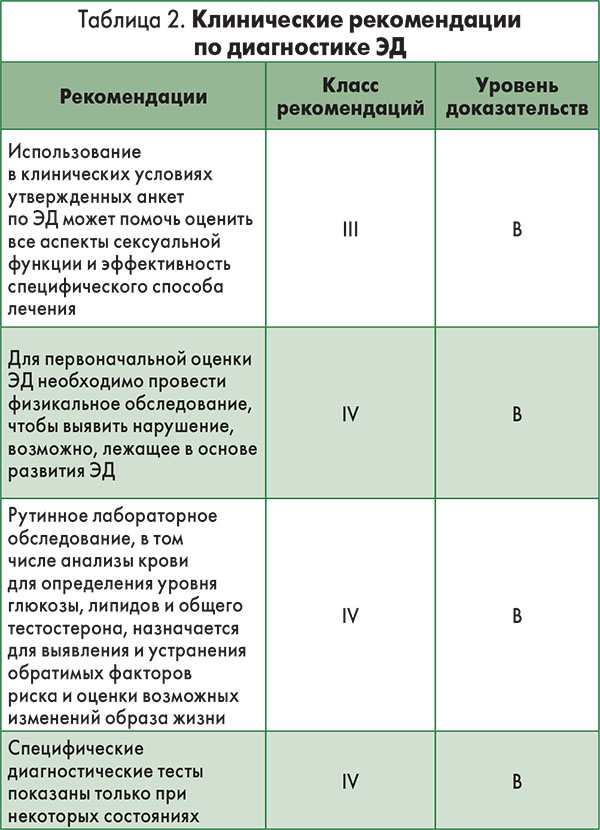
Перечень клинических рекомендаций по диагностике ЭД, изложенных в руководстве, с указанием УД и степени рекомендации (СР) представлен в таблице 2.
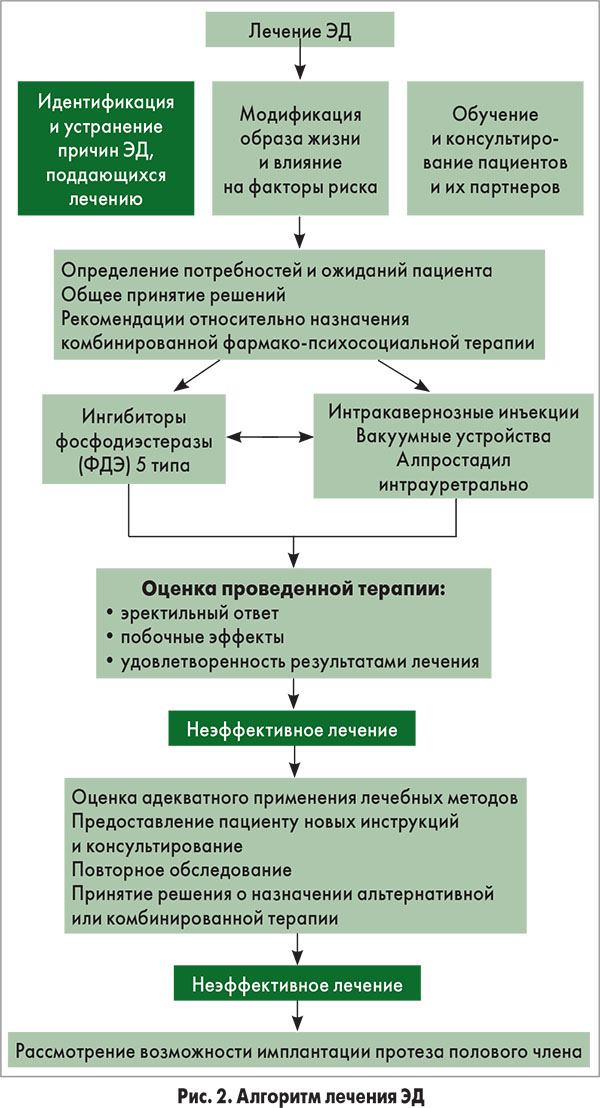
Лечение эректильной дисфункции
Первичная цель лечения ЭД – определить ее этиологию и при возможности вылечить, а не только купировать симптомы. ЭД может быть связана с модифицируемыми или обратимыми факторами, в том числе касающимися образа жизни или приема лекарственных средств. Эти факторы можно изменить как до назначения специфической терапии, так и одновременно с таковой.
Как правило, ЭД можно успешно лечить доступными в настоящее время методами, однако нельзя излечить полностью. Исключение составляют психогенная ЭД, посттравматическая артериогенная ЭД у молодых пациентов, а также ЭД, вызванная гормональными причинами (например, гипогонадизмом и гиперпролактинемией), которые можно вылечить с помощью специфических терапевтических подходов.
Большинство мужчин, страдающих ЭД, можно лечить методами, не относящимися к этиологически специфическим. Этим обусловлено формирование структурированной стратегии терапии, которая зависит от эффективности, безопасности, инвазивности, стоимости, а также предпочтений пациента.
Для адекватного консультирования больных с ЭД врачи должны быть осведомлены относительно всех существующих вариантов лечения. В связи с этим сотрудничество врача и пациента (партнера) является необходимым элементом лечения ЭД.
При оценке терапии следует рассмотреть ее влияние на удовлетворенность пациента и его партнера, другие показатели качества жизни, а также эффективность и безопасность. Алгоритм лечения ЭД представлен на рисунке 2.
Модификация образа жизни у пациентов с ЭД при наличии факторов риска
При исходном обследовании мужчины необходимо выявить обратимые факторы риска развития ЭД. Коррекцию образа жизни и факторов риска следует осуществлять до начала медикаментозной терапии или одновременно с ее проведением.
Потенциальные преимущества от изменения образа жизни могут оказаться особенно важными для пациентов с ЭД в сочетании с рядом сопутствующих сердечно-сосудистых заболеваний или метаболических нарушений, например СД или артериальной гипертензией (C. A. Derby et al., 2000; M. A. Moyad et al., 2004). Помимо улучшения эректильной функции, активное изменение образа жизни также может обеспечить общее улучшение состояния сердечно-сосудистой системы и обменных процессов в организме. Недавно проведенные исследования показали, что модификация образа жизни оказывает благоприятное влияние как на ЭД, так и на состояние здоровья в целом (K. Esposito et al., 2004; B. P. Gupta et al., 2011).
Хотя для выяснения роли коррекции образа жизни в лечении ЭД и сопутствующих сердечно-сосудистых заболеваний необходимы дополнительные исследования, ее можно рекомендовать и как отдельное лечебное мероприятие, и в сочетании с терапией ингибиторами ФДЭ‑5. В ряде исследований установлено, что терапевтическое действие ингибиторов ФДЭ‑5 может усиливаться на фоне активного купирования сопутствующих заболеваний и факторов риска (A. T. Guay, 2003). Значительного улучшения можно ожидать не позже чем через 3 мес от начала изменения образа жизни (G. Maio et al., 2010).
Однако эти данные еще требуют подтверждения в тщательно контролируемых длительных исследованиях. С учетом достаточно высокой эффективности медикаментозной терапии ЭД специалисты должны представить убедительные доказательства пользы модификации образа жизни, и, будем надеяться, в будущих исследованиях такие доказательства будут получены.
Эректильная дисфункция после РПЭ
Применение проэректильных препаратов после РПЭ является крайне важным для восстановления эректильной функции в послеоперационном периоде. В ряде исследований показано, что на фоне приема лекарственных средств как с терапевтической, так и с профилактической целью по поводу ЭД наблюдается более высокая частота купирования данного расстройства после РПЭ (A. Salonia et al., 2012).
До настоящего времени для лечения послеоперационной ЭД использовали следующие методы: интракавернозные инъекции (F. Montorsi et al., 1997), уретральные микросуппозитории (R. Raina et al., 2007), вакуумные устройства (R. Raina et al., 2006), имплантаты полового члена (B. R. Lane et al., 2007). Инъекции в кавернозные тела и имплантация протезов в половой член по-прежнему считаются терапией второй и третьей линии соответственно в случае недостаточной эффективности пероральных лекарственных средств либо при противопоказаниях к их приему у пациентов в послеоперационном периоде.
Лечение ЭД после РПЭ претерпело значительные изменения после разработки и внедрения ингибиторов ФДЭ‑5 благодаря их доказанной эффективности, простоте применения, хорошей переносимости, отличному профилю безопасности и положительному влиянию на качество жизни. Следует подчеркнуть, что у пациентов с ЭД после РПЭ наблюдается слабый ответ на терапию ингибиторами ФДЭ‑5. Несмотря на это, они являются препаратами первого ряда пероральной терапии ЭД после нервосберегающей РПЭ. Опытность хирурга (объем хирургических вмешательств) – это ключевой фактор сохранения эректильной функции после операции. Кроме того, большое значение имеют возраст пациента и выполнение нервосберегающей техники РПЭ (B. K. Hollenbeck et al., 2003; R. Ayyathurai et al., 2008; V. Ficarra et al., 2012). Известно, что ингибиторы ФДЭ‑5 наиболее эффективны после точного соблюдения процедуры нервосберегающей РПЭ, что удается только хирургам с большим опытом проведения этой операции (V. Ficarra et al., 2012).
В ходе исследования выявлено, что раннее применение высоких доз силденафила после РПЭ сопровождается сохранением гладких мышц пещеристых тел (E. J. Schwartz et al., 2004). Ежедневный прием силденафила по сравнению с плацебо обусловливал более высокую частоту самостоятельного восстановления нормальной эректильной функции после РПЭ с двусторонним сохранением нервных путей у лиц с полностью сохраненной потенцией до операции (H. Padma-Nathan et al., 2008; A. Bannowsky et al., 2008). Эффективность лечения ЭД силденафилом после РПЭ в различных исследованиях составляла от 35 до 75% у больных, подвергшихся нервосберегающей РПЭ, и от 0 до 15% – у тех, кому выполняли данное хирургическое вмешательство иным способом (R. Raina et al., 2004; A.R. McCullough et al., 2008).
Также в исследованиях с участием пациентов с ЭД после РПЭ изучали эффективность тадалафила и варденафила в качестве препаратов для приема по требованию. Так, в большом многоцентровом исследовании, проводимом в странах Европы и США, оценивали действие тадалафила у мужчин с ЭД после двусторонней нервосберегающей операции. В связи с этим на фоне приема тадалафила 20 мг эректильная функция улучшилась у 71% пациентов (против 24% в группе плацебо), в то время как частота успешных попыток половых актов составила 52% (в группе плацебо – 26%) (F. Montorsi et al., 2004).
Аналогично в рандомизированном многоцентровом проспективном плацебо-контролируемом исследовании, проведенном в Северной Америке, изучали эффективность варденафила у больных с ЭД после одно- или двустороннего нервосберегающего вмешательства (G. Brock et al., 2003). После двусторонней нервосберегающей РПЭ эректильная функция улучшилась в 71 и 60% случаев при приеме варденафила 10 и 20 мг соответственно. При расширенном анализе данных тех же пациентов, подвергнувшихся вышеуказанной операции, выявлено преимущество применения варденафила по сравнению с плацебо в отношении твердости эрекции, оргазмической функции, удовлетворенности половыми актами, а также сексуальной жизнью в целом (A. Nehra et al., 2005).
В рандомизированном двойном слепом многоцентровом исследовании в параллельных группах, проведенном в 87 центрах Европы, Канады, Южной Африки, США, сравнивали применение варденафила по требованию и на ночь у мужчин с ЭД после двусторонней нервосберегающей РПЭ. При домене эректильной функции по опроснику IIEF-EF ≥26 баллов до операции варденафил был эффективен при приеме по требованию. Такой результат свидетельствует о постепенной смене мнения специалистов в пользу назначения ингибиторов ФДЭ‑5 пациентам с ЭД после РПЭ по потребности (F. Montorsi et al., 2008). Американское проспективное рандомизированное открытое многоцентровое исследование с участием мужчин с нормальной эрекцией, перенесших двустороннюю нервосберегающую РПЭ, показало, что пероральная и внутриуретральная терапии обладают одинаковой способностью нормализовать данную функцию в течение первого года после операции (A.R. McCullough et al., 2010).
При отсутствии эффекта от применения ингибиторов ФДЭ‑5 per os после нервосберегающей РПЭ необходимо в профилактических целях назначить введение алпростадила в пещеристые тела (J. P. Mulhall et al., 2010; G. Pace et al., 2010). В то же время установка протезов полового члена остается оптимальным лечебным методом при неэффективности пероральной или интракавернозной фармакотерапии, а также вакуумных устройств (D. K. Montague, 2005).
Излечимые причины ЭД
Гормональные причины
Пациентам с гормональными нарушениями важно получить консультацию эндокринолога. Возможно, у них имеет место дефицит тестостерона в результате первичной недостаточности яичек (первичный гипогонадизм) либо вследствие поражений гипофиза/гипоталамуса, в том числе функциональных опухолей гипофиза, вызывающих гиперпролактинемию (вторичный гипогонадизм).
Заместительная терапия тестостероном (внутримышечно, внутрь, чрескожно) весьма эффективна, однако ее следует назначать только после исключения других эндокринологических причин тестикулярной недостаточности (A. Greenstein et al., 2005). Применение заместительной терапии препаратами тестостерона является спорным у мужчин с наличием в анамнезе рака предстательной железы (A. W. Roddam et al., 2008). Существует ограниченное количество доказательств того, что такое лечение не представляет угрозы в отношении развития рецидива или прогрессирования рака простаты (A. Morgentaler, 2013). Перед началом заместительной терапии тестостероном следует провести пальцевое ректальное исследование, определить уровень простатспецифического антигена в сыворотке, гематокрит, показатели печеночных проб и липидный спектр крови (A. Morales, J. P. Heaton, 2001). При назначении больным андрогенов необходимо наблюдать за клиническим ответом на лечение, повышением гематокрита и возможным развитием поражения печени и простаты. Терапия тестостероном противопоказана мужчинам с нелеченным раком простаты и нестабильной кардиологической патологией.
Посттравматическая артериогенная ЭД у пациентов молодого возраста
У молодых пациентов с травмой органов таза или промежности отдаленная эффективность хирургической реваскуляризации полового члена составляет 60-70% (D. S. Rao et al., 2001). Наличие повреждения необходимо подтвердить с помощью дуплексного УЗИ и фармакоартериографии полового члена. Противопоказанием к реваскуляризации является веноокклюзионное поражение пещеристых тел, которое необходимо исключить при динамичной инфузионной кавернозометрии и кавернозографии. В настоящее время сосудистые хирургические вмешательства при веноокклюзионной дисфункции проводить не рекомендуется из-за низкой эффективности в отдаленном периоде (E. Wespes et al., 2003).
Психосексуальное консультирование и лечение
У пациентов с выраженными психическими расстройствами можно проводить психосексуальную терапию. Ее назначают как отдельно, так и в сочетании с другими методами лечения длительным курсом. При этом эффективность терапии варьирует (R. C. Rosen, 2001).
Терапия первой линии
Пероральная медикаментозная терапия
Фермент ФДЭ‑5 гидролизует циклический гуанозинмонофосфат (цГМФ) в кавернозной ткани. Подавление ФДЭ‑5 вызывает расслабление гладкой мускулатуры с повышением артериального кровотока в половом члене, что приводит к компрессии подоболочечного венозного сплетения и эрекции (T. F. Lue, 2000).
На сегодняшний день на рынке представлены три эффективных селективных ингибитора ФДЭ‑5, одобренных Европейским агентством по оценке лекарственных средств (EMA) для лечения ЭД. Они не инициируют эрекцию, однако требуют наличия сексуальной стимуляции для возникновения эректильного ответа.
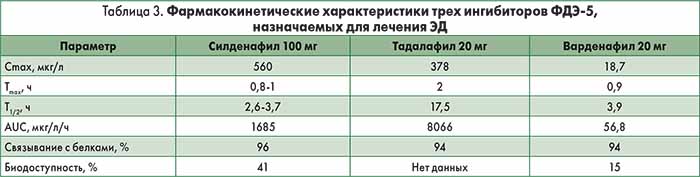
Силденафил. Силденафил появился на фармацевтическом рынке в 1998 г. и стал первым ингибитором ФДЭ‑5, доступным в продаже. Его эффективность определяется твердостью эрекции, достаточной для вагинального проникновения. Действие силденафила проявляется спустя 30-60 мин после приема. Употребление тяжелой жирной пищи перед применением препарата снижает его эффективность вследствие замедленного всасывания. Силденафил выпускается в дозах 25, 50 и 100 мг. Рекомендуемая начальная доза составляет 50 мг, и она должна быть адаптирована в соответствии с индивидуальной реакцией пациента и наличием побочных эффектов. Эффективность препарата может сохраняться до 12 ч (I. Moncada et al., 2004). Фармакокинетические характеристики силденафила представлены в таблице 3.
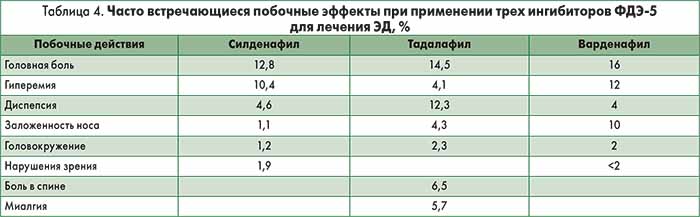
Неблагоприятные эффекты (табл. 4), как правило, выражены слабо и купируются самостоятельно. Частота отмены препарата из-за развития осложнений сопоставима с таковой в группе плацебо (H. D. Langtry, A. Markham, 1999).
По данным исследования, в ходе которого изучали эффективность применения силденафила в различных дозировках у пациентов с ЭД, через 24 нед лечения наблюдалось улучшение эрекции у 56,77 и 84% мужчин, получавших соответственно 25, 50 и 100 мг силденафила, по сравнению с 25% в группе плацебо (I. Goldstein et al., 2002). При применении силденафила статистически значимо улучшились показатели по опросникам IIEF, Sexual Encounter Profile (SEP) 2 и SEP3 (профиль сексуальных отношений), General Assessment Question (GAQ), а также удовлетворенности лечением.
В другом исследовании эффективность силденафила выявлена почти в каждой подгруппе пациентов с ЭД. Среди больных СД 66,6% сообщили об улучшении эрекции (согласно GAQ) и 63% – об успешных попытках совершить половой акт по сравнению с 28,6 и 33% соответственно в группе пациентов, получавших плацебо (B. G. Stuckey et al., 2003).
Тадалафил. Тадалафил был лицензирован для лечения ЭД в феврале 2003 г. Действие препарата начинается через 30 мин после приема и становится максимальным спустя 2 ч. Эффективность тадалафила поддерживается в течение 36 ч (H. Porst et al., 2003) и не зависит от приема пищи. Препарат в дозировках 10 и 20 мг был одобрен для лечения ЭД в режиме по требованию. Рекомендуемая начальная доза – 10 мг, затем дозу определяют в соответствии с ответом пациента на лечение и побочными эффектами. Фармакокинетические характеристики тадалафила представлены в таблице 3. Побочные эффекты (табл. 4), как правило, незначительные, при длительной терапии самостоятельно купируются. Частота отмены препарата вследствие развития побочных эффектов сопоставима с таковой в группе плацебо (G. B. Brock et al., 2002).
По данным предпродажных исследований зависимости «доза-ответ», после 12 нед лечения улучшение эрекции наблюдалось у 67 и 81% пациентов, принимавших соответственно 10 и 20 мг тадалафила, по сравнению с 35% мужчин в контрольной группе плацебо (G. B. Brock et al., 2002). На фоне приема тадалафила значительно повысились показатели по опросникам IIEF, SEP2, SEP3, GAQ, а также степень удовлетворенности лечением. Эти результаты подтвердились в постмаркетинговых исследованиях (F. Montorsi et al., 2004).
Применение тадалафила способствовало нормализации эрекции в подгруппах пациентов, тяжело поддающихся лечению. Среди больных СД 64% сообщили об улучшении эрекции (например, по опроснику GAQ) по сравнению с 25% пациентов в контрольной группе, а также об изменениях конечного показателя IIEF-EF – 7,3 по сравнению с 0,1 в группе плацебо (I. Sаenz de Tejada et al., 2002). Тем не менее у больных СД имеет место слабый ответ на терапию тадалафилом по требованию. При этом показатель успешных попыток совершить половой акт у них повысился с 21,8% в группе плацебо до 45,4 и 49,9% на фоне приема тадалафила по требованию в дозе 10 и 20 мг соответственно (V. Fonseca et al., 2004).
Варденафил. Варденафил доступен в продаже с марта 2003 г. Препарат проявляет свое действие спустя 30 мин после приема, эффект ослабляется из-за употребления тяжелой жирной пищи (>57% жира). Варденафил в дозировках 5, 10 и 20 мг был одобрен для лечения ЭД в режиме по требованию. Рекомендуемая начальная доза – 10 мг, затем дозу определяют в соответствии с ответом на лечение и побочными эффектами. Исследование in vitro показало, что действие варденафила в 10 раз мощнее, чем силденафила, однако при этом не подразумевается его более высокая клиническая эффективность (E. Bischoff, K. A. Schneider, 2001). Фармакокинетические характеристики варденафила представлены в таблице 3. Побочные эффекты (табл. 4), как правило, слабо выражены и исчезают при длительной терапии. Частота отмены препарата сходна с таковой в группе плацебо (G. M. Keating, L. J. Scott, 2003).
После 12 нед лечения в рамках исследования зависимости «доза-ответ» об улучшении эрекции сообщили 66, 76 и 80% мужчин с ЭД, принимавших 5, 10 и 20 мг варденафила соответственно, по сравнению с 30% лиц, получавших плацебо (H. Porst et al., 2001). На фоне терапии варденафилом выявлено статистическое улучшение показателей по опросникам IIEF, SEP2, SEP3 и GAQ, а также удовлетворенности лечением. Эффективность препарата подтвердилась в постмаркетинговых исследованиях (A. J. Potempa et al., 2004).
Прием варденафила также способствовал нормализации эрекции в подгруппах больных, тяжело поддающихся лечению. У пациентов с СД конечный показатель IIEF-EF составил 19 против 12,6 в группе плацебо. При этом известно, что у больных СД отмечается слабый ответ на терапию варденафилом по требованию. Вместе с тем показатель успешных попыток совершить половой акт у них повысился с 23% в группе плацебо до 49 и 54% при приеме варденафила по требованию в дозе 10 и 20 мг соответственно (I. Goldstein et al., 2003).
Не так давно варденафил был выпущен в новой форме – в виде ородисперсных таблеток (ODT). Предполагалось, что ODT-форма будет более удобна в приеме по сравнению с таблеткой с пленочным покрытием, поэтому пациенты будут отдавать предпочтение именно ей. На всасывание варденафила в ODT-форме не влияет прием пищи, при этом он обладает лучшей биодоступностью по сравнению с таблетками с пленочным покрытием (R. Heinig et al., 2011). Эффективность варденафила ODT изучали в нескольких рандомизированных контролируемых исследованиях, в ходе которых было установлено, что она не отличается от таковой при приеме препарата в обычной форме (M. Gittelman et al., 2010; F. M. Debruyne et al., 2011; H. Sperling et al., 2011).
Выбор или предпочтение между различными ингибиторами ФДЭ‑5
На сегодняшний день отсутствуют данные двойных или тройных слепых многоцентровых исследований, в которых бы сравнивали эффективность и/или предпочтение мужчин в выборе силденафила, тадалафила и варденафила. Выбор препарата зависит от частоты половых актов (случайный прием или регулярная терапия, 3-4 р/нед), а также индивидуальной реакции организма на лекарственное средство. Пациенты должны быть осведомлены, обладает препарат длительным или краткосрочным эффектом, а также о его возможных недостатках и способе применения.
Назначение ингибиторов ФДЭ‑5 по требованию или длительно
В исследованиях на животных моделях выявлено, что длительный прием ингибиторов ФДЭ‑5 снижает или в значительной степени предотвращает поражение внутрикавернозных структур, вызванное старением, СД или повреждением при операциях (G. J. Ahn et al., 2005; M. G. Ferrini et al., 2007; I. Kovanecz et al., 2008). Результаты исследований в популяции людей отсутствуют.
В рандомизированном исследовании (n=145) показано, что при ежедневном приеме тадалафила отмечались значительно более высокие показатели IIEF-EF и частоты успешных попыток половых актов по сравнению с назначением тадалафила по требованию (C. McMahon, 2003). В 2 крупных рандомизированных двойных слепых исследованиях пациенты ежедневно получали тадалафил по 5 и 10 мг в течение 12 нед (n=268) (H. Porst et al., 2006), а также по 2,5 и 5 мг на протяжении 24 нед (n=286) (J. Rajfer et al., 2006). В результате выявлено, что такая ежедневная терапия переносилась больными удовлетворительно и значительно улучшала эректильную функцию. Однако в этих исследованиях не были предусмотрены группы лечения по требованию для сравнения различных режимов приема препарата. При расширенном анализе данных обоих исследований длительностью один (n=234) и два (n=238) года установлены эффективность и хорошая переносимость тадалафила, принимаемого по 5 мг 1 р/сут (H. Porst et al., 2008). Именно поэтому терапию тадалафилом 5 мг 1 р/сут можно считать альтернативой назначению препарата по требованию для семейных пар, предпочитающих спонтанный, а не плановый характер сексуальной жизни, либо предполагающих осуществлять частые половые акты. В качестве преимущества данного метода рассматривается возможность избежать временной связи между приемом препарата и сексуальной активностью. В дополнительном исследовании при назначении 5 мг тадалафила в течение года, после чего следовал 4-недельный период вымывания препарата, установлено, что после прекращения терапии у большинства (около 75%) пациентов эректильная функция не сохранялась.
В 2007 г. тадалафил по 2,5 и 5 мг был одобрен EMA для ежедневного лечения ЭД. Согласно рекомендациям EMA для лиц, которые планируют частый прием тадалафила (по меньшей мере, 2 р/нед), может быть оптимальным режим его применения в вышеуказанных дозах 1 р/сут (с учетом выбора пациента и решения врача). В таких случаях рекомендуемая доза тадалафила составляет 5 мг 1 р/сут, причем его следует принимать примерно в одно и то же время. При этом доза препарата может быть снижена до 2,5 мг 1 р/сут на основании индивидуальной переносимости. Целесообразность длительного использования ежедневного режима приема тадалафила необходимо периодически пересматривать.
В двойном слепом плацебо-контролируемом мультицентровом исследовании J. Zumbе и соавт. (2008), проведенном в параллельных группах, 236 мужчин с легкой или умеренной ЭД рандомизированно получали варденафил по 10 мг 1 р/сут + по требованию плацебо в течение 12 или 24 нед либо плацебо 1 р/сут + по требованию варденафил 10 мг на протяжении 24 нед. После этого следовал 4-недельный период вымывания препарата. Несмотря на результаты доклинических исследований, выявлено, что при ЭД легкой или средней степени тяжести прием варденафила по 10 мг 1 р/сут не обеспечивает сколько-нибудь устойчивого эффекта после прекращения лечения по сравнению с назначением по требованию.
В других рандомизированных перекрестных исследованиях с ограниченным количеством участников установлено, что длительная (но не в режиме по требованию) терапия тадалафилом улучшает эндотелиальную функцию при сохранении эффективности после прекращения приема (G. M. Rosano et al., 2005; A. Aversa et al., 2007). Эти данные были подтверждены в исследовании A. Aversa и соавт. (2008) при длительном применении силденафила у мужчин, страдающих СД 2 типа.
В связи с этим в недавно проведенном двойном слепом плацебо-контролируемом исследовании, в котором участвовали 298 мужчин, страдавших СД и ЭД, показана эффективность и хорошая переносимость терапии тадалафилом по 2,5 и 5 мг 1 р/cут в течение 12 нед. Этот режим лечения в ряде случаев можно считать альтернативой приему препарата по требованию у пациентов с СД (D. Hatzichristou et al., 2008).
Тематичний номер «Урологія. Нефрологія. Андрологія» № 2 (6) червень 2016 р.