23 лютого, 2021
Ведення пацієнтів після гострого ішемічного інсульту на тлі COVID‑19
Торік у березні Всесвітня організація охорони здоров’я (ВООЗ) офіційно оголосила пандемію COVID‑19. В осіб із коронавірусом, як і з іншими інфекціями дихальних шляхів, можливе підвищення ризику розвитку ішемічного інсульту. Ґрунтуючись на консенсусних висновках експертів із 18 країн, A. Qureshi et al. представили вичерпні практичні рекомендації на допомогу клініцистам у веденні дорослих пацієнтів із гострим ішемічним інсультом та підтвердженою або підозрюваною інфекцією COVID‑19. Документ розроблений на основі систематичних оглядів літератури, наявних рекомендацій щодо ведення хворих на інсульт із метою узагальнення доступних даних, виявлення прогалин у сучасних знаннях, формулювання висновків і практичної значущості. Пропонуємо до вашої уваги ключові положення даного матеріалу, опублікованого у виданні International Journal of Stroke (2020; 15 (5): 540‑554).
У квітні 2020 р. загальна кількість осіб із підтвердженим діагнозом коронавірусної інфекції SARS-CoV‑2 становила 30 64 895, з яких 211 609 випадків були летальними. Більшість хворих скаржилися на високу температуру, кашель та/або задишку. Також наявні повідомлення про розвиток пневмонії, дихальної недостатності, гострого респіраторного дистрес-синдрому, пошкодження міокарда, ниркової недостатності, енцефаліту тощо (Moriguchi et al., 2020). У деяких пацієнтів початковим проявом хвороби була транзиторна ішемічна атака (ТІА) або інсульт. Тож A. Qureshi et al. (2020) розробили всеосяжний документ, що містить сучасні дані та рекомендації, які мають допомогти фахівцям охорони здоров’я при наданні допомоги особам після гострого інсульту на тлі COVID‑19.
Гострий інсульт у пацієнтів із COVID‑19
Узагальнення даних
За даними одноцентрового дослідження за участю 221 пацієнта, госпіталізованого із приводу COVID‑19, у 5% розвинувся гострий ішемічний інсульт, у 0,5% – тромбоз церебральних венозних синусів та ще у 0,5% – внутрішньомозковий крововилив (Li et al., 2020). В осіб з інсультом частіше спостерігалося порушення функції печінки та нирок. Також у таких хворих була вищою частота артеріальної гіпертензії (АГ), цукрового діабету (ЦД) та раніше перенесеної цереброваскулярної патології. Середній термін від перших симптомів інфікування COVID‑19 до інсульту становив 10 днів (міжквартильний діапазон – 1‑29 днів).
В 11 пацієнтів з ішемічним інсультом 5, 3 і 3 епізоди були пов’язані з ураженням великих, дрібних артерій та кардіоемболічними подіями відповідно. Рівень D-димеру був у 12 разів вищим у хворих після інсульту, що вказувало на стан гіперкоагуляції. Серед 11 осіб з ішемічним інсультом шестеро отримували антитромбоцитарне лікування ацетилсаліциловою кислотою (АСК) або клопідогрелем, а п’ятеро – антикоагулянтну терапію еноксапарином. Загальний рівень смертності становив 38,5%, а з-поміж тих, хто отримував антиагрегант або антикоагулянт, – 50 та 20% відповідно. Також доступні повідомлення про виникнення цереброваскулярних захворювань у 5,7% з 88 пацієнтів із тяжкою інфекцією COVID‑19 та у 1% з 126 – із легкою формою (Mao et al., 2020; Zhou et al., 2020). Цереброваскулярні порушення частіше зустрічалися у літніх хворих із такими факторами ризику інсульту, як АГ та ЦД, а також за наявності підвищеного рівня D-димеру (Li et al., 2020).
Частка пацієнтів, інфікованих COVID‑19, які мають підвищений ризик гострого інсульту, становить 4,9% (Li et al., 2020). На тлі COVID‑19 ризик розвитку інсульту, ймовірно, зростає. Адже, за наявними даними, він підвищується у 3,2‑7,82 раза протягом перших трьох днів після інших інфекцій дихальних шляхів (Smeeth et al., 2004; Warren-Gash et al., 2018).
Висновки та практична значущість
1. Пацієнти, інфіковані COVID‑19, мають високий ризик розвитку гострого інсульту, особливо за наявності поліорганної недостатності.
2. Основну причину розвитку гострого інсульту в осіб із коронавірусом SARS-CoV‑2 досі не встановлено. Доступні попередні дані щодо розвитку гіперкоагулопатії у поєднанні з підвищеним ризиком інсульту в пацієнтів із COVID‑19. Значну ймовірність гострого ішемічного інсульту також відзначено у хворих, що мають інші інфекції дихальних шляхів.
3. Необхідні додаткові дослідження для оцінки ризику гострого ішемічного інсульту, який, імовірно, зростає у пацієнтів із COVID‑19, а також пошуку доказів щодо підвищення частоти інсультів під час пандемії COVID‑19.
Ризик інфікування COVID‑19 в інсультної команди
Узагальнення даних
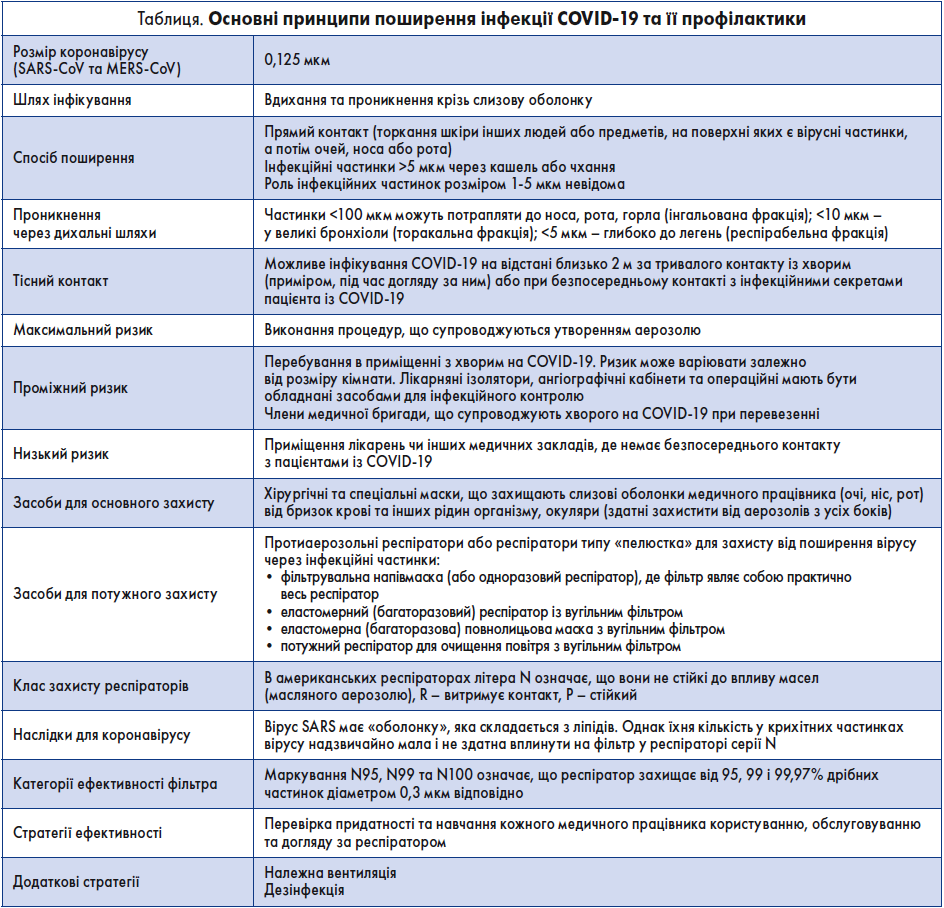
У медичних працівників, які контактують із пацієнтами після інсульту, що мають підозрюваний чи підтверджений коронавірус SARS-CoV‑2, наявний підвищений ризик інфікування. Основні шляхи поширення інфекції та принципи захисту узагальнені в таблиці.
У Китаї на початок березня 2020 р. із 3300 медичних працівників 22 були інфіковані COVID‑19 із летальними наслідками. Серед 44 672 лабораторно підтверджених випадків коронавірусної інфекції SARS-CoV‑2 3,8% становили працівники у галузі охорони здоров’я (найбільше в місті Ухань) (Wu, McGoogan, 2020). В Італії у березні 2020 р. було зареєстровано 2026 випадків захворювання на COVID‑19 серед медичного персоналу (Livingston, Bucher, 2020).
Висновки та практична значущість
4. У медичних працівників, які надають медичну допомогу пацієнтам із гострим інсультом, що хворіють на COVID‑19, спостерігається підвищений ризик інфікування коронавірусом SARS-CoV‑2.
5. Точний ризик передачі інфекції COVID‑19 під час лікування хворих після гострого інсульту не встановлений. Ризик поширення COVID‑19, імовірно, нижчий серед медичних працівників, які надають допомогу особам із гострим інсультом, ніж серед тих, які проводять обстеження із приводу респіраторних чи інфекційних захворювань та виконують процедури, що супроводжуються утворенням аерозолю.
Категорії хворих після інсульту, інфікованих COVID‑19
Узагальнення даних
Є три категорії пацієнтів з інсультом:
- хворі на підтверджену інфекцію COVID‑19;
- особи з підозрою на коронавірус SARS-CoV‑2;
- пацієнти з недіагностованою інфекцією COVID‑19.
За наявними даними, у пацієнтів із COVID‑19 інсульт розвинувся на пізній стадії інфекції (в середньому на 10-й день) (Li et al., 2020).
Однією із проблем при виявленні інфекції COVID‑19 у хворих після гострого інсульту є неможливість отримати точну історію клінічних симптомів через афазію, дизартрію та сплутаність свідомості. Когнітивна недостатність має місце у 10‑12% осіб із гострим інсультом залежно від тяжкості стану (Qureshi et al., 2014; Kim et al., 2016). При госпіталізації до стаціонара в 44 і 68% пацієнтів спостерігаються підвищення температури та кашель відповідно. У 82% хворих на COVID‑19 можуть бути виявлені аномалії грудної клітки на рентгенограмі чи комп’ютерній томографії (КТ). Необхідно розуміти часові обмеження для підтвердження інфікування COVID‑19.
Для підтвердження зараження COVID‑19 виявляють унікальні послідовності вірусної РНК за допомогою методу полімеразної ланцюгової реакції зі зворотною транскрипцією шляхом взяття мазка з носо- та ротоглотки, отримання ендотрахеального аспірату або виконання бронхоальвеолярного лаважу. Повторне тестування може знадобитися через низьку якість зразків, їхню обмежену кількість у пацієнта, неприйнятний час збору секрету (надто рано чи пізно) під час перебігу інфекції тощо.
Особи з гострим інсультом можуть бути безсимптомними носіями вірусу, або ж хвороба перебігає у продромальному періоді. Також першим проявом у таких пацієнтів може бути неврологічний дефіцит. Час між поширенням інфекції та початком симптомів коливається від 2 до 14 днів (Lauer et al., 2020). Вірусне навантаження в осіб із/без симптомів COVID‑19 є зіставним, що підкреслює однакову можливість поширення інфекції від безсимптомних пацієнтів або хворих із мінімальними проявами симптомів (Zou et al., 2020). Наявність окремих неврологічних симптомів у хворого на COVID‑19, таких як сплутаність свідомості (8%), головний біль (8‑13%) та запаморочення (17%), може вказувати на необхідність проведення обстеження із приводу інсульту (Mao et al., 2020).
Висновки та практична значущість
1. У пацієнтів, інфікованих коронавірусом SARS-CoV‑2, може розвинутися інсульт після встановлення діагнозу COVID‑19. Така послідовність подій відповідає виникненню гострого інсульту, який спостерігається на тлі інших інфекцій дихальних шляхів.
2. Наявність COVID‑19 навряд чи можна підтвердити або виключити за допомогою лабораторного обстеження на етапі первинної оцінки в осіб із гострим інсультом. Отже, при обстеженні хворого після інсульту із клінічною підозрою на інфікування коронавірусом SARS-CoV‑2 слід припускати наявність у нього COVID‑19.
3. Існує ймовірність того, що пацієнти з гострим інсультом можуть мати недіагностовану інфекцію коронавірусом SARS-CoV‑2 за низки причин:
- відповідний скринінг був неможливий через неповний анамнез пацієнта, наявність неврологічного дефіциту, пов’язаного з інсультом, та відсутність родичів;
- пацієнти мали інфекцію COVID‑19 у продромальному періоді;
- хворий був безсимптомним носієм.
4. Якщо у пацієнта після перенесеного інсульту є підозра на COVID‑19, може бути корисною візуалізація легень за допомогою КТ грудної клітки та/або рентгенограми для виявлення аномальних змін, що свідчать про інфікування.
Ризик інфікування при обстеженні пацієнтів із COVID‑19 після гострого інсульту
Узагальнення даних
Доступні дані показують, що вірус SARS-CoV‑2 може бути наявним у повітряно-крапельній зависі частинок до 3 год (van Doremalen et al., 2020). Однак їхню роль у поширенні інфекції досі не визначено. Стандартні хірургічні маски можуть виявитися неефективними для забезпечення захисту, адже не призначені для щільного прилягання до обличчя та фільтрування інфекційних частинок. У 2003 р. застосування захисних масок, рукавичок, халатів та миття рук було ефективним у запобіганні внутрішньолікарняному поширенню тяжкого гострого респіраторного синдрому (Seto et al., 2003).
У настанові Кампанії за виживання пацієнтів при сепсисі, застосовуваній при лікуванні тяжкохворих на COVID‑19, медичним працівникам, які доглядають пацієнтів без штучної вентиляції легень (ШВЛ) та виконують процедури, що не супроводжуються утворенням аерозолю, при застосуванні ШВЛ (закрита циркуляція), рекомендовано щонайменше надягати захисну маску (Alhazzani et al., 2020). Ризик тяжкої інфекції COVID‑19 може бути вищим у медичних працівників похилого віку або із супутніми патологіями, зокрема серцево-судинними хворобами, ЦД, АГ, хронічним захворюванням легень або нирок, раком тощо (Zhou et al., 2020; Wu, McGoogan, 2020).
Технологія Telestroke є унікальною для оцінки стану пацієнта з гострим інсультом, яку можна здійснити віддалено (Silva, Schwamm, 2012; Agarwal et al., 2014). Ця методика продемонструвала еквівалентність приліжковій оцінці для негайного визначення тяжкості стану за шкалою інсульту Національного інституту охорони здоров’я (NIHSS), а також необхідності внутрішньовенного (в/в) введення рекомбінантного тканинного активатора плазміногену (rt-PA) та/або тромбектомії. Крім того, доступним варіантом швидкої клінічної оцінки стану пацієнтів із гострим інсультом є спеціальний застосунок для смартфонів (Martins et al., 2020).
Висновки та практична значущість
1. Члени інсультної команди повинні дотримуватися основних принципів, що спрямовані на запобігання інфікуванню при контакті з хворим, зокрема дотримуватися відстані 2 м (якщо протилежне не є абсолютно необхідним) та використовувати захисні маски, рукавички, халати, мити руки тощо. Чи потрібне застосування респіратора для фільтрування твердих частинок, може залежати від доступності, політики медичного закладу та регіональної поширеності інфекції COVID‑19.
2. Інсультна бригада, яка проводить обстеження пацієнта після перенесеного інсульту, повинна включати мінімальну кількість осіб, а тим, хто відповідає критеріям високого ризику інфікування COVID‑19, не варто брати участі в цьому процесі.
3. Для запобігання інфікуванню COVID‑19 бажано не перебувати в одному приміщенні з пацієнтом після інсульту, щодо якого є підозра на інфікування вірусом SARS-CoV-2 (або діагноз підтверджений).
4. Використання технології Telestroke може бути максимально ефективним у такій ситуації. У разі її недоступності в медичному закладі слід розглянути можливість придбання додатків для смартфонів.
Необхідність дотримання санітарних норм
Узагальнення даних
Через централізоване кондиціонування повітря вірусні частинки можуть рециркулювати від хворих на COVID‑19 до неінфікованих осіб та медичних працівників (Lu et al., 2020). Крім того, SARS-CoV‑2 виявлено у зразках калу інфікованих пацієнтів (Wu et al., 2020). Наявність вірусної РНК SARS-CoV‑2 встановлено у зразках, узятих з поверхонь особистих речей, як-от спірометр, пульсоксиметр, назальна канюля, ноутбук, окуляри для читання тощо; поверхонь приміщень, зокрема туалетів, а також приліжкових тумбочок та ліжок, підвіконь тощо (Santarpia et al., 2020).
Висновки та практична значущість
1. Щоб уникнути поширення вірусу в медичному закладі, доцільно створити «зелений» коридор (включно з кабінетами для консультацій, проведення КТ, магнітно-резонансної томографії [МРТ] та ангіографії), який буде відокремлений від потенційно небезпечного відділення інтенсивної терапії (ВІТ), для уникнення прямої взаємодії інсультної команди із хворими на COVID‑19.
2. У випадку госпіталізації пацієнта з підтвердженим або підозрюваним коронавірусом, слід проводити дезінфекцію приміщення, в якому він має перебувати окремо від інших хворих.
Загальний план лікування хворого після гострого інсульту
Узагальнення даних
В осіб після інсульту, інфікованих COVID‑19, показник смертності є дуже високим (38%) (Li et al., 2020). Для порівняння, летальність серед госпіталізованих пацієнтів з інсультом у Китаї становила 1,5‑2,3% при ішемічному та 2,3‑3,2% – будь-якому типі інсульту (He et al., 2014). Тож клінічні наслідки у пацієнтів із COVID‑19 значною мірою пов’язані з тяжкістю інфекції вірусом SARS-CoV‑2. Частота летальних випадків серед госпіталізованих хворих на COVID‑19 без інсульту коливається від 22 до 45% (Ruan et al., 2020; Wu et al., 2020). Пацієнтів із COVID‑19 та ризиком внутрішньолікарняної смертності можна ідентифікувати за допомогою таких факторів, як похилий вік, високий показник за шкалою оцінки органної недостатності (SOFA), серцево-судинні захворювання, вторинні інфекції, гострий респіраторний дистрес-синдром, гостре ураження нирок та лабораторні результати щодо лімфопенії, підвищених рівнів печінкових ферментів, C-реактивного білка, феритину, креатинінфосфокінази та D-димеру (Shi et al., 2020).
Отже, обстеження із приводу дисфункції інших органів із використанням перевірених методик, як-от шкала SOFA, є важливим для загального прогнозу та призначення відповідного лікування пацієнтам із гострим інсультом. За допомогою SOFA можна оцінити дихання (співвідношення PaO2/FiO2), коагуляцію (кількість тромбоцитів), активність печінкових ферментів (рівень білірубіну), неврологічну функцію, роботу серцево-судинної системи, нирок (вміст креатиніну в сироватці крові / діурез), наявність/відсутність сепсису. У пацієнтів з органною недостатністю всіх шести проаналізованих органів та сепсисом показник смертності становить 91,3%, а за її відсутності – 3,2% (Moreno et al., 1999).
Висновки та практична значущість
Необхідно визнати наявність високого рівня смертності серед пацієнтів, інфікованих COVID‑19, які мають поліорганну недостатність, і навряд чи інтенсивне лікування інсульту матиме вплив у цій клінічній ситуації. Оцінка ступеня органної недостатності за допомогою шкали SOFA може допомогти у визначенні загальної парадигми надання медичної допомоги особам із гострим інсультом відповідно до очікуваного прогнозу на додаток до факторів, пов’язаних з інсультом.
Нейроваскулярні процедури візуалізації
Узагальнення даних
Поточні рекомендації щодо лікування гострого інсульту вказують на те, що у всіх пацієнтів із підозрою на інсульт слід виконати візуалізацію мозку (неконтрастну КТ) після прибуття до лікарні, бажано протягом 20 хв після госпіталізації до ВІТ (Powers et al., 2019). Хворим, яким, імовірно, буде проведено механічну тромбектомію (МТ), може знадобитися КТ-ангіографія. У пацієнтів без ниркової недостатності в анамнезі доцільно здійснювати контрастну візуалізацію для визначення концентрації креатиніну в сироватці крові. Як інфекція COVID‑19, так і інсульт пов’язані з високим ризиком розвитку ниркової недостатності, а у разі їхнього поєднання цей показник, ще вищий (Yichun et al., 2020). Варто зазначити, що вплив контрастної рідини при виконанні КТ-ангіографії та перфузійної КТ може спричинити гостре ураження нирок (ГУН) у пацієнта з COVID‑19, що має ризик розвитку даної патології; при цьому ймовірність летального наслідку зростає.
Для виконання нейроваскулярної візуалізації використовують ізолятори на принципі негативного тиску. Під час цієї процедури можна також провести КТ грудної клітки для виявлення аномальних змін, які можуть спостерігатися у 82% пацієнтів із COVID‑19 на момент госпіталізації.
Висновки та практична значущість
1. У пацієнтів із COVID‑19 наявна досить висока частота ниркової недостатності з подальшим розвитком ГУН. Ниркова недостатність та/або ГУН збільшують імовірність летальних наслідків у хворих на COVID‑19 та осіб з інсультом. Доцільно також встановити наявність інших факторів ризику контрастно-індукованої нефропатії у пацієнтів із вірусом SARS-CoV‑2 перед введенням контрастної рідини під час КТ-ангіографії та/або перфузійної КТ, щоб визначити точне співвідношення користі й ризику.
2. Мета призначення КТ-ангіографії та перфузійної КТ полягає у відборі пацієнтів для проведення МТ. Ці процедури можна не виконувати, якщо МТ не розглядається через поганий стан хворого або побажання пацієнта/родини.
3. Паралельну візуалізацію легень за допомогою КТ грудної клітки для виявлення аномальних змін, що свідчать про наявність інфікування COVID‑19, може бути включено до початкових процедур візуалізації у пацієнтів із гострим інсультом. Є імовірність того, що ступінь ураження легень вплине на терапевтичні рішення при лікуванні гострого інсульту, включно з потребою в інтубації. Однак на ранній стадії COVID‑19 КТ грудної клітки може бути доцільною.
4. Для виконання нейроваскулярної візуалізації у хворих на COVID-19 можна використовувати ізолятори на принципі негативного тиску.
Внутрішньовенний тромболізис
Узагальнення даних
Використання rt-PA в/в рекомендоване для окремої популяції пацієнтів, здатних отримувати терапію протягом 3 год, а також ретельно відібраної групи хворих, яких можна лікувати протягом 3 та 4,5 год від появи симптомів або останніх очевидних проявів хвороби. В осіб із гострим ішемічним інсультом та інфекційним ендокардитом застосування в/в rt-PA є недоцільним через підвищений ризик внутрішньочерепних крововиливів (ВЧК) (Powers et al., 2019). При інфекції SARS-CoV‑2 септична емболія не розвивається, але можлива наявність прокоагуляційного стану, подібного до сепсису. Пацієнти з сепсисом та системною запальною реакцією можуть мати гіпер- або гіпокоагуляцію (Muller et al., 2014).
У хворих на COVID‑19 був виявлений лейкоцитоз (із лімфоцитопенією) зі збільшенням кількості нейтрофілів, рівня С-реактивного білка (СРБ) та D-димеру. Попередні дослідження пацієнтів, не інфікованих вірусом SARS-CoV‑2, продемонстрували тяжчий ступінь інвалідності, більшу ймовірність розвитку ВЧК та вищий рівень смертності в осіб після ішемічного інсульту з лейкоцитозом, підвищеним вмістом СРБ та D-димеру, які отримували rt-PA в/в (Yichun et al., 2020; Hsu et al., 2016).
На додачу, слід враховувати розвиток печінкової дисфункції, що проявляється підвищенням рівня трансаміназ у пацієнтів із COVID‑19. При в/в введенні rt-PA піддається печінковому кліренсу, який може зменшуватися при ураженні печінки з потенційним зростанням цього сироваткового показника та ризику ВЧК. Тяжка дисфункція печінки може бути пов’язана з коагулопатією, супроводжуваною підвищенням протромбінового часу (ПЧ), міжнародного нормалізованого відношення (МНВ) та тромбоцитопенією. Однак при гострому порушенні функції печінки є ймовірність розвитку протромботичного стану або коагулопатії, що не завжди ідентифікуються за допомогою показників ПЧ та МНВ (Stravitz et al., 2012). Тож застосування тромбоеластографу у приліжковому режимі допоможе визначити гемостатичні характеристики у пацієнтів із дисфункцією печінки та сепсисом (Harrison, 2018).
Зв’язок між низьким рівнем тромбоцитів, підвищеним ПЧ або активованим частковим тромбопластиновим часом (АЧТЧ) та ризиком геморагічних ускладнень у пацієнтів з ішемічним інсультом, які отримують rt-PA в/в, до кінця не встановлений. У поточних рекомендаціях зазначено, що в/в введення rt-PA може розглядатися в індивідуальних випадках і є обґрунтованим у пацієнтів, які раніше отримували варфарин та мали МНВ 1,7 та/або ПЧ <15 с, а також осіб із нирковою недостатністю у термінальній стадії на гемодіалізі чи системним злоякісним новоутворенням за нормальних показників МНВ та АЧТЧ (Powers et al., 2019).
Висновки та практична значущість
1. Підвищена концентрація маркерів запалення та гіперкоагуляції, таких як лейкоцитоз, СРБ і D-димер, у пацієнтів із COVID‑19 є вельми поширеною. Жодне з цих відхилень лабораторних показників не є протипоказанням для в/в застосування rt-PA. Однак у дослідженнях за участю осіб із гострим ішемічним інсультом, але не інфікованих COVID‑19 спостерігався вищий рівень інвалідності, посттромболітичного ВЧК чи смертності.
2. У пацієнтів із COVID‑19 може виникати дисфункція печінки (підвищення рівня трансаміназ) без коагулопатії (нормальний рівень ПЧ, МНВ, АЧТЧ, тромбоцитів). Незважаючи на стурбованість із приводу порушення печінкового кліренсу rt-PA, даних, що свідчили б про вищий ризик або користь при в/в використанні rt-PA, бракує.
3. У хворих на інфекцію SARS-CoV‑2 може розвиватися порушення функції печінки, що проявляється коагулопатією (підвищені показники ПЧ, МНВ, АЧТЧ або зменшення кількості тромбоцитів). У рекомендаціях визначені певні порогові значення ПЧ, МНВ, АЧТЧ або зниженого рівня тромбоцитів, хоча існує неоднозначність щодо цих параметрів, пов’язаних із вищим ризиком або користю при в/в введенні rt-PA.
4. В осіб із сепсисом та дисфункцією печінки можна розглянути проведення додаткових тестів, як-от тромбоеластографія та визначення концентрації D-димеру в сироватці крові. У пацієнтів із COVID‑19 та ураженням інших органів перед в/в введенням rt-PA доцільною є детальна коагулограма для оцінки співвідношення користі й ризику.
Механічна тромбектомія
Узагальнення даних
У поточній настанові рекомендовано виконувати МТ стент-ретривером у дорослих пацієнтів з ішемічним інсультом, спричиненим оклюзією внутрішньої сонної артерії або проксимальною оклюзією середньої мозкової артерії (визначено за допомогою КТ-ангіографії), які мають показник ≥ 6 балів за NIHSS, не мають значних ішемічних змін на КТ та можуть отримувати лікування протягом 6 год із моменту появи симптомів. МТ доцільно виконувати окремим хворим, що перенесли гострий інсульт, у період між 6-ю і 16-ю годинами від останньої зафіксованої нормалізації стану. Також процедура вважається обґрунтованою в пацієнтів із гострим інсультом, відібраних за індивідуальними характеристиками, в період між 6-ю та 24-ю годинами від останньої зафіксованої нормалізації стану, але потрібне проведення перфузійної КТ або МРТ для виявлення потенційно відновлюваної тканини (Powers et al., 2019).
Під час пандемії COVID‑19 при веденні пацієнтів з інсультом та підозрюваною або підтвердженою інфекцією SARS-CoV‑2 виникають труднощі, адже хворих неможливо швидко перевести із ВІТ або з-за меж лікарні в ангіографічний кабінет. Цей процес може потребувати спеціального обладнання та персоналу, що затягує виконання процедури (Froehler et al., 2017; van Veenendaal et al., 2018). Через очікувані проблеми особам після гострого інсульту рекомендоване в/в введення rt-PA в ізоляційному приміщенні, а не черезшкірне коронарне втручання (Welt et al., 2020; Zeng et al., 2020).
Висновки та практична значущість
1. Слід враховувати труднощі при переміщенні хворих із підозрюваним чи підтвердженим COVID‑19 між кабінетами лікарні або з-за її меж та сприяти ранньому виявленню інфекції з метою зменшення поширення.
2. З огляду на труднощі, пов’язані з виконанням інвазивних процедур у пацієнтів із підозрюваною або підтвердженою інфекцією SARS-CoV‑2, необхідне запровадження суворих вимог щодо відбору осіб із гострим ішемічним інсультом для проведення МТ. Незважаючи на те що рішення слід приймати в кожному конкретному випадку, найбільш сприятливі результати очікуються у хворих, які відповідають критеріям включення, що використовуються у клінічних випробуваннях, а також коли процедури можуть бути розпочаті та проведені швидко.
3. У кандидатів для виконання МТ процедуру слід розпочинати припускаючи, що у них є COVID‑19, із застосуванням відповідних запобіжних заходів для уникнення можливих затримок.
4. У світлі введених обмежень щодо візитів відвідувачів до лікарні для отримання інформованої згоди на проведення процедури може бути розглянуте запровадження віддаленої електронної версії.
Інтубація та штучна вентиляція легень
Узагальнення даних
У сучасних рекомендаціях зазначено, що загальну або місцеву анестезію слід обирати на основі індивідуальних факторів ризику пацієнта, технічних аспектів процедури та інших клінічних характеристик (Powers et al., 2019). Приблизно 28‑38% осіб із гострим ішемічним інсультом (до пандемії COVID‑19) при проведенні МТ потребували застосування загальної анестезії через високий ступінь тяжкості інсульту, порушення функції дихання, свідомості або неможливість виконувати необхідні дії (Emiru et al., 2014). Орієнтовно 6‑14% хворих після гострого ішемічного інсульту під час МТ потребували позапланової інтубації через виразну ажитацію, апное після болюсної седації та дихальну недостатність (Schonenberger et al., 2015).
Пацієнти із COVID‑19 можуть мати вищий ризик інтубації через дихальну недостатність, при цьому майже у 20% спостерігається її гіпоксична форма (Wu, McGoogan, 2020). При розгляді питання щодо проведення інтубації у хворих із граничним значенням функції дихання необхідно встановити низький поріг тиску, щоб уникнути екстреної інтубації та знизити ризик поширення інфекції шляхом здійснення штучної вентиляції легень за замкнутим контуром (Welt et al., 2020).
Висновки та практична значущість
1. У пацієнтів із COVID‑19, відібраних для проведення МТ, перед початком інтубації, ШВЛ та загальної анестезії може знадобитися встановлення низького порогу тиску, щоб знизити ризик несприятливих наслідків.
2. Під час інтубації може бути отриманий трахеобронхіальний секрет для підтвердження наявності/відсутності COVID‑19.
Терміни інтубації та штучної вентиляції легень
Узагальнення даних
Ендотрахеальна інтубація, відкрите відсмоктування секрету дихальних шляхів, небулайзерна терапія, ручна вентиляція перед інтубацією, розміщення пацієнта у положенні лежачи та неінвазивна вентиляція з позитивним тиском – усі ці процедури супроводжуються утворенням аерозолю, що підвищує ризик інфікування медичних працівників SARS-CoV‑2 (Tran et al., 2012). Тому рекомендовано проводити інтубацію у приміщенні з негативним тиском з ларингоскопією при залученні медичної бригади із 2‑4 осіб у спеціальних захисних костюмах за мінімальної кількості спроб, щоб скоротити тривалість впливу на пацієнта (Verbeek et al., 2003; Alhazzani et al., 2020).
Висновки та практична значущість
Низка процедур інтубації та ШВЛ супроводжуються утворенням аерозолю, що збільшує імовірність поширення інфекції COVID‑19. Тому їх слід проводити у найбільш оптимальних умовах, що може бути неможливо в ангіографічному кабінеті. Ймовірно, інтубацію та ШВЛ краще виконувати до проведення ангіографії.
Ризики, пов’язані з інтубацією та загальною анестезією
Узагальнення даних
За даними досліджень, значна частка пацієнтів із гострим ішемічним інсультом, які отримували загальну анестезію через наявність інфекції COVID‑19, при проведенні МТ мали високий ризик інвалідності, респіраторних ускладнень (пневмонія та тривала ШВЛ) (Emiru et al., 2014). Причинами зростання серед хворих інвалідності або смертності, асоційованих із загальною анестезією, були внутрішньопроцедурна гіпотензія та гіпокапнія у зв’язку з гіпервентиляцією під час інтубації (Rasmussen et al., 2020; Curley et al., 2010). У пацієнтів з інфекцією SARS-CoV‑2 може спостерігатися вищий ризик гіпотонії через гіповолемію (зменшення споживання рідини, підвищення температури, тахіпное), сепсису або поліорганної недостатності.
У трьох рандомізованих клінічних випробуваннях при використанні строгих параметрів протоколу інтубації/анестезії ризик інвалідизації або смерті знижувався до показників, порівнянних із такими при місцевій анестезії (Schonenberger et al., 2016; Simonsen et al., 2018; Lowhagen Henden et al., 2017). У всіх випадках застосовували анестетики короткої дії, були попередньо визначені цільові рівні артеріального тиску, а за розвитку гіпотонії під час інтубації використовували вазопресори в/в.
Висновки та практична значущість
Таким чином, у пацієнтів, які потребують проведення інтубації та ШВЛ перед МТ, особливо за підозрюваної чи підтвердженої інфекції COVID‑19, слід застосовувати строгі значення систолічного або середнього артеріального тиску та CO2 у кінці видиху для зменшення ризику інвалідизації або летальних наслідків.
Застосування АСК, гепарину та інгібіторів рецепторів P2Y12
Узагальнення даних
Особам, що перенесли малий ішемічний інсульт / ТІА, рекомендоване пероральне приймання АСК або комбінації АСК та клопідогрелю – негайно або ж через 24 год у разі отримання в/в rt-PA (Powers et al., 2019). Питання, що є ефективнішим у хворих з інсультом і COVID‑19 – антикоагулянти чи антиагреганти, потребує ретельнішого розгляду. При сепсисі ліпополісахарид викликає прокоагулянтний стан через залежний від коагуляції шлях тканинного фактора, виразність якого знижується при використанні гепарину та гірудину, але не АСК (Pernerstorfer et al., 2000). У пацієнтів з інфекціями спостерігається гіперактивність тромбоцитів через АДФ-сигналінг. Також лишається незрозумілим, чи мають переваги антагоністи рецепторів P2Y12, як-от клопідогрель або тікагрелор, у таких клінічних умовах (Kullaya et al., 2018).
Висновки та практична значущість
1. Відповідно до наявних даних, за можливості слід уникати призначення антитромбоцитарних препаратів протягом перших 24 год після в/в введення rt-PA та застосування МТ у пацієнтів з інсультом і підозрюваною або підтвердженою інфекцією COVID‑19 до визначення точного ризику.
2. В осіб із гострим ішемічним інсультом та підозрюваною або підтвердженою інфекцією SARS-CoV‑2, які не отримують в/в введення rt-PA та/або МТ, можна розглянути застосування моно- чи подвійної антитромбоцитарної терапії. Клінічних даних щодо переваг одного антитромбоцитарного засобу над іншим у межах вторинної профілактики ішемічного інсульту в таких пацієнтів бракує.
Підготувала Олена Коробка
Спецвипуск «Інсульт», Додаток до № 1 (56), 2021 р.