14 березня, 2021
Постковідний синдром: патогенез та основні напрями реабілітації
.jpg) Спалах коронавірусної хвороби (COVID‑19), що з’явилася в Китаї в грудні 2019 р. та швидко переросла в пандемію світового масштабу, продовжує залишатися однією з найсерйозніших проблем людства. Наразі накопичилося чимало даних, які пояснюють природу зумовленого коронавірусом SARS-CoV‑2 тяжкого гострого респіраторного дистрес-синдрому (ГРДС) з погляду вірусології, епідеміології та клінічної тактики. Сьогодні науковці всього світу наполегливо працюють над створенням ліків від COVID‑19, зокрема проводять дослідження в таких напрямах, як перешкоджання проникненню SARS-CoV‑2 до клітини, порушення реплікації вірусу, пригнічення надмірної запальної реакції, використання плазми крові пацієнтів, які видужали, вакцинація тощо. Безумовно, це необхідно, але не менш важливим напрямом успішного повернення до нормального життя пацієнтів, які перенесли COVID‑19, вважається реабілітація.
Спалах коронавірусної хвороби (COVID‑19), що з’явилася в Китаї в грудні 2019 р. та швидко переросла в пандемію світового масштабу, продовжує залишатися однією з найсерйозніших проблем людства. Наразі накопичилося чимало даних, які пояснюють природу зумовленого коронавірусом SARS-CoV‑2 тяжкого гострого респіраторного дистрес-синдрому (ГРДС) з погляду вірусології, епідеміології та клінічної тактики. Сьогодні науковці всього світу наполегливо працюють над створенням ліків від COVID‑19, зокрема проводять дослідження в таких напрямах, як перешкоджання проникненню SARS-CoV‑2 до клітини, порушення реплікації вірусу, пригнічення надмірної запальної реакції, використання плазми крові пацієнтів, які видужали, вакцинація тощо. Безумовно, це необхідно, але не менш важливим напрямом успішного повернення до нормального життя пацієнтів, які перенесли COVID‑19, вважається реабілітація.
Багато пацієнтів, які перенесли гострі прояви COVID‑19, перебувають лише на початку шляху до одужання. На які наслідки очікувати після гострої фази коронавірусної інфекції? Це залежить від поширеності й тяжкості вірусних уражень у різних типах клітин і органах. Незважаючи на величезну кількість наукових публікацій, чітка картина віддалених наслідків COVID‑19 залишається нез’ясованою. Без масштабних проспективних обсерваційних досліджень, які тільки розпочинають проводити, клініцисти можуть отримувати певну інформацію лише зі звітів про випадки постковідних ускладнень або невеликих досліджень [1].
Наскільки поширеними є ці ускладнення? У рамках дослідження за участю 150 некритичних пацієнтів із COVID‑19, проведеного співробітниками університету м. Тур (Франція), виявлено, що на 30-й або 60-й день після появи симптомів COVID‑19 у хворих, які перенесли некритичну форму захворювання, зберігалися такі симптоми (щонайменше один із них): втрата маси тіла (≥5%), сильна задишка чи астенія, біль у грудях, серцебиття, аносмія/агевзія, головний біль, шкірні ознаки, артралгія, міалгія, розлади травлення, підвищення температури тіла. На 30-й день у 68% (n=103/150) пацієнтів спостерігався щонайменше один симптом, а на 60-й – у 66% (n=86/130).
Найпоширенішими симптомами є:
- аносмія/агевзія: в 59% на початку захворювання, у 28% на 30-й і у 23% на 60-й день;
- задишка: в 36,7% на 30-й день і в 30% на 60-й день;
- астенія: в 50% на 30-й день і в 40% на 60-й день;
- стійкі симптоми на 60-й день частіше спостерігалися в осіб віком від 40 до 60 років; асоціювалися з госпіталізацією та змінами аускультативної картини на початку захворювання;
- тяжкий перебіг COVID‑19 і задишка на початку захворювання були асоційовані з наявністю стійких симптомів на 30-й день [4].
Постковідні стани: термінологія, визначення
За повідомленням Всесвітньої організації охорони здоров’я в лютому 2020 р. (на основі попередніх даних), час від початку до клінічного одужання при легких випадках COVID‑19 становить приблизно 2 тиж, у разі тяжких або критичних – від 3 до 6 тиж. Однак у багатьох пацієнтів певні симптоми зберігаються протягом тижнів або навіть місяців. Наявні документально підтверджені стійкі ушкодження багатьох органів і систем (легені, серце, мозок, нирки та судинна система тощо) в пацієнтів, які перенесли COVID‑19. Вивчаються різні механізми розвитку цих станів. Такі ушкодження, можливо, спричиняються вираженими запальними реакціями, тромботичною мікроангіопатією, венозною тромбоемболією, кисневою недостатністю, автоімунними процесами, патологічними наслідками після гострого періоду (пневмофіброз) або персистенцією збудника.
Крім цього, нині немає чітко сформульованого узгодженого визначення зазначеного стану. У клінічних настановах Національного інституту охорони здоров’я та вдосконалення медичної допомоги Великої Британії (NICE) «Лікування довгострокових наслідків COVID-19» (NG188) застосовуються такі клінічні визначення для первинного захворювання та тривалої COVID-19 залежно від часу, коли вони виникли та протягом якого зберігаються:
- гостра COVID-19 – ознаки та симптоми захворювання зберігаються до 4 тиж;
- тривала симптоматична COVID-19 – ознаки та симптоми зберігаються від 4 до 12 тиж;
- пост-COVID-синдром – ознаки та симптоми розвиваються під час або після інфекційного захворювання, що відповідає COVID-19, зберігаються понад 12 тиж і не пояснюються альтернативним діагнозом [26].
Своєю чергою, Американське товариство з інфекційних захворювань (IDSA) виділяє «тривалу COVID-19», «пост-COVID-синдром» і «пост-гострий COVID-синдром». Гарвардська медична школа використовує визначення «далекобійники». Поняття «хронічний» або «тривалий» перебіг інфекційного захворювання передбачає персистенцію збудника. Відомо, що інші коронавіруси мають потенціал тривало зберігатися в нервовій системі, можливо, SARS-CoV-2 також [24, 25]. Якщо патологічний стан після перенесеного захворювання зберігається, але збудник не виявляється, то йдеться про наслідки захворювання, котре має право називатися постковідним синдромом.
Post-COVID long-hauler («далекобійник») – будь-яка людина, в якої діагностовано COVID-19, спричинену SARS-CoV‑2, та яка не повернулася до свого рівня здоров’я й функціонування через 6 міс після перенесеного захворювання.
За різними даними, «далекобійниками» стають від 10 до 50% осіб, які перенесли COVID‑19. Виокремлюють дві групи таких хворих: особи, котрі мають незворотні ушкодження легень, серця, нирок або мозку, що впливають на їхню здатність функціонувати; ті, в кого продовжують спостерігати виснажливі симптоми, незважаючи на відсутність помітних ушкоджень органів. Хоч би якою була природа змін, пов’язаних із тривалим збереженням клінічних проявів або появою нових симптомів після перенесеного гострого захворювання, їх наявність зумовлює потребу в реабілітації таких пацієнтів.
Необхідність реабілітації після COVID-19
Ураховуючи очевидну потребу в настанові з реабілітації осіб, які перенесли COVID‑19, групою експертів реабілітаційного центру Міністерства оборони в Стенфорд-холі (Велика Британія) розроблено відповідний документ – Консенсус Stanford Hall, який містить такі загальні рекомендації після COVID‑19 для цільової групи активних людей:
- план реабілітаційного лікування має бути індивідуалізованим відповідно до потреб пацієнта з урахуванням супутніх захворювань;
- для хворих на COVID‑19 реабілітація має бути спрямована на полегшення симптомів (задишки), поліпшення психологічного стану, фізичної форми та якості життя;
- пацієнти повинні періодично обстежуватися під час реабілітації;
- хворі мають отримувати інформацію про свій стан і про стратегії відновлення після COVID‑19 [5].
Утім, це переважно загальні рекомендації, що описують обстеження пацієнтів із постковідним синдромом і догляд за ними. Медикаментозне лікування таких хворих ці настанови не висвітлюють.
Для чіткішого розуміння спрямованості реабілітаційних заходів і їх можливого медикаментозного доповнення доцільно докладніше розглянути морфологію та патогенез постковідних змін.
Ендотеліїт
Ендотеліїт – один із ключових синдромів при COVID‑19, а надалі й пусковий механізм постковідного синдрому. На сьогодні наявні докази прямого інфікування вірусом SARS-CoV‑2 ендотеліальних клітин і спричиненого цим дифузного запалення ендотелію. Добре відомо, що вірус використовує для проникнення в клітину рецептор ангіотензинперетворювального ферменту-2 (АПФ2), експресований на пневмоцитах альвеол, зумовлюючи тим самим пошкодження легень. Утім, рецептор АПФ-2 також широко експресується на ендотеліоцитах, які вистилають судини багатьох органів [16]. Було доведено, що SARS-CoV‑2 може безпосередньо інфікувати епітеліоцити кровоносних судин людини in vitro [17]. Пряме ураження ендотеліоцитів вірусом або їх опосередковане пошкодження імунними клітинами, цитокінами та вільними радикалами може призвести до вираженої дисфункції ендотелію.
Ендотелій судин є активним паракринним, ендокринним й автокринним органом, який бере участь у регуляції судинного тонусу та підтриманні судинного гомеостазу [18]. Ендотеліальна дисфункція, що розвивається при COVID‑19, призводить до порушень мікроциркуляції, вазоконстрикції з подальшим розвитком ішемії органів, запалення та набряку тканин, прокоагуляції [19]. Ендотеліїт може пояснити системні порушення мікроциркуляторної функції в різних судинних руслах та їх клінічні наслідки в пацієнтів із COVID‑19.
Ендотеліальна дисфункція обґрунтовує необхідність застосування лікувальних методів для стабілізації ендотелію під час боротьби з реплікацією вірусів, особливо терапії протизапальними протицитокіновими препаратами, інгібіторами АПФ і статинами. Така стратегія особливо актуальна для пацієнтів, які мають фактори ризику ендотеліальної дисфункції, як-от артеріальна гіпертензія, цукровий діабет, ожиріння та діагностовані серцево-судинні захворювання, куріння [20-23].
Ураження ендотелію судин унаслідок гіперімунної реакції (ушкодження цитокінами та вільними радикалами) спричиняє розвиток системного фонового «тліючого» запалення в постковідний період [6].
Ендотеліальна дисфункція та хронічне запалення супроводжуються гіперкоагуляцією, підвищенням рівня фібриногену, зниженням процесів фібринолізу й антикоагуляції, що, своєю чергою, зумовлює тромбоутворення.
Імунна система поступово відновлюється після COVID‑19; утім, стійка гіперзапальна відповідь протягом >14 днів після зникнення гострих симптомів захворювання передбачає необхідність продовження медичного спостереження після виписки з лікарні.
Після перенесеної COVID‑19 у пацієнтів унаслідок ураження ендотелію судин:
- на 25% підвищується ризик тромбоемболії;
- виявляється вазоконстрикція.
Унаслідок ураження міокарда:
- в постковідний період спостерігаються аритмії;
- на 22% зростає ризик інфарктів;
- спостерігаються порушення перфузії й ішемічні зміни в міокарді [9].
Вплив SARS-CoV‑2 на серцево-судинну систему
SARS-CoV‑2 може впливати на серцево-судинну систему багатьма шляхами, але наразі не зовсім зрозуміло: вірус ускладнює вже наявні серцево-судинні захворювання (ССЗ) чи зумовлює розвиток нових. У пацієнтів із COVID‑19 описано багато випадків захворювань серця, включаючи серцеву недостатність (особливо часто трапляється в госпіталізованих хворих) і кардіоміопатію. Припускають, що кардіоміопатія розвивається внаслідок прямих ефектів вірусу та/або токсичних ефектів цитокінів, які утворюються під час інфекції.
У багатьох хворих під час гострої фази COVID‑19 розвивається протромботичний стан, який може спричинити тромбоемболію легеневої артерії, утворення внутрішньосерцевих тромбів і загострення ішемічної хвороби серця. На найбільший ризик негативних наслідків наражаються пацієнти із серцево-судинними факторами ризику – чоловіча стать, цукровий діабет, гіпертензія й ожиріння, наявні ССЗ [10].
Підходи до кардіологічної реабілітації в пацієнтів, які перенесли COVID‑19, відповідно до Консенсусу Stanford Hall
- Кардіологічні ускладнення слід передбачати в усіх пацієнтів, які перенесли коронавірусну інфекцію, незалежно від тяжкості перебігу. У таких пацієнтів необхідно визначити кардіологічні симптоми й потенційні порушення серцевої функції. За потреби потрібно звернутися за консультацією до фахівця та пройти поглиблене обстеження.
- Період спокою після перенесеного захворювання може знизити ризик постінфекційної серцевої недостатності та міокардиту.
- За наявності кардіологічної патології мають бути розроблені спеціальні персоналізовані програми реабілітації на основі оцінки наявних ускладнень, порушень і потреб пацієнта [5].
Системне запалення й ураження нервової системи
Китайські науковці встановили, що в осіб, які перенесли COVID‑19, через 2 тиж після одужання концентрація цитокінів у сироватці крові (включаючи інтерлейкіни (ІЛ) 2, 4, 6, 17) була вищою порівняно з групою контролю, що вказує на продовження запального процесу після одужання [7, 8].
Системне гіперзапалення, пов’язане зі вродженим імунітетом (провокується зв’язуванням спайкового білка SARS-CoV‑2 (S1) з експресувальними АПФ-2-клітинами), нейросудинною ендотеліальною дисфункцією, ушкодженням гематоенцефалічного бар’єра (ГЕБ) й активацією вродженого імунітету центральною нервовою системою (ЦНС), потенційно спричиняє розвиток ускладнень ЦНС, пов’язаних із SARS-CoV‑2. Подальше ушкодження ендотелію периферичних судин через прямий ушкоджувальний вплив вірусної інфекції на ендотелій зумовлює ендотеліїт і пригнічення ендотеліального АПФ-2.
Цитокіни, що виділяються при периферичному запаленні, можуть збільшувати проникність ГЕБ, забезпечуючи шлях вірусу до проникнення в мозок. Потрапляючи до ЦНС, SARS-CoV‑2 може інфікувати астроцити й мікроглію, активуючи каскад нейрозапалення та нейродегенерації за рахунок вивільнення фактора некрозу пухлини (ФНП), цитокінів та інших медіаторів запалення.
Крім того, є непрямі механізми залучення мозку:
- порушення регуляції цитокінів (доведено зв’язок прозапальних цитокінів, наприклад ІЛ‑6 і ФНП, із розвитком енцефаліту на тлі синдрому цитокінового шторму);
- трансміграція периферичних імунних клітин за механізмом «троянського коня», що спричиняє нейрозапалення й вірус-індуковану невропатію;
- автоімунна агресія;
- гіпоксична травма внаслідок безпосереднього впливу вірусу на кардіореспіраторний центр. Гіпоксія головного мозку зумовлює активацію анаеробного метаболізму, наслідком чого є набряк мозку, зниження кровотоку, підвищення внутрішньочерепного тиску, розвиток нейропсихіатричних симптомів;
- тромботична мікроангіопатія зумовлює продукування антитіл проти кардіоліпіну, а отже, ушкодження мозку за участю антифосфоліпідних антитіл [11].
Астенічний синдром
У багатьох пацієнтів розвивається виражений астенічний синдром, який значно погіршує їхню якість життя й істотно знижує працездатність. У таких осіб може тривалий час зберігатися запалення низької інтенсивності в головному мозку, зниження припливу крові до мозку, автоімунне ушкодження мозку чи поєднання цих аномалій. Накопичення прозапальних цитокінів, які долають ГЕБ, у ЦНС може зумовити дисрегуляцію центральних структур і спричинити вегетативну дисфункцію (підвищена температура тіла, порушення циклу сну/неспання, когнітивні порушення, швидка втомлюваність) [3].
Найчастіше постковідний астенічний синдром проявляється психічними проблемами та загальним виснаженням пацієнта. Найпоширенішими проявами астенії при постковідному синдромі є:
- швидка втомлюваність;
- дратівлива слабкість (підвищена збудливість, яка швидко змінюється виснаженістю);
- афективна лабільність із рисами примхливості та невдоволення;
- сльозливість;
- розлади пам’яті.
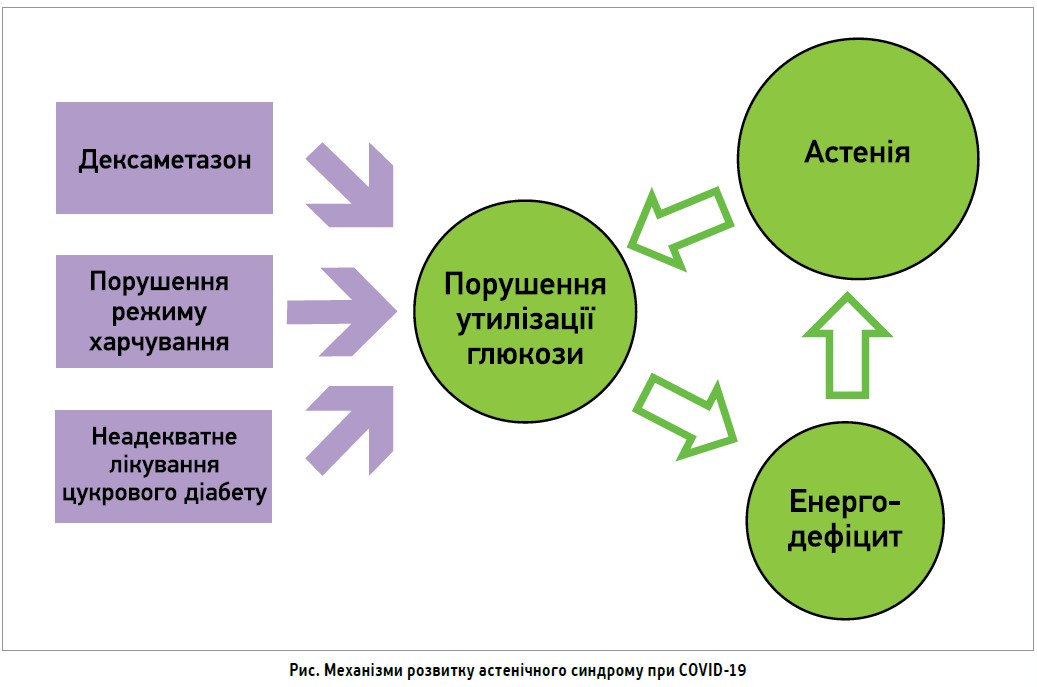
Серед можливих причин розвитку астенії при постковідному синдромі називають:
- масивне медикаментозне навантаження під час терапії COVID‑19 (зокрема, призначення дексаметазону, що має катаболічну спрямованість дії);
- тривалий і виснажливий перебіг захворювання з дихальною недостатністю та водно-електролітними розладами;
- супутні тяжкі та/або некомпенсовані системні захворювання, як-от цукровий діабет (рис.).
Основні напрями лікування при постковідному астенічному синдромі:
- оптимізація медикаментозного лікування та раннє скасування препаратів із катаболічною спрямованістю дії (дексаметазон);
- організація оптимального за кількістю та збалансованого за складом харчування;
- психологічна підтримка в родині та на роботі;
- виявлення та контроль водно-електролітних і метаболічних порушень;
- моніторинг і корекція порушень за наявності супутніх захворювань (цукровий діабет, артеріальна гіпертензія);
- профілактика метаболічних розладів (кетоацидозу голодування та діабетичного кетоацидозу);
- покриття внутрішньоклітинного енергодефіциту;
- ліквідація «тліючого» системного запалення.
Можливими напрямами лікування «тліючого» системного запалення є зменшення рівня цитокінів і медіаторів, проникності ГЕБ; корекція порушення ендотеліальної функції; підвищення ефективності власних антиоксидантних систем організму.
Варто враховувати, що COVID‑19 може спричиняти й серйозніші неврологічні порушення. На сьогодні отримано свідчення, що SARS-CoV‑2 може бути залучений у розвиток енцефалопатії, енцефаліту, менінгіту, гострого дисемінованого енцефаломієліту, судомних нападів, інсульту, нейром’язових розладів (синдрому Гієна-Барре, полінейропатії, парезів, атаксії). Частими неврологічними симптомами, котрі супроводжують COVID‑19, також є запаморочення, головний біль, порушення свідомості.
Оскільки ми все ще переживаємо пандемію та її наслідки, описувати повну клінічну картину постковідного неврологічного синдрому занадто рано. Проте опубліковані дані вже переконливо довели зростання кількості неврологічних порушень після перенесеної COVID‑19, що зумовлює необхідність постійного неврологічного та когнітивного/афективного моніторингу всіх випадків COVID‑19 (незалежно від ступеня тяжкості). Особливу увагу варто приділяти маркерам запалення в периферичній крові (співвідношення нейтрофілів і лімфоцитів, С‑реактивний білок, D‑димер, сироватковий феритин).
Глобальні клінічні реєстри з ретельним системним підходом до оцінки, ведення та звітності про пацієнтів, які перенесли COVID‑19, допоможуть з’ясувати ключові клінічні особливості виникнення неврологічних ускладнень, а також визначити ефективність потенційних терапевтичних втручань найближчим часом [12].
Підходи до неврологічної реабілітації в пацієнтів, які перенесли COVID‑19, відповідно до Консенсусу Stanford Hall
- Усіх пацієнтів, які перенесли COVID‑19, слід обстежити на наявність будь-яких неврологічних симптомів, які можуть бути виявлені під час активної фази інфекції чи протягом декількох тижнів після COVID‑19. Рекомендується скринінг на наявність когнітивних порушень для пацієнтів групи ризику (пацієнти після реанімації або із залишковими когнітивними порушеннями).
- Слід запевнити пацієнтів, що незначні неврологічні симптоми, як-от головний біль, запаморочення, втрата нюху чи смаку, а також сенсорні порушення, ймовірно, покращаться при мінімальному лікарському втручанні, а неврологічні симптоми легкого та середнього ступеня тяжкості, ймовірно, будуть повністю нівельовані.
- Тяжкі симптоми потенційно можуть спричинити значні порушення, здатні суттєво вплинути на якість життя, тому для максимального одужання пацієнтам із помірними чи тяжкими неврологічними симптомами рекомендується мультидисциплінарна реабілітація в умовах стаціонару [5].
Пневмонія (ураження дихальної системи)
Оксидативний стрес має важливу роль у патогенезі COVID‑19, посилюючи наслідки цитокінового шторму, згортання крові та гіпоксії, що зумовлює ушкодження тканин і органну недостатність. Вірус SARS-CoV‑2 може порушувати рівновагу між ядерним фактором транскрипції NF‑κB (бере участь в експресії цитокінів) і активацією Nrf2 (відповідає за експресію антиоксидантних ферментів). Передбачається, що існує перехресний зв’язок між цитокіновим штормом і оксидативним стресом. Ці порушення можуть відігравати важливу роль у вираженості симптомів у хворих на COVID‑19. Отже, логічно представляти модель патогенезу коронавірусної інфекції з первинним ураженням легень і пізньою гематологічною, тканинною гіпоксемією (цитопатична гіпоксемія) та мітохондріальною дисфункцією через участь оксидативного стресу. Це підтверджується надійними експериментальними даними [13].
Основними ланками патоморфогенезу інтерстиціальної пневмонії при COVID‑19 є дисрегуляторна активація моноцитарних фагоцитів, розвиток генералізованого тромбозу мікроциркуляторного русла, прогресивний внутрішньоальвеолярний та інтерстиціальний фіброз. У відповідь на проникнення вірусу SARS-CoV‑2 в ексудативній і проліферативній стадіях переважають реакції Т‑клітинного імунітету. У фібротичній стадії загальна кількість Т‑лімфоцитів різко знижена, тоді як клітин гуморального імунітету не виявляють. Превалювання CD8+ Т‑лімфоцитів-супресорів над CD4+ Т‑лімфоцитами-хелперами, можливо, пов’язане з механізмами автоімунного ураження.
Ушкодження легень унаслідок безпосереднього ураження коронавірусом і цитокінами ендотелію судин та альвеолярного комплексу (альвеолоцитів і міжальвеолярних перегородок; при цьому розвивається рентгенологічний симптом «матового скла») зумовлює розвиток інтерстиціальної пневмонії, активацію процесу фіброзоутворення, а також зниження функції легень.
Питання пато- та морфогенезу коронавірусної інфекції поглиблено вивчаються; зокрема, проводиться порівняльний аналіз морфологічних змін легеневої тканини пацієнтів, які померли в різні часові проміжки після появи перших клінічних симптомів захворювання. Аналіз макро- та мікроскопічних змін респіраторного тракту із застосуванням імуногістохімічних досліджень дав змогу оцінити стан легень пацієнтів у разі COVID‑19 у 80 випадках, які закінчилися летально.
Виявлено особливості дифузного альвеолярного ушкодження, що дають змогу припустити 3 фази патоморфогенезу інтерстиціальної пневмонії при COVID‑19:
- фульмінантна (до 10 діб; відповідає ексудативній і проліферативній стадіям ГРДС);
- персистувальна (11-20-та доба; відповідає проліферативній стадії ГРДС);
- фібротична (виявлена в пацієнтів, які померли на 21-45-ту добу; відповідає стадії організації ГРДС) [14].
Принципи легеневої реабілітації в пацієнтів, які перенесли COVID‑19, відповідно до Консенсусу Stanford Hall
- Респіраторні ускладнення після COVID‑19 можуть являти собою порушення й функціональні обмеження певного ступеня вираженості, в т. ч. (але не тільки) через зниження дихальної функції.
- Рекомендується своєчасна первинна оцінка стану пацієнта, проведення котрої залежить від ступеня дисфункції, нормокапнічної дихальної недостатності, фізичного та психічного стану пацієнта.
- На початковому етапі реабілітації слід розглянути виконання вправ низької інтенсивності, особливо для пацієнтів, які потребують кисневої терапії. Одночасно необхідно контролювати життєво важливі показники (частота серцевих скорочень, пульсоксиметрія, артеріальний тиск). Поступове збільшення фізичних навантажень має враховувати вираженість симптомів пацієнта [5].
У хворих, які перенесли COVID‑19, метою респіраторної реабілітації є зменшення проявів задишки, полегшення занепокоєння та депресії, запобігання дихальній дисфункції, зниження частоти інвалідизації, збереження дихальної функції в максимальному обсязі, а також поліпшення якості життя.
Рекомендації з респіраторної реабілітації містять фізичні вправи:
- аеробні: ходьба, швидка ходьба, біг підтюпцем, плавання тощо, починаючи з низької інтенсивності, поступово збільшуючи інтенсивність і тривалість;
- силові тренування: прогресивні тренування з ваговими навантаженнями;
- тренування дихання: за наявності задишки, хрипів, труднощів із відходженням мокротиння слід застосовувати тренувальні техніки дихання для покращення відходження мокротиння, режим дихання, включаючи регулювання ритму дихання, тренування активності грудної клітки та мобілізацію певних груп м’язів [15].
Звичайними симптомами в госпіталізованих пацієнтів із COVID‑19 є дихальна недостатність, сухий кашель, задишка й аномалії легень при комп’ютерній томографії (помутніння та/або ущільнення у вигляді «матового скла»). Під час гострої фази переносимість фізичного навантаження не можна оцінювати за допомогою стандартних тестів (наприклад, тесту з 6-хвилинною ходьбою). Деякі пацієнти все ще потребують кисневої терапії чи мають респіраторні симптоми під час виписки. Подальше спостереження за станом респіраторної системи має вирішальне значення для оцінки функції легень, альвеолярно-артеріального газообміну та толерантності до фізичного навантаження в пацієнтів, які видужали від COVID‑19. Про віддалені респіраторні ускладнення у хворих на COVID‑19 наразі нічого не відомо [1].
Висновки
Проходження гострої фази COVID‑19 геть не означає повного одужання. Вірус SARS-CoV‑2 здатен уражати багато типів клітин організму людини, що надалі визначає вид і тяжкість постковідних ускладнень. Велике значення в патогенезі цих змін має фонове системне запалення як відлуння цитокінового шторму й оксидативного стресу, що спостерігалися під час спалаху хвороби. Саме тому після перенесення гострих симптомів COVID‑19 потрібен обов’язковий моніторинг дихальної функції, кардіальних симптомів, стану нервової системи та психічних функцій, а також синдромно-патогенетичний підхід до реабілітації пацієнтів, спрямований насамперед на усунення системного фонового запалення, покращення ендотеліальної функції та зменшення проявів астенії.
Для максимального одужання пацієнтам із помірними чи тяжкими постковідними симптомами рекомендується мультидисциплінарна реабілітація в умовах стаціонару.
Література
1. Gemelli Against COVID-19 Post-Acute Care Study Group. Post-COVID-19 global health strategies: the need for an interdisciplinary approach. Aging Clinical and Experimental Research. https://doi.org/10.1007/s40520-020-01616-x.
2. Levison M.E. Commentary: what we know so far about post-COVID syndrome. https://www.msdmanuals.com/professional/news/editorial/2020/09/23/20/17/post-covid-syndrome.
3. Komaroff A. The tragedy of the post-COVID “long haulers”. Available at: https://www.health.harvard.edu/blog/the-tragedy-of-the-post-covid-long-haulers-2020101521173.
4. Carvalho-Schneider С. et al. Follow-up of adults with noncritical COVID-19 two months after symptom onset. Clin. Microbiol. Infect. 2020 Oct 5. doi: 10.1016/j.cmi.2020.09.052 [Epub ahead of print].
5. Barker-Davies R., O’Sullivan O., Senaratne K. et al. The Stanford Hall consensus statement for post-COVID-19 rehabilitation. Br. J. Sports Med. 2020; 54: 949-959.
6. Varga Z., Flammer A., Steiger P. et al. Endothelial cell infection and endotheliitis in COVID-19. The Lancet. 2020; 395 (2): 1417-1418.
7. Hasichaolu, Zhang X., Li X. et al. Circulating cytokines and lymphocyte subsets in patients who have recovered from COVID-19. Biomed. Res. Int. 2020 Nov 26; 2020: 7570981.
8. Zhang W., Zhao Y., Zhang F. The use of anti-inflammatory drugs in the treatment of people with severe coronavirus disease 2019 (COVID-19): the perspectives of clinical immunologists from China. Clinical Immunology. 2020; 214: 108393.
9. Коваленко С.В. Досвід застосування методів синдромно-патогенетичної терапії при пневмонії, спричиненій COVID-19, в умовах пульмонологічного відділення. Медична газета «Здоров’я України 21 сторіччя». № 13-14 (481-482), 2020 р.
10. Akhmerov A., Marban E. COVID-19 and the heart. Circ. Res. 2020; 126: 1443-1455.
11. Najjar S., Najjar A., Chong D. et al. Central nervous system complications associated with SARS-CoV-2 infection: integrative concepts of pathophysiology and case reports. Journal of Neuroinflammation. 2020; 17: 231.
12. Wijeratne T. et al. Post-COVID 19 Neurological Syndrome (PCNS); a novel syndrome with challenges for the global neurology community. Journal of the Neurological Sciences. 2020; 419: 117179.
13. Cecchini R., Cecchini F. Medical Hypotheses. SARS-CoV-2 infection pathogenesis is related to oxidative stress as a response to aggression. 2020; 143: 110102.
14. Забозлаев Ф.Г., Кравченко Э.В., Галлямова А.Р., Летуновский Н.Н. Патологическая анатомия легких при новой коронавирусной инфекции (COVID-19). Предварительный анализ аутопсийных исследований. Федеральный научно-клинический центр специализированных видов медицинской помощи и медицинских технологий. Том 11, № 2 (2020): 21-37. https://journals.eco-vector.com/clinpractice/article/view/34849.
15. Chinese Association of Rehabilitation Medicine, Respiratory rehabilitation committee of Chinese Association of Rehabilitation Medicine, Cardiopulmonary Rehabilitation Group of Chinese Society of Physical Medicine and Rehabilitation. Recommendations for respiratory rehabilitation of COVID-19 in adults. Zhonghua Jie He He Hu Xi Za Zhi. 2020; 43: E029.
16. Ferrario C., Jessup J., Chappell M. et al. Effect of angiotensin-converting enzyme inhibition and angiotensin II receptor blockers on cardiac angiotensin-converting enzyme 2. Circulation. 2005; 111: 2605-10.
17. Monteil V., Prado P., Hagelkrüys A. et al. Inhibition of SARS-CoV-2 infections in engineered human tissues using clinical-grade soluble human ACE2. Cell. 2020; published online in press. https://www.cell.com/pbassets/products/coronavirus/CELL_CELL-D-20-00739.pdf (accessed April 17, 2020).
18. Flammer A., Anderson T., Celermajer D. et al. The assessment of endothelial function: from research into clinical practice. Circulation. 2012; 126: 753-67.
19. Bonetti P., Lerman L., Lerman A. Endothelial dysfunction – a marker of atherosclerotic risk. Arterioscl. Throm. Vas. 2003; 23: 168-75.
20. Anderson T., Meredith I., Yeung A., Frei B., Selwyn A., Ganz P. The effect of cholesterollowering and antioxidant therapy on endothelium-dependent coronary vasomotion. N. Engl. J. Med. 1995; 332: 488-93.
21. Taddei S., Virdis A., Ghiadoni L., Mattei P., Salvetti A. Effects of angiotensin converting enzyme inhibition on endothelium-dependent vasodilatation in essential hypertensive patients. J. Hypertens. 1998; 16: 447-56.
22. Flammer A., Sudano I., Hermann F. et al. Angiotensin-converting enzyme inhibition improves vascular function in rheumatoid arthritis. Circulation. 2008; 117: 2262-69.
23. Hurlimann D., Forster A., Noll G. et al. Anti-tumor necrosis factor-alpha treatment improves endothelial function in patients with rheumatoid arthritis. Circulation. 2002; 106: 2184-87.
24. Arbour N., Côté G., Lachance C., Tardieu M., Cashman N., Talbot P. Acute and persistent infection of human neural cell lines by human coronavirus OC43. J. Virol. 1999; 73: 3338-3350. doi: 10.1128/JVI.73.4.3338-3350.1999.
25. Arbour N., Ekandé S., Côté G., Lachance C., Chagnon F., Tardieu M., Cashman N., Talbot P. Persistent infection of human oligodendrocytic and neuroglial cell lines by human coronavirus 229E. J. Virol. 1999; 73: 3326-3337. doi: 10.1128/JVI.73.4.3326-3337.1999.
26. COVID-19 rapid guideline: managing the long-term effects of COVID-19. NICE guideline. Published: 18 December 2020. Available at: www.nice.org.uk/guidance/ng188.
Медична газета «Здоров’я України 21 сторіччя» № 3 (496), 2021 р.