28 листопада, 2021
Антидепресанти та ризики з боку серцево-судинної системи. Позитивні й негативні сторони використання в клінічній практиці
Незважаючи на неоднозначність отриманих результатів щодо впливу АД на ліпідний профіль, за їх тривалого використання необхідний моніторинг метаболічних показників (особливо в пацієнтів з наявними іншими факторами ризику щодо ССЗ). При виявленні таких порушень можливе супутнє застосування статинів для їхньої корекції. Оскільки статини є високоселективними інгібіторами ГМГ-КoA-редуктази та не впливають на інші ферменти чи рецептори, фармакодинамічні лікарські взаємодії з АД малоймовірні [50].
Оскільки надмірна маса тіла – часте порушення в хворих на афективні розлади, вона може прогресивно збільшуватися із часом при використанні більшості АД, що може посилювати метаболічні розлади та згодом зумовлювати МС. Відомо, що найбільший вплив на збільшення маси тіла чинять АД із вираженою дією на Н1-гістамінові рецептори, що й обумовлює їхню побічну дію.
Раніше було встановлено, що блокатори гістамінових рецепторів 1 типу (Н1), які зазвичай використовуються для полегшення симптомів алергії, спричиняють збільшення маси тіла в пацієнтів, а також розвиток МС і ожиріння [57]. Крім того, дія на Н1-рецептори зумовлює підвищену сонливість та збільшення апетиту. Всі ці фактори в комбінації з гіподинамією, притаманною для цієї категорії хворих, у т. ч. із наявними ССЗ і ЦВЗ, спричиняє зростання індексу маси тіла, об’єму талії та підвищує ризики появи МС. Водночас імовірним є вплив АД, які не мають антигістамінної дії, на окремі серотонінові рецептори, що може також впливати на збільшення маси тіла. Тривале лікування циталопрамом, флуоксетином, міртазапіном і сертраліном було пов’язане зі збільшенням індексу маси тіла в ⅔ пацієнтів [12].
Австралійське дослідження з використанням АД протягом 3 років виявило, що пацієнти, які приймають АД, мають вищу ймовірність додати >3% до своєї маси тіла на рік, ніж ті, котрі їх не приймають (КР 1,19; 95% ДІ 1,03-1,38; р=0,003). Ризик збільшення маси тіла суттєво не змінювався (залежно від класу АД) [52].
Аналіз 257 рандомізованих досліджень 54 різних препаратів, у т. ч. АД, які приймали 84 696 хворих, виявив у середньому збільшення маси тіла за використання амітриптиліну на 1,8 кг і міртазапіну на 1,5 кг. Втрата маси тіла була зафіксована лише при застосуванні флуоксетину на 1,3 кг [16].
За різними даними, ТЦА зумовлюють найбільший приріст маси тіла серед АД. Амітриптилін (від 0,4 до 7,3 кг) і нортриптилін (від 0,3 до 4,1 кг) пов’язані з найбільшим збільшенням маси тіла. Інші ТЦА, як-от дезипрамін (від -0,9 до +2,0 кг), іміпрамін (від 0,6 до 1,8 кг) і доксепін (від 0,0 до 2,7 кг), пов’язані з суттєвішими нейтральними ефектами. Тразодон (від -1,2 до +0,9 кг) може бути найсприятливішим у ваговому профілі АД. Циталопрам (від -0,1 до +7,1 кг) пов’язаний з найбільшим збільшенням маси тіла, флувоксамін (від -3,5 до +1,7 кг) – з найбільшою втратою маси тіла для СІЗЗС. Інші СІЗЗС мають відносно нейтральний вплив на масу тіла. Есциталопрам (від -0,1 до +1,83 кг), пароксетин (від +0,1 до 1,7 кг), сертралін (від -1,6 до +1,0 кг) і флуоксетин (від -1,3 до +0,5 кг) пов’язані зі зміною маси тіла приблизно на ±2 кг. ІЗЗСН часто мають нейтральний вплив на масу тіла. Так, дулоксетин (від -0,5 до +1,1 кг), венлафаксин (від -1,4 до +1,2 кг). Міртазапін є атиповим АД із середнім приростом маси тіла від 0,4 до 2,4 кг, тоді як бупропіон пов’язаний із втратами маси тіла від -0,4 до -2,4 кг [71].
Загалом АД не пов’язані з розвитком МС, за винятком АД із високою афінністю до Н1-рецепторів (амітриптилін, міртазапін, міансерин, доксепін) [27].
Депресія є поширеною супутньою патологією при ЦД і пов’язана з підвищеним ризиком розвитку гіперглікемії, захворюваності та смертності [6].
Чи існують ризики появи ЦД при депресії або тривожних розладах і чи існують певні ризики виникнення ЦД за використання АД (особливо довготривалого)? Звісно, це потребує подальших спеціальних досліджень, оскільки більшість даних свідчить про наявний вплив АД на глікемію.
Згідно з даними популяційного когортного дослідження, проведеного в Японії, до якого залучили 90 530 осіб віком 20-79 років, при використанні АД у 5225 (5,8%) учасників розвинувся ЦД. Застосування АД дозозалежно було пов’язане з ризиком розвитку діабету через деякий час (скорегований КР 1,27; 95% ДІ 1,16-1,39 для короткострокового використання в низьких дозах і скорегований КР 3,95; 95% ДІ 3,31-4,72 для довгострокового застосування у високих дозах). Рівні HbA1c були нижчими в пацієнтів, які припинили використання АД або зменшили їхню дозу (р<0,001). ВР розвитку ЦД 2 типу був високим у хворих, яким призначали (на 2 роки) високі дози АД [44].
У дослідженні S. Siafis і G. Papazisis (2018) 6 із 22 АД були пов’язані з ризиком появи ЦД 2 типу: нортриптилін (ВШ 2,01; 95% ДІ 1,41-2,87), доксепін (ВШ 1,97; 95% ДІ 1,31-2,97), іміпрамін (ВШ 1,82; 95% ДІ 1,09-3,06), сертралін (ВШ 1,47; 95% ДІ 1,29-1,68), міртазапін (ВШ 1,33; 95% ДІ 1,04-1,69), амітриптилін (ВШ 1,31; 95% ДІ 1,09-1,59). Була також виявлена кореляція між спорідненістю АД до мускаринових М1, М3, М4, М5 та гістамінових Н1-рецепторів і виникненням ЦД 2 типу [59].
Ще один метааналіз виявив зв’язок між використанням АД і появою ЦД 2 типу (сукупний ВР 1,27; 95% ДІ 1,19±1,35; р<0,001) [62].
Ретроспективне когортне дослідження дітей та молоді віком від 5 до 20 років визначило, що ризик ЦД 2 типу значно підвищувався за використання АД групи СІЗЗС або ІЗЗСН у середній добовій дозі та >150 днів (скорегований ВР 2,39; 95% ДІ 1,04-5,52). Ризик не збільшувався при застосуванні АД від 1 до 150 днів. Водночас поточне використання TЦА було пов’язано з підвищенням ризику ЦД 2 типу. Застосування АД інших груп не було пов’язано з підвищеним ризиком ЦД 2 типу (незалежно від тривалості використання та дози) [7].
Однак, незважаючи на можливі ризики, які зумовлюють АД у хворих, котрі не мають ЦД 2 типу, існують дослідження, що свідчать про їхній позитивний ефект на перебіг ЦД 2 типу у хворих із супутніми депресивними порушеннями.
В окремих дослідженнях виявлено, що лікування депресії у хворих на ЦД 2 типу сприятливо впливає на контроль рівня глікемії. Особливий стабілізувальний ефект, а також показники зниження рівня глюкози крові у хворих на ЦД 2 типу мають СІЗЗС [54].
За допомогою ретроспективного когортного випробування за участю 1399 пацієнтів виявлено, що хороший глікемічний контроль був досягнутий у 50,9% осіб із депресією, які отримували АД, проти 34,6% депресивних учасників, котрі їх не застосовували. Пацієнти, які отримували АД, мали вдвічі більшу достовірність (порівняно з тими, хто їх не використовував) досягти хорошого глікемічного контролю (ВШ 1,95; 95% ДІ 1,02-3,71) [6].
Ще в одному дослідженні використання АД для лікування депресії у хворих на ЦД 2 типу спричиняло значне зниження їхньої смертності (ВР 0,65; 95% ДІ 0,59-0,71). Подальший аналіз виявив, що зниження смертності відрізнялося залежно від групи АД, яка застосовувалася. Найбільше зниження визначалося в хворих, які отримували СІЗЗС (ВР 0,63; 95% ДІ 0,56-0,71), ІЗЗСН (ВР 0,58; 95% ДІ 0,44-0,78), ІЗЗДН (ВР 0,20; 95% ДІ 0,07-0,63), міртазапін (ВР 0,60; 95% ДІ 0,45-0,82), ТЦА (ВР 0,73; 95% ДІ 0,54-0,97), тразодон (ВР 0,52; 95% ДІ 0,29-0,91). Також було виявлено, що зворотні інгібітори МАО-А пов’язані зі збільшенням смертності пацієнтів, котрі страждали на ЦД 2 типу (ВР 1,48; 95% ДІ 1,09-1,99) [11].
З огляду на відповідні дослідження СІЗЗС можуть бути препаратами вибору для лікування депресивних порушень у хворих на ЦД 2 типу [54].
Можливі патогенетичні механізми позитивного та негативного впливу АД
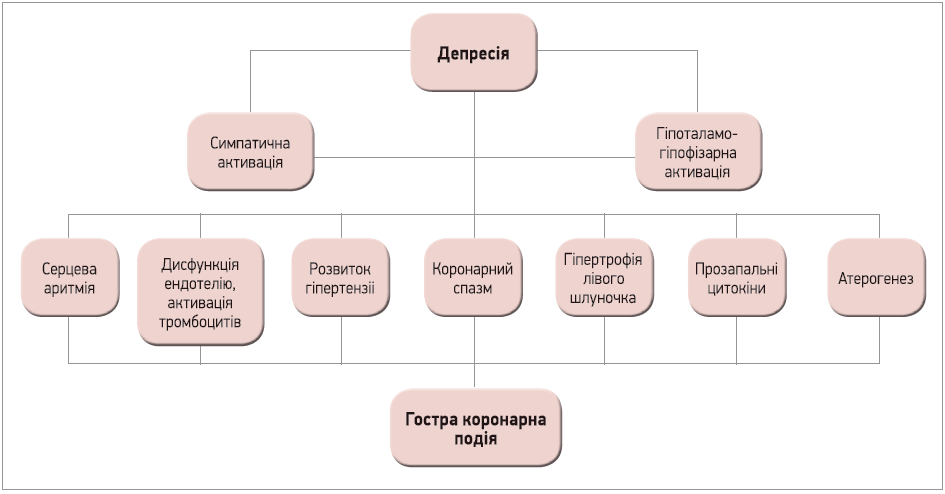
Основні механізми, що пов’язують депресію і ССЗ, є складними та багатофакторними, до котрих належать гіперактивація симпатичної нервової системи, гіперактивація тромбоцитів, запалення тощо (рис.) [17].
Рис. Механізми, що пов’язують депресію та СЗЗ (адаптовано згідно із Dhar A. K. і Barton D. A., 2016)
З огляду на такі взаємозв’язки використання АД може мати як лікувальний, так і профілактичний вплив на розвиток ССЗ і ЦВЗ, що і було виявлено в переважній більшості вищезазначених досліджень.
СІЗЗС можуть втручатися в кардіометаболічну фізіологію шляхом модуляції хронічного запалення, яке є одним із ключових патофізіологічних механізмів при ЦД 2 типу і ССЗ [22]. Хронічне запалення також тісно пов’язане з резистентністю до інсуліну й ожиріння – двома основними елементами МС [10]. Однак дозування необхідні для досягнення сприятливого впливу; їхня клінічна кореляція залишається суперечливою [10].
Існують дані, які свідчать про те, що активація імунозапальних механізмів відіграє значну роль у патофізіології розвитку великого депресивного розладу з підвищенням рівнів у сироватці крові прозапальних цитокінів і С-реактивного білка. Лікування АД суттєво зменшило периферичні рівні маркерів запалення, як-от IL‑6 (р<0,001), TNF (р=0,015), IL‑10 (р=0,012), хемокіну CCL‑2 (р=0,006) [34].
Дослідження на пацюках довели, що СІЗЗС зменшують атеросклеротичні зміни в ендотелії, визначені за допомогою зменшення експресії ендотеліальних адгезивних молекул (VCAM‑1). Рандомізоване клінічне випробування за участю людей продемонструвало, що в хворих із застійною серцевою недостатністю, які приймали сертралін, СІЗЗС, спостерігалося зниження експресії ендотеліальних адгезивних молекул (VCAM, ICAM) після 3-місячного впливу порівняно з пацієнтами, котрі отримували плацебо [8].
Есциталопрам може чинити деякий інгібувальний ефект на фермент, який відповідає за розщеплення жирів; він також може мати деяку активність щодо рецепторів ЛПНЩ [3].
Однак передбачається, що протизапальні ефекти з’являються в разі застосування доз, які є більшими за звичайний терапевтичний діапазон; СІЗЗС можуть бути прозапальними в разі використання (особливо тривалого) менших доз, оскільки фізіологічні рівні внутрішньоклітинного серотоніну зазвичай сприяють синтезу TNF та IL‑6 у макрофагах, тоді як супрафізіологічні рівні позаклітинного серотоніну можуть бути пов’язані зі зниженням регуляції серотонінових рецепторів, отже, зі зниженням вивільнення прозапальних цитокінів [10].
Що стосується цереброваскулярних патологій, то в більшості досліджень використання АД мають обнадійливі результати, особливо в період реабілітації після гострого інсульту, що пов’язано з низкою виявлених механізмів, які позитивно впливають на відновлення ушкоджених ділянок мозку та котрі не завжди пов’язані з антидепресивною дією.
Збільшуючи активність ГАМК, СІЗЗС можуть запобігати дисбалансу збудження та гальмування, що зазвичай погіршує нервову пластичність, а також регенерацію після інсульту. Однак вплив СІЗЗС щодо регуляції нервового збудження та гальмування є багатофакторним і складним. Відомо, що СІЗЗС посилюють клітинні захисні шляхи, котрі ініціюються під час ішемічного ушкодження, а також регулюють мозковий кровоток завдяки безпосередньому впливу на активність вазоактивних моноамінів. Ці два механізми зумовлюють поліпшення відновлення після інсульту та реабілітацію пацієнтів. На додаток до нейрорегенерації, пов’язаної з руховим навчанням і відновленням після інсульту, було встановлено позитивний вплив нейротрофічного мозкового фактора (BDNF) на процес відновлення мозку після інсульту, який також був причетний до позитивних ефектів АД при лікуванні депресії [19].
Тривале лікування СІЗЗС спричиняє стабільно підвищений рівень BDNF, що, своєю чергою, посилює місцеве гальмування і відновлює рівновагу між збудженням та гальмуванням [63].
Важливі механізми відновлення структурних і функціональних порушень після інсульту, які можуть мати АД, були встановлені на тваринних моделях ішемічного інсульту, до яких належать стимуляція нейрогенезу з міграцією новоутворених клітин до ішемізованих ділянок мозку, протизапальна дія (шляхом пригнічення пізньої стадії постішемічного запалення), покращення регуляції мозкового кровотоку, модуляція адренергічної нейрогормональної системи (центральне симпатоінгібування та послідовні зміни вегетативної серцево-судинної функції, як-от збільшення варіабельності серцевого ритму чи покращення вазомоторної реактивності) [64].
Явний захисний ефект СІЗЗС для профілактики ішемічних подій не залежить від супутнього лікування аспірином або іншими антитромботичними засобами. Основним механізмом антиагрегантної дії СІЗЗС є вплив на пригнічення активації тромбоцитів за рахунок зниження рівня тромбоцитарного серотоніну [43].
Що стосується механізмів негативного впливу АД на деякі складові МС (інсулінорезистентність, збільшення маси тіла), а також ризиків розвитку ЦД 2 типу, вони є недостатньо вивченими та потребують проведення подальших досліджень.
Результати експериментальних випробувань свідчать про те, що СІЗЗС – інгібітори функції білка субстрату рецептора інсуліну (IRS‑2) та дії інсуліну через активацію кінази IRS GSK3β. Інгібування дії IRS‑2 СІЗЗС асоціювалося з помітним пригніченням секреції інсуліну, стимульованого глюкозою з острівців підшлункової залози, активацією процесу апоптозу та загибелі β-клітин. З огляду на те, що СІЗЗС стимулюють резистентність до інсуліну, пригнічуючи його секрецію, ці засоби можуть прискорити перехід від інсулінорезистентного стану до явного діабету [31].
ТЦА мають властивості спричиняти зворотне захоплення норадреналіну шляхом пригнічення його транспортера. Інгібування транспортера зворотного захоплення норадреналіну збільшує утилізацію синаптичного норадреналіну безпосередньо шляхом сприяння глюконеогенезу та глікогенолізу. Деякі ТЦА мають високу спорідненість до мускаринових M3, блокування яких у β-клітинах пригнічує секрецію інсуліну й індукує гіперглікемію [45, 72].
Попередні клінічні дослідження продемонстрували, що амітриптилін, нортриптилін, іміпрамін та міртазапін пов’язані зі збільшенням маси тіла [40].
Антагонізм щодо серотонінергічних рецепторів 5-HT2C та гістамінергічних рецепторів H1 був ідентифікований як ключовий механізм, котрий сприяє цьому побічному ефекту [45].
Було висловлено припущення про те, що гістамінергічна система бере участь у контролі апетиту та харчовій поведінці. Ці гістамінергічні нейрони знаходяться в ділянці туберомамілярного ядра заднього гіпоталамуса. Продемонстровано, що гістамінергічні рецептори взаємодіють з орексигенними нейропептидами, як-от орексин А та грелін, що пов’язано з посиленням апетиту і збільшенням маси тіла, а також, навпаки, використання СІЗЗС флуоксетину пов’язане зі швидким зниженням маси тіла, що спричинено значним спорідненням (агонізм) із серотоніновими 5НТ2С-рецепторами, які відіграють роль у пригніченні апетиту [40].
Зменшення витрат калорій через седативну дію (пов’язану переважно з дією на Н1-гістамінові рецептори) та збільшення споживання калорійних напоїв через сухість у роті / горлі (зумовлену переважно дією на М-мускаринові рецептори), спричинену АД, також може сприяти збільшенню маси тіла [45].
Однією з побічних дій ТЦА (амітриптилін, іміпрамін тощо) на серцево-судинну систему може бути проаритмогенний ефект, який пов’язують із блокадою натрієвих каналів та дією на мускаринові рецептори, що спричиняє тахікардію й аритмогенну дію [65].
Слід також пам’ятати про можливість взаємодії лікарських препаратів. Хворі з тривожно-депресивними станами можуть мати супутні серцево-судинні та цереброваскулярні патології і систематично приймати засоби для їхнього лікування, які можуть взаємодіяти з АД і зумовлювати побічні ефекти (іноді вони є потенційно небезпечними для життя) (табл. 3) [49].
Висновки
АД є достатньо ефективними засобами для лікування тривожних і депресивних розладів у хворих на серцево-судинні та цереброваскулярні патології, однак їхнє використання потребує урахування деяких аспектів, а також ретельного контролю в окремих категорій пацієнтів.
Застосування АД асоціюється зі зниженням ризику (за деякими дослідженнями на 30%) появи гострих ССП (серцева смертність, інфаркт міокарда), що може свідчити про їхній профілактичний вплив у пацієнтів, які не мали в анамнезі гострих серцево-судинних патологій.
Використання АД у період гострого інфаркту міокарда пов’язане з вищою смертністю від усіх причин і є незалежним предиктором смертності. У хворих на хронічні серцеві захворювання застосування АД для лікування депресії може поліпшувати стан хворих і мати позитивний терапевтичний потенціал, оскільки депресія – незалежний фактор серцевого ризику. Однак слід уникати АД, що зумовлюють ортостатичну гіпотензію (це може погіршити перебіг стенокардії) та мають проаритмічний потенціал (наприклад, ТЦА, тразодон). Препаратами вибору у хворих із супутньою серцево-судинною патологією можуть бути СІЗЗС.
Загалом АД мають низький потенціал ризику проаритмогенної дії (особливо в хворих без супутньої серцево-судинної патології). Згідно з даними FDA, до категорії АД, які можуть підвищувати ризик появи серцевих аритмій, належать кломіпрамін, амітриптилін, іміпрамін, нортриптилін, моклобемід, циталопрам, есциталопрам і венлафаксин. Інші АД не асоційовані з розвитком серцевих аритмій.
АД можуть мати профілактичний потенціал щодо ішемічного інсульту як за рахунок зменшення депресії (як фактора ризику), так і за рахунок додаткових ефектів, характерних для деяких класів АД (антиагрегантний ефект для СІЗЗС), що потребує подальших досліджень. Вживання АД після ішемічного інсульту може поліпшити функціональні результати в пацієнтів, а також знизити смертність від усіх причин (незалежно від тяжкості). Однак використання АД може підвищувати ризик розвитку геморагічного інсульту, що є найхарактернішим для СІЗЗС і ІЗЗСН і менш характерним для ТЦА та полімодальних АД (тразодон, міртазапін, міансерин). Ризик особливо збільшений у 1-й міс застосування АД, який поступово зменшується в разі тривалішого використання.
Переважна більшість АД чинить нейтральний вплив на АТ і ЧСС; у деяких хворих можна спостерігати навіть його стабілізацію та зниження в процесі лікування АД. Певний ризик підвищення АТ може спостерігатися лише за використання ІЗЗСН (дулоксетин, венлафаксин), тоді як збільшення ЧСС відзначається при застосуванні ТЦА (амітриптилін, кломіпрамін тощо).
Вплив АД на окремі компоненти МС може залежати як від окремого препарату, так і від тривалості його використання. Збільшення маси тіла є найпоширенішим ефектом тривалого застосування АД, особливо ТЦА, міртазапіну, міансерину, меншою мірою – СІЗЗС (частіше при використанні пароксетину, циталопраму, есциталопраму). Тразодон ІЗЗСН і деякі СІЗЗС (сертралін, флувоксамін) мають переважно нейтральний ефект, а бупропіон, флуоксетин здатні спричиняти зниження маси тіла. АД (особливо ТЦА, меншою мірою – СІЗЗС) можуть збільшувати загальний холестерин і ЛПНЩ, тоді як флуоксетин і циталопрам особливо підвищують рівень ТГ. Відзначається нейтральний вплив більшості АД на ЛПВЩ, а для есциталопраму навіть його збільшення. Однак невідомо, наскільки ці зміни можуть вплинути на розвиток атеросклерозу чи збільшувати фактор ризику щодо ССЗ.
Більшість АД (особливо СІЗЗС, ІЗЗСН, ТЦА) значимо збільшують ризик появи ЦД 2 типу, який підвищується за тривалого застосування АД (згідно з дослідженнями тривалістю >6 міс або декілька років) і має дозозалежний ефект (що більшою є доза АД, то більший ризик появи ЦД 2 типу). У хворих з наявним ЦД 2 типу АД (особливо СІЗЗС) можуть сприяти покращенню контролю глікемії та зменшують смертність пацієнтів від його ускладнень.
Список літератури знаходиться в редакції.