26 січня, 2022
Омега-3 поліненасичені жирні кислоти: чому це працює?
За  останні 20 років відбулося помітне посилення наукового і суспільного інтересу до омега‑3 і омега‑6 поліненасичених жирних кислот (ω‑3 ПНЖК і ω‑6 ПНЖК відповідно) та їхнього впливу на здоров’я людини.
останні 20 років відбулося помітне посилення наукового і суспільного інтересу до омега‑3 і омега‑6 поліненасичених жирних кислот (ω‑3 ПНЖК і ω‑6 ПНЖК відповідно) та їхнього впливу на здоров’я людини.
ω‑3 ПНЖК були відкриті на початку XX ст. як корисні компоненти риб’ячого жиру. Свою назву вони отримали через значну кількість ненасичених С‑3 зв’язків у хімічній будові. Оскільки ці ненасичені зв’язки спостерігаються починаючи з позиції «-3», якщо відраховувати від кінця молекули (тобто від останнього атома, або «омега»), весь клас сполук називають ω‑3 ПНЖК (рис. 1).
Ще в 1944 р. H.M. Sinclair написав про рідкість випадків ішемічної хвороби серця (ІХС) серед гренландських ескімосів, у харчуванні яких переважали жирна риба, м’ясо тюленя і кита. Наприкінці 70-х років минулого століття данські вчені H.O. Bang і J. Dyerberg з’ясували, що, незважаючи на низьке споживання фруктів, овочів і складних вуглеводів, ескімоси Гренландії практично не страждають на серцево-судинні захворювання (ССЗ) і вирізняються міцним здоров’ям і довголіттям («Гренландський феномен»). Після аналізу складу жирних кислот (ЖК) у плазмі крові ескімосів був виявлений високий уміст пальмітинової, пальмітолеїнової і тимнодонової кислот, тоді як уміст лінолевої кислоти був нижче норми.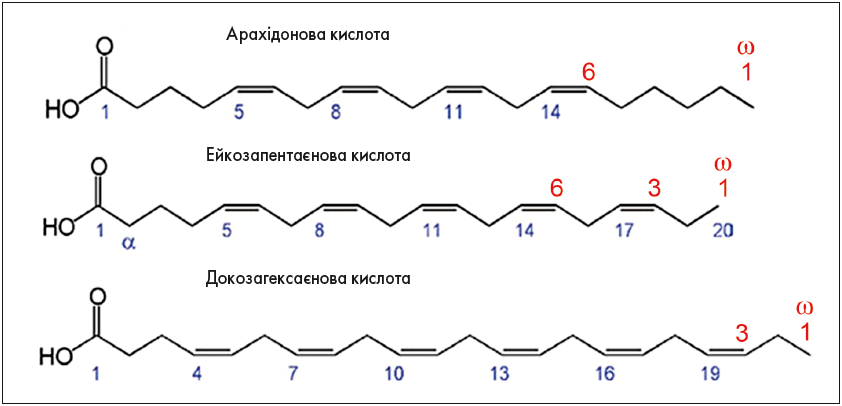
Рис. 1. Будова молекул ПНЖК
У західноєвропейских країнах і США рівень смертності від атеросклеротичних ССЗ, зокрема інфаркту міокарда (ІМ), залишається стало високим. Саме тому епідеміологічні дослідження були зосереджені на відмінностях у способі життя, зокрема в харчових звичках, у країнах, які відрізняються за рівнем захворюваності на атеросклероз-асоційований (АС) ІМ.
Дослідження, проведене в 7 країнах, встановило, що смертність від ІХС в Японії та країнах Середземномор’я нижча, ніж у США і країнах Північної Європи, і що далеко не останню роль у цьому грають ненасичені ЖК, на які багаті страви японської та середземноморської дієт.
А ось про що в цьому контексті свідчать результати епідеміологічного дослідження, проведеного серед гренландських інуїтів: низький рівень захворюваності на АСССЗ, тромбози і цукровий діабет (ЦД) 2 типу в цій етнічній групі пов’язаний із регулярним уживанням морської риби, багатої на ω‑3 ПНЖК.
Із метою створення глобальної світової карти забезпеченості населення різних країн ω‑3 ПНЖК було проведено системний аналіз 298 досліджень, в яких вивчали вміст у крові ейкозапентаєнової і докозагексаєнової кислот (ЕПК і ДГК). Регіони з високим рівнем ЕПК і ДГК в крові (>8%) охоплювали район Японського (Східного) моря, Скандинавію та райони з корінним населенням, не повністю адаптованим до західних звичок харчування. Дуже низькі рівні ЕПК і ДГК в крові (≤4%) спостерігали в жителів Північної, Центральної і Південної Америки, Європи, Близького Сходу, Південно-Східної Азії та Африканського континенту. Однак ці показники можуть бути пов’язані з іншими причинами. У багатьох суспільствах уживання риби асоціюється з кращим соціальним статусом і свідомим поглядом на життя.
Людина здатна синтезувати насичені і деякі мононенасичені ЖК з вуглеводних і білкових вуглецевих груп, однак через відсутність ферментів ω‑3 ПНЖК практично не синтезуються в організмі людини, тобто вони є есенціальними харчовими речовинами і мають надходити ззовні в адекватній кількості.
В організмі людини є шляхи метаболізму для утворення ДГК та ЕПК з попередника – незамінної жирної альфа-ліноленової кислоти (АЛК) – за допомогою серії реакцій десатурації (додавання подвійного зв’язку) і подовження (додавання двох атомів вуглецю). Ці реакції відбуваються за участю ферментів дельта‑6-десатурази (FADS2) і дельта‑5-десатурази (FADS1), проте ефективність такого синтезу невисока і має велику індивідуальну варіабельність. Встановлено наявність генетичних поліморфізмів генів FADS, які впливають на активність синтезу ПНЖК, зокрема гаплотип D підвищує активність FADS1 і FADS2, що сприяє ефективнішій конверсії АЛК їжі в ДГК і ЕПК. Поширення в популяції поліморфізмів FADS (до 30%) пояснює варіабельність рівнів ω‑3 ПНЖК у крові в людей, які проживають в одній географічній зоні. Завдяки естрогенам жінки здатні краще, ніж чоловіки, перетворювати АЛК на ω‑3 ПНЖК. Дослідження метаболізму АЛК у здорових молодих осіб чоловічої статі показує, що приблизно 8% АЛК з раціону перетворюється на ЕПК, а 0-4% – на ДГК. У здорових молодих жінок приблизно 21% АЛК з їжі перетворюється на ЕПК, а 9% – на ДГК. Вивчено процес конверсії ДГК в ЕПК, яка відбувається з низькою базальною швидкістю. Так, у групах практично здорових добровольців на звичайному раціоні і вегетаріанців, які протягом 6 тиж отримували ДГК без ЕПК (1,62 г/добу), рівні ЕПК і ДГК підвищилися у фосфоліпідах сироватки на 7,4-11,4%, а в тромбоцитах – на 12,3-13,8%.
Таким чином, здатність синтезувати як ДГК, так і ЕПК з АЛК в організмі людини є дуже варіабельною в окремих когортах, і її не можна розглядати як ефективну, тому ω‑3 ПНЖК мають надходити в організм ззовні у збалансованій і адекватній кількості. ω‑3 ПНЖК містяться в риб’ячому жирі, яєчному жовтку, лляному і кунжутному насінні, зародках вівса і пшениці, волоських горіхах, квасолі, капусті броколі тощо. Оптимальне споживання ω‑3 ПНЖК – 0,25 г/добу, проте середнє глобальне становить лише 0,10 г/добу. У Великій Британії обсяги споживання риби жирних сортів залишаються незмінними впродовж десятиріччя і становлять 50% від рекомендованої норми. Саме споживання риби відображає надходження ω‑3 ПНЖК, яке в ескімосів становить 3-4 г/добу, японців – 5-6 г/добу, австралійців – 0,189 г/добу та європейців – 0,25 г/добу. Аналіз даних Національного дослідження охорони здоров’я і харчування США за 2003-2008 рр. показав, що населення отримувало з їжею 0,17 г/добу (у середньому 0,11 г/добу) довголанцюгових ω‑3 ПНЖК, тобто менше рекомендованих 0,5 г/добу.
ω‑3 ПНЖК і ω‑6 ПНЖК метаболічно і функціонально відрізняються, часто мають протилежні фізіологічні ефекти, тому їх баланс у харчовому раціоні вкрай важливий. Баланс між ω‑3 ПНЖК і ω‑6 ПНЖК зберігався впродовж усієї історіїї людства. Однак стрімкі зміни в системі і звичках харчування, які відбулися за останні 100-150 років, – абсолютно нове явище в еволюції людини (рис. 2).
Сучасне сільське господарство, змінивши акценти у виробництві продуктів харчування, знизило вміст ω‑3 ПНЖК у м’ясі тварин, яйцях і навіть у рибі. Зокрема, жовток яйця від курки на вільному вигулі має співвідношення ω‑6:ω‑3 ПНЖК 1:3 проти 19:9 у жовтку яєць від курей, вирощених в агрокомплексах міністерства сільського господарства США. У раціоні харчування сучасного жителя більшості європейських країн міститься надмірна кількість ω‑6 і дуже низька – ω‑3 ПНЖК, що формує неадекватне співвідношення ω‑6:ω‑3 ПНЖК 20:1, а потрібно 1:1, як у раціоні первісної людини (рис. 2).
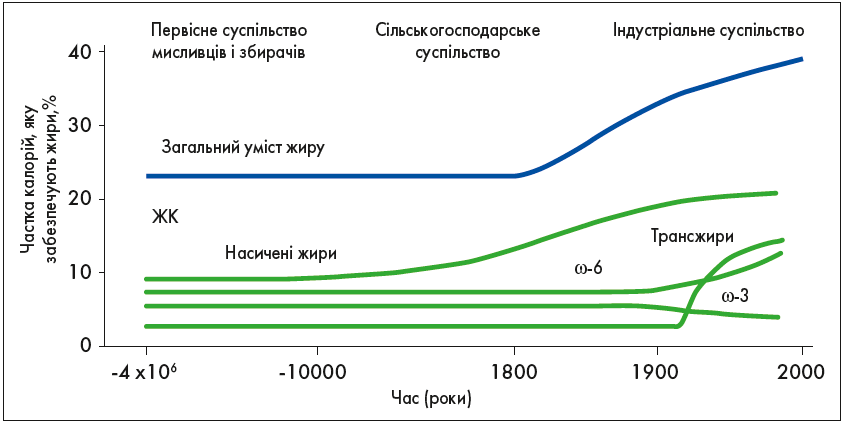 Рис. 2. Еволюційні аспекти дієти і споживання ПНЖК (Simopoulos A.P., 2001)
Рис. 2. Еволюційні аспекти дієти і споживання ПНЖК (Simopoulos A.P., 2001)
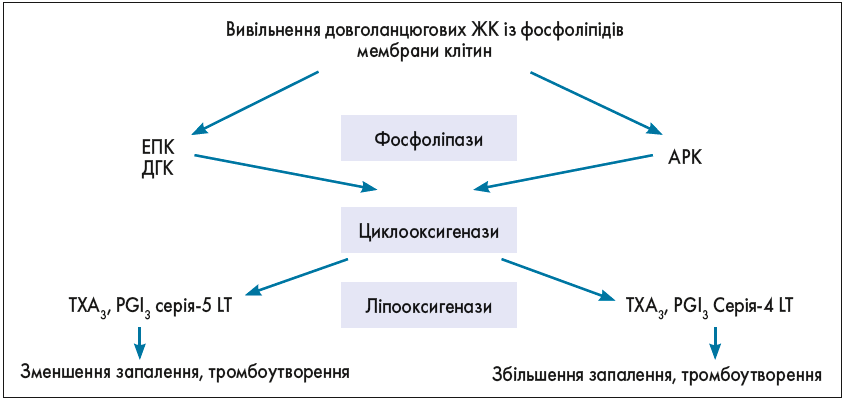
В організмі людей і тварин ПНЖК метаболізуються до важливих сигнальних молекул – ейкозаноїдів і докозаноїдів. Саме з арахідонової кислоти (АРК), яка є різновидом ω‑6 ПНЖК і значна кількість якої міститься у фосфоліпідах клітинних мембран, передусім у головному мозку, утворюються всі форми ейкозаноїдів (простагландини – PG, лейкотрієни – LT, простацикліни і тромбоксани – ТХ), що опосередковують запальні реакції. Біотрансформація АРК відбувається за допомогою сукупності хімічних реакцій, відомих як «каскад арахідонової кислоти».
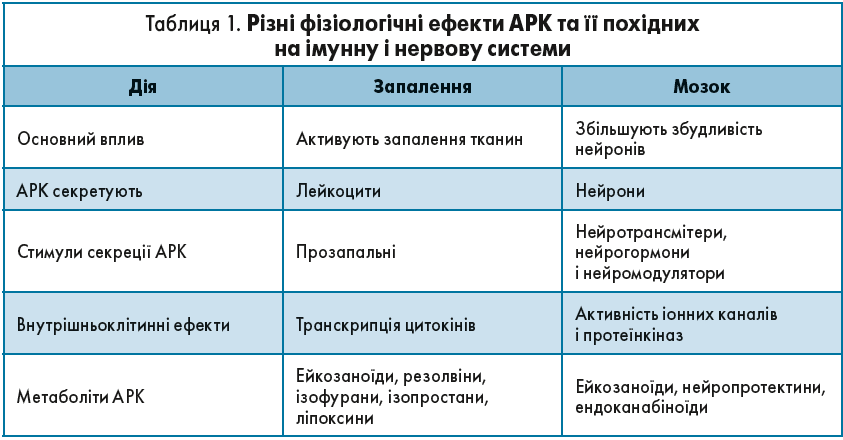
Сигнальні молекули, що утворюються під час перетворень АРК, контролюють функціонування імунної та нервової систем (рис. 3).
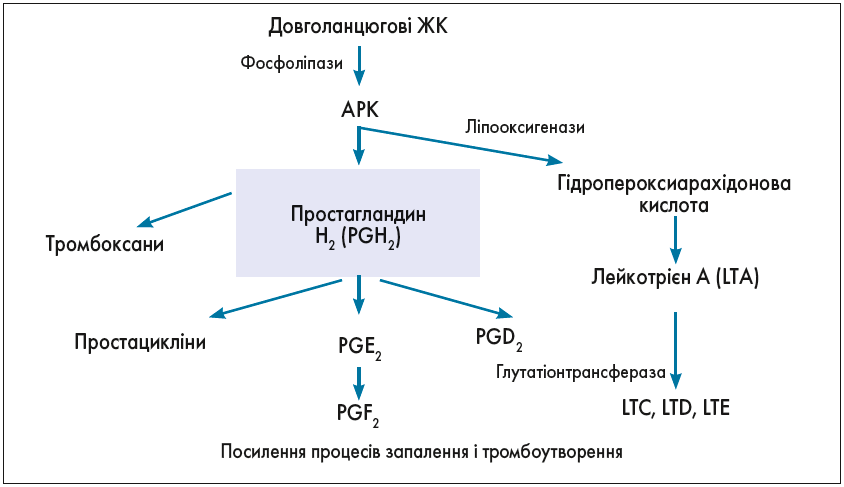 Рис. 3. Каскад біотрансформації АРК
Рис. 3. Каскад біотрансформації АРК
Довголанцюгові ω‑3 ПНЖК, до яких належать АЛК, ЕПК і ДГК, регулюють ліпідний обмін, чинять протизапальну і кардіопротекторну дію, сприяють пролонгації вагітності і поліпшують когнітивні здібності людини.
Основний механізм дії ω‑3 ПНЖК – гальмування каскаду АРК і синтез протизапальних ейкозаноїдів (рис. 4).
Рис. 4. Схема гальмування каскаду АРК за участю ω-3 ПНЖК
Дослідження з експериментальної фармакології підтверджують цей механізм для ДГК і вказують на низку інших позитивних ефектів ДГК на молекулярному рівні, які стосуються антиапоптотичних та імуномодулювальних властивостей ДГК та її похідних. Встановлено, що регулярне застосування ДГК (400 мг/добу) сприяє збільшенню кількості лімфоцитів і стійкості моноцитів до апоптозу.
Такі продукти ω‑6 ПНЖК, як PGE2 і LTB4, синтезовані з АРК, є потужнішими активаторами тромбозу і запалення, ніж аналогічні продукти ω‑3 ПНЖК – PGE3 і LTB5, синтезовані з ЕПК (табл. 1).
ЕПК і ДГК здатні частково пригнічувати патофізіологічні механізми запалення, у тому числі хемотаксис лейкоцитів, експресію молекул адгезії та лейкоцит-ендотеліальні адгезивні взаємодії, продукцію ейкозаноїдів, прозапальних цитокінів і реактивність Т-хелперів 1 типу.
Механізмами, які лежать в основі протизапальної дії ω‑3 ПНЖК, є: вплив на клітинні мембрани зі зміною складу і властивостей фосфоліпідів, руйнування ліпідних рафтів; пригнічення активації прозапального ядерного транскрипційного фактора NF-kB, що призводить до зниження експресії генів прозапальних цитокінів. Експерименти на тваринах продемонстрували користь застосування ω‑3 ПНЖК на моделях ревматоїдного артриту, запальних захворювань кишечнику і бронхіальної астми.
З ω‑3 ПНЖК утворюється широкий спектр протизапальних молекул – резолвінів, які сприяють нормальному фізіологічному припиненню запалення при ЦД. Наприклад, прийом ω‑3 ПНЖК у дозі 2720 мг/добу в рандомізованому дослідженні за участю 84 пацієнтів (віком від 45 до 85 років) із ЦД 2 типу привів до зниження рівнів прозапальних медіаторів – інтерлейкіну‑2, фактора некрозу пухлини-α – у плазмі, порівнюючи з контрольною групою.
З’ясовано, що ω‑3 ПНЖК – потужні антиоксиданти, які чинять комплексну протизапальну і нейропротекторну дію, сприяють нормалізації ліпідного профілю, гальмують розвиток і прогресування атеросклерозу, регулюють концентрацію факторів запалення в кардіоміоцитах, виявляють антиаритмічні властивості, сприяють зниженню в’язкості крові, відновлюють еластичність і тонус судин, знижують ризик розвитку ІХС, раптової коронарної смерті, гострого ІМ тощо.
Імовірні механізми антиаритмічного ефекту ω‑3 ПНЖК полягають у зміні активності натрієвих, калієвих і кальцієвих каналів L-типу, оскільки фізико-хімічні особливості ω‑3 ПНЖК дають їм можливість вбудовуватись або в ділянки подвійного шару фосфоліпідів, які розташовані поряд з іонними каналами, або безпосередньо в гідрофобні структури білків іонних каналів.
ω‑3 ПНЖК пригнічують секрецію альдостерону, що може бути пов’язаним зі змінами внутрішньоклітинного сигналу трансдукції, ступенем в’язкості плазми крові або зі впливом на активність ангіотензинперетворювального ферменту (АПФ). Пригнічення активності АПФ призводить до зменшення продукції ангіотензину II, розширення судин і зниження секреції альдостерону. В експериментальному дослідженні показано, що ω‑3 ПНЖК сприяють збільшенню продукції оксиду азоту ендотелієм судин, що також сприяє їх розширенню.
Ефекти ДГК на серцеву-судинну систему (ССС) проявляються як через безпосереднє зменшення запалення і пов’язаного з ним атеросклерозу, так і через антиаритмічний ефект і нормалізацію ліпідного профілю шляхом зниження рівня тригліцеридів (ТГ). Рівні ДГК також позитивно корелюють із рівнями гомоцистеїну і фолієвої кислоти в плазмі крові.
Довголанцюгові ω‑3 ПНЖК є важливими структурними компонентами клітинної мембрани, які визначають її властивості: плинність, гнучкість, проникність, а також активність мембранопов’язаних ферментів. Як доповнення до ендогенного метаболізму споживання ЖК може модифікувати склад і молекулярну структуру клітинних мембран. Результатом збільшення споживання ω‑3 ПНЖК є підвищення їхнього вмісту в еритроцитах, імунних клітинах та інших типах клітин організму людини. ДГК вибірково вбудовується в мембрани сітківки і постсинаптичних нейронних клітин і відіграє важливу роль у функціях зору і в роботі нервової системи.
Результати експериментальних досліджень на клітинних лініях тварин показують, що ω‑3 ПНЖК можуть модулювати експресію цілої низки генів, у тому числі пов’язаних із метаболізмом ЖК і запаленням. ω‑3 ПНЖК регулюють експресію гена або шляхом безпосередньої взаємодії зі специфічними факторами транскрипції, такими як рецептори, що активуються проліфераторами пероксисом (PPARs), або завдяки регуляції низки транскрипційних факторів в ядрі клітини.
Експериментальні й клінічні дослідження довели перспективність використання ω‑3 ПНЖК у профілактиці і лікуванні ожиріння та асоційованих із ним метаболічних захворювань.
Так, у дослідженнях in vivo показано, що ω‑3 і ω‑6 ПНЖК антагоністично впливають на адипогенез, гомеостаз ліпідів і системне запалення. Метаболіти АРК відіграють важливу роль в остаточній диференціації преадипоцитів до зрілих адипоцитів, яка може бути пригнічена ω‑3 ПНЖК на декількох етапах. ω‑6 ПНЖК підвищують уміст ТГ у клітинах, проникність клітинних мембран, тоді як ω‑3 ПНЖК зменшують відкладення жиру в жировій тканині, пригнічуючи ліпогенні ферменти та активуючи процес деградації ЖК, основного джерела енергії для синтезу аденозинтрифосфорної кислоти. З’ясовано, що ω‑3 і ω‑6 ПНЖК по-різному модулюють функціонування вісі «мозок-кишечник-жирова тканина».
У дослідженнях продемонстровано дозозалежне зменшення маси вісцерального (епідидимального і/або ретроперитонеального) жиру в щурів, які отримували раціон харчування з високим умістом ω‑3 ПНЖК. Зменшення маси вісцерального жиру пов’язують зі зменшенням розміру адипоцитів та їх кількості. Водночас харчовий раціон із високим умістом ω‑6 ПНЖК підвищував ризик лептинорезистентності, ЦД 2 типу й ожиріння як у людини, так і в дослідних тварин. Низка випробувань надає переконливі докази впливу ω‑3 ПНЖК на зменшення маси тіла і відчуття голоду.
Американська діабетологічна асоціація (ADA) рекомендує дотримуватися середземноморської дієти, збагаченої ω‑3 ПНЖК. Метааналіз 50 клінічних проспективних і перехресних досліджень довів позитивну протекторну дію середземноморської дієти на компоненти метаболічного синдрому: окружність талії, рівні холестерину ліпопротеїнів високої щільності (ХС-ЛПВЩ), ТГ, глікемії та артеріальний тиск тощо. Встановлено, що високий індекс маси тіла в дорослих пацієнтів асоціюється з низькою концентрацією ω‑3 ПНЖК у плазмі крові.
У суспільстві поширена думка про безумовну користь ω‑3 ПНЖК для ССС. Національний інститут здоров’я і клінічної досконалості (NICE) Великої Британії заохочує населення до споживання риби, але не рекомендує вживати дієтичні добавки – «особам із ССЗ або з високим ризиком їх розвитку треба рекомендувати споживати принаймні 2 порції жирної риби на тиждень». Водночас у рекомендаціях NICE зазначено, що ω‑3 ПНЖК «не варто пропонувати для первинної або вторинної профілактики ССЗ». Американська кардіологічна асоціація (AHA) також «рекомендує вживати рибу (особливо жирну) принаймні двічі на тиждень», що відповідає споживанню ω‑3 ПНЖК у дозі 0,2-0,4 г/добу; дві порції жирної риби забезпечують приблизно 500 мг ЕПК/ДГК. Хоча AHA декларує, що краще споживати ω‑3 ПНЖК з їжею, згадана Асоціація проявляє більш лояльне ставлення до дієтичних добавок з ω‑3 ПНЖК – «хворі на ІХС, можливо, не отримують достатньої кількості ω‑3 ПНЖК лише з харчового раціону, тому за рекомендацією лікаря можуть бути призначені дієтичні добавки».
Передбачається, що збільшення споживання ω‑3 ПНЖК може сприяти зниженню ризику ССЗ завдяки таким ефектам: запобігання аритміям, здатним спричинити раптову серцеву смерть, зниження ризику тромбозу, наслідком якого може бути ІМ або інсульт, уповільнення росту атеросклеротичної бляшки, поліпшення ендотеліальної функції та помірна гіпотензивна дія.
В огляді 79 рандомізованих досліджень (n=112 059) проаналізовано ефекти додаткового споживання ω‑3 ПНЖК при ССЗ. Показано, що додатковий прийом ЕПК і ДГК практично не впливає на загальну смертність і смертність від серцево-судинних подій. Однак результати метааналізу продемонстрували, що ЕПК і ДГК значуще знижують рівень ТГ у сироватці крові і підвищують рівень ХС-ЛПВЩ, а також дещо знижують ризик виникнення порушень серцевого ритму. Необхідно зазначити, що значна частина досліджень, включених у цей метааналіз, була проведена за участю пацієнтів з уже наявними ССЗ, що є серйозним фактором, який обмежує екстраполяцію результатів на профілактику ССЗ.
Рандомізовані дослідження типу «випадок-контроль» і проспективні випробування показали, що прийом ω‑3 ПНЖК дійсно знижує ризик ІМ і раптової зупинки серця. Наприклад, дослідження GISSI-Prevenzione, в якому спостерігали за 11 324 пацієнтами протягом 3,5 року, показало ефективність етилових ефірів ω‑3 ПНЖК у зниженні смертності в пацієнтів після недавнього ІМ. Позитивний ефект терапії спостерігався незалежно від супутніх патологій, звичок або інших видів терапевтичного втручання в разі прийому ω‑3 ПНЖК у дозі 1000 мг/добу.
Для об’єктивізації думки щодо користі ω‑3 ПНЖК необхідно також зазначити, що 10-річні дослідження доводять позитивне клінічне значення адекватного споживання ω‑3 ПНЖК у профілактиці й лікуванні ССЗ. Так, американське багатоцентрове проспективне обсерваційне когортне дослідження за участю 2692 дорослих пацієнтів віком від 65 років виявило прямий зв’язок між умістом ω‑3 ПНЖК у фосфоліпідах і серцево-судинною смертністю. Вищий уміст ω‑3 ПНЖК у фосфоліпідах асоціювався з нижчою загальною смертністю (відносний ризик (ВР) 0,73; 95% ДІ 0,61-0,86). Зниження ризику серцево-судинної смертності на тлі вищого вмісту циркулювальної ДГК переважно пояснюється меншою кількістю смертей унаслідок аритмії (ВР 0,52; 95% ДІ 0,31-0,86).
Метааналіз 17 когортних досліджень за участю 315 812 осіб продемонстрував, що позитивний вплив низького (1 порція/тиж) і помірного (2-4 порції/тиж) споживання риби на профілактику смертності від ІХС є малозначущим. Порівняння найнижчого споживання риби (<1 порція/міс) зі споживанням 1 і 2-4 порцій на тиждень показало зниження ризику смерті від ІХС в 16 разів (ВР 0,84; 95% ДІ 0,75-0,95) і на 21% (ВР 0,79; 95% ДІ 0,67-0,92) відповідно.
Наприкінці 2020 року були оприлюднені результати дослідження ОМЕМІ, в якому застосовували ЕПК і ДГК в добовій дозі 1,8 г на додаток до стандартної терапії в пацієнтів літнього віку (70-82 роки) після гострого ІМ (2-8 тиж). Статистично значущої різниці в результатах між групами лікування і групами плацебо не було, що можна пояснити недостатнім дозуванням ω‑3 ПНЖК.
У дослідженні DART 2033 особи після перенесеного ІМ перебували під контролем протягом 2 років. Доведено, що в групі хворих із підвищеним споживанням риби (для досягнення щоденного споживання ЕПК і ДГК у дозі приблизно 900 мг) спостерігали зниження смертності від усіх причин на 29% і частоти повторного ІМ на 32%.
У досліджені JELIS за участю 18 645 пацієнтів із гіперліпідемією, які отримували гіполіпідемічну терапію статином або статином у комбінації з ЕПК у дозі 1,8 г/добу, показано, що через 5 років комбінованого лікування відбулося значне зниження первинної комбінованої кінцевої точки (смерть, реваскуляризація, ІМ і нестабільна стенокардія) – на 19%. Найбільше зниження відносного ризику серцево-судинних подій – на 53% – спостерігали в пацієнтів із гіпертригліцеридемією та гіпо-α-холестеринемією.
Доведено, що ω‑3 ПНЖК підвищують чутливість тромбоцитів до субтерапевтичних доз антикоагулянтної терапії, зокрема до ацетилсаліцилової кислоти (АСК). Нещодавно вченими було зазначено, що реакція пацієнтів на АСК для антикоагулянтної терапії значуще варіює, а частка пацієнтів із низькою відповіддю на АСК або резистентністю до неї оцінюється в діапазоні від <1 до 45%. Однак доведено, що в пацієнтів з ІХС, які приймають низькі дози АСК, дієтичні добавки з ЕПК/ДГК так само ефективні, як і підвищення дози АСК до 325 мг/добу.
Загалом результати досліджень доводять користь споживання риби або риб’ячого жиру, адже воно знижує ризик смертності від ІХС, у тому числі ІМ з летальним результатом і раптової серцевої смерті. Ці ефекти зіставні в осіб і чоловічої, і жіночої статі, різного віку і не залежать від расової/етнічної приналежності.
Рекомендації різних експертних товариств, зокрема AHA і ADA, передбачають для первинної профілактики ССЗ підтримання добового споживання ДГК і ЕПК в дозовому діапазоні 300-600 мг, для вторинної профілактики – 900-1200 мг/добу, для корекції гіпертригліцеридемії – 3000-4000 мг/добу. Рекомендованої добової дози ω‑3 ПНЖК можна досягати за рахунок збільшення споживання риби жирних сортів; однак для корекції гіпертригліцеридемії дієтичні добавки ЕПК і ДГК все ж таки необхідні.
З огляду на позитивні результати дослідження REDUCE-IT Європейське кардіологічне товариство і Європейське товариство атеросклерозу опублікували оновлені Клінічні практичні рекомендації з лікування дисліпідемій, в яких пропонують «пацієнтам високого ризику з рівнем ТГ 1,5-5,6 ммоль/л, незважаючи на лікування статинами, вживати дієтичну добавку ω‑3 ПНЖК у дозі 4000 мг/добу».
Нарешті позиція Національної ліпідної асоціації (NLA – National Lipid Association) полягає в тому, що для пацієнтів віком ≥45 років із доведеними атеросклеротичними ССЗ або віком ≥50 років із ЦД 2 типу з ≥1 фактором ризику ССЗ і рівнем ТГ натще 135-499 мг/дл, які отримують максимальні дози статинів, рекомендовано призначати етиловий ефір ЕПК. 2017 року AHA посилила свою попередню підтримку доцільності використання ЕПК/ДГК у пацієнтів із ССЗ і розширила рекомендації для пацієнтів з ІХС з нещодавнім ІМ – «лікування дієтичними добавками ω‑3 ПНЖК є розумним для цих пацієнтів; навіть потенційне зниження смертності від ІХС на 10% у зазначеній клінічній популяції виправдовує лікування за допомогою порівняно безпечної терапії».
Розглядають такі механізми профілактичного впливу ω‑3 ПНЖК щодо розвитку ССЗ: за рахунок вбудовування в клітинну мембрану вони здатні змінювати конфігурацію натрієвих каналів; завдяки трансмембранній дії подовжують абсолютний рефрактерний період і скорочують відносний рефрактерний період міокарда аналогічно до дії антиаритмічних лікарських засобів III класу, зменшують проникність ендотелію судин, судинну реакцію на ангіотензин II і норадреналін, збільшують ендотелійзалежну дилатацію судин і підвищують продукцію оксиду азоту. Додавання ω‑3 ПНЖК (1 г/добу) до комплексної терапії пацієнтів із нестабільною стенокардією сприяє зниженню шлуночкової аритмічної активності, а також підвищенню загального резерву нейрогуморальної регуляції.
ω‑3 індекс – виражене у відсотках відношення сумарного вмісту ЕПК і ДГК в мембранах еритроцитів до загальної кількості в них ЖК. Обсерваційні дослідження показали, що низький ω‑3 індекс пов’язаний із вищим ризиком розвитку ІХС. Зміна співвідношення ω‑3:ω‑6 ПНЖК призводить до зміни співвідношень концентрацій різних LT і простагландинів, спричинюючи тим самим різні фізіологічні ефекти.
Доведено, що незбалансоване співвідношення ω‑3:ω‑6 ПНЖК чинить протромботичну і прозапальну дію, призводить до розвитку атеросклерозу, ожиріння і ЦД 2 типу. У разі ССЗ співвідношення ω‑3:ω‑6 ПНЖК 4:1 сприяє зниженню смертності на 70%. Дехто з дослідників пропонує використовувати ω‑3 індекс як маркер для додаткового визначення ризику ССЗ. Запропоновано такі градації ω‑3 індексу: <4% – високий ризик ССЗ, 4-8% – проміжний, >8% – низький. Однак перед введенням ω‑3 індексу в рутинну клінічну практику необхідно встановити його контрольні значення в популяції. Доведено, що значуще підвищення ω‑3 індексу залежить від застосованих добових доз ЕПК і ДГК. Низька варіабельність ω‑3 індексу пов’язана з тим, що період напіввиведення еритроцитарних ЕПК і ДГК в 4-6 разів більший за такий сироваткових. Крім того, уміст ЖК у мембрані еритроцита не залежить від постійних змін ліпідного спектра на відміну від умісту ЖК у плазмі; це сприяє тому, що ω‑3 індекс не змінюється прандіально. На відміну від інших оцінок рівнів ЕПК і ДГК ω‑3 індекс корелює з їхніми рівнями в серцевому м’язі. Тому ω‑3 індекс вважається найоб’єктивнішим довгостроковим параметром, що відображає статус ЕПК і ДГК, тоді як короткотривале споживання краще відображається в змінах концентрації ЖК у плазмі.
На сьогодні досі не встановлено дозу ЕПК і ДГК для підтримання певного рівня ω‑3 індексу, що пов’язано з різними факторами, наприклад різною фармакокінетикою лікарських засобів. 2015 року проведено дослідження, метою якого було визначення дози ЕПК і ДГК для досягення цільового рівня ω‑3 індексу (>8%). Встановлено, що сумарної дози ЕПК і ДГК 3500 мг/добу протягом 2 міс достатньо для досягнення мети, тоді як добова доза 2000 мг виявилася недостатньою. На рівень ω‑3 індексу, поряд зі споживанням ЕПК і ДГК, також впливають вік (+0,50% на кожне десятиріччя), наявність ЦД (-1,13% за його наявності), ІМТ (-0,30% на кожні 3 одиниці вище норми), стать, фізична активність та інші фактори (соціальний статус, зловживання алкоголем).
Метааналіз на основі 16 проспективних досліджень за участю 402 127 осіб показав, що збільшення споживання риби пов’язане зі зниженим ризиком ішемічного, але не геморагічного, інсульту. Згідно з цим аналізом споживання риби навіть 1 раз на тиждень може значно знизити ризик ішемічного інсульту. Метааналіз 8 проспективних досліджень виявив наявність нелінійного зв’язку між споживанням ω‑3 ПНЖК і ризиком інсульту – його знижував помірний прийом ω‑3 ПНЖК у дозі 200-400 мг/добу.
Встановлено, що ω‑3 ПНЖК відіграють роль у розвитку атеросклерозу та захворювань периферійних артерій. Вважається, що ЕПК і ДГК покращують стабільність бляшок, зменшують активацію ендотелію і проникність судин, тим самим зменшуючи ймовірність небажаних серцево-судинних подій.
Показано, що харчові добавки ЕПК і ДГК покращують функцію ендотелію в пацієнтів із захворюваннями периферійних артерій шляхом зниження рівня розчинного тромбомодуліну в плазмі крові з 33,0 до 17,0 мкг/л (р=0,04).
Метааналіз 24 клінічних досліджень показав, що у хворих на ЦД 2 типу в разі додавання в раціон дієтичних добавок ω‑3 ПНЖК в дозі 2,4 г/добу протягом 24 тиж рівень ТГ знижувався на 7%, фібриногену – на 10%, колагену – на 21%, а рівень ХС-ЛПВЩ підвищувався на 3%, якщо порівняти з групою плацебо. При цьому рівні глікемії, інсулінемії та біомаркерів запалення суттєво не змінювалися. Після закінчення 20-річного дослідження фінські вчені навели нові докази, що розкривають потенціал ω‑3 ПНЖК у зниженні ризику розвитку ЦД 2 типу.
Показано, що в чоловіків, які вживали дві порції риби на тиждень, ризик розвитку ЦД 2 типу знижувався на 33% проти групи контролю.
Дані обсерваційних досліджень, проведених у різних країнах, свідчать про зворотний зв’язок між споживанням морепродуктів і частотою виникнення глибокої депресії і біполярного розладу. У кількох невеликих дослідженнях показано, що концентрації ω‑3 ПНЖК в плазмі і жировій тканині хворих на депресію нижчі за такі в контрольній групі. Висловлено припущення, що ω‑3 ПНЖК знижують частоту виникнення депресії завдяки модуляції нейрональних сигнальних шляхів і продукції ейкозаноїдів.
Особливої уваги заслуговує застосування ω‑3 ПНЖК в акушерстві і гінекології, оскільки вони входять до складу тканин головного мозку і можуть бути важливими для розвитку плода. ω‑3 ПНЖК ефективно застосовують як для забезпечення нормального виношування, так і для своєчасної профілактики і лікування ускладнень вагітності.
Підвищена схильність до тромбоутворення відіграє значну роль в етіології не тільки серцево-судинних, церебро-васкулярних, а й акушерсько-гінекологічних захворювань. ω‑3 ПНЖК впливають на більшість цих факторів завдяки своїм значущим дезагрегаційним і антикоагулянтним властивостям (рис. 5).
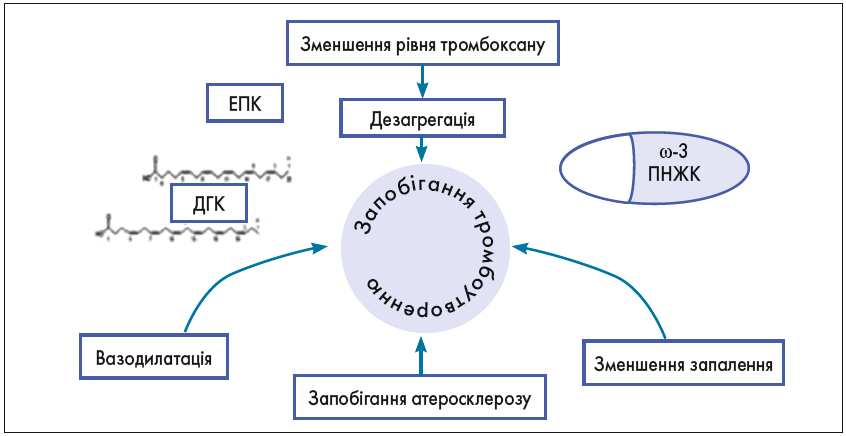 Рис. 5. Механізм профілактичного впливу ω-3 ПНЖК на розвиток тромбоемболії
Рис. 5. Механізм профілактичного впливу ω-3 ПНЖК на розвиток тромбоемболії
В акушерсько-гінекологічній практиці вплив ω‑3 ПНЖК на коагуляцію на молекулярному рівні сприяє ефективнішому веденню пацієнток із тромбозами, прееклампсією, флебопатіями, порушеннями матково-плацентарного кровотоку, а також суттєво сприяє формуванню головного мозку плода.
Не менш ніж 35% жінок страждає на післяпологову депресію. Зниження ризику її розвитку пов’язано з позитивним впливом ω‑3 ПНЖК на метаболізм серотоніну – нейротрансмітера, із недостатнім синтезом якого пов’язують розвиток згаданого стану. У жінок серотоніновий тип депресії спостерігають частіше, ніж у чоловіків. Експериментальні дослідження виявили зв’язок між дефіцитом ω‑3 ПНЖК у харчуванні з рівнем серотоніну, стресом і депресією.
У багатьох країнах запроваджено свої норми споживання вагітними ω‑3 ПНЖК як есенціального мікронутрієнта – від 0,5 до 3,0 г/добу. При цьому споживання ЕПК і ДГК має бути не менше 500 мг/добу, а відношення ЕПК:ДГК – 2:1. У період виношування дитини жінки-вегетаріанки і вегани продовжують уникати риби, ключового джерела ЕПК і ДГК, що ставить під загрозу стан здоров’я майбутньої матері і може стати причиною порушень розвитку плода. У вагітних жінок-вегетаріанок і веганів зазвичай низький рівень ЕПК і ДГК у плазмі крові і, як наслідок, низький ω‑3 індекс. Тому багато авторитетних медичних видань, експертних спільнот і наукових організацій наполегливо рекомендують вагітним вживати додатково 200 мг/добу ДГК, наприклад, у вигляді морської риби жирних сортів 1 раз на тиждень.
З огляду на низьку забезпеченість ω‑3 ПНЖК у більшості вагітних, стає очевидною необхідність використання спеціальних препаратів на основі ω‑3 ПНЖК. На жаль, під маркою ω‑3 ПНЖК можуть активно просуватися препарати риб’ячого жиру недостатнього ступеня очищення, із дуже неприємним запахом, який провокує у вагітних нудоту, без доказової бази і навіть офіційного дозволу до використання під час вагітності. Тому гостро стоїть питання щодо вибору насправді якісного і безпечного препарату ω‑3 ПНЖК і, що не менш важливо, найбільш відповідного його дозування в кожному конкретному випадку. Зауважимо, що традиційна «обережність» до впровадження нових лікарських препаратів в акушерсько-гінекологічну практику часто переноситься на харчові добавки на основі вітамінів, мікроелементів та ω‑3 ПНЖК. Уже понад 30 років ефекти ω‑3 ПНЖК досліджують у кардіології та терапії і отримали доказовість класу «А», наприклад, для профілактики ССЗ, а ось в акушерській галузі їх впровадження тільки починається.
ω‑3 ПНЖК впливають на зростання і формування плода. Щоденний прийом 1200 мг ω‑3 ПНЖК на ранньому терміні вагітності в групі 208 здорових вагітних жінок сприяв значущому підвищенню вмісту ДГК в еритроцитах, а вищий рівень ДГК в еритроцитах на 32-му тиж вагітності позитивно корелював із нормальною, а не зниженою, масою тіла дитини при народженні. Варто зазначити, що надлишок ω‑3 ПНЖК (перевищення добових доз більш ніж учетверо) при виношуванні небажаний. Дослідження 2109 вагітних указало на можливість зниження маси тіла плода при народженні (на 23-166 г) в разі застосування дуже високих доз ω‑3 ПНЖК (>3-5 г/добу), тобто при перевищенні добових потреб у 4-10 разів.
Дослідження, проведене в Данії, за участю 12 373 вагітних показало, що низькі концентрації ω‑3 ПНЖК у плазмі пов’язані з нижчою масою тіла новонароджених (відношення шансів становило 1,4). Збільшення рівня ω‑3 ПНЖК на 1% відповідало збільшенню терміну виношування на 1,5 дня. Дослідження за участю 533 вагітних виявило, що прийом 2700 мг/добу ω‑3 ПНЖК збільшує тривалість гестації на 6,4 дня. Доведено, що у вагітних, які приймали 1600 мг ЕПК і 1100 мг ДГК (перевищення добових потреб у 3-4 рази), поширеність харчової алергії була нижчою в групі ω‑3 ПНЖК (2%) проти групи плацебо (15%).
Синдром полікістозних яєчників (СПКЯ) – поширений розлад ендокринної функції в жінок, пов’язаний із суттєвим підвищенням ризику розвитку ЦД 2 типу і ССЗ. Доведено, що прийом 1200 мг/добу ω‑3 ПНЖК упродовж 8 тиж у групі пацієнток із СПКЯ у порівнянні з плацебо сприяв значному збільшенню сироваткових рівнів адипонектину, ХС-ЛПВЩ, зниженню рівня інсуліну, загального ХС, ТГ і ХС ліпопротеїнів низької щільності, якщо порівнювати з показниками учасників із групи плацебо.
Оскільки ω‑3 ПНЖК у великій кількості синтезуються фітопланктоном, який є традиційним джерелом харчування для морських риб та інших морських тварин, що живуть у холодних арктичних водах, риба і деякі морепродукти є продуктами першої лінії для забезпечення організму людини корисними ЖК. ПНЖК містяться в рослинній олії (лляна, соєва, із насіння хрестоцвітних), проте ω‑3 ПЖНК у ній практично відсутні. Олія криля містить як ЕПК, так і ДГК і вважається порівнянною з риб’ячим жиром джерелом ω‑3 ПНЖК.
У 80-х роках ХХ ст. були розроблені технології отримання риб’ячого жиру з жирової тканини рибної туші. Вдосконалення методів переробки дало можливість повністю позбутися токсинів, що містилися в рибі. Треба розрізняти такі терміни, як риб’ячий і рибний жир.
Риб’ячий жир – це витяжка з печінки риб, тому може містити токсини. Через те що більшість ЖК міститься у формі ТГ, цей продукт має низьку біодоступність за ω‑3 ПНЖК. Рибний жир видобувається з тушки риб, завдяки чому не має недоліків риб’ячого жиру. Найчастіше сировиною для виділення ω‑3 ПНЖК є фермерський лосось.
Оскільки більшість ω‑3 ПНЖК надходять в організм людини з жирною рибою або риб’ячим жиром (часто печінкою риби), повідомляється про високі рівні в них різних токсичних сполук, таких як ртуть, діоксини і поліхлоровані біфеніли, що зумовлює певне занепокоєння. Усі ці хімічні сполуки є жиророзчинними і накопичуються в організмі, тому їх шкода може бути виявлена тільки після тривалого споживання риби або добавок риб’ячого жиру. Відомо, що у тварин і людей, які зазнали випадкового впливу діоксинів і поліхлорованих біфенілів, можуть виникати проблеми із заплідненням, а високі рівні ртуті спричинюють неврологічну патологію. З огляду на те що багато людей споживають жирну рибу 1-2 рази на тиждень або приймають добавки з риб’ячим жиром, важливо вивчити потенційно шкідливі наслідки споживання ω‑3 ПНЖК.
Нещодавнє дослідження з оцінки вмісту ω‑3 ПНЖК і окислювальних маркерів у дієтичних добавках риб’ячого жиру в Новій Зеландії показало, що у 83% добавок перевищено рекомендований рівень перекису. Дієтичні добавки з ω‑3 ПНЖК мають відповідати двом основним вимогам: по-перше, містити достатню кількість ω‑3 ПНЖК для забезпечення надходження в організм ЕПК в дозі не менш ніж 1 г/добу; по-друге – порівняно низьку концентрацію ω‑6 ПНЖК, біологічних конкурентів ω‑3 ПНЖК. У зв’язку з цим відношення ω‑3:ω‑6 ПНЖК у дієтичних добавках має бути на користь ω‑3 ПНЖК, що забезпечить потужніші фармакологічні властивості препарату.
Сьогодні дієтичні добавки риб’ячого жиру доступні і широко використовуються. При виборі дієтичної добавки ω‑3 ПНЖК зазвичай звертають увагу на загальний уміст риб’ячого жиру, тоді як потрібно враховувати відношення ЕПК:ДГК. Більшість дієтичних добавок містить не більше 30% корисних ЖК. Якщо порівнювати різні дієтичні добавки з однаковим умістом риб’ячого жиру, виявиться, що дози ЕПК і ДГК в них різні. Найвіщі містять комплекси ЕПК і ДГК, достатні дози – ω‑3-комплекси і найнижчі – риб’ячий жир.
Є 2 варіанти додаткового надходження ω‑3 ПЖНК до організму людини: харчові продукти і біологічно активні добавки. Міжнародне товариство з вивчення ЖК і ліпідів (ISSFAL) рекомендує дорослим споживати принаймні 500 мг/добу ЕПК і ДГК для здоров’я ССС, а вагітним і жінкам – додатково (до загальноприйнятих доз для дорослого населення) 200 мг/добу ДГК. Таке саме дозування жінкам, які годують, і вагітним рекомендує і Всесвітня асоціація перинатальної медицини. Адекватне споживання для дорослої популяції становить 600 мг/добу ЕПК і 700 мг/добу ДГК, тобто 1300 мг на добу ЕПК+ДГК. За рекомендацією FDA дорослі можуть безпечно споживати до 3000 мг/добу ЕПК+ДГК, проте не більш як 2000 мг/добу з дієтичних добавок.
Широкий спектр клініко-фармакологічних ефектів і висока безпека сучасних збалансованих дієтичних добавок ω‑3 ПНЖК дає можливість ефективно застосовувати їх у здорових осіб, у тому числі в дітей. Оскільки рибу, як алергенний продукт, часто виключають із раціону харчування дітей-алергіків, для корекції раціону педіатричної популяції з харчовою алергією доцільно використовувати препарати ω‑3 ПНЖК.
Отже, численні докази, зібрані під час довгострокових проспективних когортних досліджень, послідовно демонструють зв’язок між більшим споживанням риби, жирної риби та ω‑3 ПНЖК або вищими рівнями ЕПК і ДГК в організмі з нижчим ризиком розвитку ССЗ, особливо ІХС, ІМ і серцево-судинної смертності в загальній популяції. Кардіопротекторний ефект ЕПК/ДГК є доведеним, ураховуючи чітке визначення механізмів, здатних модулювати низку відомих факторів ризику ССЗ, таких як рівень ліпідів крові, артеріальний тиск, ЧСС і варіабельність серцевого ритму, агрегація тромбоцитів, функція ендотелію і запалення. Крім того, результати окремих клінічних досліджень, а також метааналізи впливу ω‑3 ПЖНК на організм людини надають достатньо доказів заохочувати щоденне споживання ЕПК/ДГК для профілактики ЦД 2 типу і дисліпідемій.
Треба зазначити, що добова доза ω‑3 ПЖНК має відповідати фактичній потребі конкретного пацієнта, яку оцінюють на основі визначення концентрації ω‑3 ПЖНК у плазмі. Потрібні подальші дослідження, щоб визначити оптимальне дозування і співвідношення ДГК і EPA в харчових добавках, щоб забезпечити їхній максимальний терапевтичний ефект. У майбутньому можливий персоніфікований підхід до призначення харчових добавок ω‑3 ПНЖК, заснований на оцінці індивідуальних потреб в ω‑3 ПНЖК, із використанням, наприклад, ω‑3 індексу.
Література
- Dyerberg J., Bang H.O., Hjorne N. Fatty acid composition of the plasma lipids in Greenland Eskimos. Am J Clin Nutr. 1975; 28: 958-66.
- Mori T.A. Marine OMEGA‑3 fatty acids in the prevention of cardiovascular disease. Fitoterapia. 2017. Vol. 123. P. 51-58. doi: 10.1016/j.fitote.2017.09.015.
- Simopoulos A.P. Evolutionary aspects of diet and essential fatty acids. World Rev Nutr Diet. 2001;88:18-27. doi: 10.1159/000059742.
- GBD2017 Diet Collaborators. Health effects of dietary risks in 195 countries, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet. 2019. Vol. 393 (10184). P. 1958-1972. doi: 10.1016/S0140-6736(19)30041-8.
- Public Health England Statistical Summary: National Diet and Nutrition Survey: Years 1 to 9 of the Rolling Programme (2008/09-2016/17): Time trend and income analyses. Public Health England, 2019.
...
63. Furuhjelm C., Warstedt K., Duchén K. Fish oil supplementation in pregnancy and lactation may decrease the risk of infant allergy // Acta Paediatr. 2009; Sep; 98(9):1461-1467.
Повний список літератури – у редакції.
Тематичний номер «Діабетологія, Тиреоїдологія, Метаболічні розлади» № 4 (56) 2021 р.