31 січня, 2022
Перспективи застосування токсинів зміїної отрути для лікування нейродегенеративних захворювань та знеболення
Зло, як і отрути, має своє призначення. Є хвороби, які нічим іншим не вилікуєш
Томас Пейн
На нейродегенеративні захворювання страждають мільйони людей у світі. На жаль, специфічного хворобомодифікувального лікування для таких пацієнтів наразі немає, що робить пошук ефективних препаратів нагальною потребою. Нейродегенерацію спричиняє активація низки клітинних процесів, зокрема окисного стресу, порушень функцій мітохондрій, нейрозапалення, старіння, утворення білкових агрегатів, глутаматергічної ексайтотоксичності та апоптозу. Метою дослідницьких груп є виявлення речовин, які можуть пригнічувати одну або декілька з цих подій, що призводять до загибелі нейронних клітин. Тваринні отрути являють собою перспективні природні джерела нових молекул, які невпинно вдосконалювалися шляхом природного добору.
Багато природних пептидів, ідентифікованих в отрутах змій, скорпіонів, бджіл, павуків, молюсків тощо, зменшують запалення, регулюють вивільнення глутамату, змінюють рівень нейромедіаторів, блокують активацію іонних каналів, знижують концентрацію білкових агрегатів та підвищують нейропротекторні фактори. Ці компоненти здатні потенційно уповільнювати або навіть припиняти нейродегенерацію, застосовуються для лікування широкого спектра нейродегенеративних станів, зокрема хвороб Альцгеймера (ХА) й Паркінсона (ХП), ішемії мозку, глаукоми, бічного аміотрофічного (БАС) та розсіяного склерозу, а також місцевої терапії невралгій, нейрозапальних захворювань, радикулітів, люмбаго тощо.
Механізми нейродегенерації
Нейродегенерація є основною причиною розвитку багатьох неврологічних патологій, як-от ХА, ХП, хвороба Гентінгтона та ішемія головного мозку (Kalogeris et al., 2012). Патологічні механізми, що лежать в їх основі, характеризуються порушенням структури тканин і клітинних функцій в окремих уразливих нейронних системах, що може поступово спричинити виникнення таких станів, як (Yan et al., 2013):
- когнітивна дисфункція;
- моторний дефіцит;
- психічні розлади.
Незважаючи на зусилля дослідників, складність процесів загибелі клітин і визначення етіології захворювань створюють багато перешкод для повного розуміння їх природи та розробки методів лікування, здатних модифікувати перебіг патологій.
Причинами загибелі нейронів можуть бути апоптоз, некроз та автофагія. Незважаючи на відмінності, ці механізми клітинної смерті співіснують і мають деякі спільні риси. Також у розвитку низки нейродегенеративних захворювань вирішальну роль відіграє ексайтотоксичність. На жаль, внутрішньоклітинні механізми, відповідальні за цей тип загибелі нейронних клітин, наразі ще повністю не з’ясовані. Надмірна активація нейронів збудливими нейромедіаторами, такими як глутамат, вважається основною причиною ексайтотоксичного пошкодження мозку (Quillinan et al., 2016).
Гострі ураження ЦНС, як-то ішемія та черепно-мозкова травма, викликають інтенсивне вивільнення глутамату, що призводить до надмірної стимуляції глутаматних рецепторів і масивного припливу іонів, зокрема Ca2+. Порушення іонної рівноваги деполяризує потенціал плазматичної мембрани та знижує внутрішньоклітинний рН (Surin et al., 2014). Надмірна активація АТФ-залежних іонних насосів, спрямована на відновлення іонного гомеостазу, спричиняє виснаження АТФ і енергетичний стрес (Mukherjee et al., 2008). Механізми, залучені до метаболічної відповіді нейронів на ексайтотоксичність, є вельми складними і відіграють фундаментальну роль у здатності нейрона адаптуватися та відновлюватися після такого руйнівного впливу.
Нейрони значно більш сприйнятливі до метаболічного стресу, викликаного ексайтотоксичними процесами. Ці події можуть призвести до збільшення вмісту активних форм кисню (АФК) (Vergun et al., 2003). Хоча АФК є важливими внутрішньоклітинними сигнальними молекулами, у високих концентраціях вони можуть бути цитотоксичними, що призводить до окисного стресу та, як наслідок, – пошкодження структури ДНК, руйнування клітинної мембрани, зміни структури й функцій білків через їх окиснення (Gandhi, Abramov, 2012).
Підвищений вміст АФК було виявлено при вивченні посмертних зразків тканин мозку осіб із нейродегенеративними розладами, зокрема ХП, ХА та БАС (Yan et al., 2013; Zuo et al., 2015; Pedersen et al., 1998). Також АФК-залежні зміни в метаболізмі білків збільшують вміст нерозчинних агрегатів або накопичення протофібрил за патологічних умов, що спричиняє нейродегенерацію (Horiguchi et al., 2003).
Навіть за відсутності окисного стресу деякі білки з неправильною тривимірною структурою здатні викликати токсичність, і це спричиняє загибель клітин. Неправильно згорнутий білок також може секретуватися в позаклітинний простір, що призводить до формування позаклітинних бляшок (Friedrich et al., 2010). Дослідження показали, що в міру старіння організм поступово втрачає деякі механізми, пов’язані з запобіганням накопиченню помилково згорнутих білків (Kirstein-Miles, Morimoto, 2010). Однак межа між патологічною нейродегенерацією та нормальними змінами при старінні не є чіткою.
Власне, однозначно визнано, що старіння викликає нейродегенерацію, оскільки пов’язане з порушенням білкового гомеостазу, що зумовлює:
- розвиток агрегатів і тілець включення;
- пошкодження ДНК;
- лізосомну дисфункцію;
- епігенетичні зміни;
- імунну дисрегуляцію.
Незважаючи на всі набуті знання, шкідливі події, внаслідок яких відбувається загибель нейронних клітин, ще не до кінця вивчені. Розкриття механізмів, що лежать в основі нейродегенерації, може допомогти розробити альтернативні підходи для припинення розвитку таких пошкоджень (de Souza et al., 2018).
Токсини зміїної отрути для лікування нейродегенеративних захворювань
Хвороба Альцгеймера
ХА є причиною 60‑80% випадків деменції та переважно вражає осіб віком від 65 років, що призводить до смерті приблизно через 7‑10 років від дебюту симптомів (Plassman et al., 2007). ХА характеризується тяжкою атрофією мозку і прогресувальною загибеллю нейронів, що спричиняє серйозні проблеми із пам’яттю, поведінкові зміни, мовленнєві порушення, дефіцит уваги та загальне зниження когнітивних функцій (Holtzman et al., 2011).
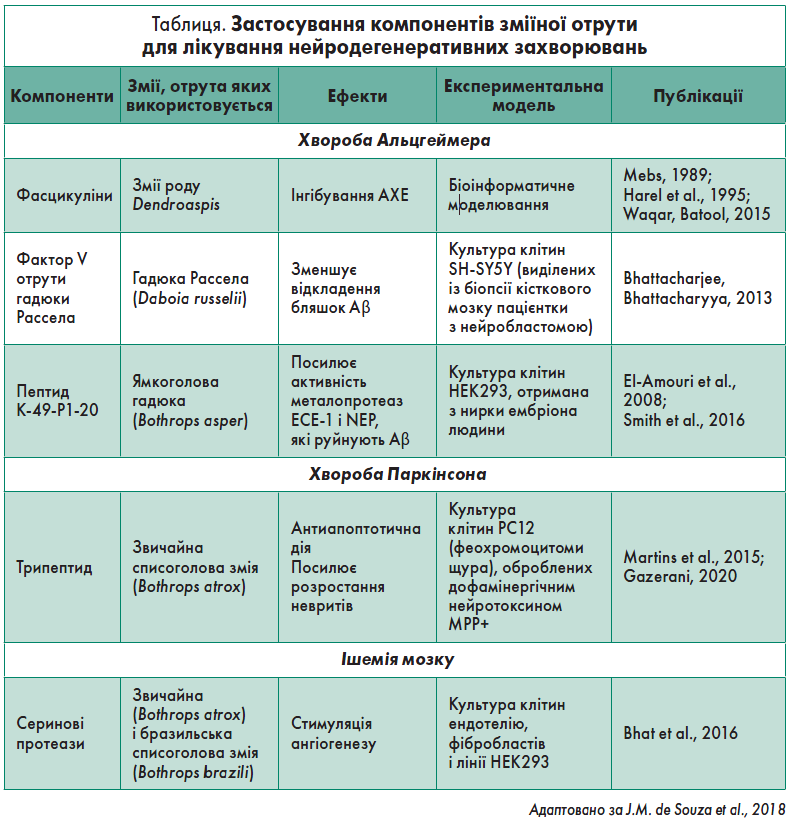
Нині препаратами для лікування пацієнтів із ХА, які схвалені Управлінням з контролю за якістю харчових продуктів і медикаментів США (FDA), є антагоніст NMDA-рецепторів мемантин та інгібітори ацетилхолінестерази (АХЕ), які дещо зменшують холінергічний дефіцит. Проте жоден із них не затримує прогресування захворювання. Розробка нових молекул, спрямованих на різні аспекти патології, з використанням природних токсинів може бути перспективним підходом, якщо брати до уваги їх селективність дії щодо різних ферментів, каналів і субодиниць (таблиця).
Токсини, отримані зі зміїної отрути, широко досліджувалися для потенційного терапевтичного застосування при ХА та інших патологіях. Як відомо, вони можуть бути корисними для зменшення дефіциту ацетилхоліну при таких захворюваннях, як ХА. Нещодавно зусилля вчених привели до виявлення токсинів із потенційною інгібіторною активністю щодо АХЕ (Waqar, Batool, 2015).
Гадюка Рассела (Daboia russelli) виробляє отруту, що містить багато ізоформ фосфоліпази А2, ферменти-прокоагулянти (активатори факторів X і V), геморагіни, нуклеази, протеази, гіалуронідази та інші сполуки. Наявні дані, що фактор V отрути цієї гадюки дестабілізує агрегати β-амілоїду (Aβ) в in vitro культурах клітин SH-SY5Y людини, інкубованих із пептидами Aβ42/Aβ40 (Bhattacharjee, Bhattacharyya, 2013). Також він захищає клітини від токсичності, спричиненої Aβ. Подальші дослідження з використанням даних пептидів можуть мати потенціал для розробки нових терапевтичних засобів (Van Dam, De Deyn, 2006).
Металопротеази відіграють важливу роль у регуляції багатьох фізіологічних процесів. Результатом активності металопротеаз ECE‑1 і NEP є руйнування Aβ у мозку. Своєю чергою для її стимуляції використовують поліфеноли зеленого чаю і кінуренову кислоту (Klein et al., 2013). Вважається, що посилена активність ECE‑1 і NEP чинить сприятливий вплив проти ХА, – це продемонстровано їх генетично індукованою підвищеною експресією на трансгенних мишачих моделях ХА (El-Amouri et al., 2008).
Також вчені виявили пептид K‑49-P1‑20, що міститься у структурі міотоксину 2, гомолога фосфоліпази А2 з отрути ямкоголової гадюки (Bothrops asper). Було доведено його ефективність для стимуляції активності ECE‑1 і NEP. До того ж стало відомо, що за наявності пептиду K‑49-P1‑20 інтенсивність розщеплення ендогенного Aβ40 у спинномозковій рідині суб’єкта з ХА металопротеазою ECE‑1 збільшується, що підтверджує його потенційну роль для лікування цієї патології (Smith et al., 2016).
Хвороба Паркінсона
ХП є другим за поширеністю нейродегенеративним захворюванням, на яке страждають переважно люди віком від 55 років. ХП характеризується прогресувальною нейродегенерацією компактної частини чорної речовини, що зазвичай вражає дофамінергічні нейрони. Нейродегенерація є безпосередньою причиною симптомів ХП, які включають брадикінезію, тремор спокою та ригідність (George et al., 2009). Окрім рухових змін, в осіб із ХП можливий розвиток когнітивних порушень та психіатричних розладів (Beitz, 2014).
Дослідження зміїної отрути як терапевтичного засобу для лікування ХП проводили на клітинах PC12 (отриманих із феохромоцитоми щура), оброблених дофамінергічним нейротоксином MPP+, що викликає симптоми ХП. Було показано, що нейропротекторна активність і здатність індукувати нейритогенез притаманна пептиду, виділеному із фракції Ba-IV отрути звичайної списоголової змії (Bothrops atrox). Цей пептид може значно зменшувати загибель клітин, а його захисний ефект пов’язаний зі зниженням активності каспази‑9/-3. Крім того, у даній клітинній моделі ХП після обробки пептидом спостерігався ріст нейритів. Це означає, що основний протективний механізм може включати нейротрофічний ефект (див. таблицю) (Gazerani, 2020).
Ішемія мозку
Ішемія – це результат недостатнього кровопостачання тканин через обструкцію артеріального кровотоку (Kalogeris et al., 2012). Основним наслідком ішемії мозку є зменшення вмісту енергетичних субстратів, зокрема глюкози та кисню. Синтез АТФ шляхом гліколізу та окисного фосфорилювання сповільнюється або навіть припиняється, призводячи до швидкого зниження рівня АТФ у клітинах. До того ж, коли дихання гальмується, але гліколіз триває, накопичення протонів і лактату спричиняє швидке підкислення внутрішньоклітинного вмісту. Усе це викликає стійке підвищення позаклітинної концентрації глутамату, а каскад подій завершується значним зростанням внутрішньоклітинного вмісту Ca2+ у нейронах і астроцитах, що зумовлює загибель нейронів (de Souza et al., 2018).
Ефективність лікування ішемії, що полягає у застосуванні тромболітичних засобів та препаратів, які зменшують уразливість тканини мозку, все ще далека від задовільної, переважно через обмежене терапевтичне вікно та можливі внутрішньочерепні крововиливи. Тому пошук ефективних ліків є першочерговим завданням.
Деякі компоненти тваринних отрут здатні знижувати ішемічне ураження. Так, отрути звичайної та бразильської списоголової змії містять серинові протеази, здатні стимулювати ангіогенез через активацію сигнального шляху PI3K/AKT. Це захищає від церебральної ішемії/реперфузії, зменшує патологічні зміни в мозку та інгібує апоптоз нейронів, підвищуючи експресію білків FAK, p-FAK, Bcl‑2 та знижуючи експресію каспази‑3 (див. таблицю) (Lu et al., 2016).
Застосування компонентів зміїної отрути для знеболення та лікування нейрозапалення
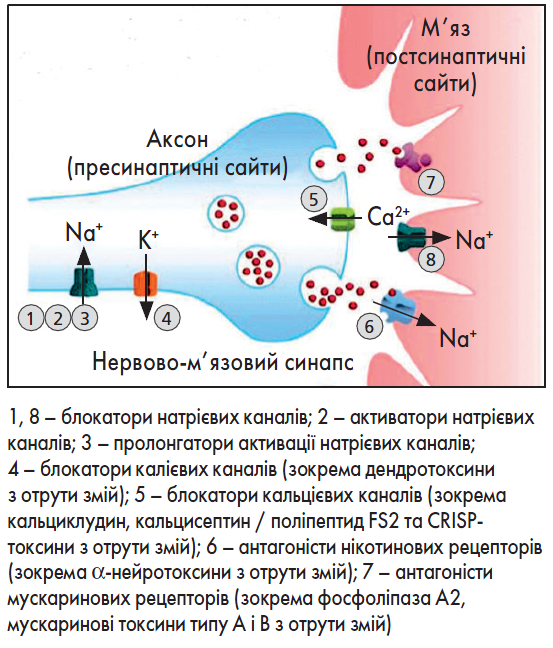
Різні отрути діють на нервову систему хребетних на пре- та постсинаптичному рівнях (рисунок). Вивчення механізмів дії цих токсинів є ключовим для розуміння природи болю та нейронної сигналізації, а також надає потенційні можливості для їх застосування у медицині (Trim, 2013).
Рисунок. Схематичне зображення пре- та постсинаптичних сайтів зв’язування нейротоксинів тваринного походження, зокрема виділених зі зміїної отрути
Адаптовано за N.R. Casewell et al., 2013
Кобратоксин – α-нейротоксин із довгим ланцюгом у складі отрути таїландської кобри (Naja spp.), здавна використовували для знеболювання. Отрута аспідових змій містить складні нейротоксини, які насамперед блокують нікотинові ацетилхолінові рецептори, результатом чого є атонічний параліч. Такий ефект пов’язаний із потенційною терапевтичною користю при болю і низці неврологічних захворювань (Hurst et al., 2013). Також отрути багатьох аспідових і деяких гримучих змій чинять знеболювальну дію через опіоїдні та неопіоїдні механізми (dos Santos et al., 2012).
Крототоксин, токсин фосфоліпази А2 отрути гримучої змії Crotalus durissus terrificus, використовують як протипухлинний засіб, що сприяє зменшенню споживання анальгетиків за рахунок неопіоїдного механізму дії (Nogueira-Neto et al., 2012). На додаток, виявлено знеболювальну активність так званих трипальцевих токсинів отрути чорної мамби (Dendroaspis polylepis). Ці токсини зв’язуються з гомомерними кислоточутливими іонними (ASIC)1a і гетеромерними каналами, що містять ASIC1a, чинять центральну анальгетичну і периферичну дію через гетеромери ASIC1a/ASIC2a та ASIC1a/1b відповідно (Diochot et al., 2012).
У медичній практиці препарати на основі отрут використовують як засоби, що сприяють болезаспокійливому та протизапальному ефектам. Широке застосування вони отримали і в лікуванні застарілих форм радикуліту, ішіасу, ревматизму, а також при артриті, невралгіях, поліартритах, міозитах (Конопльова, 2012).
У разі місцевого застосування отрута сприяє збільшенню еластичності тканин. Вона чинить такі позитивні ефекти, як (Хабрієв та співавт., 2016):
- кератолітичний;
- анальгетичний;
- протизапальний;
- протинабряковий;
- місцевоподразнювальний.
Засоби, що містять складні суміші органічних і неорганічних речовин, зокрема мазі, до складу яких входять отрути деяких видів змій, використовують для лікування запальних захворювань суглобів, невралгій, радикулітів, люмбаго, запалення периферичних нервів (Шишкова, 2018; Громова, Цурко, 2020). Подразнення чутливих рецепторів шкіри і подальше всмоктування таких речовин, як гістамін, ферменти й органічні кислоти, сприяє розширенню судин, поліпшенню трофіки тканин та знеболювальному ефекту препаратів. Різноманітні механізми дії та наявність багатокомпонентної основи таких мазей роблять їх цікавими для проведення клінічних досліджень з метою детального вивчення ефективності та подальшого впровадження в клінічну практику.
До засобів локальної терапії належить мазь Випросал В® (АТ «Гріндекс»), яка містить зміїну отруту. Інгредієнти мазі саліцилова кислота (1%), камфора (3%) і скипидар (3%) здавна успішно використовують у препаратах місцевої дії. Cкипидар чинить подразливий ефект, камфора діє на шкірні рецептори як легкий болезаспокійливий і протисвербіжний засіб, стимулює нервові закінчення та зменшує інтенсивність болю (Reynolds, 1995).
Проте основним компонентом мазі є отрута гадюки звичайної (Viperae berus), що являє собою складну суміш білків, багато з яких мають ферментативну дію. Отрута містить протеолітичні ферменти, такі як тромбін, фосфатаза, фосфодіестераза, оксидаза L-амінокислот тощо. При нанесенні у невеликих концентраціях на неушкоджену шкіру отрута не чинить системних ефектів, оскільки білки у її складі не проникають всередину. При місцевому застосуванні отрута діє як подразнювальний компонент.
Мазь Випросал В® є сумішшю контрподразнювальних складових, проте містить їх у невеликих концентраціях, не призводячи до надмірного подразнення шкіри. При нанесенні на шкіру контрподразники стимулюють місцеву запальну реакцію, і цей парадоксальний ефект сприяє зменшенню болю в ділянці під поверхнею шкіри (Green, 1991).
Окрім того, мазь Випросал В® містить парафін, вазелін, гліцерин, емульгатор, ізотонічний сольовий розчин і очищену воду. Така основа мазі забезпечує поступове вивільнення активних компонентів та їх тривалу дію безпосередньо в патологічному вогнищі.
Про стійку клінічну ефективність мазі Випросал В® свідчать наявні результати досліджень. У рандомізованому плацебо-контрольованому подвійному сліпому випробуванні за участю 92 амбулаторних пацієнтів віком 18‑70 років з остеоартрозом, болем у попереку, невралгією та захворюваннями м’яких тканин (як-то тендиніти, міозити, бурсити) вплив даного засобу аналізували за візуальною аналоговою шкалою (ВАШ). Полегшення болю було достовірно суттєвішим у групі Випросалу В порівняно із плацебо: зміна показників за ВАШ становила -27,9±2,62 і -19,6±2,91 бала відповідно (p=0,038). Поліпшення оцінок спонтанного болю та болю під час руху також було більш значущим у групі Випросалу В (Бадокін, 2011).
У рандомізованому відкритому порівняльному дослідженні із залученням 25 хворих на дегенеративно-дистрофічні захворювання суглобів і хребта, що супроводжувалися больовим синдромом (вік – від 18 до 74 років), застосування мазі Випросал В® сприяло значущому полегшенню болю за ВАШ на 51,87% (p<0,05). Бальні оцінки спонтанного болю та болю під час руху чи при пальпації теж достовірно зменшилися: з 2,5±0,22 до 1,3±0,26 бала і з 3,3±0,33 до 1,6±0,48 бала відповідно (p<0,05) (Шмирьова, 2014).
Окрім того, під наглядом перебували 90 амбулаторних пацієнтів із неспецифічним болем у нижній частині спини легкого/помірного ступеня, розподілених на три групи по 30 осіб у кожній (Пономарьов, Аркінд, 2014):
- основна група отримувала традиційні нестероїдні протизапальні препарати (НПЗП) та локально мазь Випросал В®;
- перша група порівняння – лише НПЗП;
- друга група порівняння – лише мазь Випросал В®.
Аналіз результатів показав, що в усіх групах хворих у процесі лікування спостерігався регрес больового синдрому, але до 7-го дня терапії залишковий біль був найменш вираженим у пацієнтів основної групи.
У клінічному дослідженні за участю 120 пацієнтів із ранніми стадіями остеоартрозу колінного суглоба застосування мазі Випросал В® у комплексному лікуванні сприяло максимальному знеболювальному ефекту та стійкому зниженню активності запального процесу (Вирва та співавт., 2014).
Висновки
Компоненти зміїних отрут є перспективними природними джерелами для розробки нових препаратів, які мають потенціал для зменшення або навіть інгібування прогресування нейродегенеративних процесів. Засоби локальної дії з додаванням зміїної отрути чинять знеболювальний ефект на додачу до стійкого зниження активності запального процесу.
Підготувала Наталія Купко
Тематичний номер «Неврологія, Психіатрія, Психотерапія» № 4 (59) 2021 р.