29 жовтня, 2022
Ключові принципи ведення пацієнтів із шлуночковими аритміями та профілактики раптової серцевої смерті
Попри значні досягнення в діагностиці й лікуванні захворювань серця, шлуночкові аритмії (ША) сьогодні становлять значну загрозу для життя хворого. Крім того, проблема раптової серцевої смерті (РСС) навіть у розвинених країнах досі лишається суттєвою. Саме тому Європейське товариство кардіологів (ESC) 2022 року оновило та доповнило рекомендації щодо терапії пацієнтів із ША та профілактики РСС за 2015 р. Документ містить нові дані, що стосуються епідеміології РСС, генетики, стратифікації ризику ША та РСС, а також досягнень у діагностиці й розробці терапевтичних стратегій. Настанова покликана допомогти лікарям у прийнятті оптимальних індивідуалізованих клінічних рішень для окремих пацієнтів, визначенні та реалізації профілактичних, діагностичних і терапевтичних тактик у рутинній практиці. Пропонуємо до вашої уваги основні положення цих рекомендацій.
Визначення і поширеність ША
ША – це порушення серцевого ритму, які виникають нижче розгалуження пучка Гіса. Шлуночкові екстрасистоли (ШЕ) бувають передчасними або замісними, моно- чи поліморфними, одиночними або множинними. Своєю чергою, множинні екстрасистоли можуть мати форму пар, нестійкої чи стійкої шлуночкової тахікардії (ШТ). На підставі електрокардіографічних (ЕКГ) критеріїв розрізняють: двоспрямовану, плеоморфну ШТ, тахікардію типу пірует (torsade de pointes), тріпотіння шлуночків, фібриляцію шлуночків (ФШ), електричний шторм.
Як відомо, ША є поширеним клінічним станом, частота яких зростає з віком пацієнта і ступенем ураження серця. Аритмії з подібною ЕКГ-картиною можуть мати різну причину виникнення та різне прогностичне значення. Визначення етіології ША дає багатьом пацієнтам можливість отримати етіотропне лікування.
Епідеміологія РCC і стратифікація ризику
РСС – це смерть від серцевих причин, якій передує раптова втрата свідомості за умови маніфестації гострих симптомів, що передували смерті, не раніше ніж за 1 год. Можлива наявність діагнозу серцево-судинного захворювання (ССЗ), але час і спосіб настання смерті несподівані. Причина РСС часто лишається нез’ясованою, попри детальну патоморфологічну експертизу.
На РСС припадає приблизно 50% усіх смертей через ССЗ, причому до 50% є їх першою ознакою. Частота РСС помітно зростає з віком і становить орієнтовно 50 випадків на 100 тис. людино-років серед осіб віком 50‑60 років і щонайменше 200 випадків на 100 тис. людино-років віком 80 років. Навіть після поправки щодо чинників ризику розвитку ішемічної хвороби серця (ІХС), у чоловіків поширеність РСС вища порівняно з жінками в будь-якому віці.
За оцінками, частка РСС становить 10‑20% усіх смертей у Європі. Відповідно до наявних даних частота РСС знижується, але ризик її виникнення в структурі загальної смертності внаслідок ССЗ зростає.
У загальній популяції найефективнішим підходом до запобігання РСС є кількісна оцінка індивідуального ризику розвитку ІХС. Ступінь ризику РСС (низький, проміжний або високий) залежить від віку, статі пацієнта та інших чинників ризику, зокрема супутніх захворювань.
Діагностика, профілактика й терапія
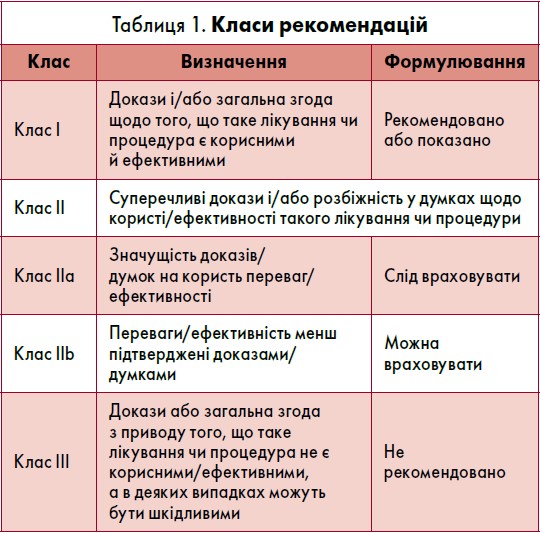
Класи рекомендацій і рівні доказовості щодо ведення пацієнтів із ША та профілактики РСС наведено в таблицях 1 і 2.
Діагностичні тестування та обстеження пацієнтів
Основою діагностики ША є ЕКГ. Якщо аритмія виникає рідко, використовують системи пролонгованої або періодичної реєстрації ЕКГ, як-от холтерівське моніторування, реєстратор подій або теле-ЕКГ. Пацієнтам зі спорадичними симптомами (наприклад, синкопе) у разі підозри на їх поєднання з кардіальними аритміями рекомендовано імплантацію петлевого реєстратора.
У більшості хворих на ША доцільно проводити допоміжні дослідження, які дають змогу виключити органічне захворювання серця, або, якщо воно існує, встановити детальний діагноз і ризик РСС.
Залежно від індивідуальних потреб проводять такі тестування, як:
- стандартна ЕКГ;
- ЕКГ-тест із фізичним навантаженням;
- ехокардіографія (ЕхоКГ);
- 24-годинне або триваліше холтерівське моніторування ЕКГ.
Пацієнтам із нещодавно підтвердженою ША насамперед рекомендовано провести стандартну ЕКГ у 12 відведеннях, запис ША на ЕКГ у 12 відведеннях за можливості та ЕхоКГ (клас І, рівень доказовості С).
ША потребують диференціювання переважно із суправентрикулярними аритміями, набагато рідше – із ритмами, індукованими імплантованим кардіовертером-дефібрилятором (ІКД) або кардіостимулятором.
Генетичне тестування. Якщо ША діагностовано в пацієнта (живого або померлого) з імовірною генетичною схильністю та ризиком розвитку ША і РСС, рекомендовано виконати генетичне тестування (клас І, рівень доказовості В). У разі, якщо передбачуваний причинний варіант ідентифіковано вперше, слід визначити його патогенність із використанням валідованої міжнародної системи оцінки (клас І, рівень доказовості С). Генетичне тестування та консультування щодо можливих наслідків має проводити міждисциплінарна група експертів. В індексних пацієнтів із недостатньою кількістю доказів генетичного захворювання генетичне тестування виконувати не рекомендовано (клас ІІІ, рівень доказовості С).
Обстеження пацієнтів після раптової зупинки серця (РЗС). Обстеження пацієнтів, які перенесли РЗС без очевидної екстракардіальної причини, необхідно проводити під наглядом мультидисциплінарної команди (клас І, рівень доказовості В). Особам з електричною нестабільністю міокарда після РЗС із підозрою на триваючу ішемію міокарда рекомендовано коронарографію (клас І, рівень доказовості С). У хворих після РЗС слід виконувати забір зразків крові під час госпіталізації для можливого токсикологічного і генетичного тестування (клас І, рівень доказовості В).
В усіх пацієнтів, які перенесли РЗС, рекомендовано отримати записи із серцево-судинних імплантованих електронних пристроїв та портативних моніторів (клас І, рівень доказовості В). Крім того, таким хворим варто провести повторну ЕКГ у 12 відведеннях при стабільному ритмі, а також безперервний моніторинг серця (клас І, рівень доказовості В).
ЕхоКГ доцільно виконувати для оцінювання структури і функції серця в усіх осіб, які перенесли РЗС (клас І, рівень доказовості С). Водночас коронарну візуалізацію та магнітно-резонансну томографію (МРТ) із пізнім контрастним посиленням (LGE) рекомендовано для оцінювання структури і функції серця в усіх осіб після РЗС без чіткої основної причини (клас І, рівень доказовості В).
Також у таких пацієнтів слід проводити провокаційні проби із застосуванням блокаторів натрієвих каналів, а також навантажувальні тестування (клас І, рівень доказовості В).
Оцінка випадків раптової смерті. Дослідження осіб, які перенесли раптову смерть, особливо в разі підозри на спадкове захворювання, має стати пріоритетом охорони здоров’я (клас І, рівень доказовості В). Важливо зібрати детальний опис обставин летального випадку, наявних перед смертю симптомів, сімейний анамнез та переглянути попередні медичні записи (клас І, рівень доказовості В). Повну автопсію рекомендовано проводити в усіх випадках РСС і завжди в осіб віком до 50 років (клас І, рівень доказовості В).
Зокрема, у разі РСС слід зберегти матеріал для проведення процедури екстракції ДНК і проконсультуватися з кардіологом, якщо є підозра на спадкову причину смерті або вона нез’ясована (клас І, рівень доказовості В). У разі РСС за відомої або можливої спадкової причини рекомендовано генетичне тестування (клас І, рівень доказовості В). За підозри на наявність спадкової хвороби серця (незалежно від того, чи висновок зроблено на підставі автопсії, чи ні) родичів першого ступеня необхідно скерувати для обстеження серця до спеціалізованої клініки (клас І, рівень доказовості В).
Оцінка у разі синдрому раптової аритмічної смерті. Рекомендовано проводити генетичне тестування родичам померлого від зазначеного синдрому, якщо під час посмертного генетичного тестування померлого виявлено патогенні мутації (клас І, рівень доказовості В). Базове обстеження родичів померлого передбачає збір анамнезу, фізикальний огляд, ЕКГ у стандартних і високих прекардіальних відведеннях, ЕхоКГ та навантажувальні проби (клас І, рівень доказовості В). Якщо після обстеження жодних клінічних ознак у родині не виявлено, рекомендовано спостереження за дітьми померлого від синдрому раптової аритмічної смерті до досягнення ними повноліття (клас І, рівень доказовості С).
Профілактичні та лікувальні підходи
Терапія зворотних станів. У разі підозри на медикаментозно-індуковані ША препарати, що спричинюють такі порушення, рекомендовано відмінити (клас І, рівень доказовості В). У Пацієнтів із ША треба обстежити на наявність зворотних причин, як-от дисбалансу електролітів, ішемії, гіпоксемії, гарячки (клас І, рівень доказовості С).
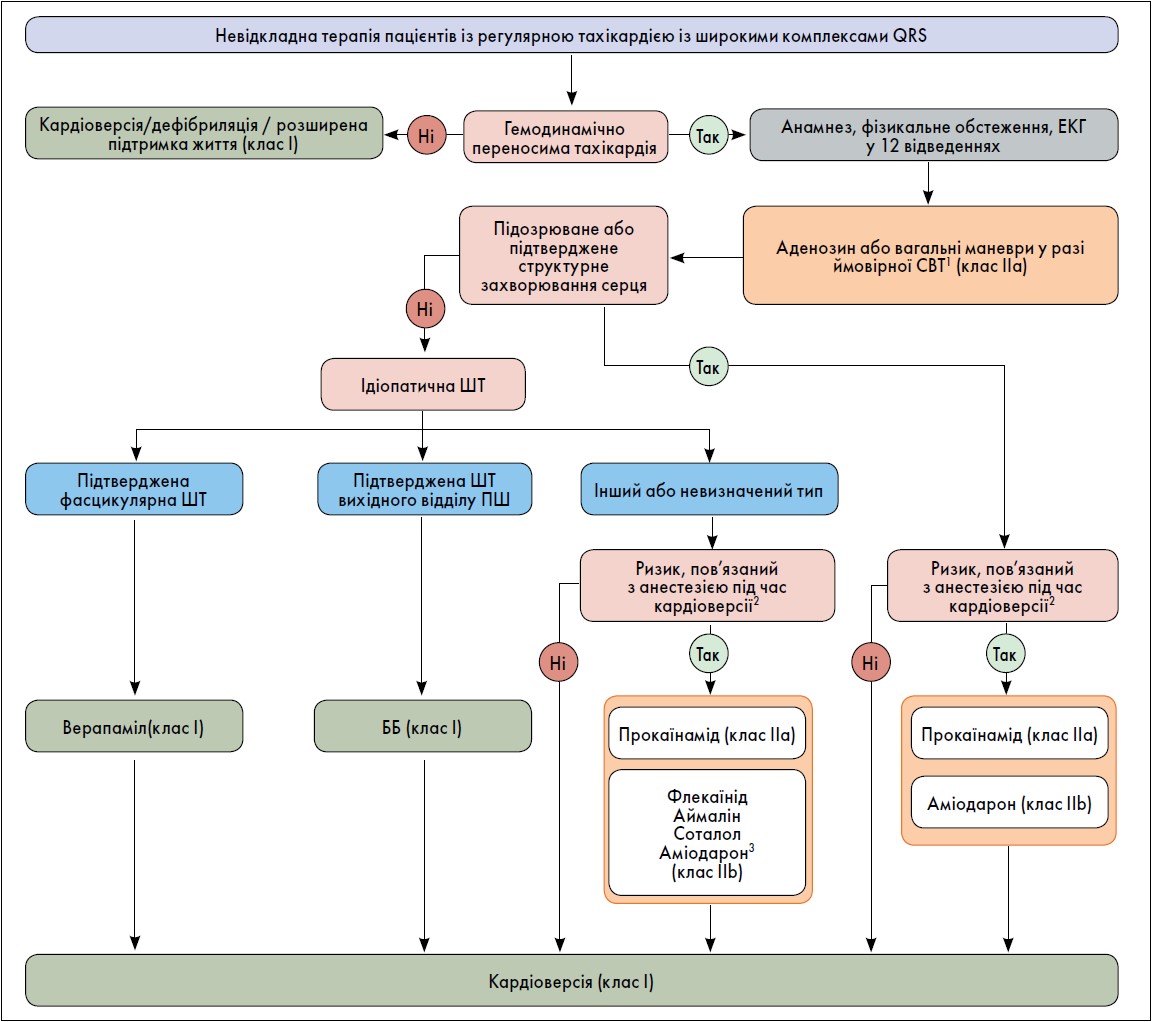
Невідкладне лікування стійкої ШТ та електричного шторму. Кардіоверсію постійним струмом рекомендовано як засіб терапії першої лінії для осіб із гемодинамічно непереносимою стійкою мономорфною ШТ (СМШТ) (клас І, рівень доказовості В). Крім того, у зазначеній категорії хворих кардіоверсію постійним струмом слід проводити як засіб лікування першої лінії за умови низького ризику, пов’язаного з анестезією/седацією (клас І, рівень доказовості С).
Для пацієнтів із гемодинамічно переносимою ідіопатичною ШТ доцільним є внутрішньовенне (в/в) застосування β-блокаторів (за тахікардії вихідного відділу правого шлуночка [ПШ]) або верапамілу (за фасцикулярної ШТ) (клас І, рівень доказовості С). У разі тахікардії із широким комплексом QRS невідомого походження в/в введення верапамілу не рекомендовано (клас ІІІ, рівень доказовостіВ).
Алгоритм невідкладної терапії при регулярній тахікардії із широким комплексом QRS наведено на рисунку.
Рисунок. Алгоритм невідкладної терапії при регулярній тахікардії із широким комплексом QRS
Примітки: СВТ – суправентрикулярна тахікардія.
1 Окрім СВТ, аденозин також може бути ефективним у разі ідіопатичної ШТ, що вказує на тригерну активність як механізм, що лежить в основі аритмії.2 Переваги кардіоверсії слід порівняти з ризиками, пов’язаними з анестезією/седацією.3 Зважаючи на обмежену доступність інших антиаритмічних препаратів.
Хворим з електричним штормом слід проводити легку або помірну седацію для зменшення психологічного стресу і зниження симпатичного тонусу (клас І, рівень доказовості С). Антиаритмічну терапію β-блокаторами (бажано неселективними) у поєднанні з в/в уведенням аміодарону рекомендовано пацієнтам зі структурним захворюванням серця й електричним штормом, якщо немає протипоказань (клас І, рівень доказовості В).
Особи з тахікардією типу пірует потребують в/в введення магнію з добавками калію (клас І, рівень доказовості С). Водночас хворим із набутим синдромом подовженого інтервалу QT і рецидивною тахікардією типу пірует рекомендовано ізопротеренол або трансвенозну стимуляцію для підвищення частоти серцевих скорочень (клас І, рівень доказовості С).
Катетерну абляцію варто проводити пацієнтам із безперервною ШТ або електричним штормом через СМШТ, рефрактерну до антиаритмічної терапії (клас І, рівень доказовості В).
Терапія серцевої недостатності (СН). Оптимальне медикаментозне лікування, зокремаінгібіторами ангіотензинперетворювального ферменту/блокаторами рецепторів ангіотензину/інгібіторами ангіотензинових рецепторів і неприлізину, антагоністами мінералокортикоїдних рецепторів, β-блокаторами (ББ) та інгібіторами натрійзалежного котранспортера глюкози 2-го типу, рекомендовано всім пацієнтам із СН зі зниженою фракцією викиду (ФВ) (клас І, рівень доказовості А).
Встановлення ІКД. Процедуру слід проводити лише тим хворим, у котрих очікувана виживаність становить ˃1 року (клас І, рівень доказовості С). Не рекомендовано встановлювати ІКД особам із повторюваними ША, доки вони не стануть контрольованими (клас ІІІ, рівень доказовості С). Щодо вторинної профілактики РСС, ІКД є доцільними для пацієнтів із підтвердженою ФШ або гемодинамічно непереносимою ШТ за відсутності зворотних причин (клас І, рівень доказовості А). Під час прийняття рішення стосовно додавання до ІКД серцевої ресинхронізаційної терапії (СРТ) варто оцінити, чи отримає хворий користь внаслідок встановлення пристрою для СРТ із функцією дефібрилятора (клас І, рівень доказовості С).
Оптимізація програмування ІКД є важливою, щоб уникнути невідповідної/непотрібної терапії та знизити рівень смертності серед хворих (клас І, рівень доказовості А). У контексті супутнього лікування, пацієнтам з ІКД із повторюваною суправентрикулярною тахікардією, що свідчить про невідповідність терапії ІКД, рекомендовано катетерну абляцію (клас І, рівень доказовості С). Медикаментозне лікування або катетерну абляцію слід застосовувати в осіб із невідповідною терапією ІКД, пов’язаною з фібриляцією передсердь (ФП), попри оптимальне програмування ІКД (клас І, рівень доказовості С).
Лікування ША при гострому коронарному синдромі (ГКС) і вазоспазмі. Використання ББ в/в показане пацієнтам із рецидивною поліморфною ШТ/ФШ під час інфаркту міокарда (ІМ) з елевацією сегмента ST, якщо немає протипоказань (клас І, рівень доказовості В). Профілактичне лікування антиаритмічними препаратами (окрім ББ) при ГКС не рекомендовано (клас ІІІ, рівень доказовості В).
Стратифікація ризику і лікування ША на ранніх стадіях ІМ. В усіх пацієнтів із гострим ІМ доцільною є раннє (до виписки) оцінювання ФВ лівого шлуночка (ЛШ) (клас І, рівень доказовості В). Особам із ФВ ЛШ ≤40% рекомендовано повторне її оцінювання через 6‑12 тижнів після ІМ, щоб визначити потребу в застосуванні ІКД для первинної профілактики (клас І, рівень доказовості С).
Стратифікація ризику, профілактика РСС і лікування ША в разі ІХС. Пацієнтам із синкопе і перенесеним ІМ з елевацією сегмента ST рекомендовано програмовану електричну стимуляцію, якщо після неінвазивного оцінювання причина синкопе залишається нез’ясованою (клас І, рівень доказовості С). Установлювати ІКД варто хворим на ІХС, симптоматичну СН ІI‑III класу за класифікацією Нью-Йоркської асоціації серця (NYHA) і ФВ ЛШ ≤35%, попри оптимальну фармакотерапію протягом ≥3 місяців (клас І, рівень доказовості А). Профілактичну антиаритмічну терапію (окрім ББ) пацієнтам з ІХС не рекомендовано (клас ІІІ, рівень доказовості А).
Застосування ІКД є доцільним в осіб без триваючої ішемії з підтвердженою ФШ або гемодинамічно непереносимою ШТ, яка виникла пізніше ніж через 48 год після ІМ (клас І, рівень доказовості А). У пацієнтів з ІХС і повторюваною симптоматичною СМШТ або встановленим ІКД із приводу зазначених порушень ритму, попри тривале лікування аміодароном, рекомендовано віддавати перевагу катетерній абляції, а не ескалації антиаритмічної терапії (клас І, рівень доказовості В).
Ведення пацієнтів з ідіопатичними передчасними шлуночковими комплексами (ПШК)/ШТ. Регулярне оцінювання функції шлуночків рекомендовано особам із частотою ПШК >10% і нормальною функцією шлуночків (клас І, рівень доказовості С). Катетерну абляцію як засіб лікування першої лінії рекомендовано в разі симптоматичної ідіопатичної ШT/ПШК із вихідного відділу ПШ або лівої ніжки пучка Гіса (клас І, рівень доказовості В). ББ або недигідропіридинові блокатори кальцієвих каналів слід призначати симптомним пацієнтам з ідіопатичною ШТ/ПШК не з вихідного відділу ПШ або лівої ніжки пучка Гіса (клас І, рівень доказовості С).
Аміодарон як препарат першої лінії не рекомендовано призначати особам з ідіопатичною ШТ/ПШК (клас ІІІ, рівень доказовості С). Верапаміл не слід призначати дітям віком до року із ШТ/ПШК, особливо якщо вони мають ознаки СН або застосовують інші антиаритмічні засоби (клас ІІІ, рівень доказовості С).
Діагностика, стратифікація ризику, профілактика РСС і лікування ША при аритмогенній кардіоміопатії ПШ. Пацієнтам із підозрою на наявність аритмогенної кардіоміопатії ПШ рекомендовано провести МРТ серця (клас І, рівень доказовості В). Для осіб із підозрюваним або встановленим діагнозом цього захворювання доцільними є генетичне консультування та тестування (клас І, рівень доказовості В). Застосування ІКД рекомендовано хворим на аритмогенну кардіоміопатію ПШ із гемодинамічно непереносимою ШТ або ФШ (клас І, рівень доказовості С). Пацієнтам із такими порушеннями ритму серця за нестійких або стійких ША слід призначити терапію ББ (клас І, рівень доказовості С).
Стратифікація ризику, профілактика РСС і лікування ША в разі гіпертрофічної кардіоміопатії (ГКМП). Пацієнтам із ГКМП з діагностичною метою рекомендовано МРТ із LGE, а також генетичні консультації та тестування (клас І, рівень доказовості В). Крім того, важливо оцінювати 5-річний ризик РСС під час першого обстеження та кожні 1‑3 роки або в разі зміни клінічного статусу (клас І, рівень доказовості С). Встановлювати ІКД рекомендовано хворим на ГКМП із гемодинамічно непереносимою ШТ або ФШ (клас І, рівень доказовості В).
Профілактика РСС і лікування ША в разі міокардиту й кардіального саркоїдозу. Пацієнтам із гемодинамічно непереносимою СМШТ, яка виникла у хронічній фазі міокардиту, а також особам із кардіальним саркоїдозом і ФВ ЛШ ≤35% рекомендовано встановлювати ІКД. На додаток, використання ІКД є доцільним для хворих на кардіальний саркоїдоз за підтвердженої стійкої ШТ або перерваної зупинки серця.
Ведення пацієнтів із синдромом подовженого інтервалу QT. Особам із клінічно діагностованим синдромом подовженого інтервалу QT слід провести генетичне тестування та консультування (клас І, рівень доказовості С).
Також таким хворим рекомендовано уникати:
- використання препаратів, що подовжують інтервал QT;
- корегування порушення електролітного балансу;
- специфічних тригерів аритмії (клас І, рівень доказовості С).
ББ, в ідеалі неселективні (надолол або пропранолол), варто призначати пацієнтам із підтвердженим подовженням інтервалу QT, щоб знизити ризик аритмії (клас І, рівень доказовості В). Крім того, їм рекомендовано лікування мексилетином (клас І, рівень доказовості С). Особам із синдромом подовженого інтервалу QT і перенесеною зупинкою серця рекомендовано встановлювати ІКД на додаток до ББ (клас І, рівень доказовості В).
Ведення осіб із синдромом Бругада (СБ). Цей синдром рекомендовано діагностувати в пацієнтів без інших захворювань серця зі спонтанним ЕКГ-патерном 1-го типу СБ (клас І, рівень доказовості С). До того ж цей синдром слід діагностувати у хворих без інших патологій серця, які перенесли зупинку серця внаслідок ФШ або поліморфної ШТ і мають ЕКГ-патерн 1-го типу СБ, спричинений уведенням блокаторів натрієвих каналів або під час лихоманки (клас І, рівень доказовості С). Проби із застосуванням блокаторів натрієвих каналів не варто проводити особам із попереднім ЕКГ-патерном 1-го типу СБ (клас ІІІ, рівень доказовості С).
Усім пацієнтам із СБ рекомендовано:
- уникати застосування препаратів, які можуть спричинити підйом сегмента ST у правих прекардіальних відведеннях;
- лікування лихоманки жарознижувальними препаратами (клас І, рівень доказовості С).
Встановлення ІКД є доцільним у хворих на СБ, які перенесли перервану зупинку серця і/або мають документально підтверджену спонтанну ШТ (клас І, рівень доказовості С). Катетерну абляцію у безсимптомних пацієнтів із СБ не рекомендовано (клас ІІІ, рівень доказовості С).
Ведення хворих на катехоламінергічну поліморфну ШТ. Пацієнтам із підозрюваним або встановленим діагнозом катехоламінергічної поліморфної ШТ рекомендовано генетичне тестування та консультування (клас І, рівень доказовості С). ББ, в ідеалі неселективні (надолол або пропранолол), рекомендовано всім особам із підтвердженим діагнозом зазначеної патології (клас І, рівень доказовості С).
Крім того, хворим на катехоламінергічну поліморфну ШТ після перерваної зупинки серця слід провести імплантацію ІКД у поєднанні із застосуванням ББ і флекаїніду (клас І, рівень доказовості С).
Ведення пацієнтів із синдромом укороченого інтервалу QT. Цей синдром рекомендовано діагностувати в разі QTc ≤360 мс і за наявності однієї або кількох із таких характеристик:
- патогенна мутація;
- сімейний анамнез;
- виживання пацієнта після епізоду ШТ/ФШ за відсутності захворювань серця (клас І, рівень доказовості С).
Особам із підтвердженим синдромом укороченого інтервалу QT рекомендовано здійснювати генетичне тестування (клас І, рівень доказовості С).
Також таким пацієнтам слід встановити ІКД, за умови якщо вони перенесли перервану зупинку серця і/або мають задокументовану спонтанну стійку ШТ (клас І, рівень доказовості С).
Загалом антиаритмічні препарати відіграють важливу роль у додатковій терапії ША, особливо симптомних пацієнтів. Однак дотепер жоден антиаритмік, за винятком ББ, не продемонстрував зниження рівня смертності від усіх причин, до того ж ці препарати асоційовані з низкою побічних явищ, зокрема проаритмією.
Модифікація чинників ризику, коли це можливо, важлива для запобігання розвитку проаритмії. Пацієнтам, які потребують призначення анти аритмічного препарату, що здатен спричинювати аритмію, рекомендовано регулярно проводити ЕКГ та інші тестування відповідно до профілю хворого і характеристик антиаритмічних засобів.
Загальні аспекти антиаритмічної терапії (невідкладної й тривалої) наведено в таблиці 3.
Підготувала Олена Коробка
Оригінальний текст документа читайте на сайті www.escardio.org