29 березня, 2023
Перехід на нові стандарти діагностики та прорив у лікуванні пацієнтів із хронічним лімфоцитарним лейкозом в Україні
17-18 листопада 2022 р. в онлайн-форматі відбулася XIV Науково-практична конференція з міжнародною участю «Сучасні підходи до діагностики та лікування лімфопроліферативних захворювань». Традиційно конференція була проведена на високому професійному рівні з доповідями провідних зарубіжних та українських спеціалістів у галузі діагностики й лікування лімфопроліферативних захворювань.
.jpg) У рамках секції, присвяченої хронічному лімфоцитарному лейкозу (ХЛЛ), лікар-гематолог Медичного центру СitiDoktor, керівник центру гематології, хіміотерапії гемобластозів та трансплантації кісткового мозку КЛ «Феофанія» Державного управління справами, завідувач кафедри клінічної лабораторної діагностики Національного університету охорони здоров’я України імені П.Л. Шупика (м. Київ), доктор медичних наук, професор Сергій Вікторович Клименко детально розповів про сучасні підходи до лікування уперше виявленого ХЛЛ.
У рамках секції, присвяченої хронічному лімфоцитарному лейкозу (ХЛЛ), лікар-гематолог Медичного центру СitiDoktor, керівник центру гематології, хіміотерапії гемобластозів та трансплантації кісткового мозку КЛ «Феофанія» Державного управління справами, завідувач кафедри клінічної лабораторної діагностики Національного університету охорони здоров’я України імені П.Л. Шупика (м. Київ), доктор медичних наук, професор Сергій Вікторович Клименко детально розповів про сучасні підходи до лікування уперше виявленого ХЛЛ.
– Основні підходи до першої лінії лікування ХЛЛ базуються на оцінці мутаційного статусу гена важких ланцюгів імуноглобуліну (IGHV), мутації TP53 або делеції Del(17p) [1]. Так, наявність IGHV-мутованого статусу асоціюється з більш сприятливими клінічними наслідками, зокрема перебігом захворювання та відповіддю на терапію. Наявність TP53 або Del(17p)/TP53 характеризується гіршим прогнозом, що зумовлює належність пацієнтів із цими аномаліями до групи високого ризику. Сучасні дані свідчать, що пацієнти з Del(17p)/TP53 погано відповідають на хіміотерапію (ХТ), краще відповідають на лікування інгібіторами тирозинкінази Брутона (Bruton tyrosine kinase – BTKі), фосфоінозитид-3-кінази (phosphoinositide 3’-kinase – PI3Kі) або антиапоптозного білка В-клітинної лімфоми (anti-apoptotic B-cell lymphoma 2 protein – BCL-2). Згідно з рекомендаціями Національної онкологічної мережі США (NCCN) та Європейського товариства медичної онкології (ESMO), саме ці три мутації визнані основними предикторами перебігу ХЛЛ, тому проведення генетичного аналізу є обов’язковим для всіх пацієнтів з ХЛЛ перед плануванням терапії.
На жаль, в Україні доступні поки не всі можливості діагностики ХЛЛ: доступне визначення Del(17p), тоді як виявлення IGHV та мутації TP53 тільки впроваджується. Ген TP53, як відомо, розташований на хромосомі 17р і кодує трансляцію протеїну 53 (р53). Цей білок працює як супресор пухлинного росту: утримує клітини від швидкого безконтрольного росту та поділу. Як зазначалося вище, мутації гена TP53 та/або Del(17p) асоціюються зі зниженою виживаністю пацієнтів та поганою відповіддю на ХТ. Таким чином, оцінка мутаційного статусу IGHV і наявності Del(17p) та/або аберації TP53 – наріжний камінь ведення пацієнтів з ХЛЛ, оскільки вся парадигма лікування цього захворювання базується на тому, що визначення наявності/відсутності цих предикторів допомагає виявити тих пацієнтів, яким не показана традиційна імунохіміотерапія (ІХТ) [2].
За останньою редакцією настанов NCCN щодо ведення пацієнтів з ХЛЛ, ІХТ у першій лінії рекомендована хворим із наявною мутацією IGHV та без цитогенетичних аномалій del(17p) та/або ТР53 мутації гена TP53. В усіх інших випадках перевагу віддають іншим підходам до лікування, зокрема застосуванню малих таргетних молекул. У 2021 р. була опублікована настанова щодо лікування ХЛЛ, згідно з якою при виборі ІХТ або малих таргетних молекул слід враховувати не лише наявність/відсутність цитогенетичних аномалій, а й відповідність терапії [3]. Якщо проаналізувати сучасні настанови щодо першої лінії лікування ХЛЛ, в більшості випадків рекомендоване застосування саме малих таргетних молекул, тоді як ІХТ показана рідко, лише для вузької популяції пацієнтів, та асоціюється з високою токсичністю.
Наразі підходи до терапії ХЛЛ як в Україні, так і в світі значно змінюються. Це пов’язано із розробленням нових, ефективніших препаратів, які забезпечують кращі результати лікування. Акалабрутиніб – новий високоселективний BTKі, який добре зарекомендував себе у терапії ХЛЛ. У 2020 р. були оприлюднені результати дослідження ІІІ фази ELEVATE-TN, у якому оцінювали ефективність та безпеку застосування акалабрутинібу порівняно зі стандартною терапією у пацієнтів з уперше виявленим ХЛЛ. Загалом до дослідження було включено 535 пацієнтів, яких рандомізували у три групи: перша група отримувала комбіноване лікування акалабрутинібом та обінутузумабом (n=179), друга – монотерапію акалабрутинібом (n=179), а третя – комбінацію обінутузумабу з хлорамбуцилом (n=177).
Результати дослідження ELEVATE-TN продемонстрували, що застосування акалабрутинібу як у монотерапії, так і в комбінації з обінутузумабом є значно ефективнішою стратегією лікування ХЛЛ порівняно зі стандартною ІХТ обінутузумабом і хлорамбуцилом. За отриманими результатами, виживаність без прогресування (ВБП) у групі акалабрутинібу з обінутузумабом склала 84% протягом 5 років, при монотерапії акалабрутинібом ВБП становила 72%, тоді як при комбінованій терапії обінутузумаб + хлорамбуцил – лише 21% (рис. 1). Завдяки результатам дослідження ELEVATE-TN здійснено значний прорив у лікуванні ХЛЛ. Сьогодні застосування BTKі (акалабрутинібу) у формі таблеток можна розглядати у монорежимі, що певним чином полегшує лікування, зменшує токсичне навантаження і підвищує комплаєнтність пацієнта до терапії. При цьому важливо зазначити, що акалабрутиніб продемонстрував значну ефективність у терапії ХЛЛ у пацієнтів з цитогенетичними аномаліями. Зокрема, наявність цитогенетичних аномалій, таких як Del(17p) та мутації ТР53 у пацієнтів з ХЛЛ не впливала на ВБП в групі акалабрутинібу.
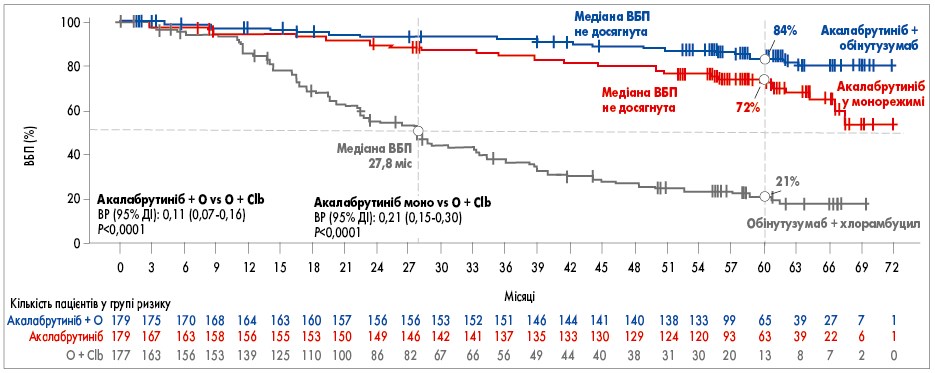 Рис 1. ВБП за результатами дослідження ELEVATE-TN: 5 років спостереження
Рис 1. ВБП за результатами дослідження ELEVATE-TN: 5 років спостереження
О – обінутузумаб; Clb – хлорамбуцил; ВР – відношення ризиків; ДІ – довірчий інтервал.
Sharman J.P, et al. Poster Presented at: ASCO; June 3-7, 2022.
Таким чином, результати дослідження ELEVATE-TN продемонстрували, що акалабрутиніб є ефективним при лікуванні ХЛЛ, незалежно від наявності/відсутності факторів поганого прогнозу у пацієнтів. Отримані дані засвідчили прорив у лікуванні ХЛЛ і виділили акалабрутиніб серед інших таргетних препаратів, оскільки ефективність інших малих молекул, наприклад, венетоклаксу (інгібітор BCL-2), певним чином змінюється залежно від наявності/відсутності у пацієнтів Del(17p) та TP53 [5, 6]. Ефективність застосування акалабрутинібу при ХЛЛ знайшла своє відображення і в настановах ESMO (2021), згідно з якими пацієнтам з наявною Del(17p) або мутацією TP53 в першій лінії терапії ХЛЛ рекомендовано використовувати акалабрутиніб (ІІІ, А) [7].
Наразі в арсеналі лікарів наявні кілька препаратів групи BTKі, в тому числі ібрутиніб. І важливим питанням ведення пацієнтів з ХЛЛ є визначення, який з представників BTKі має кращий профіль ефективності в групі пацієнтів високого ризику. Відповідно до результатів сучасних досліджень, медіана ВБП на фоні застосування ібрутинібу перевищувала 40 міс: при Del(17p) та TP53 – 40,6 міс, при Del(17p) або TP53 – 40,7 міс, при відсутності Del(17p) або TP53 – 56,9 міс [8]. За сучасними даними, медіана ВБП на фоні застосування акалабрутинібу протягом 5 років не досягнута в підгрупі пацієнтів із зазначеними генетичними порушеннями.
Оскільки основною популяцією пацієнтів з ХЛЛ є особи старшого віку, питання токсичності терапії у цих хворих стоїть дуже гостро. Сучасні дані свідчать, що частота побічних явищ (ПЯ) на фоні застосування акалабрутинібу є нижчою порівняно з іншими таргетними молекулами. За результатами дослідження ELEVATE-TN, більшість несприятливих подій були 1-2 ступенів тяжкості і головним чином проявлялись як головний біль, діарея, синці та втомлюваність. Нейтропенія спостерігалась лише в 32% випадків. Такий прийнятний профіль безпеки препарату також відобразився на прихильності пацієнтів до лікування. За отриманими даними, у групі пацієнтів, які отримували акалабрутиніб, відзначалася низька частота відміни лікування та зниження дози внаслідок ПЯ [4, 11].
У 2021 р. оприлюднені результати метааналізу M.S. Davids та співавт. (2021), в якому також порівнювали ефективність застосування акалабрутинібу з ібрутинібом та венетоклаксом [12]. Для оцінки безпеки терапії був застосований метод узгодженого скоригованого непрямого порівняння (matchingadjusted indirect comparison – MAIC). Він дав змогу продемонструвати сприятливий профіль безпеки терапії на основі акалабрутинібу порівняно з іншими таргетними препаратами (ібрутинібом, венетоклаксом) у пацієнтів із ХЛЛ, які раніше не отримували лікування. При цьому статистично значущої різниці щодо ВБП при використанні акалабрутинібу (з обінутузумабом або без нього) та будь-якого із препаратів порівняння не виявлено. За отриманими даними, використання акалабрутинібу характеризується нижчим ризиком розвитку нейтропенії, тромбоцитопенії та інфекцій. Оскільки основним чинником самостійного припинення лікування хворими є саме ПЯ, хороший профіль безпеки терапії – важливий фактор ефективності лікування.
Таким чином, стратифікація пацієнтів за групами ризику з виявленням цитогенетичних аномалій (Del(17p), TP53) та мутаційного статусу IGHV необхідна для визначення прогнозу пацієнтів та вибору стратегії лікування. Нові таргетні молекули мають значну перевагу щодо тривалості лікування без рецидиву або смерті у пацієнтів з ХЛЛ, в тому числі групи високого ризику прогресування та смерті, порівняно зі стандартною ІХТ. Результати сучасних досліджень підтвердили ефективність і безпеку застосування акалабрутинібу при ХЛЛ. Ці дані знайшли своє відображення у рекомендаціях ESMO й NCCN та в українському уніфікованому протоколі з ведення пацієнтів з ХЛЛ (наказ МОЗ України № 1635 від 09.09.2022) [7, 13, 14].
.jpg) Завідувачка науково-дослідного відділення хіміотерапії гемобластозів та ад’ювантних методів лікування Національного інституту раку (м. Київ), доктор медичних наук, професор Ірина Анатоліївна Крячок у своїй доповіді продовжила висвітлення проблеми ведення пацієнтів з ХЛЛ, зокрема з рецидивами і рефрактерними формами.
Завідувачка науково-дослідного відділення хіміотерапії гемобластозів та ад’ювантних методів лікування Національного інституту раку (м. Київ), доктор медичних наук, професор Ірина Анатоліївна Крячок у своїй доповіді продовжила висвітлення проблеми ведення пацієнтів з ХЛЛ, зокрема з рецидивами і рефрактерними формами.
– Перебіг ХЛЛ супроводжується накопиченням мутацій з формуванням резистентних клонів. І якщо на початку захворювання може бути наявний лише один резистентний клон, то з часом їх кількість значно збільшується (рис. 2А). Це сприяє прогресуванню захворювання та відповідно супроводжується погіршенням клінічної симптоматики, перебіг захворювання стає більш агресивним [15, 16]. Відомо, що ХЛЛ може прогресувати до агресивної форми, яка є рефрактерною до ХТ. Пацієнти цієї групи зазвичай мають коротку виживаність (медіана <12 міс) і більш схильні до розвитку ПЯ, зокрема інфекцій (рис. 2Б).
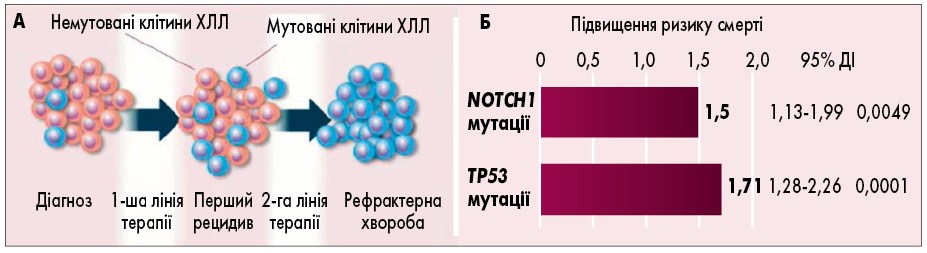 Рис. 2. Клональні зміни клітин при ХЛЛ та їх наслідки [17]: А – клональність клітин змінюється протягом перебігу ХЛЛ; Б – накопичення мутованих клонів асоціюється з підвищеним ризиком смерті
Рис. 2. Клональні зміни клітин при ХЛЛ та їх наслідки [17]: А – клональність клітин змінюється протягом перебігу ХЛЛ; Б – накопичення мутованих клонів асоціюється з підвищеним ризиком смерті
Першочерговим етапом ведення пацієнтів з ХЛЛ, згідно з міжнародними рекомендаціями, є їх стратифікація за групами ризику з визначенням цитогенетичних аномалій, які включають Del(17p) та мутацію TP53. Відповідно до останньої редакції настанови ESMO щодо ведення пацієнтів з ХЛЛ, друга лінія терапії призначається на основі наявності/відсутності у пацієнта з ХЛЛ цитогенетичних аномалій, а також тривалості ремісії захворювання [7]. Так, при наявності Del(17p) або мутації TP53 у другій лінії терапії рекомендовані такі схеми: ібрутиніб або акалабрутиніб [І, А], венетоклакс + ритуксимаб [І, А], монотерапія венетоклаксом [ІІІ, А], іделалісиб + ритуксимаб [ІІ, В] та алогенна трансплантація стовбурових клітин для хворих молодого віку; повторення ІХТ або призначення de novo може бути рекомендоване лише пацієнтам, які мали тривалу ремісію (>36 міс).
Наразі у світі схвалено п’ять опцій лікування рецидивуючої/рефрактерної форми (р/р) ХЛЛ – ібрутиніб [18], іделалісиб + ритуксимаб [19], акалабрутиніб [20], дувелісиб [21], венетоклакс [22] та венетоклакс + ритуксимаб [23]. Однак сьогодні в Україні доступні лише чотири опції лікування р/рХЛЛ: ібрутиніб, акалабрутиніб, венетоклакс і венетоклакс + ритуксимаб. Оскільки всі вищенаведені таргетні препарати мають різні механізми дії, постає питання щодо вибору найбільш ефективного та безпечного препарату для лікування р/рХЛЛ. Якщо проаналізувати наявні на сьогодні дані, перевагу мають ВТКі або венетоклакс, тоді як РІ3Кі менш ефективні [24].
Наразі наявна значна кількість досліджень, у яких оцінювали ефективність застосування малих таргетних молекул при р/рХЛЛ. У 2014 р. були презентовані результати багатоцентрового відкритого дослідження ІІІ фази RESONATE, у якому порівнювали ефективність використання ібрутинібу та офатумумабу у пацієнтів з ХЛЛ [25]. Було визначено, що застосування ібрутинібу значно покращує ВБП, загальну виживаність і рівень відповіді на терапію пацієнтів із ХЛЛ. Схожі дані були отримані у дослідженні HELIOS: додавання ібрутинібу до бендамустину та ритуксимабу сприяло значному покращенню результатів лікування та не супроводжувалося розвитком ПЯ порівняно з контрольною групою [26]. При цьому застосування ібрутинібу було ефективнішим, якщо препарат використовували після меншої кількості ліній попередньої терапії ХЛЛ.
У 2019 р. були оприлюднені результати дослідження RESONATE-2, у якому проаналізовано довгострокові результати терапії ВТКі. Так, 60-місячна ВБП у пацієнтів, які отримували ібрутиніб у першій лінії терапії, склала 70%, включно з пацієнтами з цитогенетичними факторами високого ризику [27]. При 7-річному спостережні було визначено, що застосування ібрутинібу в першій лінії терапії та при р/рХЛЛ залишається ефективним: ВБП при використанні препарату у першій лінії терапії складала 80%, при р/рХЛЛ – 32% [28].
Відомим представником групи інгібіторів BCL-2 є венетоклакс, який за час свого застосування зарекомендував себе як ефективний препарат для лікування ХЛЛ, в тому числі р/рХЛЛ. У 2018 р. були презентовані результати міжнародного багатоцентрового рандомізованого відкритого клінічного дослідження ІІІ фази MURANO, в якому порівнювали ефективність застосування у пацієнтів з р/рХЛЛ комбінованої терапії венетоклаксом і ритуксимабом з бендамустином та ритуксимабом [29]. Результати 5-річного аналізу продемонстрували, що використання венетоклаксу дає змогу зберегти переваги щодо ВБП, починаючи від первинного аналізу і до 5-річного аналізу [30-32]. Як за результатами первинного аналізу, так і 5-річного аналізу довша ВБП зареєстрована у пацієнтів, у яких не було мінімальної залишкової хвороби (undetectable minimal residual disease – uMRD). Через 5 років після завершення дослідження MURANO перевага за показником ЗВ застосування венетоклаксу та ритуксимабу порівняно з бендамустином та ритуксимабом зберігалася на всіх етапах дослідження. Через 3 роки після закінчення лікування ризик смерті у групі венетоклаксу був на 60% нижчим.
Щодо безпеки застосування венетоклаксу, за отриманими даними, найпоширенішим ПЯ була нейтропенія, менш поширеними ПЯ – тромбоцитопенія, пневмонія та ін. Звичайно, розвиток ПЯ був ключовим чинником відміни терапії. Загальна частота передчасної відміни венетоклаксу складала 24,7% (48 з 194 пацієнтів). Проте розвиток ПЯ іноді можна контролювати шляхом корекції дози препарату. Так, аналіз даних 5-річного спостереження продемонстрував, що профіль безпеки схем з венетоклаксом є керованим, при цьому частота ПЯ 3-4 ступеня знижується протягом курсу лікування, а протягом 3 і 5 років після завершення лікування нових небажаних подій виявлено не було.
Акалабрутиніб – новий представник групи BTKі, схвалений для лікування онкогематологічних захворювань як у США, так і в Європі [33, 34]. Підґрунтям для схвалення застосування препарату при ХЛЛ були результати рандомізованого багатоцентрового відкритого дослідження ІІІ фази ASCEND, у якому оцінювали безпеку й ефективність використання препарату у пацієнтів з р/рХЛЛ [35, 36]. Загалом до дослідження було включено 310 пацієнтів з р/рХЛЛ, які отримали принаймні один курс терапії, що не включав інгібітори BCL-2 або BTKі у попередніх лініях. Учасників рандомізували у такі групи:
- монотерапії акалабрутинібом у дозі 100 мг двічі на добу до прогресування захворювання або розвитку неприйнятної токсичності;
- порівняння з терапією на вибір дослідника:
- іделалісиб у дозі 150 мг двічі на добу у комбінації з ритуксимабом у дозі 375 мг/м2 площі поверхні тіла внутрішньовенно у 1-й день першого циклу, потім у дозі 500 мг/м2 внутрішньовенно через кожні 2 тижні до отримання 4 доз, а потім через кожні 4 тижні до отримання 3 доз, що загалом відповідає 8 інфузіям (IdR);
- бендамустин у дозі 70 мг/м2 (у 1-й та 2-й дні кожного 28-денного циклу) у комбінації з ритуксимабом (375 мг/м2/500 мг/м2) у 1-й день кожного 28-денного циклу протягом до 6 циклів (BR).
Пацієнти були стратифіковані за мутаційним статусом Del(17p), функціональним статусом за шкалою ECOG (0 або 1 проти 2) та кількістю отриманих курсів терапії (1-3 проти ≥4). Також важливо зазначити, що у цьому дослідженні була обговорена можливість кросоверу. Так, після підтвердження прогресування захворювання 52% пацієнтів, які були рандомізовані за вибором дослідника для отримання комбінації IdR/BR, перейшли на монотерапію акалабрутинібом.
За результатами дослідження ASCEND, медіана ВБП у групі акалабрутинібу досягнута не була, у групі IdR/BR вона склала 16,1 міс (95% ДІ 14,0-17,1; рис. 3). ВБП в групі акалабрутинібу не залежала від попередніх ліній терапії. Проте якщо пацієнт отримав одну або дві попередні лінії терапії, ВБП була дещо вищою порівняно із групою хворих, які попередньо отримували чотири і більше ліній терапії. Що стосується цитогенетичних аномалій, то згідно з результатами акалабрутиніб демонстрував однакову ефективність щодо ВБП (80%), незалежно від наявності/відсутності Del(17p) та/або мутації ТР53. Протягом 4 років спостереження медіана ВБП у групі акалабрутинібу не була досягнута. При цьому у 62% пацієнтів групи акалабрутинібу не виявлено прогресування чи смерті, тоді як в групі бендамустину й ритуксимабу (стандартної схеми лікування в Україні) кількість пацієнтів без подій становила лише 5%, тобто 95% пацієнтів мали прогресування захворювання або померли (рис. 3). Водночас частота загальної відповіді була зіставною з такою у групі порівняння: акалабрутиніб 83%, IdR/BR 84%. Говорячи про безпеку терапії, особливістю акалабрутинібу є його відносно низький профіль токсичності: нейтропенія спостерігалася у 19%. Такий прийнятний профіль безпеки асоціювався з низькою частотою переривання терапії, яка складала 23%, відміни препарату – 19%, в тому числі з приводу ПЯ – 11%.
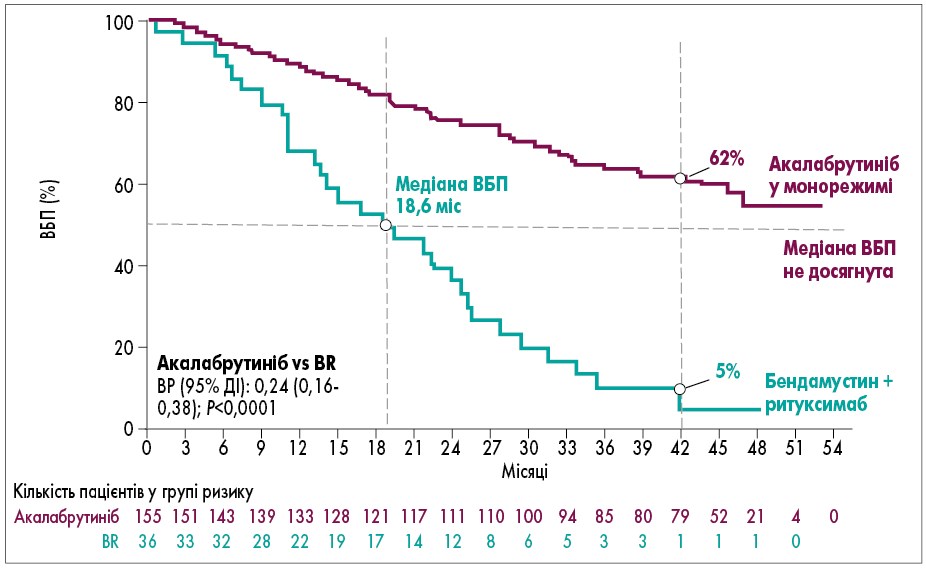 Рис 3. ВБП за результатами дослідження ASCEND: акалабрутиніб vs бендамустин + ритуксимаб (BR); 4 роки спостереження
Рис 3. ВБП за результатами дослідження ASCEND: акалабрутиніб vs бендамустин + ритуксимаб (BR); 4 роки спостереження
Jurczak W. et al. Poster Presented at: ASCO; June 3-7, 2022.
Особливий інтерес представляє рандомізоване багатоцентрове відкрите дослідження III фази ELEVATE-RR, у якому порівнювали ефективність акалабрутинібу у дозі 100 мг з ібрутинібом у дозі 420 мг у пацієнтів з р/рХЛЛ із групи високого ризику [37]. У цьому дослідженні вперше порівнювали BTKі II покоління з ібрутинібом. Згідно з отриманими даними, обидва препарати мають зіставні результати за ВБП. Що стосується профілю безпеки, у групі ібрутинібу частота ПЯ будь-якого ступеня тяжкості була на 37% вищою, ніж у пацієнтів, які отримували акалабрутиніб. Окрім того, застосування акалабрутинібу супроводжувалося статистично нижчою частотою фібриляції передсердь та артеріальної гіпертензії, а також кровотеч, ніж ібрутинібу.
Відповідно до сучасних стандартів надання медичної допомоги пацієнтам з р/рХЛЛ, вибір нового агента повинен бути виваженим і ґрунтуватися на доказах ефективності та безпеки такої терапії, в тому числі враховувати такі фактори, як зручність застосування, тривалість лікування та можливість економії коштів. Сучасні дані підтверджують, що таргетна терапія сьогодні має істотні переваги перед стандартним лікуванням р/рХЛЛ, особливо це стосується пацієнтів високого ризику з цитогенетичними порушеннями. Сукупність даних досліджень ASCEND та ELEVATE-RR підтверджує, що акалабрутиніб є кращим варіантом лікування ХЛЛ, в тому числі р/рХЛЛ, у дорослих пацієнтів і має сприятливіший профіль безпеки, ніж інші варіанти класичної терапії. Нові дані знайшли своє відображення і в останній настанові NCCN (2023), у якій акалабрутиніб рекомендований до застосування як у першій, так і в наступних лініях терапії ХЛЛ, тоді як ХТ не рекомендована пацієнтам цієї групи [13].
Список літератури знаходиться в редакції.
Підготувала Анна Хиць
Тематичний номер «Онкологія. Гематологія. Хіміотерапія» № 6 (79) 2022 р.



