19 липня, 2024
Оновлені стандарти лікування пацієнтів із цукровим діабетом: огляд важливих положень
Сьогодні цукровий діабет (ЦД) є однією з найактуальніших медико-соціальних проблем суспільства й частих причин передчасної захворюваності та смертності. Внаслідок неконтрольованого ЦД виникає гіперглікемія, що призводить до ураження багатьох систем організму людини. Саме тому необхідний комплексний підхід до лікування пацієнтів із ЦД, що передбачає зниження ризиків ускладнень, асоційованих із цим захворюванням. Американська діабетична асоціація (ADA, 2024) розробила оновлені стандарти лікування пацієнтів із ЦД, які охоплюють поточні науково обґрунтовані рекомендації щодо ведення таких хворих. Основну увагу автори зосередили на стратегіях діагностики, профілактики та лікування ЦД в осіб різного віку, контролі пов’язаних із ним супутніх патологій, а також терапевтичних підходах, спрямованих на мінімізацію ускладнень і поліпшення показників здоров’я. Пропонуємо до вашої уваги огляд розділів документа «Summary of Revisions: Standards of Care in Diabetes‑2024» з акцентом на таких аспектах, як зниження ваги та лікування ожиріння в межах профілактики й терапії ЦД 2-го типу, фармакологічні підходи за глікемії та контроль серцево-судинних захворювань (ССЗ) і ризиків на тлі ЦД.
Важливість контролю ваги та лікування ожиріння в межах профілактики й терапії ЦД 2-го типу. Ожиріння – це хронічне, часто рецидивне захворювання, що супроводжується метаболічними, фізичними та психосоціальними ускладненнями, зокрема зі значним підвищенням ризику розвитку ЦД 2-го типу (Narayan et al., 2007).
За даними наукових досліджень, лікування ожиріння може запобігти прогресуванню переддіабету, відіграваючи важливу роль у терапії ЦД 2-го типу (Davies et al., 2015; Rubino et al., 2017).
Систему класифікації даних, на яких ґрунтуються представлені рекомендації ADA (2024) щодо стандартів лікування пацієнтів із ЦД, наведено в таблиці 1.
|
Таблиця 1. Система класифікації доказових даних |
|
|
Рівень доказо-вості |
Роз’яснення |
|
А |
Чіткі доказові дані належної якості, отримані завдяки: • добре виконаним РКД, зокрема багатоцентрового дослідження метааналізу, який охоплює оцінювання їх якості Підтверджувальні дані належної якості, отримано завдяки добре виконаним РКД, зокрема: • дослідження в одній або кількох установах • метааналізу, який охоплює оцінювання їх якості |
|
В |
Підтверджувальні доказові дані, отримані завдяки добре виконаним дослідженням, зокрема: • проспективного когортного дослідження або реєстру • метааналізу когортних досліджень Підтверджувальні доказові дані, отримані завдяки добре проведеному дослідженню типу «випадок–контроль» |
|
С |
Підтверджувальні доказові дані, отримані в неналежний спосіб організованих контрольованих / неконтрольованих досліджень, зокрема: • РКД з однією або кількома серйозними чи ≥3 незначними методологічними помилками, які можуть трансформувати результати у недійсні • Обсерваційних досліджень із високою ймовірністю систематичної похибки (наприклад, серії випадків порівняння з історичним контролем) • Серії випадків або звітів про клінічні випадки Суперечливі доказові дані за наявності певних вагомих висновків, що підтверджують рекомендацію |
|
E |
Консенсус експертів або клінічний досвід |
|
Примітка. РКД – рандомізовані контрольовані дослідження. |
|
Оцінювання й моніторинг осіб із надлишковою вагою та ожирінням
Для підтвердження діагнозу ожиріння в осіб із ЦД необхідно визначити зріст і вагу для розрахунку індексу маси тіла, а також окружність талії, її співвідношення до стегон та/або до зросту для встановлення розподілу жиру в організмі (рівень доказовості E).
Моніторинг антропометричних вимірювань, пов’язаних з ожирінням, важливо виконувати щонайменше раз на рік для коригування тактики лікування (рівень доказовості E).
В осіб із ЦД 2-го типу та надмірною вагою або ожирінням контроль маси тіла та глікемії є основною метою лікування (рівень доказовості А). При цьому втрата ваги на 3‑7% проти початкової асоційована з нормалізацією глікемії, зменшенням інших чинників серцево-судинного (СС) ризику та потреби в застосуванні цукрознижувальних препаратів. Своєю чергою стійке зниження ваги на >10% пов’язане зі зниженням рівня глікованого гемоглобіну (HbA1C) і глюкози натще, а також сприяє досягненню стійкої ремісії ЦД і зменшенню СС наслідків та смертності (рівень доказовості В) (Lean et al., 2019; Kahan et al., 2017). Ефективними методами для досягнення й підтримання значущої втрати ваги, а також зниження пов’язаних з ожирінням ризиків для здоров’я є:
- Інтенсивне консультування пацієнтів щодо поведінки та способу життя.
- Фармакотерапія ожиріння.
- Метаболічна хірургія.
Зазначені стратегії лікування ожиріння мають бути індивідуалізованими (рівень доказовості A) на підставі даних історії хвороби пацієнта, життєвих обставин, уподобань та мотивації (рівень доказовості C). У разі потреби доцільно розглянути комбінований підхід до терапії (рівень доказовості E).
Препарати для фармакотерапії ожиріння
Для короткострокового лікування (≤12 тижнів)
Симпатоміметичний аноректик фентермін
Для довгострокового лікування (>12 тижнів)
- Інгібітор шлунково-кишкових ліпаз орлістат
- Комбінація симпатоміметичного аноректика / протиепілептичного засобу фентерміну й топірамату
- Комбінація антагоніста опіоїдів налтрексону та антидепресанту бупропіону подовженого вивільнення
- Агоністи рецепторів ГПП‑1 ліраглутид, семаглутид
ГІП/арГПП‑1 тирзепатид
Примітка: ГПП – глюкагоноподібний пептид, арГПП – агоністи рецепторів глюкагоноподібного пептиду, ГІП – глюкозозалежний інсулінотропний поліпептид.
Адаптовано за American Diabetes Association Professional Practice Committee Diabetes Care, 2024.
Контроль харчування, належна фізична активність та поведінкова терапія
Хворим на ЦД 2-го типу з надмірною вагою або ожирінням рекомендовано дотримуватись режиму здорового харчування, рівня належної фізичної активності і поведінкової терапії для досягнення та підтримання втрати ваги на ≥5% (рівень доказовості В). Рекомендації щодо харчування мають бути персоналізованими відповідно до вподобань і потреб пацієнта (Evert et al., 2019).
Програми підтримки ваги передбачають регулярний моніторинг маси тіла та інші стратегії самоконтролю, а також заохочення до стабільної фізичної активності (200‑300 хв/тиждень) (рівень доказовості А). Для підтримання зниження ваги рекомендовано застосовувати комплексні стратегії та консультування у довгостроковій перспективі (рівень доказовості В).
У разі досягнення пацієнтом цільової втрати ваги необхідно продовжувати відстежувати його прогрес, надавати підтримку та надалі вживати заходів для збереження нормальної маси тіла (рівень доказовості E) (Gregg et al., 2016).
Інтенсивна поведінкова терапія з підтвердженою ефективністю, що передбачає ≥16 сеансів упродовж перших шести місяців, охоплює заходи з контролю харчування, адекватну фізичну активність та поведінкові стратегії для досягнення дефіциту калорій ~500‑750 ккал/день (Franz et al., 2015).
Фармакологічне лікування
Фармакотерапію ожиріння для осіб із ЦД та надмірною вагою або ожирінням рекомендовано розглядати разом із модифікацією способу життя, зважаючи на ймовірні чинники користі й ризику (рівень доказовості А). У разі вибору цукрознижувальної терапії (ЦЗТ) для пацієнтів із ЦД 2-го типу та надлишковою вагою або ожирінням варто віддавати перевагу лікарським засобам, які не зумовлюють збільшення маси тіла (рівень доказовості В).
Управління з контролю за якістю харчових продуктів та лікарських засобів США (FDA) затвердило низку препаратів для контролю ваги як додаткову стратегію до низькокалорійної дієти та підвищеної фізичної активності в осіб з ожирінням та одним чи кількома супутніми захворюваннями (як-от ЦД 2-го типу, артеріальна гіпертензія (АГ) та/або дисліпідемія).
Майже всі схвалені FDA ліки проти ожиріння поліпшують контроль глікемії у пацієнтів із ЦД 2-го типу та запобігають прогресуванню хвороби (Kahan et al., 2017).
Під час лікування хворих на ЦД із надлишковою вагою чи ожирінням доцільно віддавати перевагу препаратам, які мають як цукрознижувальний ефект, так і допомагають втратити вагу. Це агоністи рецепторів глюкагоноподібного пептиду 1 (арГПП‑1) ліраглутид та семаглутид або подвійний агоніст інкретину – глюкозозалежний інсулінотропний поліпептид (ГІП) / арГПП‑1 тирзепатид, які мають підтверджену ефективність щодо зниження ваги, а також глікемічну й кардіометаболічну дії (рівень доказовості А) (Marso et al., 2016; Garvey et al., 2023).
Для пацієнтів, які не можуть досягти цільового зменшення маси тіла на тлі використання цих препаратів, або погано їх переносять чи вони протипоказані, доцільно:
- Переглянути стратегію контролю ваги.
- Інтенсифікувати лікування за допомогою інших підходів, як-от метаболічна хірургія, додаткові фармакологічні засоби та структуровані програми контролю способу життя (рівень доказовості А).
Також необхідно за можливості звести до мінімуму застосування препаратів для лікування супутніх захворювань, які можуть спричиняти збільшення ваги, та запропонувати альтернативні варіанти (рівень доказовості E). Як відомо, до збільшення маси тіла також можуть призводити антипсихотики (як-от клозапін, оланзапін, рисперидон), деякі антидепресанти (трициклічні антидепресанти, деякі селективні інгібітори зворотного захоплення серотоніну та інгібітори моноаміноксидази), глюкокортикоїди, ін’єкційні прогестини, деякі протисудомні засоби (як-от габапентин і прегабалін), β-блокатори, седативні антигістамінні й антихолінергічні засоби (Domecq et al., 2015).
Метаболічна хірургія
Завдяки метаболічній хірургії як методу розв’язання проблеми надмірної ваги та лікування ожиріння можна значно знизити рівень глюкози крові, досягти ремісії ЦД, поліпшити якість життя цих пацієнтів, зменшити СС наслідки та смертність (Wiggins et al., 2020; Aminian et al., 2021).
Власне, метаболічну хірургію рекомендовано розглядати для контролю рівня ваги та глікемії у хворих на ЦД з індексом маси тіла ≥30,0 кг/м2 без протипоказань для виконання хірургічного втручання (рівень доказовості А). Після операції пацієнти мають отримувати тривалу медичну та поведінкову підтримку, проходити регулярний моніторинг мікронутрієнтів, режиму харчування та метаболічного статусу (рівень доказовості В). Пацієнти, які перенесли метаболічну операцію, мають щонайменше що 6‑12 міс. проходити регулярний моніторинг рівня глюкози та маси тіла (рівень доказовості E).
У разі недостатньої втрати ваги або рецидиву необхідно оцінити можливі причини та розглянути додаткові заходи для її зниження (як-от фармакотерапія ожиріння) (рівень доказовості C).
Фармакологічні підходи до лікування глікемії
Медикаментозна терапія за цукрового діабету 1-го типу
Інсулінотерапія є важливою для осіб із ЦД 1-го типу, оскільки деструкція β-клітин підшлункової залози на тлі хвороби призводить до різкого зниження секреції інсуліну. За останні десятиліття накопичено доказові дані (завдяки підтвердженим ефективності й безпеці для хворих на ЦД 1-го типу) щодо потреби в інтенсивнішій замісній терапії з використанням багаторазових щоденних ін’єкцій або безперервного підшкірного введення інсуліну (Lachin et al., 2021).
Для лікування дорослих пацієнтів із ЦД 1-го типу рекомендовано безперервне підшкірне введення інсуліну або багаторазове щоденне застосування прандіального (ін’єкційного чи інгаляційного) та базального інсуліну (рівень доказовості А) (Holt et al., 2021). Для осіб із ЦД 1-го типу аналоги інсуліну (або інгаляційний) мають переваги над людським інсуліном для ін’єкцій завдяки нижчому ризику гіпоглікемії (рівень доказовості А) (Tricco et al., 2014; Bartley et al., 2008). Дорослим із ЦД 1-го типу рекомендовано ранній безперервний моніторинг рівня глюкози для:
- Поліпшення глікемічних показників.
- Підвищення рівня якості життя.
- Мінімізації гіпоглікемії (рівень доказовості В).
Пацієнти мають пройти навчання щодо розрахунку дози інсуліну за кількістю вуглеводів, жирів і білків у їжі та її корекції на основі ступеня супутньої глікемії та очікуваної фізичної активності (рівень доказовості В). Глюкагон рекомендовано призначати всім хворим пацієнтам, які приймають інсулін або мають високий ризик гіпоглікемії (рівень доказовості E) (Valentine et al., 2019; Settles et al., 2020).
План інсулінотерапії рекомендовано переглядати через регулярні проміжки часу (що 3‑6 міс.) і коригувати, зважаючи на чинники, що впливають на вибір лікування та забезпечують досягнення індивідуальних глікемічних цілей (рівень доказовості E) (Champakanath et al., 2022).
Фармакотерапія за цукрового діабету 2-го типу
У пацієнтів із ЦД 2-го типу рекомендовано застосовувати цілісний багатогранний особистісно-орієнтований підхід відповідно до індивідуальних чинників, які мають вплив на вибір лікування та пов’язаних із ним ускладнень. Медикаментозну терапію рекомендовано розпочинати після встановлення діагнозу ЦД 2-го типу (без протипоказань).
Фармакологічні підходи до контролю глікемії, зокрема з комбінованою терапією, мають демонструвати адекватну ефективність для досягнення та підтримання лікувальних цілей (Davies et al., 2022).
У пацієнтів із ЦД 2-го типу, які отримують ЦЗТ, важливими є дотримання здорового способу життя, навчання та підтримка самоконтролю ЦД, уникнення терапевтичної інерції та соціальні детермінанти здоров’я (рівень доказовості А).
Під час вибору фармакологічних препаратів для дорослих хворих на ЦД 2-го типу рекомендовано дотримуватися особистісно-орієнтованого підходу за спільного прийняття рішень та брати до уваги:
- Вплив лікування на супутні захворювання нирок і ССЗ.
- Ефективність терапії.
- Ризик гіпоглікемії.
- Вплив на вагу.
- Вартість і доступність ліків.
- Ризик розвитку побічних реакцій і переносимість.
- Індивідуальні побажання пацієнта (рівень доказовості E).
У дорослих осіб із ЦД 2-го типу доцільно розглянути раннє комбіноване лікування, щоб пришвидшити досягнення індивідуальних цілей (рівень доказовості А). Зокрема, у пацієнтів із ЦД 2-го типу без патології нирок та/або ССЗ фармакотерапія має бути спрямована на досягнення індивідуальних глікемічних цілей і контролю ваги (рівень доказовості А) (рис. 1).
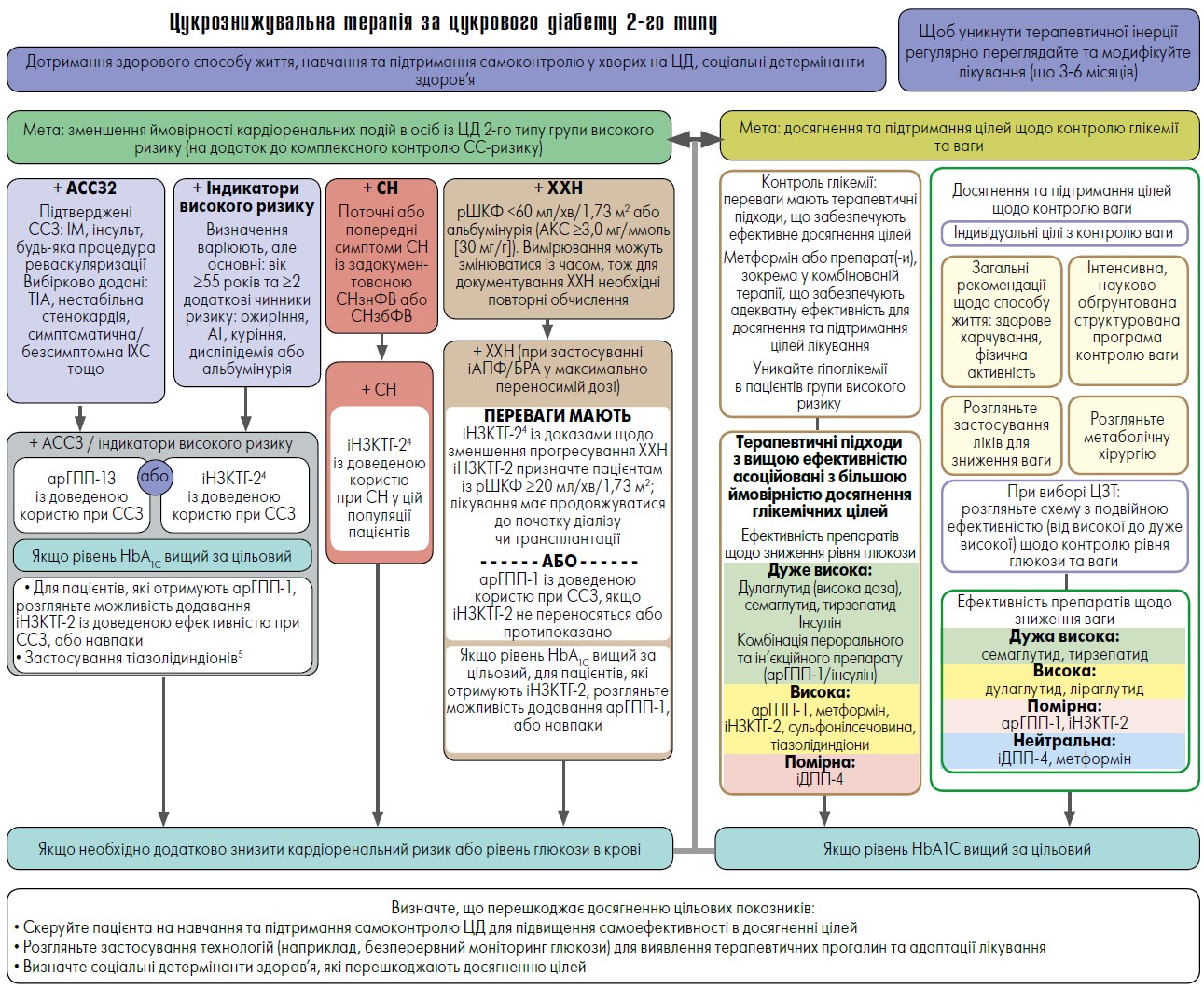 Рис. 1. Застосування цукрознижувальної терапії в пацієнтів із цукровим діабетом 2-го типу
Рис. 1. Застосування цукрознижувальної терапії в пацієнтів із цукровим діабетом 2-го типу
Примітки: АССЗ – атеросклеротичні серцево-судинні захворювання; іДПП‑4 – інгібітори дипептилпептидази‑4; AКС – співвідношення альбумін / креатинін; ХХН – хронічна хвороба нирок; СН– серцева недостатність; іНЗКТГ‑2 – інгібітори натрійзалежного контранспортера глюкози 2-го типу; арГПП‑1 – антагоністи рецепторів глюкагоноподібного пептиду; рШКФ – розрахункова швидкість клубочкової фільтрації; іАПФ – інгібітори ангіотензинперетворювального ферменту; БРА – блокатори рецепторів ангіотензину, ЦД-цукровий діабет, СНзнФВ – серцева недостатність зі зниженою фракцією викиду; СНзбФВ – серцева недостатність зі збереженою фракцією викиду; ЦЗТ – цукрознижувальна терапія, ІМ –інфаркт міокарда; ТІА – транзиторна ішемічна атака; ІХС – ішемічна хвороба серця.
1 Для осіб із СН, ХХН, встановленими ССЗ або множинними чинниками СС-ризику рішення про застосування арГПП‑1 або іНЗКТГ‑2 із доведеною користю слід приймати незалежно від приймання метформіну.2 Сильна рекомендація є виправданою для пацієнтів із ССЗ та слабша – для осіб із високим СС-ризиком.3 За даними досліджень підтверджено ефективність арГПП‑1 для зниження комбінації серйозних СС-подій, СС-смерті та від будь-яких причин, ІМ, інсульту й ренальних кінцевих точок у хворих на ЦД 2-го типу зі встановленим / високим СС-ризиком.4 За даними досліджень підтверджено ефективність іНЗКТГ‑2 для зниження ризику комбінації серйозних СС-подій, СС-смерті та від будь-яких причин, ІМ, госпіталізації з приводу СН та ниркових наслідків у пацієнтів із ЦД 2-го типу зі встановленим / високим СС-ризиком.5 Тіазолідиндіони у низьких дозах можуть краще переноситися та бути так само ефективними.
Адаптовано за M.J. Davies et al., 2022.
Запровадження стратегії зниження ваги є важливим підходом під час ЦЗТ в осіб із ЦД 2-го типу для поліпшення контролю глікемії, зменшення стеатозу печінки та чинників СС ризику (рівень доказовості А) (Lingvay et al., 2022; Wing et al., 2011). Серед препаратів, схвалених для контролю глікемії, найвищу ефективність щодо зниження ваги наразі мають семаглутид і тирзепатид (Frias et al., 2021; Sorli et al., 2017).
Для пацієнтів, які не досягли індивідуальних цілей щодо зниження ваги, рекомендовано запровадити додаткові заходи, як-от інтенсивніша модифікація способу життя, структуровані програми контролю ваги, медикаментозна терапія або метаболічна хірургія, залежно від клінічних обставин (рівень доказовості А) (Davies et al., 2022).
Найефективнішими стратегіями для досягнення глікемічних цілей у дорослих осіб із ЦД 2-го типу вважаються арГГП‑1 дулаглутид (у високій дозі) і семаглутид, ГІП / арГПП‑1 тирзепатид, інсулін, комбінована пероральна та ін’єкційна терапія (Giorgino et al., 2015; Pratley et al., 2019).
У пацієнтів із ЦД 2-го типу та встановленими атеросклеротичними ССЗ чи високим ризиком їх розвитку, серцевою недостатністю (СН) та/або хронічною хворобою нирок (ХХН) рекомендовано лікування препаратами, що знижують імовірність ССЗ і патології нирок, для контролю глікемії та зниження СС ризику, незалежно від рівня HbA1C, зважаючи на індивідуальні чинники. Це можуть бути інгібітори натрійзалежного котранспортера глюкози 2-го типу (іНЗКТГ‑2) та/або арГГП‑1 (рівень доказовості A).
Особам із ЦД 2-го типу та СН зі зниженою або збереженою фракцією викиду рекомендовано призначати іНЗКТГ‑2 для контролю глікемії та запобігання госпіталізації з приводу СН (рівень доказовості A).
У дорослих хворих на ЦД 2-го типу та ХХН із розрахунковою швидкістю клубочкової фільтрації (рШКФ) 20‑60 мл/хв/1,73 м2 та/або альбумінурією для мінімізації прогресування ХХН, зниження частоти СС подій та госпіталізації з приводу СН рекомендовано застосовувати іНЗКТГ‑2 (рівень доказовості A) (Henry et al., 2012). У разі прогресування ХХН (рШКФ <30 мл/хв/1,73 м2), арГГП‑1 є кращим вибором для контролю глюкози в крові, зокрема, через меншу ймовірність гіпоглікемії та нижчу частоту СС ускладнень (рівень доказовості В). У дорослих пацієнтів із ЦД 2-го типу та ознаками тривалого катаболізму (наприклад, раптова втрата ваги), симптомами гіперглікемії або дуже високим рівнем HbA1C чи глюкози у крові, доцільно розглянути питання щодо початку введення інсуліну незалежно від фонової ЦЗТ чи стадії захворювання (рівень доказовості E). Зокрема, у пацієнтів, які страждають на ЦД 2-го типу, арГПП‑1 або ГІП/арГПП‑1 мають переваги перед інсуліном (рівень доказовості A) (Davies et al., 2022; Dahl et al., 2022).
Для осіб із ЦД 2-го типу, які приймають інсулін, рекомендовано застосовувати комбіновану терапію із застосуванням арГПП‑1 або ГІП/арГПП‑1 задля:
- Підвищення глікемічної ефективності.
- Сприятливого впливу на вагу.
- Зниження ризику гіпоглікемії (Del Prato et al., 2021; Aroda et al., 2017).
Після додавання чи збільшення дозування арГПП‑1 чи ГІП / арГПП‑1 рекомендовано переглянути дозу інсуліну (рівень доказовості A). Дорослим хворим на ЦД 2-го типу після початку інсулінотерапії рекомендовано продовжувати приймати цукрознижувальні препарати (якщо немає протипоказань або непереносимості) для збереження глікемічних і метаболічних переваг, як-от зниження ваги, поліпшення кардіометаболічних показників чи функції нирок (рівень доказовості A).
Щоб мінімізувати ризик гіпоглікемії та зменшити тягар інсулінотерапії на самому початку, у пацієнтів із ЦД 2-го типу варто переглянути потребу в ЦЗТ, що асоційована з вищим ризиком гіпоглікемії, та/або дозування (похідних сульфонілсечовини та меглітинідів) (рівень доказовості A).
У хворих на ЦД 2-го типу, які не досягли індивідуальних терапевтичних цілей, доцільно розглянути модифікацію лікування: інтенсифікацію або деінтенсифікацію (рівень доказовості А) (Maloney et al., 2019).
План терапії рекомендовано переглядати через регулярні проміжки часу (що 3‑6 міс.) і за потреби коригувати залежно від чинників, які впливають на лікування (рівень доказовості E). У разі вибору альтернативної ЦЗТ у пацієнтів із ЦД 2-го типу, які не досягли цільових показників глюкози у крові, необхідно брати до уваги наявність інших коморбідних метаболічних розладів і ризик гіпоглікемії (рівень доказовості А).
Лікування серцево-судинних захворювань та контроль ризиків у пацієнтів із цукровим діабетом
Атеросклеротичні ССЗ (АССЗ) – основна причина захворюваності та смертності осіб із ЦД (Parker et al., 2023). У багатьох дослідженнях було продемонстровано ефективність контролю окремих чинників СС ризику для запобігання або уповільнення АССЗ у хворих на ЦД. Ще однією поширеною причиною захворюваності та смертності від ССЗ є СН. Дані виконаних досліджень засвідчили, що частота випадків госпіталізації з приводу СН була вдвічі вищою серед пацієнтів із ЦД, аніж без нього (Cavender et al., 2015; McAllister et al., 2018). Також у низці досліджень за участю осіб із ЦД 2-го типу, більшість із яких мала АССЗ, кількість госпіталізації через СН значно зменшилася на тлі застосування іНЗКТГ‑2 (Fitchett et al., 2018; McMurray et al., 2019).
За даними метааналізу, іНЗКТГ‑2 знижують ризик госпіталізації з приводу СН, смертність від ССЗ і будь-яких причин у пацієнтів із ССЗ (вторинна профілактика) та без них (первинна профілактика) (Arnott et al., 2020).
Регулювання артеріального тиску в осіб із цукровим діабетом
Скринінг і діагностика. Артеріальний тиск (АТ) рекомендовано вимірювати під час кожного планового візиту до лікаря. В осіб із підвищеним АТ – систолічним АТ (САТ) 120‑129 мм рт. ст. і діастолічним АТ (ДАТ) <80 мм рт. ст. – для підтвердження діагнозу артеріальної гіпертензії (АГ) слід виконати кілька вимірювань, зокрема в окремі дні (Unger et al., 2020). АГ визначається як САТ та ДАТ ≥130 і ≥80 мм рт. ст. відповідно на підставі даних середнього значення двох або більше вимірювань, отриманих за два або більше рази (рівень доказовості А).
У пацієнтів із АТ ≥180/110 мм рт. ст. і ССЗ АГ може бути діагностовано під час одного візиту (рівень доказовості E) (Ishigami et al., 2021). Усім хворим на АГ та ЦД рекомендовано контролювати АТ вдома (рівень доказовості А) (Omboni et al., 2015).
Цілі лікування. Наявні дані досліджень нині підтверджують, що лікування АГ зменшує СС події та мікросудинні ускладнення в осіб із ЦД (Thomopoulos et al., 2017; Xie et al., 2016).
Для осіб із ЦД та АГ цільові показники АТ мають бути індивідуалізовані на основі спільного процесу прийняття рішень, при цьому слід брати до уваги до такі чинники, як:
- СС ризик.
- Потенційні побічні ефекти антигіпертензивних препаратів.
- Уподобання пацієнта (рівень доказовості В).
Під час лікування цільовий АТ має становити <130/80 мм рт. ст., за умови його безпечного досягнення (рівень доказовості А).
У вагітних хворих на ЦД і хронічну АГ визначення верхньої межі АТ 140/90 мм рт. ст. на початку терапії або в разі титрування доз препаратів пов’язане з кращими наслідками щодо вагітності, аніж фокус лікування на тяжкій АГ (рівень доказовості A) (Abalos et al., 2018; Brown et al., 2018).
Наявні обмежені дані щодо оптимальної нижньої межі АТ, але інтенсивність терапії слід знизити, якщо АТ становить <90/60 мм рт. ст. (рівень доказовості E).
Цільового рівня АТ 110‑135/85 мм рт. ст. рекомендовано досягати в межах зниження ризику прогресування АГ у матері (рівень доказовості А).
Терапевтичні стратегії
Модифікація способу життя. Ця стратегія є важливою складовою лікування АГ у пацієнтів із ЦД, оскільки допомагає знизити АТ, підвищити ефективність деяких антигіпертензивних препаратів, а також сприяє поліпшенню метаболічних і судинних показників здоров’я. Для осіб із ЦД, які мають АТ >120/80 мм рт. ст., модифікація способу життя полягає у зниженні ваги за наявності показань, дотриманні здорового раціону харчування, спрямованого на зниження АТ, зокрема зі зменшенням споживання натрію та збільшенням калію, а також помірному вживанні алкоголю, припиненні куріння та підвищенні рівня фізичної активності (рівень доказовості А).
Фармакологічні аспекти. Початкове лікування хворих на ЦД залежить від тяжкості АГ (рис. 2). У пацієнтів із ЦД та підтвердженим офісним АТ ≥130/80 мм рт. ст. слід розпочати медикаментозне лікування та титрувати дози препаратів для досягнення цільового АТ <130/80 мм рт. ст. (рівень доказовості А). В осіб із ЦД та офісним АТ ≥150/90 мм рт. ст., на додаток до модифікації способу життя, необхідно негайно розпочати фармакотерапію та своєчасно титрувати дози двох препаратів або комбінації ліків в одній таблетці, оскільки така стратегія пов’язана зі зменшенням СС подій у хворих на ЦД (рівень доказовості А) (Feldman et al., 2009; Webster et al., 2018).
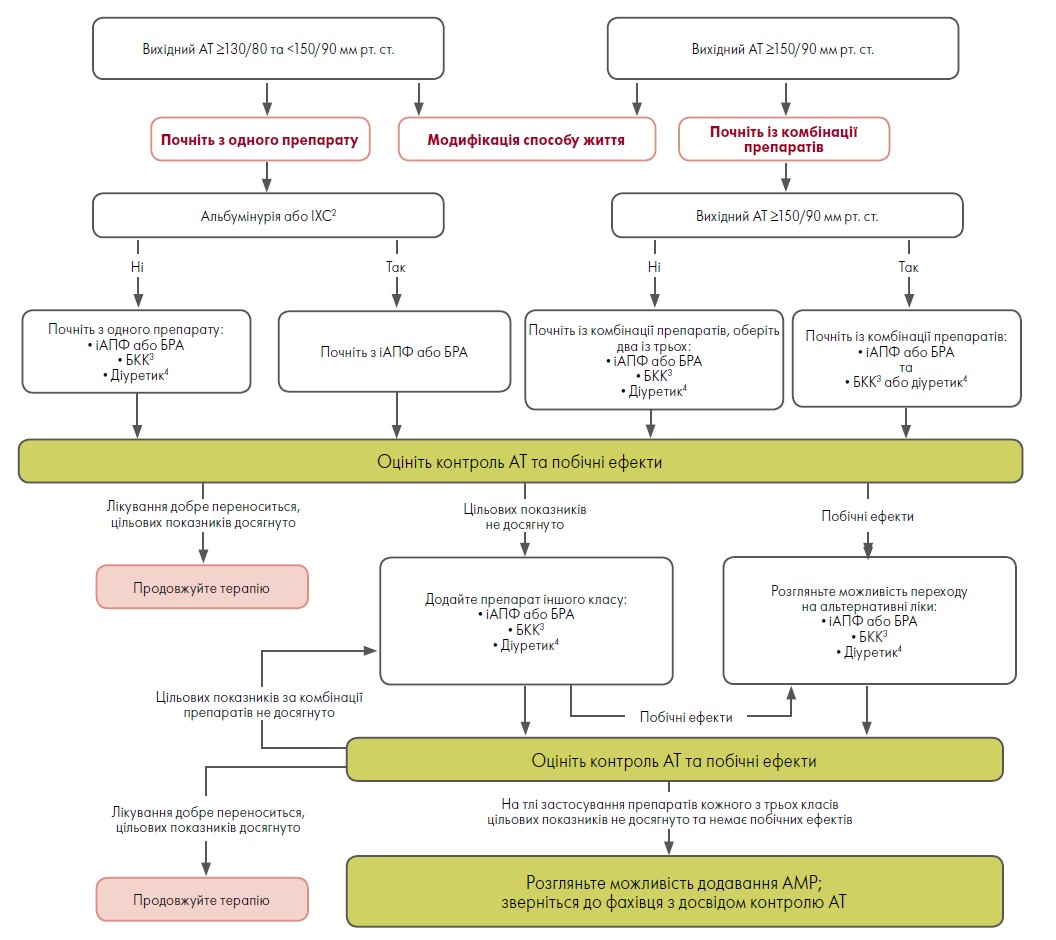
Рис. 2. Лікування підтвердженої артеріальної гіпертензії в пацієнтів із цукровим діабетом1
Примітки: іАПФ – інгібітори ангіотензинперетворювального ферменту, БРА – блокатори рецепторів ангіотензину ІІ, БКК – блокатори кальцієвих каналів, ІХС – ішемічна хвороба серця, АТ – артеріальний тиск, АМР – антагоністи мінералокортикоїдних рецепторів.
1 Необхідний регулярний перегляд терапії (що 3‑6 міс.). Лікування для вагітних пацієнток не рекомендовано.2 Інгібітори АПФ або БРА рекомендовано для лікування АГ в осіб з ІХС або 30‑299 мг/г креатиніну в сечі при визначенні співвідношення альбумін / креатинін та настійно рекомендовано – у разі ≥300 мг/г креатиніну в сечі.3 Дигідропіридиновий БКК.4 Тіазидоподібний діуретик; переваги мають препарати тривалої дії, що зменшують СС-події, як-от хлорталідон та індапамід.
Адаптовано за I.H. de Boer et al., 2017.
Таке лікування передбачає застосування класів препаратів, які продемонстрували зниження СС наслідків у пацієнтів із ЦД:
- Інгібітори ангіотензинперетворювального ферменту (іАПФ).
- Блокатори рецепторів ангіотензину ІІ (БРА).
- Тіазидоподібні діуретики.
- Дигідропіридинові блокатори кальцієвих каналів (БКК) (Palmer et al., 2015; Catala-Lopez et al., 2016).
ІАПФ або БРА рекомендовано як засіб терапії першої лінії при АГ для пацієнтів із ЦД та ішемічною хворобою серця (ІХС) (рівень доказовості А) (Arnold et al., 2020; Yusuf et al., 2008).
Зазвичай для досягнення цільових показників АТ необхідно залучати комбіновану фармакотерапію. Однак не рекомендовано застосовувати іАПФ у поєднанні з БРА, а також іАПФ або БРА (зокрема із БРА / інгібіторами неприлізину) разом із прямими інгібіторами реніну (рівень доказовості А).
Інгібітор АПФ або БРА у максимально переносимій дозі, рекомендованій для лікування АТ, застосовувати як засіб лікування першої лінії у хворих на АГ та ЦД із рівнем креатиніну в сечі ≥300 мг/г (рівень доказовості А) або 30‑299 мг/г (рівень доказовості B). Якщо використання одного класу препаратів неприпустиме, його рекомендовано замінити на інший (рівень доказовості B).
У дорослих пацієнтів, які отримують іАПФ, БРА, антагоніст мінералокортикоїдних рецепторів (АМР) або діуретик, слід контролювати рівень креатиніну, рШКФ та калію в сироватці крові протягом 7‑14 днів після початку терапії та щонайменше щорічно (рівень доказовості B) (Bandak et al., 2017; Hughes-Austin et al., 2017).
Лікування резистентної АГ. Резистентна АГ визначається як наявність у хворого АТ ≥140/90 мм рт. ст., попри запровадження терапевтичної стратегії, яка передбачає модифікацію способу життя, лікування діуретиком і двома іншими антигіпертензивними засобами з додатковими механізмами дії в адекватних дозах.
У пацієнтів з АГ, яким не вдається досягти цільових показників АТ за допомогою трьох класів антигіпертензивних препаратів, рекомендовано розглянути можливість застосування АМР (рівень доказовості А) (рис. 2).
Контроль ліпідів
Корекція способу життя. Для пацієнтів із ЦД задля поліпшення ліпідного профілю та зниження ризику розвитку АССЗ рекомендовано:
- Модифікацію способу життя з акцентом на зниженні ваги (за показаннями).
- Дотримання середземноморської дієти або здорового раціону харчування, спрямованого на зниження АТ.
- Зменшення вживання насичених жирів і трансжирів.
- Збільшення споживання жирних кислот омега‑3, в’язкої клітковини та рослинних станолів / стеролів.
- Підвищення рівня фізичної активності (рівень доказовості А) (Eckel et al., 2014; Arnett et al., 2019).
Необхідно посилити заходи з модифікації способу життя та оптимізувати глікемічний контроль в осіб із ЦД та підвищеним рівнем тригліцеридів (ТГ), що становить ≥150 мг/дл (≥1,7 ммоль/л) та/або низьким вмістом холестерину (ХС) ліпопротеїнів високої щільності (ЛПВЩ): <40 мг/дл (<1,0 ммоль/л) для чоловіків і <50 мг/дл (<1,3 ммоль/л) для жінок (рівень доказовості C).
Поточна терапія та ліпідний профіль. У дорослих пацієнтів із предіабетом або ЦД, які не отримують статини чи іншу гіполіпідемічну терапію, доцільно перевіряти ліпідний профіль на момент встановлення діагнозу, під час первинного медичного огляду та далі щорічно або частіше, якщо є показання (рівень доказовості E).
Доцільно також виконувати аналіз крові на ліпідний профіль на початку застосування статинів або іншого гіполіпідемічного лікування, через 4‑12 тижнів після ініціювання або зміни дозування, а потім щорічно, оскільки це може допомогти контролювати відповідь на терапію та інформувати про приймання ліків (рівень доказовості А) (Rana et al., 2022; Tran et al., 2022).
Лікування статинами
У пацієнтів із ЦД 2-го типу спостерігається значна поширеність порушень ліпідного обміну, що спричиняє підвищення ризику АССЗ. Дані багатьох клінічних досліджень продемонстрували сприятливий вплив статинотерапії щодо зменшення наслідків АССЗ в осіб з ІХС та без неї (Mihaylova et al., 2012; Baigent et al., 2005).
Результати аналізу підгруп хворих на ЦД у масштабних дослідженнях виключно за участю осіб із ЦД підтвердили значну ефективність первинної та вторинної профілактики АССЗ та смерті від ІХС на тлі ЦД (Knopp et al., 2006; Shepherd et al., 2006).
Відповідно статини є препаратами вибору для зниження холестерину ліпопротеїдів низької щільності (ХС ЛПНЩ) та кардіопротекції в осіб із ЦД.
У таблиці 2 наведено статини, рекомендовані для застосування у клінічній практиці ведення пацієнтів із ЦД.
|
Таблиця 2. Рекомендовані статини високої та помірної інтенсивності для лікування пацієнтів із цукровим діабетом |
|
|
Високоінтенсивна статинотерапія (зниження ХС ЛПНЩ на ≥50%) |
Помірноінтенсивна статинотерапія (зниження ХС ЛПНЩ на 30‑49%) |
|
Аторвастатин, 40‑80 мг/добу Розувастатин, 20‑40 мг/добу |
Аторвастатин, 10‑20 мг/добу Розувастатин, 5‑10 мг/добу Симвастатин, 20‑40 мг/добу Правастатин, 40‑80 мг/добу Ловастатин, 40 мг/добу Флувастатин пролонгованого вивільнення, 80 мг/добу Пітавастатин, 1‑4 мг/добу |
|
Адаптовано за American Diabetes Association Professional Practice Committee Diabetes Care, 2024. |
|
Первинна профілактика. Для пацієнтів віком 20‑39 років із ЦД та додатковими чинниками ризику АССЗ рекомендовано розглянути початок застосування статинів на додаток до корекції способу життя (рівень доказовості C) (Taylor et al., 2013; Carter et al., 2013). Тоді як для осіб віком 40‑75 років із ЦД без АССЗ доцільно використовувати статинотерапію помірної інтенсивності на додаток до модифікації способу життя (рівень доказовості А).
Хворим віком 40‑75 років на ЦД із вищою ймовірністю розвитку ССЗ, зокрема з одним або декількома чинниками ризику АССЗ, рекомендовано застосовувати високоінтенсивну статинотерапію задля:
Зниження рівня ХС ЛПНЩ на ≥50% проти вихідного рівня.
Досягнення цільового ХС ЛПНЩ <70 мг/дл (<1,8 ммоль/л) (рівень доказовості А) (Goldberg et al., 2020; Mach et al., 2020).
Натомість для пацієнтів того самого віку із ЦД та вищою ймовірністю розвитку ССЗ, особливо з одним або декількома чинниками ризику АССЗ, та вмістом ХС ЛПНЩ ≥70 мг/дл (≥1,8 ммоль/л), рекомендовано розглянути додавання езетимібу або інгібітора пропротеїнової конвертази субтилізин-кексинового типу 9 (PCSK9) до лікування статинами у максимально переносимій дозі (рівень доказовості В) (Grundy et al., 2019).
Підтверджено користь застосування додаткової терапії езетимібом або інгібіторами PCSK9 для зменшення СС подій у хворих групи високого ризику (Khan et al., 2022).
У дорослих пацієнтів віком >75 років із ЦД, які вже приймають статини, доцільно продовжувати лікування (рівень доказовості В). Крім того, у цій віковій категорії хворих на ЦД рекомендовано розглянути початок статинотерапії помірної інтенсивності після обговорення потенційних переваг і ризиків (рівень доказовості C) (Kearney et al., 2008; Cannon et al., 2015).
Для осіб із ЦД, які не переносять лікування статинами, рекомендовано використання бемпедоєвої кислоти для зниження частоти СС подій як альтернативної стратегії зниження рівня ХС (рівень доказовості А) (Nissen et al., 2023; Di Minno et al., 2020). Під час вагітності застосування статинів протипоказано (рівень доказовості В).
Вторинна профілактика. Оскільки в осіб із ЦД і встановленим ССЗ спостерігається підвищення частоти СС подій, інтенсивна терапія є рекомендованим підходом (Baigent et al., 2005; Cannon et al., 2015).
У пацієнтів будь-якого віку із ЦД та АССЗ рекомендовано призначати високоінтенсивну статинотерапію на додаток до модифікації способу життя (рівень доказовості А) (Sabatine et al., 2017). Особам із ЦД та АССЗ рекомендовано лікування статинами високої інтенсивності, спрямоване на зниження рівня ХС ЛПНЩ на ≥50% проти вихідного рівня та досягнення цільового ХС ЛПНЩ <55 мг/дл (<1,4 ммоль/л) (Cannon et al., 2004; Shepherd et al., 2006).
Однак найкращі доказові дані щодо ефективного досягнення цільового ХС ЛПНЩ у пацієнтів із ЦД і встановленими ССЗ пов’язані з додаванням нестатинових препаратів до статинотерапії. Втім, якщо не вдається досягти цільових показників на тлі застосування статинів у максимально переносимій дозі, рекомендовано додавати езетиміб або інгібітор PCSK9 із доведеною користю (рівень доказовості В) (Ray et al., 2019; Sabatine et al., 2017).
Комбінація симвастатину помірної інтенсивності та езетимібу продемонструвала значне зниження серйозних СС наслідків (МАСЕ) порівняно із застосуванням лише симвастатину в пацієнтів із ЦД (Giugliano et al., 2018). Що стосується інгібіторів PCSK9, лікування еволокумабом та алірокумабом на додаток до статинів у максимально переносимих дозах в осіб із високим ризиком АССЗ асоціювалося з помірним зниженням ХС ЛПНЩ (Moriarty et al., 2014; Zhang et al., 2015). За непереносимості статинів призначеної інтенсивності рекомендовано використовувати препарати в максимально переносимій дозі (рівень доказовості E). Для пацієнтів із ЦД та АССЗ, які не переносять статини, рекомендовано розглянути альтернативну терапію інгібіторами моноклональних антитіл PCSK9 (рівень доказовості A), бемпедоєвою кислотою (рівень доказовості A) або інгібітором PCSK9 інклізіраном (рівень доказовості E) для зниження рівня ХС (Ray et al., 2020).
Контроль ХС ліпопротеїдів інших фракцій або мішеней. У хворих на ЦД із гіпертригліцеридемією терапія передбачає запровадження дієти та корекцію способу життя, зокрема зниження ваги та відмову від алкоголю (Berglund et al., 2012). В осіб із рівнем тригліцеридів (ТГ) натще ≥500 мг/дл (≥5,7 ммоль/л) рекомендовано оцінити наявність вторинних причин гіпертригліцеридемії та розглянути медикаментозне лікування для зниження ризику панкреатиту (рівень доказовості C).
У дорослих пацієнтів із помірною гіпертригліцеридемією натще або не натще 175‑499 мг/дл (2,0‑5,6 ммоль/л) терапію має бути сфокусовано на чинниках способу життя (як-от ожиріння та метаболічний синдром), вторинних чинниках (ЦД, хронічне захворювання печінки чи нирок та/або нефротичний синдром, гіпотиреоз), а також ліках, що підвищують вміст ТГ (рівень доказовості C). У пацієнтів з АССЗ або іншими чинниками СС ризику з контрольованим рівнем ХС ЛПНЩ, але підвищеним вмістом ТГ (135‑499 мг/дл [1,5‑5,6 ммоль/л]), які приймають статини, рекомендовано розглянути додавання ікозапенту етилу для зниження СС ризику (рівень доказовості A) (Bhatt et al., 2019).
Антитромбоцитарна терапія
Ацетилсаліцилова кислота (АСК) є ефективним і рекомендованим препаратом для зниження кардіоваскулярної захворюваності та смертності в межах вторинної профілактики в осіб із високим ризиком, які раніше перенесли інфаркт міокарда (ІМ) або інсульт (Perk et al., 2012). Для хворих на ЦД із АССЗ в анамнезі рекомендовано застосування АСК (75‑162 мг/добу) як засобу вторинної профілактики (рівень доказовості А). Особам з АССЗ та підтвердженою непереносимістю АСК рекомендовано призначити клопідогрель по 75 мг/добу (рівень доказовості B).
Тривалість подвійної антитромбоцитарної терапії з використанням АСК у низьких дозах та інгібітора P2Y12-рецепторів в осіб із ЦД після перенесеного гострого коронарного синдрому або гострого ішемічного інсульту / транзиторної ішемічної атаки (ТІА) має визначати мультидисциплінарна команда фахівців (рівень доказовості E) (Levine et al., 2016; Kleindorfer et al., 2021).
Є дані на підтвердження користі тикагрелору або клопідогрелю, якщо не проводилося черезшкірне коронарне втручання, та клопідогрелю, тикагрелору або прасугрелу, якщо операцію було виконано, в осіб із ЦД (Vandvik et al., 2012). У пацієнтів із ЦД та перенесеним ІМ додавання тикагрелору до АСК значно знижувало ризик повторних ішемічних подій і смерті через ССЗ та ІХС (Bhatt et al., 2016).
Комбіновану терапію АСК і ривароксабаном у низьких дозах рекомендовано розглянути в пацієнтів зі стабільною ІХС та/або захворюванням периферичних артерій (ЗПА) і низьким ризиком кровотечі, щоб запобігти серйозним наслідкам із боку кінцівок і СС системи (рівень доказовості А) (Bhatt et al., 2020; Connolly et al., 2018). Лікування ривароксабаном в осіб із ЗПА, які перенесли реваскуляризацію, на додаток до АСК було пов’язане зі значно нижчою частотою ішемічних СС подій, зокрема із боку кінцівок. Проте спостерігається підвищений ризик великої кровотечі (Bonaca et al., 2020).
Терапію АСК (75‑162 мг/добу) рекомендовано розглядати як стратегію первинної профілактики у хворих на ЦД із підвищеним СС ризиком після обговорення з пацієнтом переваг та ймовірності кровотеч (рівень доказовості А) (Mora et al., 2016).
Ведення пацієнтів із серцево-судинними захворюваннями
Скринінг. У пацієнтів із ССЗ необхідно розглянути можливість скринінгу на ІХС за наявності будь-якого з таких ознак:
- Атипові кардіальні симптоми.
- Ознаки або симптоми супутнього захворювання судин, як-от ТІА, інсульт, ЗПА.
- Аномальні зміни на електрокардіограмі (рівень доказовості Е).
Дорослі хворі на ЦД мають підвищений ризик розвитку безсимптомних структурних чи функціональних порушень у роботі серця (СН стадії B) або симптоматичної СН (стадія C). Встановлення, стратифікація ризику та раннє лікування чинників в осіб із ЦД та безсимптомною СН зменшують імовірність її прогресування до симптоматичної СН (Ledwidge et al., 2013). Для полегшення профілактики СН стадії C може бути доцільним скринінг дорослих із ЦД завдяки вимірюванню рівня натрійуретичного пептиду B-типу або N-кінцевого пропептиду натрійуретичного гормону (рівень доказовості В).
Для безсимптомних осіб із ЦД та аномальним вмістом натрійуретичного пептиду рекомендовано виконати ехокардіографію для виявлення СН стадії B (рівень доказовості А) (Januzzi et al., 2020; Pandey et al., 2021).
Ризик ЗПА за наявності ЦД вищий, ніж без нього (Leibson et al., 2004). Так, мікросудинні захворювання в осіб із ЗПА та ЦД пов’язані з несприятливими наслідками, зокрема з підвищеним ризиком ампутації кінцівок у майбутньому (Beckman et al., 2019; Olesen et al., 2022). Для безсимптомних пацієнтів віком ≥50 років із мікросудинним захворюванням будь-якої локалізації або ураженням органів-мішеней на тлі ЦД рекомендовано виконати скринінг на ЗПА за допомогою кісточково-плечового індексу задля визначення стратегій профілактики ССЗ і збереження кінцівок (рівень доказовості A). Можливість виконання скринінгу на ЗПА рекомендовано розглянути для осіб із тривалістю ЦД ≥10 років (рівень доказовості В) (Smolderen et al., 2022).
Фармакотерапія. Для пацієнтів із ЦД 2-го типу та підтвердженим АССЗ або захворюванням нирок рекомендовано застосовувати іНЗКТГ‑2 або арГПП‑1 із підтвердженою користю у межах комплексного лікування для зниження СС ризику та/або рівня глюкози (рівень доказовості А).
Хворим на ЦД 2-го типу зі встановленим АССЗ, множинними чинниками АССЗ або діабетичною нефропатією рекомендовано призначати іНЗКТГ‑2 із доведеною ефективністю при ССЗ для зменшення ймовірності серйозних серцево-судинних наслідків (МАСЕ) та/або госпіталізації з приводу СН (рівень доказовості А) (Perkovic et al., 2019; Wiviott et al., 2019).
Особам із ЦД 2-го типу та підтвердженим АССЗ або множинними чинниками ризику АССЗ доцільно використовувати арГПП‑1 із СС користю для зниження ризику МАСЕ (рівень доказовості А) (Husain et al., 2019). Комбіновану терапію іНЗКТГ‑2 та арГПП‑1 із продемонстрованими перевагами для СС системи рекомендовано розглянути для хворих на ЦД 2-го типу зі встановленим АССЗ чи множинними чинниками ризику АССЗ задля додаткового зниження ризику ренальних та СС подій (рівень доказовості А) (Gerstein et al., 2021). Пацієнтам із ЦД 2-го типу та встановленою СН зі збереженою чи зниженою фракцією викиду рекомендовано лікування іНЗКТГ‑2 (зокрема з іНЗКТГ-1/2), щоб зменшити ймовірність погіршення СН та СС смерті (рівень доказовості А) (Bhatt et al., 2021).
Пацієнтам із ЦД 2-го типу та СН зі збереженою або зниженою фракцією викиду рекомендовано призначати іНЗКТГ‑2 із підтвердженою ефективністю для:
- Зменшення симптомів.
- Підвищення фізичних показників.
- Поліпшення рівня життя (рівень доказовості А).
В осіб із ЦД зі встановленим АССЗ або віком ≥55 років із додатковими чинниками СС ризику доцільною є терапія іАПФ або БРА для зниження ризику СС подій і смертності (рівень доказовості А) (Yusuf et al., 2000).
Хворим на ЦД 2-го типу та ХХН з альбумінурією, які отримують іАПФ або БРА у максимально переносимих дозах, рекомендовано додавати фінеренон для зменшення СС наслідків і ймовірності прогресування ХХН (рівень доказовості А) (Filippatos et al., 2022; Agarwal et al., 2022). Для пацієнтів із ЦД та безсимптомною СН стадії B рекомендовано розглянути мультидисциплінарний підхід до оптимізації фармакотерапії, щоб знизити ризик прогресування симптоматичної СН стадії C (рівень доказовості А). Хворим цієї категорії рекомендовано застосовувати іАПФ/БРА та β-блокатори для зменшення ймовірності прогресування до симптоматичної СН стадії C (рівень доказовості А) (Heidenreich et al., 2022).
Хворим на ЦД 2-го типу та безсимптомну СН стадії B із високим ризиком ССЗ або встановленими ССЗ рекомендовано призначати лікування іНЗКТГ (зокрема з іНЗКТГ‑2 або іНЗКТГ-1/2) для зниження ризику госпіталізації через СН (рівень доказовості А) (Perkovic et al., 2019).
Для зменшення ймовірності госпіталізації з приводу СН пацієнтам із ЦД 2-го типу та діабетичною нефропатією рекомендовано застосовувати фінеренон (рівень доказовості А) (Pitt et al., 2021; Bakris et al., 2020). Тоді як хворим на ЦД з ІМ або симптоматичною СН стадії С рекомендовано призначати медикаментозне лікування із застосуванням іАПФ/БРА, АМР, інгібіторів рецепторів ангіотензину/неприлізину, β-блокаторів та іНЗКТГ‑2, подібно до фармакотерапії для осіб без ЦД (рівень доказовості А).
В осіб із ЦД 2-го типу зі стабільною СН рекомендовано продовжити приймання метформіну для зниження рівня глюкози, якщо рШКФ залишається >30 мл/хв/1,73 м2; але необхідно уникати застосування препарату в нестабільних або госпіталізованих хворих із СН (рівень доказовості В) (FDA, 2023).
Пацієнти із ЦД 1 і 2-го типу, схильні до кетозу та/або ті, хто дотримується кетогенної дієти й лікується іНЗКТГ, мають бути проінформовані про ризики та ознаки кетоацидозу й методи їх контролю, а також забезпечені відповідними інструментами для точного вимірювання кетонів (рівень доказовості E) (Peters et al., 2016; Danne et al., 2019).
Підготувала Олена Коробка
Оригінальний текст документа читайте на сайті
www.diabetesjournals.org
Тематичний номер «Кардіологія. Ревматологія. Кардіохірургія» № 3 (94) 2024 р.



