22 травня, 2021
Діагностика та лікування фібриляції передсердь: огляд клінічного випадку
У клінічній практиці фібриляція передсердь (ФП) є найпоширенішою персистувальною аритмією, що зустрічається у дорослих. Серед факторів ризику ФП – похилий вік, ішемічна хвороба серця, чоловіча стать, європейське походження, артеріальна гіпертензія (АГ), ожиріння, куріння, цукровий діабет (ЦД), обструктивне апное сну (ОАС), обтяжений сімейний анамнез у родичів першої лінії, інфаркт міокарда (ІМ), легенева емболія, пневмонія або хірургічне втручання, тиреотоксикоз чи алкогольна інтоксикація. Більш як дві третини пацієнтів із нещодавно виявленою ФП демонструють нападоподібний характер аритмії, у 5‑10% з яких вона прогресує до персистувальної форми протягом року. До 20% хворих на стійку ФП, що успішно перенесли кардіоверсію, мають рецидив, за якого важко підтримувати синусовий ритм. Персистувальна ФП триває доти, доки не буде перервана за допомогою електричної або фармакологічної кардіоверсії. Цей стан більшою мірою асоційований із фіброзом передсердь, ніж пароксизмальна ФП.
Діагностика та оцінка стану пацієнтів
Симптоми ФП варіюють від мінімальних, як-от слабкість, зниження толерантності до фізичного навантаження, надмірне серцебиття, до тяжких, що можуть призвести до інвалідності пацієнта. Дана аритмія здатна також спричинити розвиток гіпотонії, синкопе, стенокардії або набряку легень – станів, які потребують екстреного лікування. Тяжкі прояви ФП часто пов’язані з гострими захворюваннями або хірургічними втручаннями, що зумовлюють підвищення симпатичного тонусу і тахікардії.
Під час електрокардіографії (ЕКГ) виявляють комплекси QRS із нерегулярними інтервалами RR, зі змінним коливанням базової лінії між ударами та відсутністю дискретних зубців Р. Залежно від частоти симптомів, для встановлення діагнозу пароксизмальної ФП доцільне проведення амбулаторної реєстрації ЕКГ протягом тижнів, а в деяких випадках – навіть місяців. Персональні системи реєстрації ЕКГ включають невеликі портативні пристрої та годинники і можуть виявляти ФП, але є загроза реєстрації артефактів, які можуть імітувати або спотворювати діагноз, тому слід отримати підтверджувальні записи ЕКГ (Wasserlauf et al., 2019).
Виявлення ФП потребує ретельного збору анамнезу та фізикального обстеження, включно з вимірюванням артеріального тиску (АТ), для виключення/підтвердження патологій. У разі їх наявності пацієнт має схильність до розвитку ФП, а також факторів ризику та інтеркурентних захворювань (Chung et al., 2020; Voskoboinik et al., 2020). Серед лабораторних досліджень доцільним є визначення рівня глюкози та тиреотропного гормону в крові хворого. Крім ЕКГ та іншого моніторингу ритму серця, рекомендоване регулярне проведення трансторакальної ехокардіографії (ЕхоКГ). Також слід проводити скринінг на порушення дихання під час сну, а за наявності в анамнезі ОАС – дослідження самого сну (Chung et al., 2020).
Лікування
До основних напрямів контролю ФП відносяться:
- відновлення синусового ритму;
- досягнення належного контролю частоти серцевих скорочень (ЧСС);
- превенція тромбоемболії та інсульту;
- зменшення або усунення симптомів;
- лікування модифікованих факторів ризику.
Симптоми можна контролювати шляхом запобігання епізодам ФП або сповільнення ЧСС під час повторної ФП. У пацієнтів, у котрих ФП розвинулася протягом попереднього року, кардіологи першочергово намагаються підтримати синусовий ритм (Kirchhof et al., 2020).
Контроль ЧСС
ЧСС частково визначає гемодинамічні наслідки та симптоми при ФП. Основу фармакологічної кардіоверсії становлять β-блокатори й недигідропіридинові блокатори кальцієвих каналів (верапаміл та дилтіазем), дигоксин або комбінована терапія (January et al., 2014). Важливо пам’ятати, що терапію доцільно підбирати для кожного пацієнта індивідуально з метою уникнення тяжких симптомів після фізичного навантаження та побічних ефектів препаратів.
Блокатор кальцієвих каналів можна комбінувати з β-блокатором, якщо дії останнього недостатньо (January et al., 2014; Washam et al., 2015; Eisen et al., 2017). У разі відсутності ефекту консервативного лікування переходять до електричної кардіоверсії, яка включає імплантацію кардіостимулятора або катетерну абляцію. Зазвичай їх використовують у пацієнтів старшого віку. Оклюзію або резекцію вушка лівого передсердя можна розглядати, коли тривала антикоагуляція є неможливою через ризик кровотечі.
Профілактика інсульту та мінімізація ризику кровотеч
Антикоагулянтна терапія є варіантом першого вибору для профілактики тромбоемболії. Таке лікування призначають на основі оцінки ризику інсульту відповідно до шкали CHA2DS2-VASc (January et al., 2014).
За результатами кокранівського огляду серед пацієнтів із ФП, у яких імовірність інсульту становила 4% на рік, тривала терапія варфарином знижувала ризик до 1,4% на рік (January et al., 2014; Aguilar, Hart, 2001). У кількох рандомізованих випробуваннях було виявлено, що пероральні антикоагулянти прямої дії не поступалися варфарину (Wann et al., 2019). Метааналіз K.M. Bruins Slot та E. Berge (2018) показав, що у дослідженнях із подальшим спостереженням від 12 тижнів до 2,8 року ризик інсульту або емболічних явищ був на 11% нижчим серед пацієнтів, які отримували пероральні антикоагулянти прямої дії, ніж на терапії варфарином. Імовірність серйозних кровотеч також зменшилася (з 5 до 4%), як і внутрішньочерепних крововиливів (із 1,3 до 0,6%).
На відміну від варфарину, пероральні антикоагулянти прямої дії не потребують повторних лабораторних досліджень для корекції дози. Варфарин все ще застосовують у пацієнтів із мітральним стенозом або механічними клапанами серця. Ацетилсаліцилова кислота та інші антитромбоцитарні методи лікування не забезпечують належного захисту від інсульту в осіб із ФП (January et al., 2014).
Якщо тривалість ФП є невизначеною або ж становить ≥48 год, рекомендовано антикоагулянтну терапію протягом трьох тижнів до кардіоверсії та ще чотири тижні після неї. Після кардіоверсії антикоагулянтне лікування має тривати впродовж життя у пацієнтів із високим ризиком інсульту (January et al., 2019; Flaker et al., 2014).
Контроль синусового ритму
Рішення щодо того, чи слід продовжувати підтримувати синусовий ритм, приймають спільно пацієнт та лікар. Це рішення визначається впливом ФП на якість життя хворого, а також ризиками й токсичними ефектами терапії.
У великому рандомізованому дослідженні раннього лікування ФП для попереджання розвитку інсульту (EAST-AFNET 4) взяли участь пацієнти, в яких ФП було діагностовано протягом одного року до госпіталізації (Kirchhof et al., 2020). У хворих відносно ранній контроль ритму (антиаритмічними препаратами або катетерною абляцією) був пов’язаний зі значно нижчим рівнем смертності від серцево-судинних причин, інсульту або госпіталізації через серцеву недостатність чи гострий коронарний синдром (зниження на 22%), без збільшення тривалості стаціонарного лікування. Серйозні побічні явища, асоційовані з терапією, мали місце у 4,9% пацієнтів групи раннього контролю ритму; найпоширенішою була медикаментозна брадикардія (1% випадків). Катетерна абляція, яку проводять із застосуванням радіочастотної або кріотерапії, є ефективнішою, ніж антиаритмічні препарати для підтримання синусового ритму в пацієнтів із пароксизмальною ФП (Calkins et al., 2017; Hakalahti et al., 2015; Packer et al., 2019; Andrade et al., 2021).
Підтримання синусового ритму покращується у разі контролю модифікованих факторів ризику (Abed et al., 2013; Rienstra et al., 2018). Рандомізоване дослідження за участю 150 пацієнтів із ФП показало, що внаслідок додавання інтенсивної програми зниження ваги до інших видів терапії (зокрема лікування та консультування із приводу АГ, ОАС, вживання алкоголю, гіперліпідемії та ЦД) спостерігалася менша кількість пароксизмів ФП та симптомів аритмії, ніж до стандартного втручання (Abed et al., 2013). За даними рандомізованого випробування, до якого були залучені хворі на ФП, які споживали більш ніж 10 доз стандартних алкогольних напоїв (1 доза містить приблизно 12 г чистого алкоголю) на тиждень, ті, хто утримувався від алкоголю (середнє споживання, ≤2 доз на тиждень), мали нижчий тягар ФП протягом наступних шести місяців, ніж учасники контрольної групи (Voskoboinik et al., 2020).
Нещодавно у науковій заяві Американської асоціації серця (AHA) було вказано на доцільність зниження ваги на 10% для пацієнтів із ФП з індексом маси тіла (ІМТ) ≥28, регулярних фізичних вправ, лікування ЦД, гіперліпідемії та апное уві сні, а також помірність вживання алкоголю (Chung et al., 2020).
Клінічний випадок
Хворий, 63 роки. На тлі вірусної респіраторної інфекції розвинулася ФП.
Анамнез захворювання. Три місяці тому вперше почав помічати задишку під час підйому сходами, симптом спостерігався протягом останнього місяця.
Об’єктивний статус. ІМТ=29, АТ=142/88 мм рт. ст., нерегулярна ЧСС (120 уд./хв), нерегулярні І і ІІ тони серця.
Під час ЕКГ було зафіксовано ФП, нормальні QRS-комплекси та частоту шлуночкових скорочень 110 уд./хв.
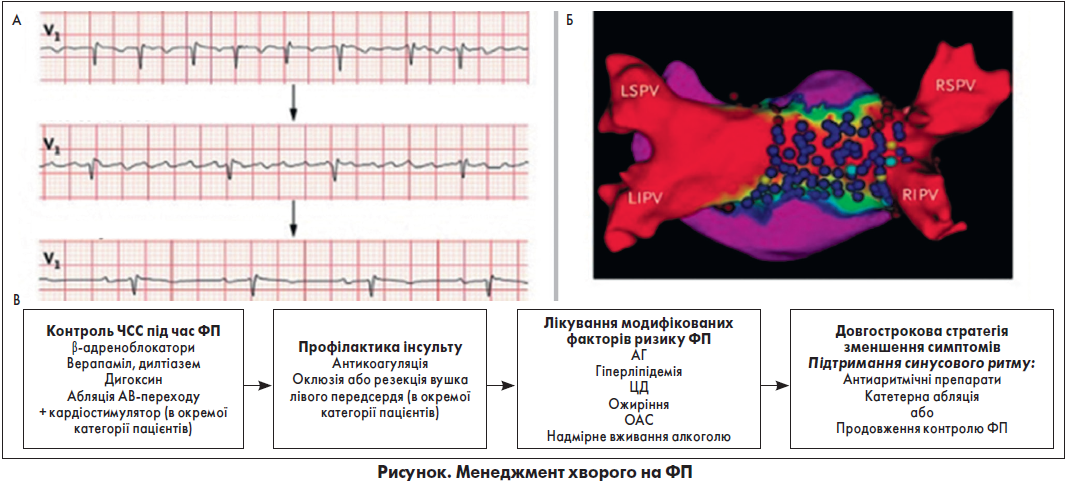
Лікування. На рисунку представлені терапевтичні втручання, застосовані у даного пацієнта.
На панелі A показано ЕКГ пацієнта у відведенні V1. На першому відрізку зафіксовано ФП зі швидкістю шлуночкових скорочень 140 уд./хв, на другому – ФП із контрольованою ЧСС 65 уд./хв, на останньому – синусовий ритм з атріовентрикулярним (АВ) блоком першого ступеня після кардіоверсії.
На панелі Б представлено електроанатомічну карту передсердь із процедури абляції. Ліве передсердя розглядається з його задньої сторони з лівою верхньою (LSPV), лівою нижньою (LIPV), правою верхньою (RSPV) і правою нижньою (RIPV) легеневими венами. Сині та темно-бордові кола позначають місця ураження абляцією, а червоні – відсутність електричних сигналів (вказує на те, що легеневі вени та задня стінка лівого передсердя після абляції електрично безшумні). На ділянках з електричними сигналами збільшення амплітуди сигналу позначається прогресуванням від зеленого до синього та фіолетового кольорів.
Панель В показує чотири фактори, які слід враховувати при лікуванні ФП. Дигоксин можна призначати пацієнтам із серцевою недостатністю, але в інших випадках він не рекомендований особам із ФП. АВ-абляцію та стимуляцію використовують, коли фармакологічного контролю ЧСС неможливо досягти, зазвичай у хворих похилого віку чи тих, хто веде малорухомий спосіб життя.
Рекомендації. У пацієнта доцільно:
- визначити рівні сироваткових електролітів, креатиніну та тиреотропного гормону;
- виконати діагностику й лікування модифікованих факторів ризику;
- провести терапію за допомогою перорального антикоагулянта прямої дії;
- призначити β-блокатори (з корегуванням дози відповідно до досягнення контролю швидкості серцевого ритму).
Далі необхідним є контроль ризику ішемічної хвороби серця за допомогою ЕхоКГ, стрес-тестів, ангіографії, а також проведення кардіоверсії після 4-тижневого курсу антикоагулянтної терапії.
Якщо ФП повторюється, рішення про подальшу терапію має ґрунтуватися на симптомах захворювання, ризиках та перевагах лікування і включати розгляд катетерної абляції для підтримання синусового ритму (Wazni et al., 2021; Andrade et al., 2021).
Підготував Денис Соколовський
Оригінальний текст документа читайте на сайті www.nejm.org