22 грудня, 2020
Ефективність фіксованої комбінації раміприлу та амлодипіну в лікуванні артеріальної гіпертензії та хронічної хвороби нирок
Артеріальна гіпертензія (АГ) є одним з основних факторів ризику розвитку як серцево-судинних (СС), так і ниркових ускладнень. Хронічну ниркову недостатність різного ступеня тяжкості мають до 20% пацієнтів з АГ. Найважливішими завданнями фармакотерапії у хворих на АГ з ураженням нирок є досягнення цільового рівня артеріального тиску (АТ), зменшення мікроальбумінурії та протеїнурії. Для забезпечення цільового значення АТ і максимального зниження ризику такі хворі потребують призначення комбінованого лікування.
Серед причин діалізної стадії хронічної хвороби нирок (ХХН) гіпертензивний нефроангіосклероз посідає у США друге місце, в Японії – третє. Упродовж останніх 10 років спостереження за європейцями з морфологічно підтвердженим діагнозом гіпертензивного нефроангіосклерозу частота ХХН IV‑V стадій зросла майже вдвічі.
Кореляцію між рівнем АТ, кардіоваскулярними, нирковими ускладненнями і смертністю вивчали у значній кількості обсерваційних досліджень. Офісний АТ характеризується незалежним безперервним зв’язком із частотою низки СС-подій – інсульту, інфаркту міокарда (ІМ), раптової смерті, серцевої недостатності (СН) та периферичного ураження артерій, а також із термінальною нирковою недостатністю (ТНН) у всіх вікових та етнічних групах.
Через важливість безсимптомного ураження органів-мішеней (УОМ) як проміжного етапу детермінанти загального СС-ризику, кардіоваскулярного і кардіоренального континуумів, необхідно ретельно виявляти ознаки УОМ із використанням, за показаннями, відповідних методик. Слід зауважити, що на даний час накопичено багато доказів ролі безсимптомного УОМ у визначенні ризику в осіб з/без підвищеного АТ. Важливим аргументом щодо доцільності виявлення УОМ у рутинній клінічній практиці є той факт, що будь-який із чотирьох маркерів органного ураження (мікроальбумінурія, підвищення швидкості пульсової хвилі, гіпертрофія міокарда лівого шлуночка [ЛШ] і наявність бляшок у сонних артеріях), є незалежним від стратифікації за SCORE предиктором СС-смертності.
Одним з органів-мішеней АГ є нирки. Діагноз зумовленого АГ ураження нирок ґрунтується на виявленні зниження функції нирок та/або підвищення екскреції альбуміну з сечею. При встановленні ХХН її класифікують залежно від розрахункової швидкості клубочкової фільтрації (рШКФ), яку обчислюють за формулою Товариства з епідеміології хронічної хвороби нирок (CKD-EPI). Збільшення концентрації креатиніну в сироватці крові або зниження рШКФ вказує на погіршення функції нирок, тоді як зростання сечової екскреції альбуміну або білка – здебільшого на ураження фільтраційного бар’єра клубочків.
Показано, що мікроальбумінурія слугує предиктором розвитку діабетичної нефропатії у пацієнтів із цукровим діабетом (ЦД) 1-го та 2-го типів, тоді як наявність протеїнурії загалом вказує на вже сформоване ураження паренхіми нирок. У хворих на АГ з/без ЦД мікроальбумінурія, яка навіть не перевищує звичайні межові значення, є предиктором виникнення СС-подій. Граничний показник мікроальбумінурії обраний на рівні 30 мг/г креатиніну. У рекомендаціях Європейського товариства кардіологів (ESC) із діагностики та лікування АГ (2018) у всіх осіб з АГ рекомендовано визначати сироватковий рівень креатиніну, ШКФ, співвідношення альбуміну/креатиніну в сечі. У документі також підкреслено, що у пацієнтів із діабетичним або недіабетичним ураженням нирок необхідно знижувати САТ до рівня <130-139 мм рт. ст. (клас рекомендації I, рівень доказовості А).
При виборі антигіпертензивних препаратів у хворих на АГ з ураженням нирок слід обов’язково враховувати їхній вплив на прогноз таких пацієнтів (насамперед за даними рандомізованих клінічних досліджень) та здатність знижувати рівень АТ та екскрецію білка з сечею. У кількох рандомізованих клінічних випробуваннях було показано, що блокатори ренін-ангіотензин-альдостеронової системи (РААС) ефективніше зменшують альбумінурію, ніж інші антигіпертензивні засоби як при діабетичній, так і недіабетичній нефропатії в осіб із СС-патологіями, а також дієво запобігають першим появам мікроальбумінурії. Тому блокатори РААС – інгібітори ангіотензинперетворювального ферменту (іАПФ) і блокатори рецепторів ангіотензину II (БРА) – є препаратами першого вибору при лікуванні таких пацієнтів.
Для досягнення цільового рівня АТ і зниження ризику пацієнтам з АГ та ураженням нирок необхідно призначати комбіновану терапію (клас рекомендації I, рівень доказовості A). Тому постає питання, яким має бути другий антигіпертензивний препарат у поєднанні з блокатором РААС.
Найбільш доцільним є поєднання блокатора РААС з антагоністом кальцію (АК) або тіазидним діуретиком. Якщо сироватковий креатинін досягає рівня 1,5 мг/дл або рШКФ <30 мл/хв/1,73 м2, тіазидний діуретик замінюють петльовим. Аналіз результатів дослідження ACCOMPLISH показав, що комбінація іАПФ з АК є ефективнішою, ніж із тіазидним діуретиком – про це йшла мова у європейських рекомендаціях з лікування АГ.
Поєднання іАПФ з амлодипіном є пріоритетним у лікуванні хворих на АГ із високим ризиком, зокрема з ураженням нирок, оскільки здатне більшою мірою уповільнювати прогресування зниження функції нирок в осіб із АГ групи високого ризику, включно з ЦД і діабетичною нефропатією, ніж комбінація блокатора РААС/гідрохлоротіазиду.
Вивченню ефективності та безпеки фіксованої комбінації раміприлу та амлодипіну присвячене спеціальне відкрите проспективне багатоцентрове дослідження RAMONA, в якому брали участь хворі на АГ. Дослідники аналізували різні фіксовані дози даної комбінації у пацієнтів з АГ, які раніше отримували терапію, але не досягли цільового рівня АТ (n=6423). Первинною кінцевою точкою була оцінка ефективності фіксованої комбінації раміприлу/амлодипіну протягом чотирьох місяців лікування, вторинною – аналіз впливу лікування на метаболічні показники та комплаєнс пацієнтів. Загалом у RAMONA було включено 9169 хворих; 6423 пацієнти відповідали протоколу, зокрема 194 особи із хронічною нирковою недостатністю.
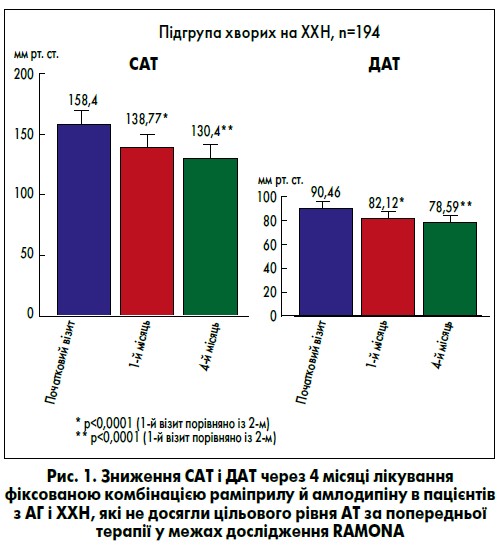 При лікуванні фіксованою комбінацією раміприлу та амлодипіну вже через чотири тижні було відзначене достовірне (p<0,0001) зниження АТ (систолічного [САТ] – із 158,04 до 138,77 мм рт. ст. і діастолічного [ДАТ] – із 90,46 до 82,12 мм рт. ст.) (рис. 1). За період подальшого спостереження АТ продовжував зменшуватися, і наприкінці дослідження (чотири місяці терапії) середні САТ і ДАТ становили 130,40 та 78,59 мм рт. ст. відповідно. Загалом за час спостереження САТ знизився у середньому на -28 мм рт. ст., ДАТ – на -12 мм рт. ст. Частота серцевих скорочень (ЧСС) також достовірно (p<0,0001) зменшилася з 77,94 уд./хв на початку дослідження до 72,48 уд./хв після чотирьох місяців.
При лікуванні фіксованою комбінацією раміприлу та амлодипіну вже через чотири тижні було відзначене достовірне (p<0,0001) зниження АТ (систолічного [САТ] – із 158,04 до 138,77 мм рт. ст. і діастолічного [ДАТ] – із 90,46 до 82,12 мм рт. ст.) (рис. 1). За період подальшого спостереження АТ продовжував зменшуватися, і наприкінці дослідження (чотири місяці терапії) середні САТ і ДАТ становили 130,40 та 78,59 мм рт. ст. відповідно. Загалом за час спостереження САТ знизився у середньому на -28 мм рт. ст., ДАТ – на -12 мм рт. ст. Частота серцевих скорочень (ЧСС) також достовірно (p<0,0001) зменшилася з 77,94 уд./хв на початку дослідження до 72,48 уд./хв після чотирьох місяців.
Лікування у даній підгрупі хворих супроводжувалося низкою позитивних ефектів на метаболічні параметри. Стосовно ліпідного обміну відзначене достовірне (p<0,0001) зниження рівня загального холестерину з 5,30 до 5,10 ммоль/л, ліпопротеїнів низької щільності з 3,13 до 2,98 ммоль/л і достовірне (p<0,01) підвищення рівня ліпопротеїнів високої щільності з 1,32 до 1,46 ммоль/л. Також привернуло увагу достовірне (p<0,0001) зниження рівня сечової кислоти (СК) – із 360,20 до 349,70 мкмоль/л – на початку та в кінці лікування відповідно (рис. 2).
Як відомо, у хворих на АГ часто відзначається гіперурикемія, яка корелює зі зниженням ниркового кровотоку і нефросклерозом. Окрім того, доведено, що гіперурикемія пов’язана з підвищеним ризиком СС-захворюваності та смертності. Тому виявлена здатність фіксованої комбінації раміприлу/амлодипіну знижувати рівень СК є показовим додатковим механізмом протективної дії препарату.
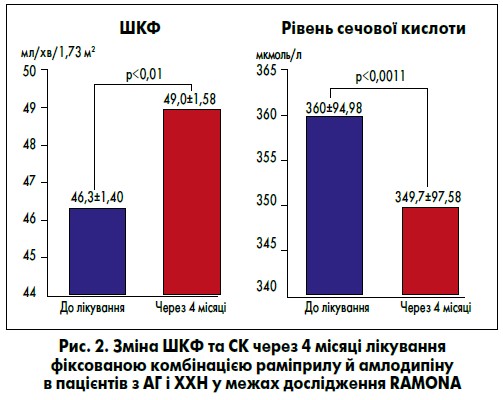 На додачу, вкрай важливим для хворих на АГ із ХХН є достовірне поліпшення ниркової функції у разі приймання фіксованої комбінації раміприлу та амлодипіну, виявлене в дослідженні RAMONA. Так, рШКФ достовірно (p<0,05) збільшилася з 46,30 до 49,00 мл/хв/1,73 м2 лише за чотири місяці лікування (рис. 2).
На додачу, вкрай важливим для хворих на АГ із ХХН є достовірне поліпшення ниркової функції у разі приймання фіксованої комбінації раміприлу та амлодипіну, виявлене в дослідженні RAMONA. Так, рШКФ достовірно (p<0,05) збільшилася з 46,30 до 49,00 мл/хв/1,73 м2 лише за чотири місяці лікування (рис. 2).
Таким чином, у випробуванні RAMONA в підгрупі хворих на АГ і ХХН застосування фіксованої комбінації раміприлу/амлодипіну для нормалізації підвищеного АТ за неефективності попередньої тривалої гіпотензивної терапії виявилося дієвим. Було відзначене суттєве зниження рівнів САТ і ДАТ, а також значне збільшення кількості пацієнтів, які досягли цільового рівня АТ. Лікування добре переносилося хворими та супроводжувалося зниженням метаболічних факторів ризику (показників ліпідного, вуглеводного і пуринового обмінів). Терапія сприяла збільшенню рШКФ вже через чотири місяці.
Варто також зауважити, що ризик розвитку і прогресування ХХН значно підвищується при поєднанні АГ із ЦД. При призначенні фармакотерапії перевагу слід надавати блокаторам РААС – іАПФ або БРА, особливо за наявності протеїнурії або мікроальбумінурії (клас рекомендації I, рівень доказовості А). Доведено і користь АК, особливо у поєднанні з блокатором РААС. За наявними даними, фіксована комбінація раміприлу та амлодипіну є варіантом першого вибору для лікування хворих на АГ та ЦД із/без ХХН.
У дослідженні RAMONA також взяли участь 1276 пацієнтів із ЦД. У групі хворих на ЦД теж спостерігалося значне зниження рівнів САТ і ДАТ. За результатами лікування, до кінця періоду спостереження (чотири місяці) цільове значення АТ мали 69,8% хворих на ЦД і АГ (первинна кінцева точка). Слід зазначити, що лише 37,5% хворих потребували призначення максимальної дози (10/10 мг) фіксованої комбінації раміприлу/амлодипіну на 3-му візиті. Зниження АТ також супроводжувалося зменшенням ЧСС із 78,0±8,47 уд./хв (1-й візит) до 72,9±6,02 уд./хв (3-й візит). Лікування добре переносилося пацієнтами, до того ж спостерігалося зменшення виразності метаболічних факторів ризику (поліпшення показників ліпідного, вуглеводного і пуринового обмінів). Терапія сприяла збільшенню рШКФ вже через чотири місяці.
 Варто підкреслити, що унікальні властивості фіксованої комбінації раміприлу та амлодипіну, виявлені у процесі лікування хворих на ХХН та/або ЦД, багато в чому зумовлені наявністю в його складі іАПФ раміприлу. Препарат можна вважати еталонним у веденні пацієнтів групи високого ризику, зокрема із ЦД.
Варто підкреслити, що унікальні властивості фіксованої комбінації раміприлу та амлодипіну, виявлені у процесі лікування хворих на ХХН та/або ЦД, багато в чому зумовлені наявністю в його складі іАПФ раміприлу. Препарат можна вважати еталонним у веденні пацієнтів групи високого ризику, зокрема із ЦД.
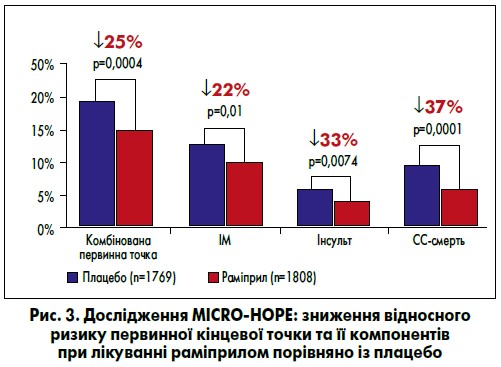
Доказова база раміприлу щодо зниження смертності та частоти кардіоваскулярних і ниркових ускладнень у хворих на ЦД величезна і включає, зокрема, дослідження MICRO HOPE. До нього загалом було залучено 3577 осіб віком ≥55 років із ЦД, СС-захворюваннями або ще принаймні одним фактором ризику. Згідно з отриманими даними, при застосуванні раміприлу порівняно із плацебо було встановлене достовірне зниження відносного ризику досягнення комбінованої первинної кінцевої точки (на 25%), зменшення ймовірності розвитку ІМ на 22%, інсульту – на 33% і СС-смерті – на 37% (рис. 3).
Підсумовуючи вищенаведене, слід зауважити, що результати дослідження RAMONA підтвердили ефективність застосування різних доз фіксованої комбінації раміприлу та амлодипіну в лікуванні пацієнтів із ЦД, які не досягли цільового значення АТ на попередній терапії. Ефект препарату не залежав від наявності СС-патологій в анамнезі, АГ або мікроальбумінурії, терапії інсуліном або пероральними цукрознижувальними засобами, типу ЦД.
Довідка «ЗУ»
Ураження нирок при АГ має повільно прогресивний перебіг з переходом у ТНН. Поєднання АГ та ХХН є вкрай несприятливим, адже зниження ШКФ являє собою фактор ризику прогресування ХХН та СС-смертності. Своєчасне лікування АГ поліпшує прогноз ХХН та знижує ризик СС-подій.
Згідно з сучасними рекомендаціями, у пацієнтів з АГ препаратами першого вибору є блокатори РААС, зокрема іАПФ раміприл. Ефективність раміприлу доведено на всіх етапах СС-континууму: при АГ, АГ і гіпертрофії ЛШ, ішемічній хворобі серця, ІМ, ЦД, хронічних СН і нирковій недостатності, протеїнурії. В осіб з АГ та різними супутніми факторами ризику приймання препарату асоціювалося зі зниженням ризику СС-ускладнень та смерті. Також у хворих на недіабетичні форми ХХН вірогідність розвитку ТНН або значного зниження ШКФ зменшувалася.
У пацієнтів, що потребуть комбінованої терапії, ефективність продемонструвала, зокрема, фіксована комбінація раміприлу з амлодипіном. На фармацевтичному ринку України вона представлена препаратом Хартил® АМ виробництва компанії «ЕГІС». Хартил АМ випускається у чотирьох варіантах поєднання доз раміприлу/амлодипіну: 5/5 мг, 5/10 мг, 10/5 мг та 10/10 мг, що дозволяє максимально індивідуалізувати лікування. Така фіксована комбінація чинить потужний антигіпертензивний ефект, добре переноситься пацієнтами, дозволяє ефективно контролювати АТ, а також забезпечує позитивну нефропротективну дію.
Таким чином, фіксована комбінація раміприлу та амлодипіну заслуговує на особливу увагу, оскільки у хворих на АГ із ХХН та/або ЦД доведено її високу антигіпертензивну ефективність, добру переносимість, позитивний вплив на ліпідний, вуглеводний і пуринових обмін, а також нефропротективні властивості. Широке застосування такого поєднання препаратів дозволить поліпшити контроль АТ та знизити частоту кардіоваскулярних і ниркових ускладнень у даної популяції пацієнтів.
Підготувала Олена Коробка
Список літератури знаходиться в редакції
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 5 (72) 2020 р.



