3 квітня, 2021
Взаємозамінність Клівасу та Крестору: доведена біоеквівалентність препаратів
Серцево-судинні захворювання (ССЗ), переважно ішемічна хвороба серця (ІХС) та інсульт, є провідними причинами смертності й одними з основних факторів інвалідності в усьому світі. Такі висновки отримані з дослідження Глобального тягаря хвороб (GBD – Global Burden of Disease) за 2019 р. Кардіоваскулярна патологія залишається основною причиною смертності в Європі та становить 47% серед жінок і 39% серед чоловіків. За даними Американської асоціації серця (АНА), вже до 2030 р. летальність від ССЗ досягне 23,6 млн осіб. За показником смертності від кардіоваскулярної патології Україна залишається одним зі світових лідерів. За останні 30 років поширеність ССЗ серед українців зросла на 8%, а рівень смертності від них становить 67%.
Аспекти статинотерапії в осіб з ІХС
Пацієнти з підтвердженою ІХС мають дуже високий ризик розвитку серцево-судинних подій. Відповідно до рекомендацій Європейського товариства кардіологів (ESC) та Європейського товариства з атеросклерозу (EAS) 2011 р., такі пацієнти повинні отримувати терапію гіполіпідемічними засобами незалежно від рівня холестерину (ХС) ліпопротеїнів низької щільності (ЛПНЩ). З огляду на складність, витратність, побічні ефекти та, отже, необхідність моніторування, проблему інтенсивного гіполіпідемічного лікування може бути розв’язано тільки за умов використання ефективного та безпечного препарату. Сьогодні серед різних груп гіполіпідемічних засобів саме статини є найважливішою складовою у комплексній медикаментозній терапії осіб з ІХС з урахуванням їхньої доведеної ефективності (профілактики та стабілізації атеросклерозу) і безпеки при тривалому застосуванні (ESC, 2019).
За даними проведених клінічних досліджень, у більшості випадків цільового значення ХС ЛПНЩ вдається досягти за допомогою монотерапії статинами. Основні фармакологічні ефекти статинів пов’язані не лише із пригніченням біосинтезу ХС, що призводить до зниження рівня ХС ЛПНЩ, але також із наявністю численних плейотропних ефектів. На сьогодні виявлено понад 20 плейотропних властивостей статинів, що є різноманітними і клінічно значущими (антиагрегантна, імуномодуляторна, протизапальна дія тощо) (Karlson et al., 2015).
Властивості розувастатину
Серед усіх представників статинів саме розувастатин має максимальну ліпідзнижувальну активність щодо ферменту ГМГ-КоА-редукази. У порівняльних дослідженнях, які проводили в межах проєкту GALAXY (STELLAR, ANDROMEDA, MERCURY I і II та ін.), переваги лікування розувастатином перед іншими статинами стосувалися практично всіх ліпідних параметрів. Окрім того, у світлі нових даних щодо ХС ліпопротеїнів високої щільності (ЛПВЩ) слід враховувати користь розувастатину щодо підвищення цього ліпідного параметра порівняно з іншими статинами, які були продемонстровані у порівняльних випробуваннях (STELLAR, MERCURY I і II, DISCOVERY-alpha, VOYAGER тощо).
Сучасна стратегія лікування всіх захворювань, зокрема ССЗ, характеризується системністю і передбачає проведення ефективної та безпечної фармакотерапії. За визначенням Всесвітньої організації охорони здоров’я (ВООЗ), раціональне медикаментозне лікування передбачає отримання пацієнтами якісних препаратів, що відповідають клінічним умовам, у необхідній дозі та за найменших витрат для хворого і держави, тобто генеричних, які є менш вартісними. У зв’язку з цим лікар-практик і пацієнт у межах розробки спільної тактики та стратегії терапії щодня стикаються із проблемою вибору не тільки ефективного й безпечного, але й економічно вигідного лікарського засобу з наявного арсеналу медикаментів. Процедура вибору препарату для конкретного хворого здійснюється за складним алгоритмом, що ґрунтується на ієрархії чинників: клінічних, економічних, етичних, психологічних, соціальних та ін.
Роль генериків у лікуванні ІХС
Характерною особливістю сучасного українського фармацевтичного ринку є насичення переважно не оригінальними препаратами, а вже відомими лікарськими засобами, що приховані за різними торговими назвами, – генериками. Відповідно до сучасних уявлень, «ідеальний» генерик повинен мати аналогічні оригінальному препарату ефективність і безпеку при проведенні фармакотерапії.
Згідно з настановою СТ-Н МОЗУ 42‑7.2:2018, двоє ліків, що містять однакову діючу речовину, вважаються біоеквівалентними, якщо вони є фармацевтично еквівалентними або фармацевтично альтернативними, а їхня біодоступність (швидкість та ступінь абсорбції) після введення у тій самій молярній дозі входить до попередньо встановлених критеріїв прийнятності. Останні слугують для забезпечення порівняння характеристик перпаратів in vivo, тобто для визначення подібності з точки зору безпеки та ефективності.
Концепція біоеквівалентності є основою для генеричних засобів згідно зі статтею 10 (1) Директиви 2001/83/ЄС Європейського Парламенту та Ради ЄС. Мета встановлення біоеквівалентності досліджуваних ліків – доведення еквівалентності біофармацевтичної якості тестованого і референтного препаратів за участю здорових добровольців, щоб екстраполювати результати доклінічних і клінічних досліджень, проведених для референтного засобу, на тестований.
Відповідно до «Порядку проведення клінічних випробувань лікарських засобів та експертизи матеріалів клінічних випробувань і Типового положення комісії з питань етики» (затверджено Наказом МОЗ України від 23.09.2009 № 690 зі змінами), «СТ-Н МОЗУ 42‑7.1:2005 «Лікарські засоби. Дослідження біодоступності та біоеквівалентності», еквівалентність in vivo генеричного та інноваційного (референтного) препаратів у твердих лікарських формах (системної дії) для перорального застосування слід доводити насамперед у межах клінічних досліджень з оцінки їхньої біоеквівалентності за участю здорових добровольців.
Одним із провідних вітчизняних фармацевтичних виробників ТОВ «Фарма Старт» (на сьогодні відбулася інтеграція зі швейцарською компанією ACINO) розроблено генеричний засіб, який містить розувастатин, і з 2013 р. доступний на фармринку України як препарат Клівас. Із 2015 р. він є найбільш продаваним (за кількістю упаковок) лікарським засобом серед найчастіше застосовуваних гіполіпідемічних ліків (як-от аторвастатин/розувастатин). Виробництво Клівасу відповідає усім вимогам стандартів належної виробничої практики (GMP), що підтверджено сертифікатом EU GMP щодо всіх ліній виробництва.
Клінічне дослідження біоеквівалентності препаратів Клівас і Крестор
Згідно з сучасними регуляторними вимогами, з метою проведення процедури державної реєстрації препаратів та отримання дозволу на маркетинг компанією ТОВ «Фарма Старт» було виконане клінічне дослідження з оцінки біоеквівалентності препаратів Клівас 20 (таблетки, вкриті плівковою оболонкою, по 20 мг виробництва ТОВ «Фарма Старт», Україна) і Крестор (таблетки, вкриті оболонкою, по 20 мг виробництва IPR Pharmaceuticals Inc., Пуерто-Ріко, США) для AstraZeneca UK Limited (Велика Британія) за участю здорових добровольців. Дане випробування проводили відповідно до Закону України «Про лікарські засоби» та затвердженого протоколу дослідження (версія 2 від 26.07.2011), з дотриманням принципів належної клінічної практики (GCP) згідно із СТ-Н МОЗУ 42‑7.0:2008 «Лікарські засоби. Належна клінічна практика», CPMP/ICH/135/95 (E6) Note for Guidance on good clinical practice, 2002, CPMP/EWP/QWP/1401/98 Revision 1 / Corr of the Guideline on the investigation of bioequivalence, СТ-Н МОЗУ 42‑7.1:2005 «Лікарські засоби. Дослідження біодоступності та біоеквівалентності», керуючих документів Європейського співтовариства, ВООЗ та ін.
Метою порівняльного рандомізованого перехресного дослідження із двома періодами і двома послідовностями було вивчення біоеквівалентності двох ліків, які містять розувастатин, – препаратів Клівас 20 та Крестор при застосуванні добровольцями одноразової дози натщесерце. Також виконували «засліплення» аналітичного етапу випробування і статистичну обробку результатів. Загалом у клінічне дослідження було залучено 26 здорових добровольців обох статей, які відповідали критеріям включення/виключення. Всі учасники завершили участь у дослідженні.
Клінічну частину дослідження було проведено у Клініко-діагностичному центрі Національного фармацевтичного університету (м. Харків), відповідальний дослідник – д. мед. н., професор І.А. Зупанець. Біоаналітичну частину та статистичну обробку результатів виконували у ТОВ «Біоаналітична лабораторія «Клінфарм», відповідальний виконавець – к. б. н. В.Є. Сабко.
На рисунку представлені дані про середню плазмову концентрацію розувастатину у здорових добровольців (n=26) після одноразового перорального застосування препаратів Клівас 20 та Крестор.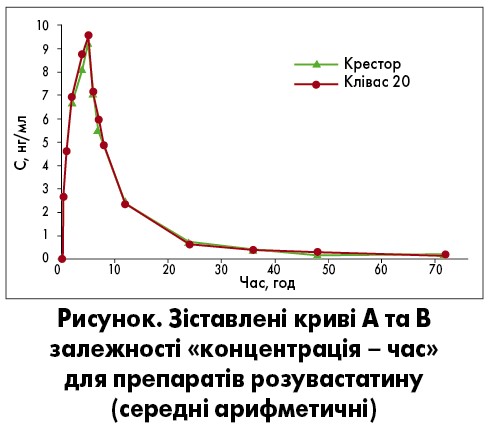
Після приймання препаратів Клівас 20 та Крестор середні значення основних констант фармакокінетики склали:
- максимальної концентрації (Сmax) розувастатину в плазмі крові – 10,18 та 9,698 нг/мл відповідно;
- значення площі під фармакокінетичними кривими розувастатину від нуля до останньої точки відбору крові (AUC0-t) – 95,35 та 96,03 нг×год/мл відповідно.
Аналіз отриманих даних для параметра AUC0-t свідчить, що знайдені межі 90%-го довірчого інтервалу (ДІ) для відношень геометричних середніх становлять 81,37‑109,89%, тобто не виходять за межі допустимого діапазону 80‑125%. Таким чином, за показником AUC0-t біоеквівалентність препарату Клівас 20 щодо препарату Крестор доведено. Стосовно параметра Cmax аналіз результатів вказує на те, що знайдені межі 90%-го ДІ для відношень геометричних середніх складають 86,80‑113,32%, тобто не виходять за межі допустимого діапазону 80‑125%. Тож біоеквівалентність препарату Клівас 20 щодо препарату Крестор за показником Cmax було доведено. Ґрунтуючись на оцінці параметрів Cmax та AUC0-t, можна дійти висновку, що препарат Клівас 20 є біоеквівалентним препарату Крестор при застосуванні здоровими добровольцями у пероральній формі одноразової дози натщесерце.
Таким чином, Клівас 20 та Крестор є біоеквівалентними, а отже, взаємозамінними лікарськими засобами.
Важливість доступності інформації щодо взаємозамінності генерика та оригінального препарату
На сьогодні українські лікарі, фармацевтичні працівники та хворі позбавлені доступу до важливої інформації стосовно того, чи доведено взаємозамінність генерика та оригінального препарату. Для клініцистів ці відомості є важливими, щоб раціонально обирати ефективні та безпечні ліки (із доведеною біоеквівалентністю), для провізорів – аби була можливість проводити належну генеричну заміну, а для пацієнтів – щоб бути поінформованими стосовно якості призначеного лікарського засобу.
Відсутність доступу до даних щодо взаємозамінності суттєво ускладнює вибір ліків, й клініцисти часто вимушені призначати той чи інший препарат на власну думку або в межах рекламних заходів фармацевтичних компаній. У зв’язку з цим доступність інформації стосовно взаємозамінності лікарських засобів є вельми актуальною в нашій країні.
Саме це було поштовхом для створення спеціалізованого видання – «Довідника еквівалентності лікарських засобів – Rx index», який містить дані про препарати, зареєстровані в Україні. Тут наявна інформація щодо належності препаратів до певного типу (оригінальний, генеричний, із добре вивченим медичним застосуванням тощо) та обраного методу доведення еквівалентності. Представлену в даному виданні класифікацію еквівалентності лікарських засобів (присвоєння відповідного коду) затверджено методичними рекомендаціями МОЗ України «Теоретичне обґрунтування та реалізація сучасних принципів оцінки еквівалентності лікарських засобів в Україні» (І.А. Зупанець та співавт., 2017). Таким чином, «Довідник еквівалентності лікарських засобів – Rx index» інформує про терапевтичну еквівалентність оригінального засобу та генерика і допоможе лікареві призначити той чи інший препарат на підставі фармакокінетичних та фармакоекономічних показників відповідно до стандарту лікувально-діагностичного процесу.
У даному виданні представлено понад 100 препаратів, що містять активну речовину розувастатин у дозуванні 10, 20, 30 та 40 мг. Але серед них не всі мають відповідну інформацію (код) щодо типу (оригінальний або генеричний) та взаємозамінності. За результатами проведеного клінічного дослідження з вивчення біоеквівалентності, у довіднику лікарський засіб Клівас 20 має код В1.1. Це означає, що:
- взаємозамінність препарату Клівас 20 встановлено шляхом проведення дослідження біоеквівалентності (in vivo);
- взаємозамінність підтверджено шляхом проведення дослідження біоеквівалентності порівняно з оригінальним засобом (Крестор);
- Клівас 20 є якісним генеричним препаратом із доведеними ефективністю та безпекою.
Список літератури знаходиться в редакції
UA-CLIV-PUB-022021-045
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 1 (74) 2021 р.



