27 листопада, 2021
Дисліпідемія в практиці сімейного лікаря
Під дисліпідемією розуміють порушення функції та/або складу ліпідів і ліпопротеїнів крові, котрі можуть виникати внаслідок багатьох причин і здатні самостійно або у взаємодії з іншими факторами ризику спричиняти маніфестацію атеросклеротичного процесу. Дисліпідемія є важливим фактором ризику атеросклеротичних кардіоваскулярних захворювань – ішемічної хвороби серця, інсульту, хвороби сонних і периферичних артерій, аневризми черевного відділу аорти. Своєчасне призначення статинів, зокрема розувастатину, в адекватних дозах дозволяє ефективно коригувати дисліпідемічні порушення, суттєво знизити кардіоваскулярний ризик і покращити прогноз пацієнтів.
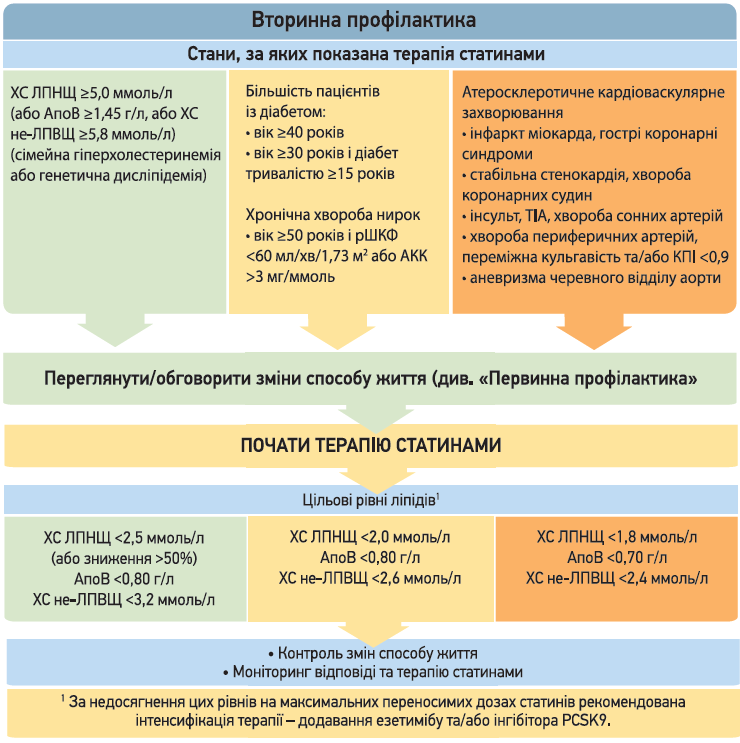
За рекомендаціями Канадського кардіоваскулярного товариства (CCS, 2021), скринінг дисліпідемії рекомендовано проводити в чоловіків і жінок віком ≥40 років, а також в усіх пацієнтів незалежно від віку за наявності додаткових факторів ризику: клінічних ознак атеросклерозу, артеріальної гіпертензії, діабету, куріння, обтяженого сімейного анамнезу тощо. Скринінг передбачає збір анамнезу та фізикальний огляд, визначення ліпідного і глікемічного профілю, а також оцінку функції нирок. Для інтерпретації ліпідограми замість рівня холестерину ліпропротеїнів низької щільності (ХС ЛПНЩ) краще використовувати рівні ліпопротеїнових часток, які не належать до холестерину ліпротеїнів високої щільності (ХС не-ЛПВЩ), або рівень аполіпротеїну В (АпоВ). Для оцінки кардіоваскулярного ризику CCS рекомендує застосовувати Фрамінгемську шкалу (FRS), що прогнозує 10-річний ризик розвитку ішемічної хвороби серця, захворювання периферичних артерій, серцевої недостатності та цереброваскулярних подій.
Стратегія лікування дисліпідемій включає немедикаментозні (дієта, корекція маси тіла, підвищення фізичної активності, припинення куріння) та медикаментозні (статини, езетиміб, інгібітори PCSK9) методи. Згідно з настановами CCS (2021), препаратами першої лінії в терапії дисліпідемій є статини. Всім пацієнтам, які отримують статини з метою вторинної профілактики, рекомендовані високоінтенсивні режими статинотерапії (розувастатин або аторвастатин).
Статини є структурними інгібіторами гідрокси-метилглутарил-коензим-А-редуктази (ГМГ-КоА) – основного ферменту, який регулює біосинтез ХС у гепатоцитах. У результаті зниження внутрішньоклітинного вмісту ХС гепатоцит збільшує кількість мембранних рецепторів до ЛПНЩ на своїй поверхні. Рецептори зв’язують і виводять із кровотоку атерогенні частки ЛПНЩ, що знижує концентрацію ХС у крові.
Терапія статинами дозволяє знизити рівень ХС ЛПНЩ на 20-60%, тригліцеридів (ТГ) – на 8-15%, підвищити рівень холестерину ліпопротеїнів високої щільності (ХС ЛПВЩ) на 5-15%. Тривале застосування статинів (не менше ніж 5 років) знижує смертність від ішемічної хвороби серця й інших кардіоваскулярних захворювань на 25-40%.
З огляду на низькі цільові рівні ХС ЛПНЩ у пацієнтів із дуже високим і високим кардіоваскулярним ризиком найважливішою властивістю статинів, яку необхідно враховувати при виборі препарату, слід вважати силу його дії. Серед усіх статинів, які застосовуються в клінічній практиці, найбільшу гіполіпідемічну ефективність має розувастатин. Діапазон доз розувастатину від 5 до 40 мг/сут перекриває весь спектр необхідних лікувальних впливів – від помірного ризику (зниження ХС ЛПНЩ на 30%, доза 5 мг/добу) до дуже високого (доза 20-40 мг/добу, зниження ХС ЛПНЩ на 55-63%).
У дослідженні STELLAR порівнювали гіполіпідемічну ефективніcть розувастатину й інших статинів упродовж 6 тиж терапії. Застосування розувастатину в дозі 10 мг/добу забезпечувало досягнення цільового рівня ХС ЛПНЩ <2,6 ммоль/л у 82% пацієнтів порівняно із 74% хворих, які приймали аторвастатин у дозі 20 мг/добу, та 66% пацієнтів, котрі отримували симвастатин у дозі 40 мг/добу.
У дослідженні METEOR за участю 984 пацієнтів із субклінічним атеросклерозом, які приймали 40 мг розувастатину або плацебо впродовж 2 років, була доведена можливість стабілізації атеросклеротичної бляшки на тлі активного лікування.
За результатами дослідження ASTEROID, де використовували внутрішньосудинне ультразвукове дослідження, застосування розувастатину в впродовж 2 років дозволило зменшити рівень ХС ЛПНЩ у середньому на 53,2% та підвищити рівень ХС ЛПВЩ у середньому на 14,7%, а також сприяло регресу коронарної атеросклеротичної бляшки в 78% пацієнтів.
Гіполіпідемічний ефект розувастатину розвивається вже після 1 тиж від початку терапії, а через 2 тиж досягається 90% від максимально можливого ефекту. Максимальний терапевтичний ефект зазвичай розвивається до 4-го тижня лікування й підтримується при постійному прийомі препарату. Висока гіполіпідемічна ефективність розувастатину є особливо важливою в амбулаторній клінічній практиці, оскільки дозволяє скоротити терміни титрування дози препарату, забезпечує швидше настання сприятливого клінічного ефекту, підвищує прихильність пацієнтів до лікування.
Суттєвими перевагами розувастатину стосовно безпеки є низька ліпофільність і практично повна відсутність взаємодії із системою цитохрому CYP (P450), за участю якого метаболізується значна кількість ліків. Ці властивості розувастатину забезпечують низький ризик медикаментозних взаємодій при його застосуванні на відміну від інших статинів.
Пацієнти, які отримують гіполіпідемічну терапію, потребують періодичного моніторингу ефективності та безпеки лікування. Перед призначенням статинів потрібно здійснити щонайменше два вимірювання ліпідів крові з інтервалом в 1-12 тиж, за винятком станів, за яких рекомендується негайна лікарська терапія (гострий коронарний синдром і дуже високий ризик). Ліпідний профіль також визначають через 4-12 тиж після початку лікування або зміни його інтенсивності, а після досягнення цільового рівня ліпідів – щорічно.
Печінкові ферменти (аналінамінотрансфереза – АЛТ) слід контролювати до лікування, через 8-12 тиж після початку статинотерапії або підвищення дози препарату. Якщо рівень АЛТ підвищений <3 ВМН (верхня межа норми), необхідно продовжувати терапію з повторним контролем через 4-6тиж. У разі підвищення АЛТ >3 ВМН слід припинити гіполіпідемічну терапію чи зменшити дозу та повторно визначити печінкові ферменти протягом 4-6тиж; відновити терапію можна після нормалізації рівня АЛТ.
Рівень креатинкінази перевіряють до початку статинотерапії і потім у разі розвитку міалгії. Лікування слід припинити за підвищення креатинкінази <10 ВМН та появи симптомів міалгії або в разі підвищення >10 ВМН незалежно від наявності симптомів.
У пацієнтів, які отримують високоінтенсивну статинотерапію і мають високий ризик розвитку цукрового діабету, рекомендовано регулярно перевіряти рівень HbA1с або глюкози крові. До цієї категорії, зокрема, належать пацієнти літнього віку, з метаболічним синдромом, ожирінням або іншими ознаками інсулінорезистентності.
Список літератури знаходиться в редакції.
За матеріалами:
Pearson G.J., Thanassoulis G., Anderson T.J. et al. 2021 Canadian Cardiovascular Society Guidelines for the Management of Dyslipidemia for the Prevention of Cardiovascular Disease in the Adult. Can. J. Cardiol. 2021 Mar 26; S0828-282X(21)00165-3.
Підготував Ігор Гладкий