30 липня, 2021
Хвороба Фабрі: основні аспекти та кардіологічні прояви
За матеріалами ХІ Науково-практичної конференції Асоціації аритмологів України» (19‑21 травня 2021 року)
Хвороба Фабрі (ХФ) – спадкове гетерогенне та мультисистемне прогресуюче захворювання, для якого характерні кардіальні, ниркові, неврологічні та інші прояви, а очікувана тривалість життя пацієнтів є значно меншою порівняно із загальною популяцією. Незважаючи на доступні методи лікування та підтримуючу терапію, ураження серця має суттєвий прогностичний вплив, оскільки є основною причиною смерті при даній патології. Про особливості перебігу, діагностики та лікування ХФ розповідає наукова співробітниця ДУ «Національний інститут серцево-судинної хірургії імені Миколи Амосова» НАМН України, к. мед. н. Лідія Олександрівна Невмержицька.
Епідеміологія та патогенез
Л.О. Невмержицька зауважила, що ХФ є лізосомною хворобою накопичення, яку вперше описали В. Андерсен та Й. Фабрі 1898 р. незалежно один від одного. Поширеність хвороби, яка має Х-зчеплений тип успадкування, становить 1:40 000‑1:117 000 серед чоловіків та 1:20 000 серед жінок (Vardarli et al., 2020).
У чоловіків зазвичай розвивається більше симптомів, які є серйознішими, ніж у жінок (Yuasa et al., 2017). У жіночій популяції часто зустрічається некласична форма з менш вираженими клінічними проявами, хоча ХФ може перебігати не менш тяжко, ніж у чоловіків, для яких характерна класична форма хвороби.
Причиною виникнення захворювання є мутації у гені GLA на довгому плечі хромосоми Хq22.1, що спричиняють недостатність α-галактозидази А та накопичення субстрату – нейтральних глікосфінголіпідів, переважно глоботріаозилцерамідів (GL‑3), у лізосомах різних клітин (Kubo, 2017). Останнє є основною рушійною силою прогресування ХФ. Залежно від того, де саме накопичується субстрат (кардіоміоцити, нейрони, подоцити, ендотеліоцити тощо), страждають відповідні органи (серце, нирки, кровоносні судини, ганглії вегетативної нервової системи, потові залози).
До групи ризику при ХФ відносять осіб, що перенесли інсульт у молодому віці, пацієнтів з ідіопатичною гіпертрофічною кардіоміопатією та термінальною стадією хронічної хвороби нирок неясного ґенезу.
Клінічні прояви
Клінічними проявами ХФ у дітей можуть бути затримка росту, психологічні особливості, ангіокератоми, помутніння рогівки, порушення з боку нирок, гіпогідроз, втрата слуху, шлунково-кишкові розлади, такі як персистувальний біль у животі, що не купується традиційними терапевтичними засобами (Ellaway, 2016). Натомість ураження нервової системи (периферична невропатія) та серця – аритмії, порушення провідності, клапанна дисфункція, гіпертрофія лівого шлуночка (ГЛШ) – зустрічаються рідше, ніж у дорослих.
За словами доповідачки, клінічна картина захворювання у дорослих схожа на таку, як у дітей, але на перший план виходять тяжчі симптоми, зокрема кардіальні:
- аритмії;
- порушення провідності;
- ГЛШ;
- інфаркт міокарда (ІМ);
- серцева недостатність (СН);
- раптова смерть.
Проявами ранньої маніфестації ХФ у дорослому віці можуть бути інсульти, транзиторні ішемічні атаки. Також зустрічаються стомлюваність, депресія, помутніння рогівки, ниркові ускладнення, порушення слуху, моторики ШКТ, периферична нейропатія, ангіокератоми та гіпогідроз (Chan, Adam, 2018).
Через поліморфізм клінічної симптоматики у пацієнтів із ХФ часто помилково діагностують ревматоїдний або ювенільний артрит, фіброміалгію, розсіяний склероз, хронічну переміжну демієлінізувальну поліневропатію, синдром Рейно, системний червоний вовчак, гострий апендицит, петехії, васкуліт, кардит тощо.
Кардіальні прояви
Відповідно до чинних рекомендацій Європейського товариства кардіологів (ESC, 2014), ХФ є однією із причин гіпертрофічної кардіоміопатії (ГКМП) – у 0,5‑1% випадків серед осіб віком від 35‑40 років. За даними метааналізу 20 досліджень зі скринінгом ХФ, ГКМП зустрічається у 0,9‑3,9% жінок та 1,1‑11,8% чоловіків. Поширеність ХФ залежно від дебюту ГКМП у чоловіків становить 6,3% при ГКМП, діагностованій у віці >40 років, 1,4% – у менш ніж 40 років та 12% у жінок із пізно діагностованим ГКМП (середній вік – 50 років). Отже, ГКМП є «червоним прапорцем», що свідчить про необхідність скринінгу на ХФ.
Кардіальні прояви зумовлюють найбільшу летальність: серцево-судинна патологія є причиною смерті у 40% чоловіків (середній вік – 55,5 років) та 41,7% жінок (середній вік – 66 років).
Без діагностики та контролю перебігу ХФ скорочує тривалість життя на 15 років у жінок та на 20 років у чоловіків (Waldek et al., 2009). Прогресування захворювання залежить від віку та початку терапії. Лекторка наголосила: що раніше буде встановлено діагноз та розпочато лікування, то кращим буде прогноз.
Найчастішим кардіальним явищем є ГЛШ >12 мм, встановлена на підставі даних ехокардіографії (ЕхоКГ), та аритмії (рис. 1). При цьому ураження серця може бути єдиним проявом ХФ (Ommen et al., 2003). ГЛШ призводить до розвитку діастолічної дисфункції та СН, порушення провідності й аритмії, таких як подовження інтервалу PR, синдром слабкості синусового вузла, атріовентрикулярної блокади, фібриляції передсердь, шлуночкової тахікардії, раптової смерті.
Також з-поміж ускладнень із боку серця зустрічаються зниження толерантності до фізичних навантажень, стенокардія, ІМ, недостатність мітрального та аортального клапанів, розширення кореня аорти (Azevedo et al., 2021).
Під час магнітно-резонансної томографії серця у пацієнта із ХФ типовими є виявлення замісного фіброзу базальної та задньолатеральної стінки ЛШ, трансмуральне ураження, потовщення стінки.
Поширеність кардіальних симптомів при ХФ залежить від наявності гіпертрофії ЛШ: чим вона більша, тим виразніші симптоми, зокрема задишка/СН, стенокардія, аритмія. Своєю чергою ураження серця на пізніх стадіях і фіброз можуть призвести до розвитку небезпечних для життя серцевих аритмій, включно зі злоякісною шлуночковою тахіаритмією і ФП. Серед 593 пацієнтів віком <18 років з електрокардіографічними даними, які є у Реєстрі Фабрі, синусова брадикардія (при частоті серцевих скорочень <60 уд./хв) була найчастішою аритмією (12,3%).
Варто зауважити, що застосування аміодарону при ХФ потребує обережності. Аміодарон – хімічна субстанція, яка має спорідненість до лізосом, зменшує їх рН та активність ферментів, що призводить до зміни клітинної морфології. У деяких випадках використання аміодарону в осіб із ХФ може спричинити розвиток гострої СН (Fine et al., 2019).
Діагностика
Для підтвердження діагнозу ХФ використовують метод сухої плями крові (DBS) для наступної ферментної та ДНК-діагностики (при зниженні активності ферменту). Скринінгу потребують усі пацієнти, що мають ГЛШ ≥12 мм, різного виду аритмії та додаткові симптоми, особливо, якщо це хворі молодого віку. Діагностика є безкоштовною для пацієнта – усі витрати, включно з логістикою зразків до лабораторії ARCHIMED Life Science GmbH Laboratories в Австрії, покриває компанія «Санофі-Авентіс Україна».
Лікування
Для лікування ХФ застосовують ферментнозамісну терапію (ФЗТ), основним принципом якої є відновлення активності ферменту до рівня, достатнього для розщеплення накопиченого субстрату в тканинах органів. Таким чином ФЗТ запобігає, стабілізує або гальмує прогресуючі відхилення у функціонуванні цих органів до настання незворотних наслідків.
На фармацевтичному ринку наявні два рекомбінантні ферментні препарати – агалсидаза альфа (рекомендоване дозування – 0,2 мг/кг) та агалсидаза бета (1,0 мг/кг) для внутрішньовенного (в/в) введення кожні два тижні. Вони є ідентичними за послідовністю амінокислот, при цьому агалсидаза бета має більше монозних груп, а отже – кращу спорідненість до рецепторів, що позначається на ефективності препарату.
У порівняльному дослідженні ефективності агалсидази бета та агалсидази альфа було показано, що, хоча у групі агалсидази бета було майже удвічі більше осіб із класичною формою ХФ (із тяжчим перебігом) та менше пацієнтів, які почали лікування у дитячому віці, вона сприяла зниженню рівня GL-3 у клітинах-мішенях. На тлі терапії агалсидазою бета було відзначено вищий рівень покращення біохімічних показників та зниження маси ЛШ (Arends et al., 2018).
У пацієнтів, що мали перейти з агалсидази бета на агалсидазу альфа або зменшити дози агалсидази бета через проблеми з поставками препарату, протягом першого року знизився кліренс креатиніну та погіршилася функція нирок. Натомість при переході на лікування агалсидазою бета відзначалося її поліпшення. Аналогічна ситуація спостерігалася через один рік із накопиченням субстрату GL‑3 у пацієнтів, що перейшли на агалсидазу альфа, тоді як ще через рік після повернення до терапії агалсидазою бета кількість субстрату зменшилася (Weidemann et al., 2014).
ФЗТ агалсидазою бета
Агалсидаза бета (препарат Фабразим®*) – рекомбінантна форма α-галактозидази А людини, яку виробляють на основі рекомбінантної ДНК із використанням культур клітин ссавців, а саме клітин яєчника китайського хом’яка. Послідовність амінокислот рекомбінантної форми, як і нуклеотидів, що її кодує, є повністю ідентичною природній α-галактозидазі А.
Рекомендована доза агалсидази бета становить 1 мг/кг маси тіла, яку вводять шляхом в/в інфузії один раз на два тижні. Початкова швидкість інфузії (максимальна – 0,25 мг/хв) може поступово підвищуватися залежно від переносимості препарату пацієнтом. Після в/в ін’єкції агалсидаза бета миттєво виводиться із кровообігу та переноситься крізь судинні ендотеліальні й паренхімні клітини до лізосом, можливо, за допомогою фосфату манози‑6, манози та асіалоглікопротеїнових рецепторів. Тобто препарат не проникає через гематоенцефалічний бар’єр.
Застосування агалсидази бета в/в є ефективним та добре переноситься пацієнтами із ХФ. За результатами дослідження III фази, агалсидаза бета сприяє зниженню рівня GL-3 у клітинах-мішенях та запобігає його повторному накопиченню. Також агалсидаза бета забезпечує значний терапевтичний ефект за рахунок зниження ризику серйозних клінічних подій (Keating, Simpson, 2012).
Ефективність застосування ФЗТ агалсидазою бета у чоловіків та жінок є приблизно однаковою. Через наявність у жінок залишкової активності ферменту в них рідше формуються антитіла до препарату. Виникнення антитіл виникає протягом трьох місяців після початку терапії. Для 50% пацієнтів з антитілами характерний розвиток асоційованих з інфузією реакцій, переважно ознобу й гарячки. Згодом титр антитіл перестає наростати та знижується (або навіть вони зникають). У невеликої кількості хворих можуть розвиватися реакції гіперчутливості.
Лікування у педіатричних пацієнтів проводять у тій самій дозі препарату, що й у дорослих – 1,0 мг/кг кожні два тижні. У дітей терапія зменшує біль, гастроінтестинальні проблеми, число днів невідвідування школи, а також поліпшує якість життя.
Лідія Олександрівна зазначила, що препарат Фабразим® показаний для застосування пацієнтам із підтвердженим діагнозом ХФ, зокрема він (Germain et al., 2007; Azevedo et al., 2021):
- знижує ризик серйозних ускладнень захворювання;
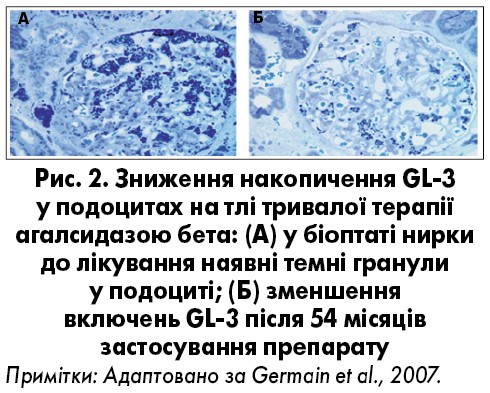
- сприяє стабілізації функції нирок (рис. 2);
- зумовлює регресію ГЛШ;
- покращує функцію міокарда;
- зменшує біль;
- підвищує кліренс GL‑3 із ключових місць накопичення;
- поліпшує якість життя.
За даними досліджень, лікування агалсидазою бета зменшує гіпертрофію міокарда, покращує серцеву функцію, підвищує толерантність до фізичного навантаження. Тяжкість початкової гіпертрофії та фіброзу визначає результат терапії (Arends et al., 2018).
За відсутності потовщення стінки ЛШ на вихідному рівні <11,5 мм застосування ФЗТ допомагає запобігати розвитку гіпертрофії. При помірному збільшенні товщини стінки ЛШ на початку терапії (11,5‑13,5 мм) протягом перших років використання спостерігається регрес гіпертрофії та повернення стінки ЛШ до норми. При тяжкій ГКМП на вихідному рівні >13,5 мм упродовж перших років лікування має місце незначний її регрес, та стінка ЛШ залишається збільшеною.
Таким чином, Фабразим® – оптимальний препарат для застосування у пацієнтів із ХФ. Пацієнти із гіпертрофією ЛШ ≥12 мм, різними видами аритмій неясного ґенезу та серцевою недостатністю, інфарктами, транзиторними ішемічними атаками та іншими клінічними проявами, особливо у молодому віці, потребують проведення скринінгу на дане рідкісне захворювання.
* Лікарський засіб Фабразим®, порошок для приготування концентрату 5 мг/мл для розчину для інфузій, зареєстрований в Україні. Р.П. № UA/10306/01/01. Наказ МОЗ України № 673 від 18.03.2020.
Підготувала Олександра Демецька
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 3 (76) 2021 р.



