15 серпня, 2022
Сучасні уявлення про ураження серцево-судинної системи на тлі COVID‑19 та постгострі наслідки
COVID‑19 чинить суттєвий негативний вплив на серцево-судинну (СС) систему. Наявні у пацієнтів серцево-судинні захворювання (ССЗ) до інфікування COVID‑19 та вірусне навантаження асоційовані з пошкодженням міокарда й гіршими результатами. Пандемія триває, зокрема, з’являються нові варіанти коронавірусу, тож розуміння патофізіології та відповідних клінічних наслідків допоможе розширити уявлення про основні механізми розвитку хвороби. Вирішальне значення також мають встановлення нових біомаркерів СС-ускладнень і розробка ефективних методів лікування COVID‑19. Пропонуємо до вашої уваги консенсусний документ Європейського товариства кардіологів (ESC) та Асоціації невідкладної кардіологічної допомоги (ACVC) у співпраці з Європейською асоціацією серцевого ритму (EHRA) 2021 р., у якому підсумовано сучасні відомості про ураження СС-системи на тлі COVID‑19 та його постгострі наслідки.
За даними ВООЗ, станом на червень 2021 р. пандемія COVID‑19 охопила понад 214 млн людей і спричинила більш ніж 4,4 млн смертей із грудня 2019 р. Це поліорганне захворювання характеризується цитокіновим штормом, що призводить до розвитку ендотеліального запалення/дисфункції, мікро- та макросудинного тромбозу.
Реакція судин на вироблення цитокінів та взаємодія між коронавірусом тяжкого гострого респіраторного синдрому 2 (SARS-CoV‑2) і рецептором ангіотензинперетворювального ферменту 2-го типу (АПФ2) можуть призвести до значного зниження скоротливої здатності серця і подальшої дисфункції міокарда. Системна запальна відповідь на COVID‑19 може посилити фіброз міокарда, а він своєю чергою – спричинити ремоделювання серця.
Результати досліджень показали наявність значної імовірності розвитку тяжких ускладнень у літніх пацієнтів, осіб із ССЗ чи високим СС-ризиком за наявності одного або кількох факторів ризику, таких як:
- артеріальна гіпертензія (АГ);
- цукровий діабет (ЦД);
- гіперхолестеринемія;
- ожиріння.
Зокрема, у нещодавній роботі продемонстровано, що деякі біологічні зміни в органах, викликані COVID‑19, є довготривалими (Nalbandian et al., 2021). Відповідно до цього висновку, значна частка пацієнтів, які були інфіковані SARS-CoV‑2, продовжують мати симптоми і постгострі ускладнення, що можуть розвиватися з часом або зберігатися впродовж місяців. Цей стан називають постгострим, або тривалим COVID‑19 (NIH, 2021).
Достеменно масштаб проблеми досі не відомий. Проте постгострий перебіг COVID‑19 у пацієнтів із ССЗ викликає серйозне занепокоєння. Адже наявність супутніх ССЗ на тлі COVID‑19 асоційована з високою смертністю, а COVID‑19 своєю чергою може спричинити ССЗ, включно із пошкодженням міокарда, аритміями, гострим коронарним синдромом (ГКС) та венозною тромбоемболією (ВТЕ).
ССЗ залишаються основною причиною захворюваності та смертності в усьому світі, а також пов’язані із 17,8 млн летальних випадків на рік (ВООЗ, 2019).
Передбачити вплив постгострого COVID‑19 на майбутні СС-результати неможливо. Однак, щоб задовольнити нагальну потребу в ефективних стратегіях лікування та профілактики, необхідно докласти значних зусиль для всеосяжного вивчення й інтеграції біологічних і клінічних даних, пов’язаних із COVID‑19, у хворих на ССЗ.
Запалення та COVID‑19
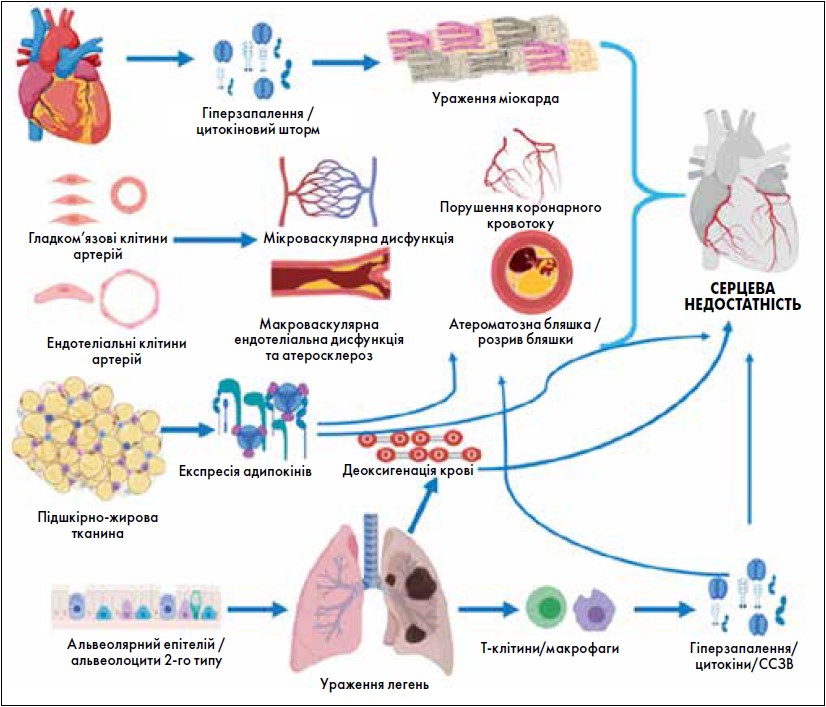
Пацієнти із тяжкою формою COVID‑19 часто мають лімфопенію, гіпоальбумінемію, вищі рівні трансаміназ, лактатдегідрогенази, С-реактивного білка (СРБ), феритину і D-димеру, а також помітно більший вміст інтерлейкіну (IЛ)-2R, ІЛ‑6, ІЛ‑8, ІЛ‑10 та фактора некрозу пухлини α (ФНП-α). Вироблення цитокінів індукується активацією макрофагів, опосередкованою дезінтегрином і металопротеїназою 17, яка також відповідає за протеолітичне розщеплення AПФ2 (Badimon et al., 2021). Надмірна активація осі ангіотензин (Ang) II / Ang II типу 1 (AT1) через порушення функції AПФ2, у поєднанні зі спричиненим цитокінами гіперзапаленням, може викликати системне ураження ендотелію, гіперекспресію медіаторів запалення в інтерстиціальному просторі різних органів, що зумовлює пошкодження паренхіматозних органів, гіперкоагуляцію, тромбоз мікросудин у легеневому й коронарному мікроциркуляторному руслі, ураження міокарда та поліорганну дисфункцію (Mehta er al., 2020; Klok et al., 2020).
Лімфопенія на тлі COVID‑19 виникає рано та є прогностичним фактором, потенційно пов’язаним зі зменшенням кількості клітин CD4+T і CD8+T. Вважається, що основні механізми, які спричиняють розвиток лімфопенії, такі (Jafarzadeh et al., 2021):
- Пряме вірусне пошкодження лімфоцитів, що призводить до апоптозу і піроптозу.
- Опосередковане вірусом ураження кісткового мозку та імунна супресія за участю Т-клітин.
- Апоптоз лімфоцитів, індукований ФНП-α, IЛ‑2R, IЛ‑6 та іншими прозапальними цитокінами.
- Перерозподіл тканинних лімфоцитів.
- Пригнічення проліферації лімфоцитів, спричинене метаболічними й біохімічними змінами, такими як гіперлактоацидемія та гіпербілірубінемія.
Зазначені механізми призводять до дисбалансу вродженої/набутої імунної відповіді. Стійка імунна активація може спричинити розвиток вторинного гемофагоцитарного лімфогістіоцитозу – гіперзапального синдрому, що характеризується цитокіновим штормом. Останній своєю чергою викликає поліорганну недостатність і смерть, подібні до явищ, що спостерігаються у пацієнтів із сепсисом (Mehta er al., 2020).
АПФ2 і серцево-судинні прояви
SARS-CoV‑2 являє собою одноланцюговий вірус, що містить рибонуклеїнову кислоту (РНК) (Zhou et al., 2020). Інфекція SARS-CoV‑2 потребує коекспресії АПФ2 і трансмембранної протеази серину 2 (TMPRSS2). AПФ2 є основним регулятором ренін-ангіотензин-альдостеронової системи (РААС). Її активність залежить від балансу між осями AПФ/Ang II/AT1 і АПФ2/Ang (1‑7)/Mas. Активація осі AПФ/Ang II/AT1 призводить до несприятливих ефектів, зокрема вазоконстрикції, запалення, фіброзу, затримки рідини тощо. Враховуючи, що AПФ2 широко експресується в ендотеліальних клітинах, кардіофібробластах, кардіоміоцитах, клітинах легеневого епітелію, легеневій судинній системі, нирках, жировій тканині, печінці, кишечника та ЦНС, порушення функції AПФ2, на додаток до цитокінового шторму, ймовірно, бере участь у розвитку поліорганної недостатності, включно із СС-проявами COVID‑19 (рис. 1).
Рис. 1. Тканинна експресія AПФ2 і потенційні механізми, що лежать в основі системної запальної відповіді та СС-ускладнень COVID-19
Примітка: ССЗВ – синдром системної запальної відповіді.
Незважаючи на те, що ураження кардіоміоцитів людини SARS-CoV‑2, супроводжуване низкою несприятливих процесів, було показане у дослідженнях in vitro, клінічних ознак прямого вірусного пошкодження кардіоміоцитів не спостерігалося (Bojkova et al., 2020). До того ж міокардит, що асоційований із COVID‑19, видається рідкісним. Таким чином, взаємозв’язок COVID‑19 і AПФ2, найімовірніше, може опосередковано впливати на СС-систему (Murray et al., 2020). Було показано, що проникнення SARS-CoV‑2 до клітин зменшує експресію AПФ2, що призводить до значного зниження скоротливої здатності серця та прогресування атеросклерозу (Crackower et al., 2020).
Кардіометаболічні фактори ризику, пов’язані з гіршими результатами при COVID‑19
Доступні докази, що наявні ССЗ і кардіометаболічні фактори ризику, такі як АГ, ЦД, ожиріння та/або куріння, є основними факторами ризику збільшення тяжкості перебігу і смертності від COVID‑19 (Mechanick et al., 2020; Petrilli et al., 2020). Порівняльний аналіз даних понад 900 тис. захворілих на коронавірус у США показав, що майже 30% госпіталізацій із приводу COVID‑19 були пов’язані з ожирінням, 26% – з АГ, 21% – із ЦД і 12% – із серцевою недостатністю (СН). За оцінками, зменшення кардіометаболічних чинників ризику на 10% потенційно може запобігти 11% госпіталізацій через COVID‑19 (O’Hearn et al., 2021).
Таким чином, поінформованість пацієнтів про необхідні профілактичні заходи щодо підтримання нормального функціонування СС-системи й способу життя загалом може знизити ризик тяжкого перебігу COVID‑19.
Гіпертонія чи вік?
За наявними даними, 1,13 млрд людей у всьому світі страждають на АГ, і найбільший тягар припадає на осіб віком ≥60 років (Kearney et al., 2005). Внаслідок оцінки ранньої серії невеликих випадків науковці припустили, що пацієнти з АГ мають вищий ризик захворіти на тяжку форму COVID‑19 і смерті. Попередні результати показали, що частота розвитку АГ коливалася від 32,6 до 34% серед хворих на підтверджений COVID‑19 (Chen et al., 2020).
Також показано, що серед пацієнтів з ураженням міокарда та підвищеним рівнем серцевого тропоніну (сТн) Т 63,5% мали АГ (Guo et al., 2020). Метааналіз, що включав ранні дані пацієнтів із COVID‑19, продемонстрував зв’язок АГ із майже у 2,5 рази більшою імовірністю (Lippi et al., 2020):
- тяжкого перебігу захворювання;
- госпіталізацій у відділення інтенсивної терапії (ВІТ);
- летальних випадків.
Тож загалом зазначені дані вказують на те, що у хворих на АГ вищий ризик розвитку тяжкої форми COVID‑19. Однак механізми, які пов’язують наявну АГ та COVID‑19, ще не повністю вивчені, оскільки АГ співіснує з багатьма іншими факторами ризику.
Одним із підходів до роз’яснення незалежної кореляції між наслідками COVID‑19 та ймовірністю АГ є дослідження осіб з АГ при виключенні хворих з іншими відомими чинниками ризику несприятливих наслідків. На цьому підході ґрунтувалися дані нещодавнього популяційного дослідження OpenSAFELY, проведеного у Великій Британії, в якому взяли участь понад 17 млн пацієнтів (Williamson et al., 2020). Так, було кількісно оцінено широкий спектр клінічних факторів ризику смерті від COVID‑19. Вчені не виявили кореляції між АГ та смертністю від COVID‑19: відносний ризик становив 0,95. Своєю чергою вік (найпотужніший предиктор), ССЗ, ЦД, ожиріння, респіраторні захворювання, злоякісні новоутворення нирок/печінки, неврологічні та автоімунні патології в анамнезі були пов’язані з підвищеним ризиком летальних випадків через COVID‑19.
Інші нещодавно проведені дослідження підтвердили ці дані. Було показано, що вік >60 років, надмірна вага/ожиріння та ЦД асоціювалися з несприятливим прогнозом, але ані АГ, ані антигіпертензивне лікування не мали такої кореляції (Jiang et al., 2020; Hosseinzadeh et al., 2021).
Крім того, вікове хронічне запалення низької інтенсивності з підвищеним вмістом прозапальних цитокінів і хемокінів лежить в основі деяких ССЗ, включно з АГ, що пов’язана зі старінням CD8+T-клітин як основи противірусного імунітету (ESC, 2021).
У нещодавньому дослідженні мали місце асоційоване з віком збільшення експресії AПФ2 у тканинах нирок і легень людини та відсутність зв’язку між АГ, блокаторами РААС і нирковою експресією AПФ2 (Jiang et al., 2020).
Отримані висновки узгоджуються з попередніми звітами, відповідно до яких використання блокаторів РААС не корелювало із вищою експресією AПФ2 і TMPRSS2 у тканинах легень, а також зі збільшенням концентрації AПФ2 у циркулювальній плазмі (Milne et al., 2020; Sama et al., 2020).
Разом зазначені дані можуть пояснити виявлені кореляції між віком, АГ і тяжкістю інфекції COVID‑19. Вік, імовірно, є найсильнішим предиктором тяжкого перебігу та смертності від COVID‑19, що може бути пов’язано з імуносенесценцією і запаленням, а також підвищеною прозапальною, протромботичною та профібротичною сигналізацією AT1 (Franceschi et al., 2020).
Цукровий діабет
Згідно з оцінками, у світі на ЦД страждають 463 млн людей (Saeedi et al., 2019). Тому не дивно, що ЦД є поширеним кардіометаболічним фактором ризику в пацієнтів із COVID‑19 (Barron et al., 2020; Dennis et al., 2021). За даними X. Yang et al. (2020), спостерігалася вища частота ЦД в осіб із тяжкою формою коронавірусу порівняно із хворими, що мали легкий і помірний перебіг (16,2 та 5,7% відповідно). До того ж рівень смертності від COVID‑19 був вищим серед пацієнтів із ЦД, ніж без нього (7,3 і 2,3% відповідно) (Wu et al., 2020).
Окрім того, в міру розвитку глобальної пандемії COVID‑19 подібну картину погіршення прогнозу в осіб із ЦД було зареєстровано в європейських та американських дослідженнях (Grasselli et al., 2020; Williamson et al., 2020). Так, у випробуванні OpenSAFELY мала місце лінійна залежність між виміряним рівнем глікованого гемоглобіну (HbA1С) ≥7,5%, зафіксованим у закладах надання первинної медико-санітарної допомоги, та ризиком асоційованої з COVID‑19 смерті, що свідчило про можливий зв’язок із гіперглікемією (Williamson et al., 2020).
В інших роботах були отримані подібні результати, відповідно до яких ризик захворюваності на COVID‑19 та пов’язаної з ним смертності незалежно корелював із гіперглікемією (Holman et al., 2020; Zhu et al., 2020).
В іншому британському популяційному дослідженні QCOVID (n=6083 102) повідомлялося, що ризик летальних випадків від ЦД 2-го типу в чоловіків і жінок на тлі COVID‑19 був у 4,74‑6,29 раза вищий відповідно (Clift et al., 2020).
Цікавим є те, що як в OpenSAFELY, так і у QCOVID спостерігався вищий ризик смерті серед молодих пацієнтів із ЦД порівняно з літніми хворими на ЦД. Імовірно, це свідчить про те, що ефективний/біологічний вік молодого пацієнта із ЦД відповідає хронологічному віку хворого похилого віку без ЦД (McGovern et al., 2021).
Як показано, абсолютний ризик смерті від COVID‑19 у молодих пацієнтів із ЦД не такий високий, як у літніх хворих. Проте отримані дані разом із потенційним модулювальним ефектом гіперглікемії на імунні та запальні реакції дозволяють припустити більш складні патофізіологічні механізми через можливий взаємозв’язок COVID‑19 і ЦД. Потенційні механізми, що, як вважають, підвищують сприйнятливість до SARS-CoV‑2 і тяжкість перебігу в пацієнтів із ЦД, включають такі:
- Клітинне зв’язування з вищими афінністю та проникненням вірусу через глікозилювання S-білка й AПФ2 характерніше для осіб із ЦД (Codo et al., 2020).
- Експресія AПФ2 у клітинах острівців Лангерганса підшлункової залози може призводити до прямого впливу SARS-CoV‑2, що спричиняє зниження резерву інсуліну в B-клітинах. Цікаво, що введення інсуліну послаблює експресію AПФ2 (Liu et al., 2020).
- Сповільнене виведення SARS-CoV‑2 з організму (Mechanic et al., 2021).
- Імуномодуляція, цитокін-опосередковане порушення метаболізму глюкози та гіперкоагуляція (Guo et al., 2020).
- Більша поширеність супутніх ССЗ, що може пояснити зв’язок із тяжкістю COVID‑19 та несприятливим прогнозом.
Ожиріння
Ожиріння, особливо «метаболічно нездорове», є основним фактором ризику ССЗ і смертності. Досягнення так званої метаболічно здорової ваги є модифікатором ризику, пов’язаним із покращенням функціонування СС-системи (Badimon et al., 2017). Епідеміологічні дані показують кореляцію індексу маси тіла (ІМТ), тяжкості COVID‑19 та смертності з нижчими ризиками при порогових значеннях ІМТ, близьких до нормальних (Kim et al., 2021; Kompaniyets et al., 2021). Цікаво, що цей зв’язок був виразнішим серед пацієнтів молодшого віку (<65 років) (Garg et al., 2020; Lighter et al., 2020). Зокрема, в осіб ˂60 років з ІМТ 30‑34 кг/м2, що захворіли на COVID‑19, ймовірність госпіталізації у ВІТ зросла удвічі порівняно з пацієнтами з ІМТ <30 кг/м2 і до 3,6 раза у хворих з ІМТ ≥35 кг/м2. Аналогічним чином, ІМТ >35 кг/м2 підвищував ризик інвазивної штучної вентиляції легень (ШВЛ) у сім разів і був пов’язаний із нижчим рівнем виживання осіб із COVID‑19 (Simonnet et al., 2020). У дослідженні OpenSAFELY показник смертності зростав зі збільшенням ІМТ від 1,05 для ІМТ <34,9 кг/м2 до 1,92 для ІМТ ≥40 кг/м2 порівняно із хворими на коронавірус без наявності ожиріння (Williamson et al., 2020).
Таким чином, зв’язок між ожирінням і тяжким перебігом COVID‑19 і те, чи може надмірна вага бути більшою мірою пов’язана з підвищеним ризиком у молодших вікових групах, викликає занепокоєння, враховуючи високий тягар ожиріння. У деяких дослідженнях розглядали питання із приводу того, чому COVID‑19 є небезпечнішим для осіб з ожирінням, навіть якщо вони молоді. Було показано, що розподіл жиру та порушення функції жирової тканини, а не загальна жирова маса та ІМТ асоційовані з ускладненнями COVID‑19 на індивідуальному рівні, особливо у молодих пацієнтів.
Погіршити клінічні результати після перенесеного COVID‑19 в осіб з ожирінням можуть такі фактори, як:
- ослаблення імунітету;
- хронічне запалення;
- підвищений ризик тромбозу.
У нещодавньому багатоцентровому дослідженні за участю 119 пацієнтів із COVID‑19 збільшення об’єму та ослаблення епікардіальної жирової тканини корелювали зі зростанням тягаря пневмонії при COVID‑19, клінічним погіршенням або смертю (Grodecki et al., 2021).
Окрім того, жирова тканина належить до тканин із найвищою експресією рецепторів AПФ2 (Chen et al., 2020). Вона також є важливим джерелом цитокінів, відомих як адипокіни, які беруть участь у регуляції рівня глюкози, метаболізму ліпідів, артеріального тиску, запалення, тромбозу та окислювального стресу (Badimon et al., 2017). На додачу, в більш ранньому дослідженні показано, що жирова тканина може виступати резервуаром вірусу (Damouche et al., 2015). Таким чином, аномальний розподіл, склад і функції жирової тканини, а не загальна кількість жиру в організмі, можуть чинити значний вплив на перебіг інфекції COVID‑19 і пов’язані з нею ускладнення, посилюючи запальну відповідь.
Як відомо, накопичення та запалення у периваскулярній, перикардіальній і епікардіальній жировій тканині, що оточує серце та сполучні судини, може підвищити локальну експресію AПФ2 та асоціюватися зі збільшенням співвідношення лептин/адипонектин. Це своєю чергою посилює ефекти деяких прозапальних цитокінів із ліпотоксичністю, таких як ФНП-α та IЛ‑6. Прозапальні цитокіни збільшують окислювальний стрес і погіршують утилізацію глюкози, що негативно впливає на функцію ендотелію. Також вони посилюють запалення міокарда та порушують його енергетичний метаболізм, що може призвести до негативної інотропної відповіді й дисфункції міокарда (Patel et al., 2016).
Ожиріння може порушити баланс між про- і антитромботичними механізмами, супроводжуватися гіпоксією, посиленням аритмій та вищою частотою тромбоемболічних подій, включно із тромбоемболією легеневої артерії (Mehta et al., 2020).
Необхідні більш масштабні дослідження, щоб підтвердити гіпотезу про те, що вісцеральне, периваскулярне, пери- й епікардіальне ожиріння відіграє важливу роль у пошкодженні міокарда на тлі COVID‑19.
Куріння
Куріння залишається провідним фактором ризику інвалідизації та ранньої смерті у всьому світі, викликаючи 6,4 млн летальних випадків на рік (GBD Study, 2017). Куріння є незалежним чинником ризику атеросклеротичних ССЗ, що асоційований також із респіраторними захворюваннями, порушенням імунної системи та, як наслідок, зростанням частоти розвитку інфекційних патологій (Piepoli et al., 2016).
Було показано, що куріння посилює експресію AПФ2, особливо в нижніх дихальних шляхах, що може зробити нинішніх курців уразливішими до інфекції COVID‑19 порівняно з колишніми курцями або тими, хто ніколи не мав цієї згубної звички (Leung et al., 2020; Brake et al., 2020). На додачу, поточне куріння пов’язують із тяжким клінічним перебігом COVID‑19 та вищою імовірністю потрапляння до ВІТ (Huang et al., 2020).
Серед 8910 госпіталізованих пацієнтів із COVID‑19 нинішні курці становили 5,5% досліджуваної популяції. Також було зафіксоване збільшення госпітальної смертності у 1,79 раза з-поміж нинішніх курців порівняно із тими, хто кинув / ніколи не курив (Mehra et al., 2020). Те саме стосувалося поціновувачів кальянів, користувачів електронних сигарет або IQOS (Brake et al., 2020). Поширеність куріння була вищою серед осіб із пошкодженням міокарда, в яких мало місце підвищення рівня сТнТ порівняно із некурцями (13,5 та 8,1% відповідно) (Guo et al., 2020).
Механізми розвитку COVID‑19 та вплив на СС-систему
Пошкодження ендотелію та тромбоз
Протромботичний і прокоагулянтний стан при COVID‑19 мають велике значення у контексті його клінічних проявів. Вірусна інфекція COVID‑19 уражає ендотеліальні клітини, які реагують на пошкодження, активуючи систему згортання крові. Взаємодія коронавірусу з ендотеліальним рецептором AПФ2 також може зменшувати перетворення Ang II на Ang (1‑7). При цьому Ang II не тільки спричиняє утворення тромбу, але й індукує продукцію інгібітора активатора плазміногену 1-го типу, що перешкоджає фібринолізу та розчиненню тромбу (Vaughan et al., 1995).
Протромботичний стан при COVID‑19
Клінічні дослідження продемонстрували значне підвищення маркерів активації ендотелію і тромбоцитів, як-от фактор фон Віллебранда, інгібітор активатора плазміногену 1-го типу, розчинний тромбомодулін, P-селектин і ліганд CD40, а також прозапальних цитокінів у пацієнтів із тяжким перебігом COVID‑19.
Тож потенційними чинниками тяжкості COVID‑19 й асоційованою із ним смертністю є (Dupont et al., 2021; Rauch et al., 2020):
- ендотеліопатія;
- тромбозапалення.
Окрім того, цитокіновий шторм викликає порушення згортання крові, що зумовлює появу ВТЕ або синдрому дисемінованого внутрішньосудинного згортання крові. Це призводить до збільшення активності фактора згортання крові VIII, утворення тромбіну та, як наслідок, підвищення рівня D-димеру, що також корелює зі зменшенням кількості тромбоцитів. Тромбоцитопенія, яка виникає внаслідок надмірного споживання тромбоцитів у пошкодженій тканині або імуноопосередкованого пошкодження гемопоетичних стовбурових клітин, асоційована з утричі вищим ризиком тяжкого перебігу COVID‑19 (Lippi et al., 2020).
Крім того, підтверджено високу експресію AПФ2 у серцевих перицитах, що під впливом COVID‑19 може призвести до дестабілізації ендотелію (Chen et al., 2020). Взаємодія між лігандами ангіопоетину і Tie-рецептором, можливо, є відповідальною за ендотеліальну дисфункцію, що призводить до:
- зниження виживання ендотеліальних клітин;
- збільшення проникності судин.
Нещодавнє дослідження показало, що S-білок здатний спричиняти пошкодження ендотеліальних клітин. Це зумовлює посилення окислювально-відновного стресу і, в кінцевому підсумку, погіршення біодоступності NO та зниження експресії AПФ2 (Lei et al., 2021).
Таким чином, через множинні патогенетичні механізми, які лежать в основі COVID‑19, хворі схильні до розвитку ендотеліопатії та тромбозу. Необхідні додаткові дослідження, щоб заповнити наявні прогалини у знаннях та визначити механізми коротко-/довгострокового впливу SARS-CoV‑2 на функцію ендотелію та нові прогностичні ендотеліальні біомаркери.
Ураження міокарда при COVID‑19
За останніми даними, пошкодження міокарда, що проявляється підвищеним рівнем циркулювального сТн, критеріями електрокардіографії або візуалізації, часто зустрічається серед пацієнтів із COVID‑19. Проте досі існує значна плутанина щодо патофізіологічних явищ, що лежать в основі ураження міокарда на тлі коронавірусу.
Точну частоту ураження міокарда у пацієнтів із COVID‑19 важко встановити через відмінності в аналізах cTн, порогових значеннях, досліджуваних популяціях та клінічних станах. Пошкодження міокарда було продемонстроване у 7‑40% осіб із COVID‑19 залежно від географічних регіонів, із вищою поширеністю серед пацієнтів, які потребували інтенсивного лікування (Giustino et al., 2020; Ruan et al., 2020). Смертність становила приблизно 22% у хворих із рівнем cTн, вищим за верхню межу норми (ВМН), і 61,5% серед тих, у кого рівень cTн більш ніж у 10 разів перевищував ВМН (Metkus et al., 2021).
Механізми зростання рівня тропоніну при COVID‑19, імовірно, є багатофакторними, включно з кардіоміопатією, пов’язаною із сепсисом та спровокованою системним гіперзапаленням, коронарними тромботичними явищами і розривом бляшки, мікросудинним ушкодженням на тлі ДВЗ-синдрому та тромбозу, асоційованою із гострим респіраторним синдромом (ГРДС) гіпоксією та прямою вірусною кардіотоксичністю (Sandoval et al., 2020; Atri et al., 2020).
Інфаркт міокарда
Пацієнтів зі збільшеним вмістом cTн залежно від ступеня підвищення слід класифікувати як таких, що мають:
- гострий інфаркт міокарда (ІМ) 1-го типу;
- гострий ІМ 2-го типу;
- гостре неішемічне ураження міокарда.
Гострий ІМ 1-го типу. Імунна відповідь, гострі інфекції, а також місцеве та системне запалення, особливо в дихальних шляхах, пов’язані з підвищеним ризиком ГКС (Madjid et al., 2007). Масивна системна запальна реакція, асоційована із тяжкою пневмонією, як при COVID‑19, може спричинити підвищену схильність до руйнування бляшок та утворення тромбів, що призводить до ІМ 1-го типу (Tang et al., 2020).
Гістопатологічне дослідження зразків автопсійного матеріалу показало, що у пацієнтів, які померли від гострих системних інфекцій, спостерігався стабільно вищий вміст макрофагів і Т-клітин в адвентиції судин серця та периадвентиціальній клітковині, ніж у неінфікованих померлих. Це вказує на наявність зв’язку між гострими системними інфекціями та локальним збільшенням запальних клітин у коронарних артеріях (Madjid et al., 2007).
Крім того, у хворих на ГКС відзначено вищу запальну активність в усьому коронарному руслі, ніж в осіб із хронічним коронарним синдромом. Запальні клітини можуть зумовлювати нестабільність бляшок, експресуючи активні молекули, зокрема цитокіни, протеази, фактори згортання крові, активні форми кисню та вазоактивні молекули (Lee et al., 2020).
Було проведено низку досліджень, в яких повідомлялося про наявність супутнього COVID‑19 у пацієнтів із ГКС (Bangalore et al., 2020; Kite et al., 2021; Hamadeh et al., 2020). Зокрема, спостерігалися вищі рівні тропоніну, D-димеру та СРБ, більша поширеність багатосудинного тромбозу, тромбозу стенту і тромботичного ураження в осіб з ІМ та COVID‑19 порівняно з неінфікованими. Крім того, у хворих на ІМ та COVID‑19 мали місце значно вищі показники невідновленого кровотоку і зниження функції лівого шлуночка (ЛШ) після реваскуляризації, що свідчило про порушення перфузії міокарда на тканинному рівні, ймовірно, через формування мікросудинних тромбів (Choudry et al., 2020).
Тож пацієнти з ІМ на тлі COVID‑19 являють собою групу високого ризику зі значною імовірністю летальних наслідків (Stefanini et al., 2020; Garcia et al., 2021).
Гострий ІМ 2-го типу. Дослідження демонструють, що пацієнти із COVID‑19 часто мають хронічні ССЗ, такі як АГ, кардіоміопатія, ішемічна хвороба серця або СН. є низка причин, за яких може бути наявне хронічне стабільне збільшення >99-го процентиля ВМН cTн при ІМ 2-го типу.
По-перше, системне запалення пов’язане з виразними гемодинамічними змінами, як-то тахікардія, опосередкована активацією симпатичної нервової системи, що призводить до підвищення потреби міокарда в кисні (Liu et al., 2020). По-друге, прямий вплив патогенів та/або їх непрямий вплив через запальні цитокіни та хемокіни зумовлює підвищення продукції активних форм кисню, що пов’язані з мітохондріальною дисфункцією. Це призводить до збільшення використання мітохондріями кисню та, отже, потреби в ньому міокарда (Van Wyngene et al., 2018).
Крім того, гострі респіраторні інфекції викликають розвиток ГРДС, що може спричинити гіпоксію та, як наслідок, зниження вмісту кисню в артеріальній крові. Це своєю чергою ще більше обмежує доставку кисню до міокарда (Liu et al., 2020). Окрім того, COVID‑19 здатний призводити до інтенсивного вивільнення великої кількості цитокінів і хемокінів, – це зумовлює не лише запалення судин, але й порушення регуляції судинного тонусу, що спричиняє коронарний вазоспазм. Дані аномалії здатні викликати зниження серцевої перфузії та навіть ІМ.
Гостре неішемічне ураження міокарда
Продовжують поширюватися дані, що гостре неішемічне ураження міокарда, ймовірно, є основною причиною збільшення вмісту cTн. Загальні кардіальні причини включають міокардит, синдром такоцубо та гостру СН на тлі систолічної або діастолічної дисфункції (Thygesen et al., 2019). Первинні некардіальні стани, такі як тромбоемболія легеневої артерії (ТЕЛА), загрозливі для життя патології та сепсис також можуть викликати розвиток пошкодження міокарда (Giustino et al., 2020).
Міокардит і міоперикардит здатні призводити до розвитку гострого неішемічного ушкодження міокарда, що викликає особливу занепокоєність у контексті COVID‑19. Пригнічення функції міокарда може спричиняти підвищення діастолічного тиску наповнення ЛШ, а в поєднанні з системною вазодилатацією – зниження діастолічного артеріального тиску. Ці гемодинамічні зміни особливо впливають на субендокардіальні шари ЛШ, які найбільше залежать від перфузії під час діастоли та, отже, найуразливіші до ішемії (Duncker, Bache, 2008).
Дослідження COVID‑19 показали помітне зростання рівня N-кінцевого пептиду натрійуретичного гормону В-типу в пацієнтів із пошкодженням міокарда (Chen et al., 2020). Іншою причиною гострого неішемічного ураження міокарда є ТЕЛА. Аналіз даних 184 пацієнтів, що перебували у ВІТ із пневмонією при COVID‑19, продемонстрував, що ТЕЛА була найчастішим тромботичним ускладненням (81%) (Klok et al., 2020).
Ще одним потенційним механізмом, що призводить до гострого неішемічного пошкодження міокарда, є пряме ураження COVID‑19 через рецептори AПФ2, які є в міокарді та являють собою функціональні рецептори для коронавірусу. У пацієнтів із СН має місце більша експресія AПФ2, що може пояснити наявний у них підвищений ризик ураження міокарда після COVID‑19.
Гострий міокардит
На сьогодні опубліковано кілька серій випадків міокардиту, пов’язаного із COVID‑19, за різних клінічних проявів (Escher et al., 2020; Wenzel et al., 2020). У пацієнтів із високою імунною відповіддю може розвинутися гострий міокардит із виразним ураженням міокарда або кардіогенним шоком (Tavazzi et al., 2020).
Однак молекулярний аналіз показав відсутність геному вірусу SARS-CoV‑2 у міокарді хворого з діагнозом COVID‑19 та лімфоцитарним міокардитом, підтвердженим ендоміокардіальною біопсією (Sala et al., 2020). Тож згідно з поточними рекомендаціями ESC, вірусний міокардит є діагнозом виключення, який встановлюють лише у випадку, коли наявність вірусного геному доведено у зразках ендоміокарда разом із гістологічними результатами активного міокардиту (Caforio et al., 2013).
Таким чином, наразі існує мало доказів, що підтверджують пряме пошкодження міокарда в результаті інфікування COVID‑19.
Тромбоемболія
Порушення згортання крові є визнаною ознакою тяжкої інфекції COVID‑19, що проявляється тромбозом глибоких вен, ТЕЛА та ДВЗ-синдромом. Запалення, активація ендотелію, підвищена реактивність тромбоцитів, зміна факторів згортання крові тощо спричиняють розвиток як артеріального, так і венозного тромбозу. В умовах COVID‑19 кілька досліджень показали, що гіперзапальний стан може призвести до виникнення мікротромбозу та внутрішньосудинної коагулопатії у легенях. Набуті антифосфоліпідні антитіла було виявлено у 45‑90% пацієнтів із COVID‑19, але точний механізм їх утворення і пов’язана з ним тромбогенність досі до кінця не з’ясовані (Tung et al., 2021).
В усіх госпіталізованих пацієнтів наявний ризик розвитку ВТЕ. Проте у хворих, в яких є ГРДС, тяжкий сепсис та/або вони перебувають у ВІТ, відзначено набагато вищий ризик через:
- фактори, специфічні для пацієнта, як-то вік, ожиріння, сепсис, гіпоксія, супутня респіраторна недостатність або СН;
- фактори, пов’язані з ВІТ, такі як седація, іммобілізація, використання вазопресорів або центральних венозних катетерів.
Коагулопатія відображає тяжчий перебіг захворювання та несприятливий прогноз, при цьому ДВЗ-синдром зареєстровано у 71% померлих із COVID‑19 порівняно з лише 0,6% тих, хто вижив (Tang et al., 2020). Дослідження також показали, що вік і коагулопатія пов’язані з розвитком тромботичних ускладнень та вищою смертністю (Klok et al., 2020; Cui et al., 2020).
Згідно з даними останніх метааналізів, загальна частота ВТЕ, пов’язаної з інфікуванням коронавірусом, у госпіталізованих пацієнтів становить 15‑21%. Цей показник у чотири рази вищий в осіб, які потрапили до ВІТ у критичному стані, порівняно з тими, хто не був госпіталізований до ВІТ (23‑31 та 7‑9% відповідно) (Dolhnikoff et al., 2020; Malas et al., 2020).
Повідомляється, що загальна поширеність ішемічного інсульту та ІМ становить майже 4% (Tan et al., 2021). У серії випадків COVID‑19 (n=20) було зафіксовано гостру ішемію кінцівок протягом 3-місячного періоду (Bellosta et al., 2020). При аналізі даних 209 пацієнтів із тяжким COVID‑19 виразний артеріальний тромбоз мав місце у 9,6% (de Roquetaillade et al., 2021).
Щоб пом’якшити протромботичний стан, асоційований із COVID‑19, у поточних рекомендаціях йдеться про необхідність призначення стандартної тромбопрофілактики низькомолекулярним, нефракціонованим гепаринами або фондапаринуксом замість пероральних антикоагулянтів усім пацієнтам, екстрено госпіталізованим із приводу COVID‑19, за відсутності протипоказань (ESC, 2021; Moores et al., 2020). Низькомолекулярний і нефракціонований гепарини мають протизапальну дію, завдяки якій здатні пригнічувати викликані ФНП-α запальні реакції та частково інгібувати вивільнення IЛ‑6 й IЛ‑8 (Young, 2008).
У деяких дослідженнях повідомлялося, що гепарин зв’язується з S-білком SARS-CoV‑2, таким чином потенційно блокуючи клітинну інвазію (Mycroft-West et al., 2020; Tree et al., 2021). Є дані, що фібринолітична терапія активатором тканинного плазміногену при рефрактерному гострому ураженні легень, викликаному COVID‑19, і ГРДС корелює із покращенням оксигенації, вентиляції та гемодинамічного статусу (Arachchillage et al., 2020).
Проте оптимальна тромбопрофілактика, включно з режимом, інтенсивністю та тривалістю, ще не встановлена. Також достеменно не доведено роль прямих пероральних антикоагулянтів у таких хворих, але їх використання чим далі поширюється. Аналогічно, точну роль фібринолітичної терапії для пацієнтів у критичному стані ще належить з’ясувати. Результати поточних рандомізованих клінічних досліджень допоможуть прояснити ці невизначеності (Talasaz et al., 2021).
Гостра СН: дисфункція правого шлуночка при COVID‑19
Все більше досліджень демонструють розвиток СН у пацієнтів із COVID‑19 навіть без наявних раніше ССЗ (Chen et al., 2020). В осіб, інфікованих SARS-CoV‑2, може спостерігатися гострий COVID‑19-асоційований серцево-судинний синдром, який, окрім інших проявів, також охоплює весь спектр симптомів гострої СН (Hendren et al., 2020). Серед госпіталізованих хворих на COVID‑19 частота гострої СН варіювала від 23 до 33% (Arentz et al., 2020).
В умовах COVID‑19 має місце підвищений ризик дисфункції правого шлуночка (ПШ) через його фізіологічний зв’язок із малим колом кровообігу. Порушення функції та недостатність ПШ у пацієнтів із COVID‑19 можуть спричинити:
- швидке погіршення гемодинаміки;
- аритмії;
- раптову смерть.
Ранні патологоанатомічні дослідження осіб із тяжкою формою COVID‑19 показали ознаки дилатації ПШ (Varga et al., 2020; Fox et al., 2020).
У міру розвитку пандемії все більше ехокардіографічних досліджень демонструють, що у хворих на COVID‑19 відзначені дилатація (12‑15%) й дисфункція ПШ (16‑35%), а також підвищення систолічного тиску в легеневій артерії, навіть за відсутності кардіоміопатії.
Ремоделювання ПШ у цих пацієнтів асоційоване із більш ніж дворазовим підвищенням ризику летальних наслідків (Kim et al., 2020; Soulat-Dufour et al., 2021).
Таким чином, зазначені дані підкреслюють важливість клінічної оцінки дисфункції ПШ та можливість стратифікації ризику в пацієнтів із COVID‑19 на її основі (Konstantinides et al., 2020).
Аритмії
Аритмії є частим ускладненням у пацієнтів із COVID‑19. За даними аналізу низки ранніх випадків госпіталізованих хворих, частота аритмій становила 8‑17% у ВІТ та 44‑60% – із летальним наслідком (Du et al., 2020; Parwani et al., 2021). Результати нещодавнього міжнародного опитування понад 4500 осіб показали, що аритмії виникли у 18% випадків, при цьому фібриляція/тріпотіння передсердь виявилися найпоширенішими при COVID‑19 (Coromilas et al., 2021).
Як свідчать G.A. Lanza et al. (2021), фібриляція/тріпотіння передсердь, блокада лівої ніжки пучка Гіса, ознаки на електрокардіограмі, що вказують на гостре перевантаження тиском у ПШ, передчасне скорочення шлуночків, а також відхилення сегмента ST пов’язані зі збільшенням вмісту тропоніну та смертністю у пацієнтів із COVID‑19. Небезпечні для життя аритмії (шлуночкова тахікардія / фібриляція шлуночків) можуть виникати у 4‑6% госпіталізованих хворих на COVID‑19, частіше – за наявності підвищеного рівня сТн (Coromilas et al., 2021).
Тож діагностичне дослідження при ураженні міокарда завжди має супроводжуватися одночасним моніторингом ритму (Varma et al., 2021).
Хоча точна природа цих аритмій наразі невідома, є п’ять патофізіологічних станів, що супроводжують COVID‑19 і можуть спричинити розвиток аритмій:
1. Раніше наявні проаритмічні стани (структурні захворювання серця, порушення іонних каналів) (Kytomaa et al., 2019).
2. Прямий кардіотропний ефект вірусу SARS-CoV‑2 або гіперзапальна реакція, яку він викликає (Lazzerini et al., 2020; Gao et al., 2021).
3. Кардіореспіраторна нестабільність, що потребує застосування інтенсивної терапії та ШВЛ (Varma et al., 2021).
4. Фармакологічна терапія препаратами, які подовжують інтервал QT (Rosenberg et al., 2020).
5. Залишкова дисфункція міокарда, ризик розвитку аритмії та патології серця після COVID‑19 (Varma et al., 2021).
Зупинка серця
Як внутрішньо-, так і позалікарняна зупинка серця є частим явищем у хворих на COVID‑19 в тяжкому/критичному стані та пов’язана з поганою виживаністю, особливо серед жінок і чоловіків віком ≥80 років (Hayek et al., 2020).
Початковий досвід роботи у лікарні м. Ухань (Китай) продемонстрував дуже низький показник виживаності після госпітальної зупинки серця у пацієнтів із COVID‑19 (лише 4 із 136 осіб вижили протягом 30 днів) (Shao et al., 2020). Нещодавнє дослідження, проведене у Швеції, включало 3027 хворих, які перенесли зупинку серця: поза лікарнею – 64,3%, госпітальну – 35,7%; особи із COVID‑19 мали у 3,4 та 2,3 раза вищий ризик 30-денної смертності відповідно порівняно з неінфікованими пацієнтами (Sultanian et al., 2021).
Дихальна недостатність і протромботичні явища, широко описані у пацієнтів із COVID‑19 в зазначених роботах, ймовірно, є основними причинами внутрішньолікарняної зупинки серця. Хоча немає прямих доказів того, що SARS-CoV‑2 безпосередньо викликає зупинку серця, цитокіновий шторм здатний потенційно призвести до розвитку поліорганної дисфункції та зупинку серця.
У нещодавньому дослідженні II фази блокування сигнального шляху IЛ‑6 за допомогою тоцилізумабу зменшувало системне запалення після зупинки серця і показало очевидний кардіопротекторний ефект (Meyer et al., 2021).
Клінічні випробування й методи терапії при COVID‑19
На сьогодні вже проведено чимало клінічних досліджень, присвячених вивченню різних методів лікування та профілактичних заходів при COVID‑19. Підсумуємо найважливіші.
Ремдесивір
Згідно з результатами адаптивного дослідження ACTT‑1 та двох допоміжних GS-US‑540‑5774 і GS-US‑540‑5773, Європейське агентство з лікарських засобів (EMA) затвердило умовну реєстрацію ремдесивіру для лікування COVID‑19 у дорослих із пневмонією, які потребують застосування додаткового кисню (Beigel et al., 2020; Spinner et al., 2020; Goldman et al., 2020). В ACTT‑1 було отримано найпереконливіші дані, які показали менший час до видужання у групі ремдесивіру порівняно із плацебо (10 та 5 днів відповідно), при цьому різниці щодо ризику смерті не спостерігалося.
Однак у листопаді 2020 р. ВООЗ випустила умовну рекомендацію проти застосування ремдесивіру в госпіталізованих пацієнтів, незалежно від тяжкості захворювання, оскільки наразі немає сильних доказів того, що препарат покращує виживання та інші результати у таких хворих (Rochwerg et al., 2020). Проміжні результати свідчать, що ремдесивір практично не впливає на летальність пацієнтів, які госпіталізовані з приводу COVID‑19 (Pan et al., 2021)
Необхідні додаткові рандомізовані контрольовані дослідження (РКД), щоб схвалити або спростувати цей метод лікування.
Кортикостероїди
У багатоцентровому рандомізованому відкритому випробуванні RECOVERY було показано нижчий рівень смертності від COVID‑19 серед госпіталізованих пацієнтів, які отримували дексаметазон, ніж таких на стандартному лікуванні (Horby et al., 2021). Однак у підгрупі учасників, які на момент включення у дослідження не потребували додаткової оксигенотерапії, не спостерігалося жодних переваг щодо виживаності у групі дексаметазону. Таким чином, ВООЗ рекомендує дексаметазон + ремдесивір або лише дексаметазон тільки для госпіталізованих пацієнтів із тяжкою формою COVID‑19 або у критичному стані. Якщо дексаметазон недоступний, замість нього можна використовувати альтернативні глюкокортикоїди, такі як преднізон, метилпреднізолон або гідрокортизон (Sterne et al., 2020; Rochwerg et al., 2020).
Результати відкритого РКД STOIC ІІ фази продемонстрували, що раннє використання інгаляційного будесоніду порівняно зі звичайним лікуванням зменшувало ймовірність потреби невідкладної медичної допомоги та скорочувало час до видужання у дорослих амбулаторних пацієнтів із легкою формою COVID‑19 (Ramakrishnan et al., 2021). Однак даних STOIC недостатньо для виключення ризику шкоди від застосування інгаляційних кортикостероїдів, таких як будесонід або циклесонід, в амбулаторних хворих із легким перебігом COVID‑19, що мають нормальний рівень кисню.
Тому EMA (2021) не рекомендує використовувати інгаляційні кортикостероїди в цій популяції. Відповідно, потрібні надійніші докази клінічних досліджень, щоб встановити переваги інгаляційних кортикостероїдів у амбулаторних пацієнтів із COVID‑19.
Хлорохін/гідроксихлорохін, азитроміцин, лопінавір/ритонавір
Під час раннього періоду пандемії гідроксихлорохін і хлорохін широко використовували для лікування пацієнтів із COVID‑19. Проте дані невеликих досліджень, в яких оцінювали гідроксихлорохін, не продемонстрували його клінічних переваг (Rochwerg et al., 2020; Cavalcanti et al., 2020). Подальше масштабне багатоцентрове випробування RECOVERY показало, що 28-денна смертність госпіталізованих хворих із приводу COVID‑19 на терапії гідроксихлорохіном була навіть вищою, ніж у групі звичайного лікування (62,9 та 59,6% відповідно) (Horby et al., 2020). Крім того, комбіноване застосування гідроксихлорохіну та антибіотика азитроміцину може подовжувати інтервал QT, що призводить до підвищення ризику раптової смерті та інших небажаних явищ (Guzik et al., 2020).
Окрім того, після огляду нових даних RECOVERY також не було виявлено сприятливого впливу лопінавіру/ритонавіру на 28-денну смертність госпіталізованих пацієнтів із COVID‑19 порівняно зі стандартним лікуванням (RECOVERY Collaborative GROUP, 2020). Ці дані були підтверджені результатами проміжного дослідження H. Pan et al. (2021). Тож було зроблено висновок, що схеми лікування ремдесивіром, гідроксихлорохіном, лопінавіром та інтерфероном мали незначний ефект або взагалі не впливали на смертність від COVID‑19, початок ШВЛ та тривалість перебування у стаціонарі.
Ці невтішні результати підкреслюють важливість надання відповіді на запитання, чи доцільно застосовувати будь-який із цих препаратів особам із COVID‑19 до завершення масштабних РКД.
Внутрішньогоспітальна імуномодулювальна терапія
Інтенсивна гіперзапальна реакція на вірусні інфекції на ранніх стадіях пандемії сприяла перепрофілюванню кількох лікарських засобів, здатних модулювати імунну відповідь, зокрема інгібіторів IЛ‑1 (анакінра) або IЛ‑6 (сарілумаб, силтуксимаб, тоцилізумаб) (Badimon et al., 2021). Останні випробування цих імуномодулювальних методів терапії показали суперечливі результати (Rosas et al., 2021; Soin et al., 2021). Застосування тоцилізумабу часто асоціювалося з покращенням результатів і зниженням смертності, тоді як доказів ефективності анакінри, силтуксимабу або сарілумабу при COVID‑19 наразі недостатньо (Gordon et al., 2021; Lescure et al., 2021).
Відповідно, потрібні подальші дослідження, щоб достеменно визначити характеристики учасників та захворювання, за яких імуномодулювальна терапія може бути максимально корисною. Ймовірно, доцільно звернути особливу увагу на вивчення взаємозв’язку ефектів цих препаратів із вихідними біомаркерами запалення, такими як IЛ‑1, IЛ‑6, CРБ тощо.
Нейтралізувальні моноклональні антитіла для амбулаторних пацієнтів із високим ризиком COVID‑19
Нові дані з приводу того, що стійка реплікація SARS-CoV‑2 є предиктором тяжкого перебігу COVID‑19, привели до розробки методів лікування, спрямованих на запобігання прогресуванню COVID‑19 від початку інфекції. У трьох дослідженнях рання терапія нейтралізувальними моноклональними антитілами (мАТ) – комбінацією казиривімабу та імдевімабу або бамланівімабу та етесевімабу – значно зменшувала вірусне навантаження SARS-CoV‑2, випадки госпіталізації та смерті, пов’язаної з COVID‑19, порівняно із плацебо в амбулаторних пацієнтів із нещодавно діагностованим COVID‑19 без необхідності застосування додаткового кисню. Проте у госпіталізованих хворих, які потребували назальної високопотокової оксигенотерапії кисню або ШВЛ, не було показано ані користі, ані погіршення клінічних результатів. Можливим поясненням є те, що запалення і тромбоз, а не реплікація вірусу, відіграють суттєвішу роль на більш пізніх стадіях захворювання (Weinreich et al., 2021; Gottlieb et al., 2021).
ЕMA (2021) надала умовний дозвіл на реалізацію, а Управління з контролю за якістю харчових продуктів та медикаментів США (FDA, 2021) схвалило ці нейтралізувальні мАТ із дозволом на екстрене використання у пацієнтів віком ≥12 років із COVID‑19 легкого й середнього ступеня тяжкості, які не потребують кисневої терапії та мають високий ризик прогресування хвороби до тяжкої форми. Дані препарати можна застосовувати як для профілактики, так і для лікування інфекції SARS-CoV‑2, оскільки вони призначені для блокування приєднання вірусу та проникнення до клітин людини, тим самим нейтралізуючи вірус.
Амланівімаб/етезевімаб і казиривімаб/імдевімаб є рекомбінантними нейтралізувальними мАТ людського IgG1, не модифікованими у Fc-ділянках. Вони зв’язуються з різними ділянками рецептор-зв’язувального домену шипованого білка SARS-CoV‑2, блокуючи зв’язування вірусу з рецептором AПФ2 на поверхні клітини-господаря (Marovich et al., 2020).
Лікування інгібіторами серинових протеаз
Камостату мезилат і нафамостату мезилат є клінічно доведеними інгібіторами TMPRSS2, які використовують для лікування панкреатиту та ДВЗ-синдрому. Нещодавно обидві сполуки були визначені як перспективна противірусна терапія при COVID‑19 (Hoffmann et al., 2021).
Дослідження на тваринах та клітинах людини in vitro показали, що нафамостату мезилат, камостату мезилат та його активний метаболіт GBPA блокують TMPRSS2, таким чином пригнічуючи праймінг вірусного S-білка та, відповідно, злиття мембрани вірусу і клітини (Hoffmann et al., 2020; Deng et al., 2021).
Проте у нещодавньому невеликому багатоцентровому РКД використання 200 мг камостату мезилату не показало клінічного поліпшення, зменшення випадків потрапляння до ВІТ або смерті порівняно із плацебо у госпіталізованих хворих на COVID‑19 (Gunst et al., 2021). Науковці сподіваються, що поточні клінічні випробування допоможуть оцінити, чи є камостату мезилат та нафамостату мезилат, застосовувані у вищих дозах або на дуже ранній стадії COVID‑19, ефективними для зниження прогресування захворювання.
Клітинна терапія при COVID‑19
Мезенхімальні стовбурові клітини (MSC) і клітини, отримані з кардіосфери (CDC), широко вивчали для клінічного застосування в регенеративній медицині, а також щодо їх протизапальних, імуномодулювальних, антифібротичних і регенеративних властивостей (Fernandez-Aviles et al., 2017). Вчені висунули припущення, що MSC та CDC можуть зменшувати запалення, ГРДС, послаблювати утворення рубців і фіброзу після пошкодження міокарда при COVID‑19 (Singh et al., 2020; Lanzoni et al., 2021). Крім того, вважається, що оскільки MSC і CDC експресують низькі рівні AПФ2 і TMPRSS2, то є стійкими до інфекції SARS-CoV‑2 (Leng et al., 2020; Schafer et al., 2021).
Дані, що підтверджують ефективність внутрішньовенного використання MSC, виділених із пуповини людини, у хворих на COVID‑19 обмежені невеликими пілотними відкритими неконтрольованими дослідженнями (Shu et al., 2020; Leng et al., 2020). В них повідомлялося про зниження рівня запальних біомаркерів, таких як CРБ і цитокіни, поліпшення виживаності пацієнтів, а також зменшення фіброзу, пов’язаного із постгострим COVID‑19. Однак результати, на жаль, не досягли статистичної значущості.
Докази стосовно ефекту введення алогенних CDC були отримані у когорті з шести пацієнтів із тяжким перебігом COVID‑19, які попередньо застосовували тоцилізумаб (Singh et al., 2020). У більшості хворих на коронавірус було відзначено сприятливий профіль безпеки та переносимості алогенних CDC, а також покращення клінічного статусу, зменшення вмісту прозапальних біомаркерів, сТн та D-димеру.
Однак перешкоджанням для застосування клітинної терапії може бути профіль безпеки препаратів при довгостроковому спостереженні.
На сьогодні жодний агент MSC або CDC не схвалений для лікування COVID‑19. Наразі тривають випробування, які допоможуть оцінити роль клітинної терапії у веденні осіб із COVID‑19.
Постгострі наслідки COVID‑19
Найчастіші ускладнення та задіяні механізми
Значна частка пацієнтів, які були інфіковані SARS-CoV‑2, повністю не видужують після виписки з лікарні та продовжують мати виснажливі симптоми, такі як стомлюваність, задишка, біль у грудях, серцебиття, тромбоемболічні явища, міалгія, тривога, депресія, а також погіршення якості життя (Nalbandian et al., 2021).
Тривалий COVID‑19 може зберігатися місяцями за відсутності вірусної інфекції, а також відрізнятися за формою й тяжкістю (Sudre et al., 2021).
Ці постгострі наслідки COVID‑19 викликають значне занепокоєння, оскільки потенційно охоплюють мільйони людей у всьому світі, підвищуючи інвалідизацію та витрати на охорону здоров’я.
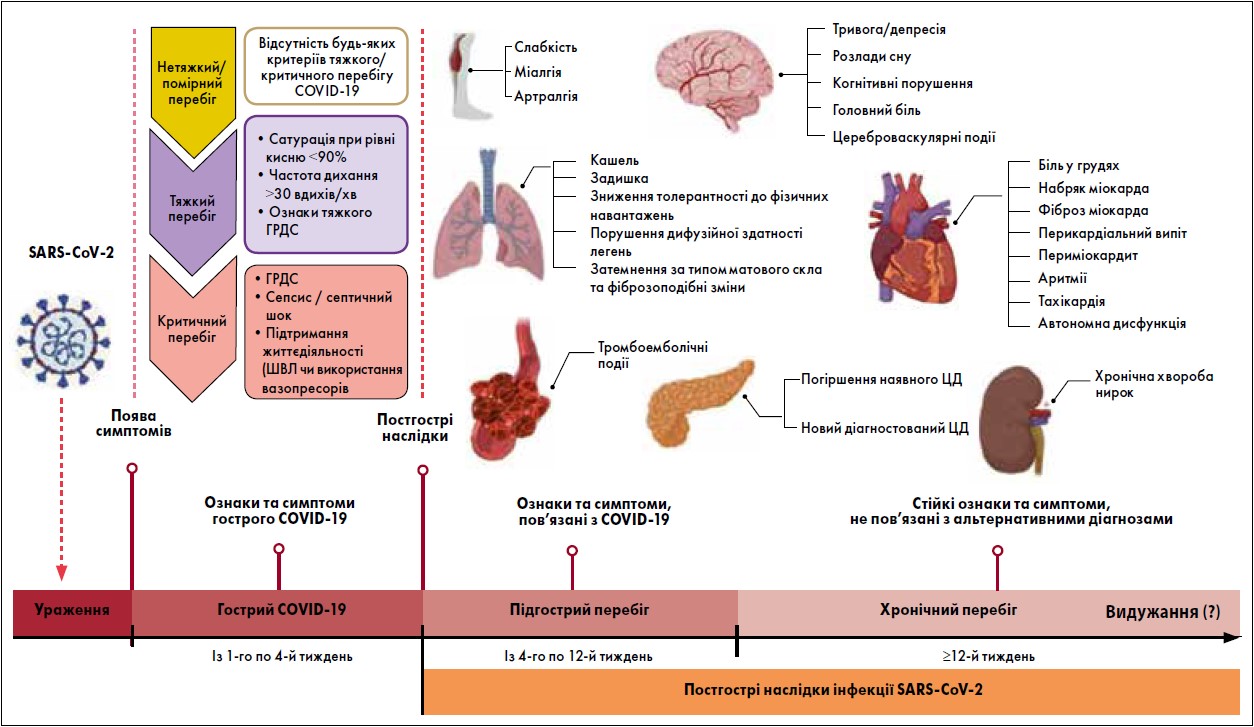
В останніх дослідженнях було запропоновано розподіл на дві категорії для визначення постгострого синдрому COVID‑19 (Shah et al., 2021; Huang et al., 2021):
- Підгострий або стійкий симптоматичний COVID‑19, який включає ознаки та симптоми тривалістю від 4 до 12 тижнів після гострої інфекції, що пов’язані з COVID‑19.
- Хронічний або постковідний синдром, який включає ознаки та симптоми, що зберігаються протягом більш ніж 12 тижнів від початку гострого COVID‑19 і не пов’язані з альтернативними діагнозами.
Звіти про результати згідно з повідомленнями пацієнтів за період від 2 до 6 місяців після виписки з лікарні показали, що найпоширенішими симптомами були стомлюваність / м’язова слабкість (50‑63%), кашель (15%), задишка, зокрема при навантаженні (23‑43%), артралгії (27%), біль у грудях (22%), серцебиття/аритмії (5%), погіршення пам’яті (34%), тривога/депресія (23%), проблеми з концентрацією уваги (28%) та розлади сну (26‑31%) (CarvalhoSchneider et al., 2021; Garrigues et al., 2020).
Також було виявлено, що у 14‑30% осіб із COVID‑19 розвивалися клінічні наслідки, які потребували медичної допомоги або госпіталізації протягом чотирьох місяців після гострої фази захворювання (Ayoubkhani et al., 2021; Daugherty et al., 2021).
Основні причини розвитку постгострих симптомів COVID‑19 наразі ще недостатньо вивчені. Як відомо, можуть бути задіяні різні механізми, приміром пошкодження клітин через пряму вірусну інвазію, системне гіперзапалення, прокоагулянтний стан, що призводить до постзапального серцевого та легеневого фіброзу, порушення дифузійної здатності легень, серцева дисфункція, емболія з обмеженням легеневого кровотоку, постгостра ТЕЛА тощо (Han et al., 2021; Mendez et al., 2021).
Прогресування в часі, а також найчастіші симптоми та ускладнення постгострого COVID‑19 узагальнено на рисунку 2.
Рис. 2. Постгострі наслідки інфекції SARS-CoV-2: найчастіші симптоми та ускладнення
Кардіальні ускладнення
Між COVID‑19 і серцем існує двоспрямований зв’язок. У пацієнтів, які мають ССЗ, наявний підвищений ризик розвитку тяжкої форми COVID‑19 і смерті. З іншого боку, в осіб, які видужують від COVID‑19, спостерігаються набряк міокарда, фіброз та пов’язані з цим ускладнення (Raman et al., 2021).
За даними магнітнорезонансної томографії, при медіані часу 71 день із моменту встановлення діагнозу COVID‑19 ураження міокарда було зафіксоване приблизно у 80% пацієнтів, а продовжуване запалення міокарда – у 60%, навіть за відсутності симптомів (Puntmann et al., 2020).
Слід зазначити, що в осіб, які одужали від COVID‑19, були відзначені:
- нижча фракція викиду та більший об’єм ЛШ;
- незворотне пошкодження міокарда (некроптоз, фіброз);
- запалення перикарда.
Крім того, у підгрупі хворих, за даними ендоміокардіальної біопсії, спостерігалося активне лімфоцитарне запалення. Подібні результати були отримані в інших невеликих дослідженнях у пацієнтів, які одужали від COVID‑19 (Rajpal et al., 2021; Kotecha et al., 2021).
Таким чином, ці дані підтверджують гіпотезу про те, що міокардіальна дисфункція є поширеною під час видужання від COVID‑19. Результати щодо наявного фіброзу міокарда у таких пацієнтів викликають занепокоєння, оскільки СН як імовірний наслідок цього стану може призвести до виникнення серцевих аритмій. Відповідно, систематична оцінка міокардіального фіброзу (візуалізація / гістологічне дослідження) має бути обов’язковою частиною постгострого спостереження у пацієнтів із COVID‑19.
Постгострі легеневі прояви та асоційований із ними ризик кардіальних подій
Когортні дослідження показали, що залишкове затемнення за типом матового скла та прогресування фіброзоподібних змін спостерігалися у третини пацієнтів за даними контрольної комп’ютерної томографії грудної клітки через шість місяців після перенесеного COVID‑19 (Huang et al., 2021; Han et al., 2021). Крім того, порушення дифузійної здатності легень було найпоширенішою фізіологічною ознакою, яка зустрічалася частіше у хворих із фіброзоподібними змінами, що свідчило про наявність ураження мікросудин (Mendez et al., 2021).
Вплив залишкового тромбозу та потенційних гемодинамічних наслідків, таких як хронічна ТЕЛА, хронічна легенева гіпертензія і ремоделювання ПШ при COVID‑19, мають бути додатково вивчені у майбутніх дослідженнях (Dhawan et al., 2021).
Постгострі тромбоемболічні явища
Більшість проведених досліджень були зосереджені на ризику тромбоемболічних подій під час гострої фази COVID‑19, тоді як на постгострій фазі захворювання – лише декілька. За даними F. Rashidi et al. (2021), сукупний ризик розвитку ВТЕ через 45 днів після виписки пацієнтів із лікарні після перенесеного COVID‑19 становив 0,2%. В одноцентровому дослідженні кумулятивна частота тромбозу (включно з ТЕЛА, внутрішньосерцевим тромбозом та ішемічним інсультом) на 30й день після виписки була 2,5% (Patell et al., 2020). Подібні результати спостерігалися в іншій когорті хворих (Salisbury et al., 2020).
Тромбоз, пов’язаний із COVID‑19, свідчить про імунотромботичну патофізіологію, безпосередньо через взаємодію з рецептором AПФ2 або опосередковано, викликаючи гіперзапалення. Аналогічно, ризик постгострих тромботичних наслідків COVID‑19 може корелювати із тривалістю та тяжкістю гіперзапалення.
На жаль, відсутність даних про тривалість гіперзапального стану після гострої фази COVID‑19, а також великих проспективних когорт хворих і РКД обмежує можливості стратифікації ризику виникнення постгострих тромбоемболічних подій.
Метаболічні наслідки COVID‑19 та ЦД
Взаємозв’язок між COVID‑19 і ЦД складний і двоспрямований. Пацієнти із ЦД мають підвищений ризик тяжкої форми COVID‑19 та смертності. Своєю чергою COVID‑19 порушує метаболізм глюкози, що є відомою ознакою системних інфекцій.
В осіб із COVID‑19 описано вперше виниклий ЦД і тяжкі ускладнення раніше наявного ЦД, такі як (Rubino et al., 2020; Hayden, 2020):
- інсулінорезистентність;
- діабетичний кетоацидоз;
- гіперосмолярність;
- мікро та макросудинні ускладнення.
J.A. Mu¨ller et al. (2021) виявили, шо SARSCoV‑2 інфікує та реплікується в культурах клітин острівців Лангерганса підшлункової залози людини, викликаючи морфологічні, транскрипційні та функціональні зміни, зокрема зменшення кількості інсулінсекреторних гранул у Вклітинах та порушення секреції інсуліну, стимульованої глюкозою.
Таким чином, нині підтверджено гіпотезу про потенційний діабетогенний ефект інфекції SARSCoV‑2, що викликає занепокоєння, з огляду на те, що ЦД спричиняє розвиток атеросклерозу та ішемічної хвороби серця. Але є низка запитань, які потребують пошуку відповідей у майбутніх дослідженнях. Приміром, чи погіршує COVID‑19 природний перебіг хвороби у пацієнтів із наявним ЦД? Чи збільшує COVID‑19 довготривалу схильність до діабетичного кетоацидозу? Чи можна вилікувати ЦД, пов’язаний із COVID‑19, після гострої фази? Та багато інших.
Висновки та майбутні напрями для вивчення
У міру того, як поліпшується розуміння епідеміології, патофізіології та інших аспектів COVID‑19, зростає консенсус із приводу того, що це – макро та мікросудинне захворювання, тому через нього значно страждає ССсистема.
На жаль, багато запитань на даний час все ще залишаються без відповідей та потребують розгляду в майбутніх дослідженнях. Найактуальніші з них наступні:
1. Чому пацієнти літнього віку, чоловіки та особи із кардіометаболічними факторами ризику піддаються підвищеному ризику тяжкого перебігу COVID‑19?
Наявні дані вказують на те, що серед інших потенційних модифікаторів тяжкості захворювання у фокусі уваги мають бути такі чинники, як нездоровий спосіб життя, глікемічні розлади, ожиріння та малорухливість, що асоційовані з розвитком хронічного запалення низької інтенсивності. Воно своєю чергою може погіршити спричинену COVID‑19 гостру органну недостатність. Тому важливо точно визначити фактори, які лежать в основі тяжкості та клінічних проявів коронавірусу. Відповідь на фармакологічні втручання також залежить від такого фактора, як старіння, що пов’язане з окислювальним стресом. Також із віком відбувається старіння імунної системи, що погіршує її відповідь на вірусне ураження.
2. Як краще справлятися із порушенням мікроциркуляції при COVID‑19 і персоналізувати потенційні терапевтичні підходи?
Через персистенцію SARSCoV‑2 та вірусної РНК може виникати запальна реакція, що стимулює розвиток ендотеліальної дисфункції, прискорення атеросклерозу, гіперкоагуляцію та мікросудинний тромбоз. Тож необхідне виявлення нових та прогностичних біомаркерів у пацієнтів із COVID‑19 у поєднанні з визначенням генетичних відмінностей та функціональним тестуванням.
3. Як пошкодження міокарда впливає на довгостроковий функціональний статус, якість життя пацієнтів та ризик аритмій? Що робить одних людей уразливішими за інших? Які біологічні механізми лежать в основі цього?
Слід зауважити, що кардіолог часто стикається зі зниженою толерантністю до фізичних навантажень на тлі COVID‑19. А діагностичну та прогностичну роль фіброзу легень та міокарда при COVID‑19 ще потрібно з’ясувати. Також необхідні систематичні спостереження за пацієнтами із COVID‑19 із глибоким і повним визначенням клінічних та біологічних фенотипів хвороби. Це дозволить ідентифікувати осіб групи ризику, щоб забезпечити індивідуальний догляд з метою запобігання подальшої вразливості до вірусу та впливу довгострокових наслідків.
4. Чи мають безсимптомні пацієнти, інфіковані SARSCoV‑2, аналогічний і пропорційно підвищений довгостроковий ризик постгострих наслідків вірусу порівняно з такими із симптомним перебігом?
Орієнтовно у 25% осіб фізичні симптоми зберігаються через місяць після того, як вони перехворіли на COVID‑19, а у 10% – через 12 тижнів. COVID‑19 – це досить нова хвороба, яка штовхає наукову спільноту та світ загалом на «недосліджені території» та потребує застосування мультидисциплінарного підходу.
Підготувала Олена Коробка
Оригінальний текст документа читайте на сайті www.escardio.org