5 грудня, 2024
У фокусі терапії: дисліпідемія та цукровий діабет
 Цукровий діабет (ЦД) є однією із глобальних надзвичайних ситуацій у сфері охорони здоров’я ХХІ ст., адже кількість людей, які страждають на це захворювання, продовжує зростати. За наявними даними, до 2030 р. частка хворих на ЦД може збільшитися із 415 до 550 млн. Ця ситуація є критичною, оскільки на тлі ЦД приблизно вдвічі підвищується ризик розвитку серцево-судинних захворювань (ССЗ). З огляду на важливість теми, практичні аспекти терапії дисліпідемії та ЦД обговорювали лікарка-ендокринологиня, к.мед.н. Олена В’ячеславівна Добровинська та лікарка-кардіологиня, д.мед.н. Марія Сергіївна Черська (ДУ «Інститут ендокринології та обміну речовин імені В.П. Комісаренка НАМН України», м. Київ).
Цукровий діабет (ЦД) є однією із глобальних надзвичайних ситуацій у сфері охорони здоров’я ХХІ ст., адже кількість людей, які страждають на це захворювання, продовжує зростати. За наявними даними, до 2030 р. частка хворих на ЦД може збільшитися із 415 до 550 млн. Ця ситуація є критичною, оскільки на тлі ЦД приблизно вдвічі підвищується ризик розвитку серцево-судинних захворювань (ССЗ). З огляду на важливість теми, практичні аспекти терапії дисліпідемії та ЦД обговорювали лікарка-ендокринологиня, к.мед.н. Олена В’ячеславівна Добровинська та лікарка-кардіологиня, д.мед.н. Марія Сергіївна Черська (ДУ «Інститут ендокринології та обміну речовин імені В.П. Комісаренка НАМН України», м. Київ).
До коморбідних станів, які часто супроводжують ЦД і додатково спричиняють розвиток ССЗ, належать артеріальна гіпертензія (АГ), дисліпідемія, абдомінальне ожиріння та неалкогольна жирова хвороба печінки (НАЖХП). Одним із основних факторів серцево-судинного (СС) ризику є дисліпідемія, що включає підвищений рівень ліпопротеїнів низької щільності (ЛПНЩ) та тригліцеридів (ТГ). За даними Американської кардіологічної асоціації та Американського коледжу кардіологів (ACC/AHA, 2019), ці показники мають прямий вплив на стан серцево-судинної системи, що підкреслює необхідність контролю ЛПНЩ і ТГ для зменшення ймовірності СС-ускладнень у пацієнтів із ЦД.
Скринінг дисліпідемії та ЦД
Скринінг на ЦД є невід’ємною складовою сучасної стратегії профілактики та ранньої діагностики цього захворювання. Згідно з оновленою настановою Американської асоціації діабету (ADA), фахівці наголошують на важливості регулярного скринінгу в таких групах пацієнтів:
- Особи віком від 35 років. За рекомендаціями ADA, скринінг необхідно проводити що три роки, навіть за відсутності очевидних факторів ризику.
- Особи будь-якого віку із надмірною вагою або ожирінням (індекс маси тіла ≥25 кг/мІ), особливо якщо є додаткові фактори ризику, як-то:
- малорухливий спосіб життя;
- АГ;
- дисліпідемія;
- спадкова схильність до ЦД.
Жінки із гестаційним ЦД в анамнезі. Жінки, які під час вагітності мали порушення толерантності до глюкози, повинні проходити скринінг через 6‑12 тижнів після пологів та щонайменше раз на три роки.
Методи скринінгу на ЦД включають три основні інструменти: вимірювання рівня глюкози у плазмі крові натщесерце, аналіз на глікований гемоглобін (HbA1С) та пероральний тест на толерантність до глюкози (ТТГ). Кожен із цих методів має свої переваги і використовується залежно від клінічної ситуації. Підготовка до тестування є критично необхідною для забезпечення точності результатів. Дотримання цих правил гарантує достовірність показників, що є важливим для діагностики та визначення тактики лікування.
ЦД можна діагностувати на підставі рівня глюкози у плазмі натще, або через 2 год після перорального ТТГ, або базуючись на визначенні рівня HbA1С. Таким чином, критеріями підтвердження ЦД є показник глюкози ≥7,0 ммоль/л, або ≥11,1 ммоль/л під час ТТГ, або HbA1С ≥6,5%, або випадкова концентрація глюкози у плазмі ≥11,1 ммоль/л (ADA, ElSayed, 2023).
Згідно з оновленими рекомендаціями ADA (2024), для профілактики та лікування атеросклеротичних ССЗ у пацієнтів із ЦД необхідно принаймні раз на рік оцінювати наявність чинників СС-ризику. Такі фактори включають тривалість ЦД, ожиріння або надмірну вагу, АГ, дисліпідемію, куріння, спадкову схильність до ішемічної хвороби серця, наявність хронічної хвороби нирок (ХХН) та альбумінурію.
Підготовка до лабораторного обстеження на показники вуглеводного обміну
- Дослідження бажано проводити зранку натщесерце. Останнє приймання їжі – за 8‑12 год до лабораторного обстеження (можна пити негазовану воду)
- Щонайменше за 24 год до здачі крові уникати вживання спиртного та обмежити фізичні навантаження
- Обмежити вживання жирної та смаженої їжі за пару днів до дослідження
- За 1 добу виключити приймання ліків (на результати аналізу може вплинути використання препаратів леводопи, кортикостероїдів і деяких оральних контрацептивів)
- За пару годин до дослідження не курити
- За півгодини до взяття крові не напружуватися емоційно і фізично
Скринінг на дисліпідемію є важливим етапом профілактики ССЗ, особливо за наявності спадкових факторів ризику, таких як сімейна гіперхолестеринемія. За рекомендаціями Американської робочої групи із профілактичних заходів та Агентства з дослідження та якості охорони здоров’я (USPSTF/AHRQ, 2015), скринінг слід починати у віці 20 років для осіб, які мають спадкову схильність до порушень ліпідного обміну або інші фактори ризику розвитку ССЗ.
Для чоловіків віком˃˃40 років і жінок ˃50 років або в постменопаузальному періоді слід проводити обов’язковий скринінг ліпідного профілю з метою виявлення потенційних ризиків (ESC/EAS, 2019). Це включає визначення вмісту загального холестерину (ХС), ЛПНЩ, ліпопротеїнів високої щільності (ЛПВЩ) та ТГ. Особливу увагу варто приділяти рівню ЛПНЩ, оскільки його підвищення прямо пов’язане з імовірністю розвитку атеросклеротичних ССЗ.
Для дорослих без відомих факторів ризику рекомендовано проводити перевірку що 4‑6 років. Однак для пацієнтів із високим ризиком, зокрема тих, у кого є супутні захворювання, такі як ЦД та/або АГ, скринінг слід виконувати частіше, залежно від клінічної ситуації. У настанові ESC/EAS (2019) зазначено, що для скринінгу загального ризику зразки, отримані не натщесерце, мають таке саме прогностичне значення, як і зразки натщесерце.
Оцінка ризиків
Оцінка ризику ССЗ у пацієнтів із ЦД є ключовою для розробки стратегії профілактики та лікування. У рекомендаціях ESC/EAS (2021) запропоновано використовувати для цього калькулятори ризику, наприклад SCORE2 – універсальний алгоритм для оцінки 10-річного ризику СС-подій у загальній популяції, адаптований у Європі.
Під час аналізу понад 200 тис. пацієнтів із ЦД 2-го типу без попередніх СС-подій, у яких за час спостереження діагностували більш як 43 тис. СС-подій, експерти Європейського товариства кардіологів (ESC) розробили та затвердили спеціальний алгоритм оцінки СС-ризику в осіб із ЦД 2 типу – SCORE2-Diabetes. Він враховує не тільки загальні фактори ризику, як-от вік, куріння, рівень артеріального тиску (АТ), загального ХС і ХС ЛПВЩ, а також чинники, пов’язані з ЦД – тривалість захворювання, HbA1С, розрахункову швидкість клубочкової фільтрації (рШКФ). Це робить його точнішим прогностичним інструментом у цій групі хворих.
Категорії СС-ризику в осіб із ЦД згідно із настановою ESC спільно з Європейською асоціацією превентивної кардіології (EAPC) 2021 р. наведені в таблиці.
|
Таблиця. Категорії СС-ризику при ЦД 2-го типу |
|||
|
Категорія пацієнтів |
Підгрупи |
Категорія ризику |
Оцінка СС-ризику та користі терапії |
|
СС-ризики у пацієнтів віком ˃40 років із ЦД 1-го типу також можуть бути класифіковані відповідно до цих критеріїв |
Пацієнти із добре контрольованим ЦД, без додаткових факторів ризику атеросклеротичного ССЗ або ураження органів-мішеней |
Помірний ризик |
Не застосовується |
|
Пацієнти із ЦД без додаткових факторів ризику аетросклеротичного ССЗ та/або тяжкого ураження органів-мішеней, які не відповідають критеріям помірного ризику |
Високий ризик |
Оцінка резидуального 10-річного СС-ризику*. Необхідно розглянути корекцію способу життя та оцінити співвідношення ризику й користі лікування |
|
|
Пацієнти із ЦД і наявним атеросклеротичним ССЗ |
Дуже |
Оцінка резидуального 10-річного СС-ризику*. Слід розглянути корекцію способу життя та оцінити співвідношення ризику й користі лікування |
|
|
Примітки: * Резидуальний СС-ризик визначається як показник, оцінений після початкових змін способу життя та лікування факторів ризику. Адаптовано за ESC/EAPC (2021) |
|||
В алгоритмі SCORE2-Diabetes враховуються специфічні фактори ризику. Тому в оновлених рекомендаціях ESC (2023) пацієнти віднесені до групи низького СС-ризику при оцінці >5%, помірного ризику – від 5 до 10%, високого ризику – від 10 до 20%. Категорія дуже високого СС-ризику включає хворих на ЦД 2-го типу із клінічно встановленим атеросклеротичним ССЗ, ураженням органів-мішеней або значенням SCORE2-Diabetes ≥20% (рис. 1).
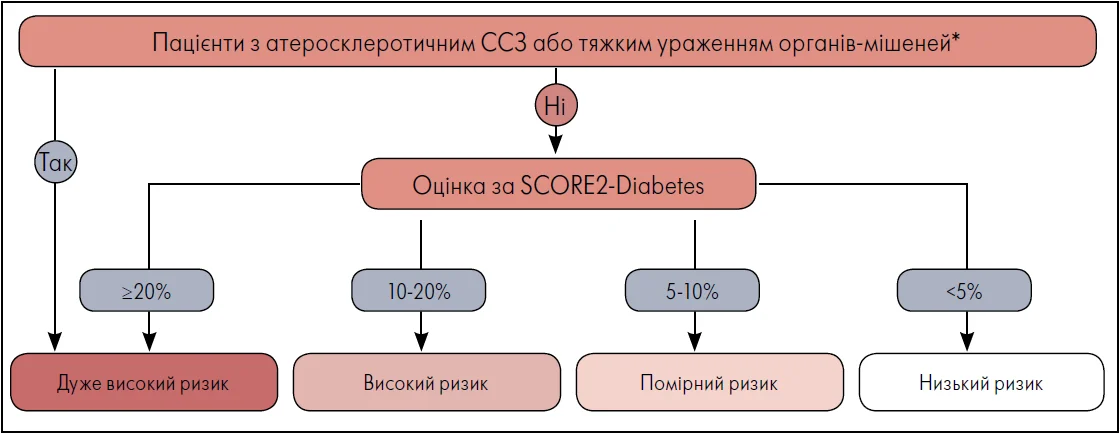 Рис. 1. Категорії СС-ризику у хворих на ЦД 2-го типу
Рис. 1. Категорії СС-ризику у хворих на ЦД 2-го типу
Примітки: * Тяжке ураження органів-мішеней визначається як рШКФ <45 мл/хв/1,73 м2 незалежно від альбумінурії, або ШКФ <45‑59 мл/хв/1,73 м2 та мікроальбумінурія (співвідношення альбуміну та креатиніну в сечі – 30‑300 мг/г, стадія A2), або протеїнурія (співвідношення альбуміну та креатиніну в сечі >300 мг/г, стадія A3), або наявність мікросудинного ураження щонайменше у трьох різних місцях (наприклад, мікроальбумінурія [стадія А2] + ретинопатія + невропатія).
Адаптовано за ESC (2023)
Механізм впливу діабетичної дисліпідемії
Атеросклеротичні ССЗ і ЦД мають спільні патофізіологічні механізми. Обидва стани характеризуються хронічним запаленням і ендотеліальною дисфункцією, що призводить до атерогенезу. Інсулінорезистентність пов’язана з активацією запальних шляхів та хронічним посиленням окисного стресу, що викликає ендотеліальну дисфункцію та спричиняє атерогенез (Shoelson, 2006; Hurrle, 2017). Результати дослідження CAPTURE продемонстрували, що у кожного третього пацієнта із ЦД 2-го типу наявне супутнє ССЗ (Mosenzon, 2021).
У 60‑70% осіб із ЦД спостерігається дисбаланс ліпідів (Low, 2016). Діабетична дісліпідемія є високоатерогенною, що робить спостереження за ліпідним профілем пацієнтів із ЦД важливим фактором оцінки СС-ризику. Механізм впливу діабетичної дисліпідемії значною мірою визначається порушенням ліпідного обміну через зміни у структурі ліпопротеїнів (Yanai, 2019). Такі зміни ліпідного спектра, як збільшення вмісту ТГ, зниження концентрації ХС ЛПВЩ, підвищення рівня ХС ліпопротеїнів дуже низької щільності та ХС ЛПНЩ (тобто збільшення ХС не-ЛПВЩ) зумовлюють розвиток атеросклерозу незалежно від підвищення загального ХС (Parcero-Valdеs, 2021).
Дослідження показали, що ТГ і багаті на ТГ ліпопротеїни є основними причинами розвитку атеросклеротичних ССЗ (Laufs et al., 2020; Farnier et al., 2021). Залишки ліпопротеїнів, багатих на ТГ, проникають в ендотелій та стають причиною його дисфункції. Під їх впливом резистентні макрофаги перетворюються на пінисті клітини та призводять до утворення бляшок.
Окрім того, ці ліпопротеїни та побічні продукти їх обміну (залишки та вільні жирні кислоти) активують прозапальні, прокоакулянтні та проапоптотичні сигнальні шляхи, що спричиняють утворення бляшок (Peng, 2017). Це збільшує ймовірність тромбозу і несприятливих СС-подій у пацієнтів із ЦД.
На додаток, хворі на ЦД часто мають надлишкову вагу. Ожиріння є основним чинником ризику резистентності до інсуліну та пов’язаних із цим захворювань, а також самостійним фактором ССЗ (Wondmkun, 2020; Powell-Wiley, 2021).
Терапевтичні цілі
У рекомендаціях ADA (2024) наголошено на застосуванні комплексного підходу для зниження ризику ускладнень, пов’язаних із ЦД (рис. 2). Важливим аспектом є терапія, що ґрунтується на доказах, яка сприяє зниженню ризику мікросудинних ускладнень – нефропатії, ретинопатії, неврологічних та СС-порушень. Основними елементами успішного ведення осіб із ЦД є контроль рівня глікемії, АТ та ліпідів, а також застосування специфічних препаратів, спрямованих на захист СС-системи й нирок відповідно до індивідуальних потреб пацієнта.
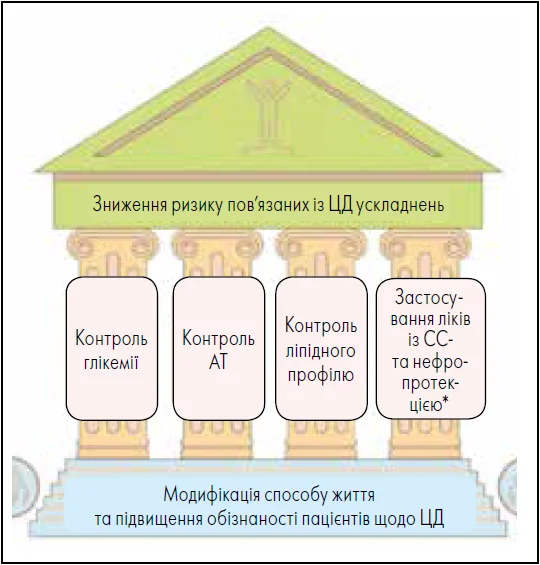 Рис. 2. Зниження ризику пов’язаних із ЦД ускладнень
Рис. 2. Зниження ризику пов’язаних із ЦД ускладнень
Примітки: * Терапевтичні втручання щодо зниження ризику, які застосовуються індивідуально.
Адаптовано за ADA (2024)
У настанові ADA (2024) в рекомендаціях щодо менеджменту пацієнтів із дисліпідемією визначено такі стратегії терапії:
- Необхідно посилити модифікацію способу життя та оптимізувати контроль глікемії для осіб із ЦД і підвищеним рівнем ТГ (≥1,7 ммоль/л) та/або низьким рівнем ХС ЛПВЩ (<1,0 ммоль/л для чоловіків і <1,3 ммоль/л для жінок).
- У дорослих із предіабетом або підтвердженим ЦД, які не отримують статини чи іншу гіполіпідемічну терапію, доцільно оцінити ліпідний профіль під час встановлення діагнозу / первинного медичного огляду.
- Слід оцінити ліпідний профіль на початку приймання статинів або інших гіполіпідемічних засобів через 4‑12 тижнів після старту чи зміни дози, а потім щорічно або частіше за наявності показань, оскільки це може допомогти контролювати відповідь на лікування та інформувати про застосування ліків.
- Особам із ЦД віком 40‑75 років без супутнього атеросклеротичного ССЗ варто призначити статинотерапію помірної інтенсивності на додаток до корекції способу життя.
- У пацієнтів із ЦД віком від 75 років доцільно розглянути початок лікування статинами помірної інтенсивності після обговорення потенційних переваг і ризиків.
- У хворих на ЦД після 75 років, які вже приймають статини, доцільно продовжувати терапію.
- Для осіб із ЦД віком 20‑39 років із додатковими факторами ризику атеросклеротичного ССЗ найкращою початковою стратегією може бути статинотерапія на додаток до модифікації способу життя.
- Пацієнтам із ЦД віком 40‑75 років із високим СС-ризиком рекомендовано призначити високоінтенсивне лікування статинами для зниження рівня ХС ЛПНЩ на ≥50% від вихідного рівня та досягнення цільового показника ХС ЛПНЩ <1,8 ммоль/л.
- Для осіб із ЦД віком 40‑75 років із високим СС-ризиком, декількома факторами ризику атеросклеротичних ССЗ та рівнем ХС ЛПНЩ ≥1,8 ммоль/л варто розглянути додавання езетимібу або інгібітора пропротеїнової конвертази субтилізин-кексинового типу 9 (PCSK9) до максимально переносимої терапії статинами.
Призначення лікування статинами
Особи із ЦД 2-го типу мають підвищену поширеність аномалій ліпідів, що спричиняє високу ймовірність атеросклеротичних ССЗ. Клінічні дослідження чітко демонструють, що статинотерапія значно знижує цей ризик. Зокрема, аналіз підгруп пацієнтів із ЦД у великих дослідженнях (Collins, 2003; Shepherd, 2006; Sever, 2005), a також оцінка когорт пацієнтів із ЦД (Knopp, 2006; Colhoun, 2004) показали значну ефективність статинів як у первинній, так і вторинній профілактиці несприятливих СС-подій та смертності від атеросклеротичних ССЗ.
Метааналіз Kearney (2008), що включав дані понад 18 тис. осіб із ЦД у 14 рандомізованих дослідженнях статинотерапії (середній період спостереження – 4,3 року), продемонстрував пропорційне зменшення смертності від усіх причин на 9% і випадків СС-смерті на 13% на кожен 1 ммоль/л зниження ХС ЛПНЩ. При цьому користь для СС-системи не залежала від базового рівня ХС ЛПНЩ і була лінійно пов’язана зі зниженням ХС ЛПНЩ без порогового значення, нижче якого ефект припинявся.
Отже, статини є препаратами вибору для зниження ХС ЛПНЩ та кардіопротекції. Згідно з рекомендаціями ESC/EAS (2019), у клінічній практиці рекомендоване застосування високоінтенсивної терапії статинами із призначенням аторвастатину (40‑80 мг) або розувастатину (20‑40 мг). Це дозволяє досягати ≥50% зменшення ХС ЛПНЩ, тоді як використання статинів середньої інтенсивності асоційоване зі знизженням даного показника на 30‑49%. Лікування статинами у низьких дозах для осіб із ЦД зазвичай не рекомендоване (ADA, 2024).
Статини як золотий стандарт терапії
Статини залишаються основною фармакологічною групою у лікуванні діабетичної дисліпідемії. Розувастатин – один із найефективніших представників статинів, що підтвердив свою користь у профілактиці атеросклеротичних ССЗ.
Дослідження ASTEROID було першим, у якому було доведено, що інтенсивна статинотерапія розувастатином сприяє регресу атеросклеротичної бляшки в коронарних артеріях (Nissen, 2006). Згідно із даними випробування STELLAR продемонстровано, що розувастатин (10-80 мг) знижував рівень ХС ЛПНЩ у середньому на 8,2% більше, ніж аторвастатин (10-80 мг), на 26% більше, ніж правастатин (10-40 мг), і на 12-18% більше, ніж симвастатин (10-80 мг). Одномоментно, розувастатин підвищував показник ХС ЛПВЩ на 8-10% (порівняно із 26, 5 і 36% відповідно) і знижував вміст ТГ на 20-26% (порівняно із 20-28, 12-15 і 8-13% відповідно) (Jones et al., 2003).
На фармацевтичному ринку України одним із найефективніших препаратів на основі розувастатину є Розуліп® виробництва ЗАТ «Фармацевтичний завод ЕГІС» (Угорщина). Цей лікарський засіб дозволяє надійно та безпечно досягати рекомендованих цільових показників ХС ЛПНЩ, що є ключовим у профілактиці ССЗ.
Пацієнтам, які не переносять високоінтенсивну статинотерапію, доцільно застосовувати статин у максимально переносимій дозі в межах комбінованої терапії. Згідно з рекомендаціями ESC/EAS (2019) щодо менеджменту осіб із дисліпідемією, до лікування варто додати езетиміб, якщо монотерапія статинами не забезпечує достатнього контролю рівня ХС (Mach et al., 2020).
У дослідженні ACTE оцінювали ефективність та безпеку комбінованої терапії езетимібом і розувастатином порівняно з титруванням доз розувастатину в пацієнтів із гіперхолестеринемією та високим / дуже високим СС-ризиком. Основна мета полягала у зниженні рівня ХС ЛПНЩ (Bays et al., 2011). За висновками авторів, збільшення дози розувастатину вдвічі (із 10 до 20 мг) зумовило додаткове зменшення вмісту ХС ЛПНЩ лише на 6,3%, тоді як додавання 10 мг езетимібу до 10 мг розувастатину дозволило знизити рівень ХС ЛПНЩ на 23,7%. Аналогічна тенденція спостерігалася щодо ТГ: збільшення дози розувастатину привело до зниження ТГ на 2,9%, тоді як додавання езетимібу забезпечило зниження ТГ на 9,8%. Що стосується досягнення цільових значень ХС, титрування дози розувастатину дозволило досягти мети лише у 30,6% пацієнтів, а поєднання розувастатину з езетимібом допомогло 62,8% хворих досягти цільових рівнів ХС ЛПНЩ.
Таким чином, комбінована терапія розувастатином (10 мг) і езетимібом (10 мг) майже в чотири рази ефективніше знижує рівень ХС ЛПНЩ, утричі краще впливає на вміст ТГ та вдвічі збільшує кількість пацієнтів, які досягають цільового показника ХС.
Єдиним препаратом езетимібу, доступним на ринку України, є Ліпобон компанії «ЕГІС», що робить його ідеальним вибором для комбінованої терапії разом із Розуліпом. Для досягнення максимальної ефективності «ЕГІС» пропонує комбінований препарат Розуліп® Плюс, що містить безпечну комбінацію розувастатину й езетимібу в одній таблетці. Лікарський засіб представлений у двох дозуваннях: 10 або 20 мг розувастатину в поєднанні з 10 мг езетимібу. Розуліп® Плюс показаний для застосування у пацієнтів із високим СС-ризиком у межах терапії дисліпідемії та ЦД.
Лікування НАЖХП
Нещодавні дослідження демонструють, що статини можуть відігравати важливу роль у профілактиці та лікуванні НАЖХП, яка часто супроводжує ЦД 2-го типу. Стеатоз печінки є поширеним метаболічним порушенням, що не лише підвищує ризик розвитку печінкової недостатності, але й тісно пов’язане із підвищеним ризиком ССЗ.
Статини сприяють зниженню рівня ліпідів у печінці та поліпшенню функції органа за рахунок зменшення синтезу ТГ і ХС у печінкових клітинах. Дослідження показують, що пацієнти із НАЖХП, які отримують терапію статинами, мають нижчий ризик прогресування до цирозу, що є серйозним ускладненням цього захворювання (Kim, 2017).
Зокрема, за даними досліджень, розувастатин проявляє виразну антистеатотичну дію. У пацієнтів із НАЖХП, які отримували розувастатин, спостерігалося зменшення жирової інфільтрації печінки та поліпшення біохімічних показників функції печінки, таких як рівні АЛТ і АСТ (Wang, 2024). Це має особливе значення для осіб із ЦД, оскільки вони частіше стикаються з ускладненнями на тлі жирової хвороби печінки, що погіршує загальний прогноз.
Підготувала Ольга Загора
Тематичний номер «Кардіологія. Ревматологія. Кардіохірургія» № 5 (96) 2024 р.



