29 червня, 2023
Діабетична нейропатія. Рекомендації Німецького діабетичного товариства (Deutsche Diabetes Gesellschaft, DDG)
Діабетична сенсомоторна полінейропатія
Визначення, фактори ризику, супутні захворювання
Діабетична нейропатія – клінічно маніфестофана або субклінічна хвороба периферичних нервів, котра розвивається як наслідок цукрового діабету (ЦД) за відсутності інших причин, може уражати соматичні нерви та/або автономну нервову систему. Ризик розвитку дистальної симетричної полінейропатії (ДСПН) й автономної нейропатії підвищують такі фактори та супутні захворювання:
- тривалість діабету;
- неадекватний контроль діабету (гіперглікемія);
- хвороба периферійних артерій (ХПА);
- склероз Менкеберга;
- діабетичні ретино- та нейропатія;
- депресія;
- вісцеральне ожиріння;
- гіперліпідемія;
- зловживання алкоголем, куріння;
- низька фізична активність;
- демографічні фактори (вік, зріст, маса тіла).
У 85-90% випадках ДСПН етіологічно пов’язана з діабетичною стопою, а отже, є важливим фактором ризику виразок й ампутацій стопи. Також ДСПН є предиктором кардіоваскулярної захворюваності та смертності.
Поширеність ДСПН у пацієнтів із маніфестованим ЦД 1 і 2 типу становить близько 30%. У 13-26% хворих на діабет присутня больова нейропатія.
Класифікація
На підставі клінічних критеріїв розрізняють такі варіанти діабетичної нейропатії:
- субклінічна нейропатія (симптоми відсутні, але змінені дані кількісних нейрофізіологічних тестів);
- хронічна больова нейропатія (часто);
- гостра больова нейропатія (рідко);
- безбольова нейропатія (часто);
- фокальна нейропатія, як-от діабетична аміотрофія (рідко);
- нейропатія як складова синдрому діабетично-нейропатичної стопи, включно з виразками, нейроостеоартропатією й ампутацією.
Скринінг
Скринінг ДСПН включає такі дані та обстеження (обов’язково двобічні):
- анамнез життя та хвороби (див. «Базова діагностика»), наявність факторів ризику ДСПН;
- оцінку нейропатичних позитивних і негативних симптомів (порушення чутливості, біль, судоми, оніміння та ін.), зокрема інтенсивності, локалізації болю та провокувальних чинників;
- клінічний огляд (колір і температура шкіри, трофічні зміни, деформації стопи, виразки);
- скринінг ХПА;
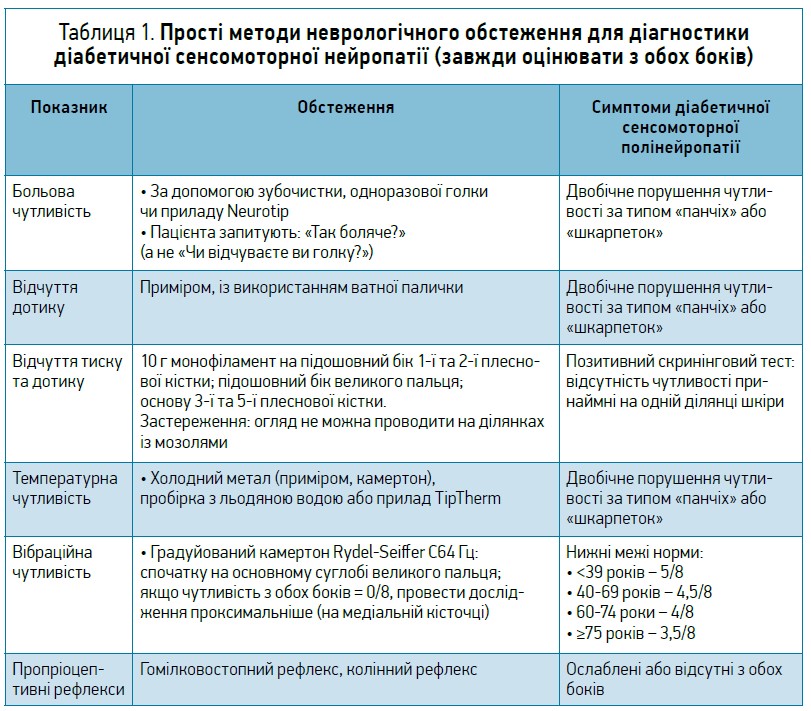
- базове неврологічне обстеження: оцінка ахілового рефлексу, вібраційної чутливості (за допомогою градуйованого камертона Rydel-Seiffer C64 Гц), тактильної чутливості (з використанням монофіламента 10 г). За відхилення будь-якого із цих трьох показників проводять уточнювальні дослідження (див. «Базова діагностика»).
У пацієнтів із ЦД 2 типу скринінг діабетичної сенсомоторної та/або автономної нейропатії проводять одразу після діагностування діабету, у хворих на ЦД 1 типу – не пізніше 5 років після встановлення діагнозу діабету.
Базова діагностика
Базові діагностичні процедури – обстеження, котрі проводить лікар загальної практики або діабетолог, – є абсолютно необхідними для діагностики ДСПН, раннього виявлення пацієнтів групи ризику, а також визначення і лікування ускладнень діабетичної нейропатії. Необхідно оглянути, клінічно обстежити й порівняти отримані дані на обох ногах. Уточнення діагнозу потрібне в усіх пацієнтів із симптомами, зокрема з болем невстановленого походження й іншими нейропатичними симптомами, а також у всіх безсимптомних хворих із відхиленнями, виявленими під час скринінгового обстеження (див. «Скринінг»).
Огляд нижніх кінцівок має включати оцінку таких показників:
- шкіра: колір, тургор, тріщини, пухирі, підшкірні крововиливи;
- гіперкератоз, утворення мозолів;
- ураження стопи, що загоїлися;
- гіпо- або ангідроз;
- ознаки бактеріальної та/або грибкової інфекції;
- деформації стопи: нейроостеоартропатія (артропатія Шарко), молотко- або кігтеподібні пальці;
- виразки стопи з визначенням локалізації, поширення та супутньої інфекції.
Клінічне обстеження передбачає:
- визначення статусу периферійного пульсу (пальпація пульсу на задній великогомілковій артерії та задній артерії стопи з обох боків);
- перевірку температури, тургору та потовидільної функції шкіри;
- оцінку деформацій стопи, функціонального стану м’язів і суглобів;
- оцінку ходи пацієнта, уважний огляд і контроль на дотик взуття й устілок (зміни матеріалу зовні і всередині, надмірне зношення підошви, сліди від ноги чи виділення з рани на устілках).
Гострі зміни шкіри, м’яких тканин або суглобів свідчать про серйозні ускладнення. Відтак, у подібних випадках слід виключити інфекцію та нейроостеоартропатію. На інфекцію вказує наявність дефекту шкіри (вхідних воріт).
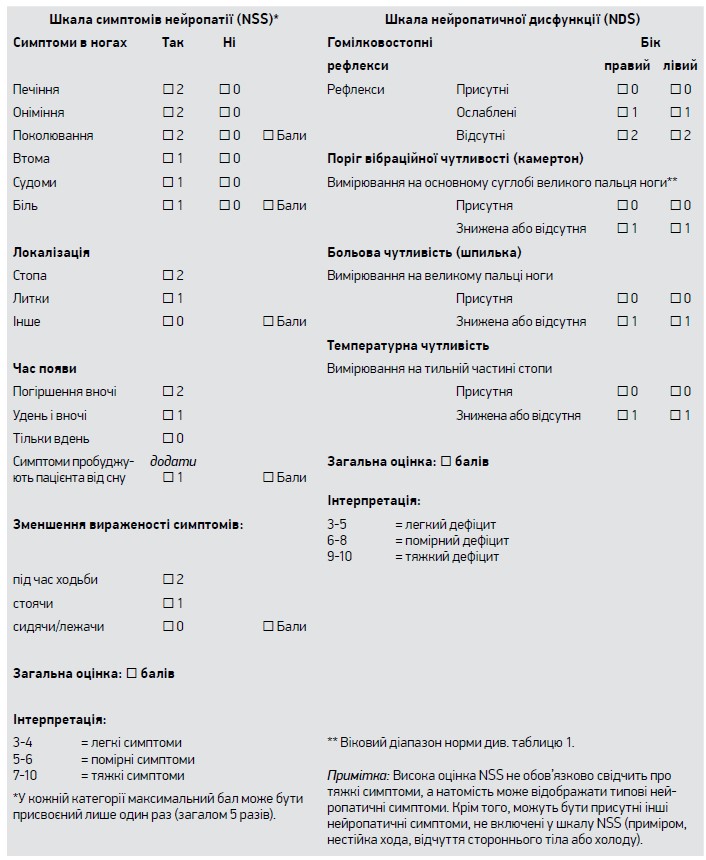
Суб’єктивні симптоми клінічно оцінюють за допомогою шкали нейропатичних симптомів (NSS, рис. 1), тяжкість сенсорного дефіциту – із використанням шкали нейропатичної дисфункції (NDS, рис. 1) або Мічиганського інструмента скринінгу нейропатії (MNSI). За наявності або тільки нейропатичних симптомів (NSS ≥3), або тільки дефіциту (NDS ≥3 чи MNSI ≥2,5) діагноз ДСПН розцінюють як можливий, а за присутності нейропатичних симптомів і дефіциту – як високоймовірний.
Рис. 1. Діагностичні критерії діабетичної сенсомоторної нейропатії
Моторну функцію перевіряють за здатністю розводити та згинати пальці, згинати стопу проти опору, ходити на носках і на п’ятах.
За наявності болю оцінюють його інтенсивність за допомогою числової рейтингової шкали (NRS), на якій 0 = болю немає, а 10 = найсильніший біль, який можна уявити.
Подальше спостереження
Періодичність обстежень і необхідність додаткових діагностичних процедур залежать від індивідуального ризику пацієнта. За відсутності нейропатії скринінг здійснюють раз на рік. Якщо є підозра на нейропатію або ж остання є встановленою, пацієнта потрібно спостерігати принаймні що пів року, а в разі присутності ХПА та/або деформацій стопи – щотри місяці.
Додаткові дослідження
Якщо підозрюваний на підставі симптомів діагноз діабетичної нейропатії неможливо встановити за допомогою базових діагностичних процедур, слід провести електронейрографію та кількісне сенсорне тестування, особливо за ознак нейропатії дрібних волокон. Із цією метою пацієнта слід направити до лікаря, знайомого з вищезазначеними методами.
У разі етіологічно не з’ясованого або стійкого до лікування болю необхідно залучити лікаря з відповідним досвідом. В історії хвороби слід зазначити інтенсивність і суб’єктивну переносимість болю, а також ситуації, що викликають біль (біль у спокої; біль, спровокований дотиком; біль під час навантаження – у положенні стоячи або під час ходьби). Останнє є нетиповим для больової нейропатії.
Диференційна діагностика
Основні диференційні діагнози включають нейропатії, зумовлені лікарськими засобами (приміром, хіміопрепаратами) або токсинами (алкоголем тощо), ниркову недостатність, ХПА, дефіцит вітамінів групи В (В1, В6, В12), новоутворення, інфекції (наприклад, ВІЛ, хвороба Лайма), васкуліти, вроджені нейропатії, ендокринні розлади (гіпотиреоз, акромегалія), імунні нейропатії, імпінджмент-синдром (синдром фемороацетабулярного конфлікту).
Мінімально необхідний стандартний перелік лабораторних тестів для виключення вищезазначених захворювань включає такі позиції: загальний аналіз крові з формулою, креатинін, С‑реактивний білок, тиреотропний гормон, вітамін В12, фолієва кислота, аланінамінотрансфераза, γ-глутамілтранспептидаза, імуноелектрофорез.
Направлення до невролога рекомендоване за наявності принаймні однієї з таких ознак:
- моторний дефіцит переважає над сенсорним;
- швидкий розвиток і прогресування симптомів;
- виражена асиметрія неврологічного дефіциту, мононейропатія або дисфункція черепно-мозкових нервів;
- поява симптомів спочатку на верхніх кінцівках;
- інші неврологічні симптоми, не характерні для синдрому діабетичної полінейропатії;
- нейропатія в сімейному анамнезі.
Загальні стратегії профілактики і лікування
Важливими терапевтичними цілями в пацієнтів із ЦД 1 або 2 типу є покращення якості життя, профілактика мікро- (ретинопатія, нефропатія) і макроваскулярних ускладнень, а також нейропатії та синдрому діабетичної стопи. Цілі лікування мають бути індивідуалізованими на підставі віку пацієнта, супутніх захворювань, очікуваної тривалості життя тощо.
Пацієнти з нейропатією будь-якої форми та стадії мають отримати рекомендації щодо способу життя, лікування діабету й догляду за стопами. У терапевтичний процес бажано залучати родичів пацієнта та, за необхідності, відповідних лікарів-спеціалістів.
Рання оптимізація метаболічного контролю та наявних факторів ризику (приміром, куріння, зловживання алкоголем, артеріальна гіпертензія) в пацієнтів із діабетом здатна попереджувати або принаймні сповільнювати прогресування діабетичної нейропатії.
Пацієнтам із ДСПН і втратою чутливості рекомендовано носити спеціальне взуття.
Лікування болю
Є три головні принципи ведення ДСПН: 1) вплив на причини, включно зі зміною способу життя, інтенсивним контролем глікемії та факторів кардіоваскулярного ризику; 2) патогенетично спрямована терапія; 3) симптоматичне полегшення болю.
На рисунку 2 зображено алгоритм фармакотерапії больової ДСПН.
У дослідженні DCCT/EDIC за участю пацієнтів із ЦД 1 типу було продемонстровано, що суворий метаболічний контроль рівня глюкози крові до майже нормальних показників відтерміновує й певною мірою попереджає розвиток ДСПН. Водночас докази поліпшення природного перебігу ДСПН у пацієнтів із ЦД 2 типу за допомогою контролю глікемії є обмеженими.
Принципи фармакотерапії больової ДСПН:
1. Фармакотерапію хронічного нейропатичного болю, асоційованого із ЦД, слід починати якомога раніше, якщо біль негативно впливає на якість життя пацієнта.
2. Більшість препаратів для лікування больової ДСПН надають лише симптоматичний ефект.
3. Серед засобів першої лінії (рис. 2) патогенетично спрямованим препаратом є тіоктова (альфа-ліпоєва) кислота.
4. Вибір фармакотерпії має ґрунтуватися на ефективності та безпеці окремих препаратів з урахуванням супутніх захворювань пацієнта. Якщо препарати мають порівнянну знеболювальну ефективність, перевагу віддають засобу з найнижчою органною токсичністю і найнижчим ризиком кардіоваскулярних і ниркових ускладнень.
5. Препарати, пов’язані з підвищеним довгостроковим ризиком каріоваскулярних і ниркових подій (зокрема, нестероїдні протизапальні засоби), не показані для лікування болю при діабетичній нейропатії.
6. Знеболювальну ефективність препаратів визначають індивідуально. Дозу препаратів слід титрувати до найнижчої ефективної; не можна перевищувати максимальну дозволену дозу.
7. Ефективність фармакотерапії слід оцінювати не раніше ніж після 2 тиж застосування в оптимальній дозі.
8. Комбінована знеболювальна терапія рекомендована тільки за умови, якщо комбінація має ефективність вищу, ніж така окремих компонентів, та/або знижує ризик небажаних реакцій завдяки застосуванню компонентів у нижчих дозах.
9. Психотропні препарати без знеболювальної ефективності не показані. Комбінації, що містять кофеїн, бензодіазепіни чи м’язові релаксанти, пов’язані з ризиком зловживання та залежності і тому не рекомендовані.
Реалістичними цілями фармакотерапії нейропатичного болю є:
- зменшення болю на 30-50% за візуальною аналоговою шкалою (VAS) або 11-бальною шкалою NRS;
- покращення сну;
- поліпшення якості життя;
- підтримання соціальної активності;
- збереження здатності працювати.
Вищезазначені цілі варто обговорювати з пацієнтами до початку і періодично під час лікування, щоб підтримувати очікування пацієнта на реалістичному рівні. У такий спосіб можна уникнути розчарувань в терапії, які можуть призвести до посилення болю.
Діабетична автономна нейропатія
Класифікація і прогноз
Діабетична автономна нейропатія (ДАН) є найчастішою після ДСПН формою периферійної нейропатії, може уражати будь-який орган, іннервований автономними нервами. Патогенетичні механізми та фактори ризику є принципово тими самими, що й для ДСПН.
ДАН, безсумнівно, має значні негативні наслідки, як-от знижена очікувана тривалість життя, підвищений ризик уражень органів-мішеней і погіршена якість життя. У пацієнтів із ЦД і діабетичною кардіоваскулярною автономною нейропатією (ДКАН), діагностованою за допомогою принаймні 2 тестів, ризик смерті впродовж наступних 16 років є у 3,5 раза вищим, ніж у хворих на діабет без ДКАН (табл. 1).
Скринінг
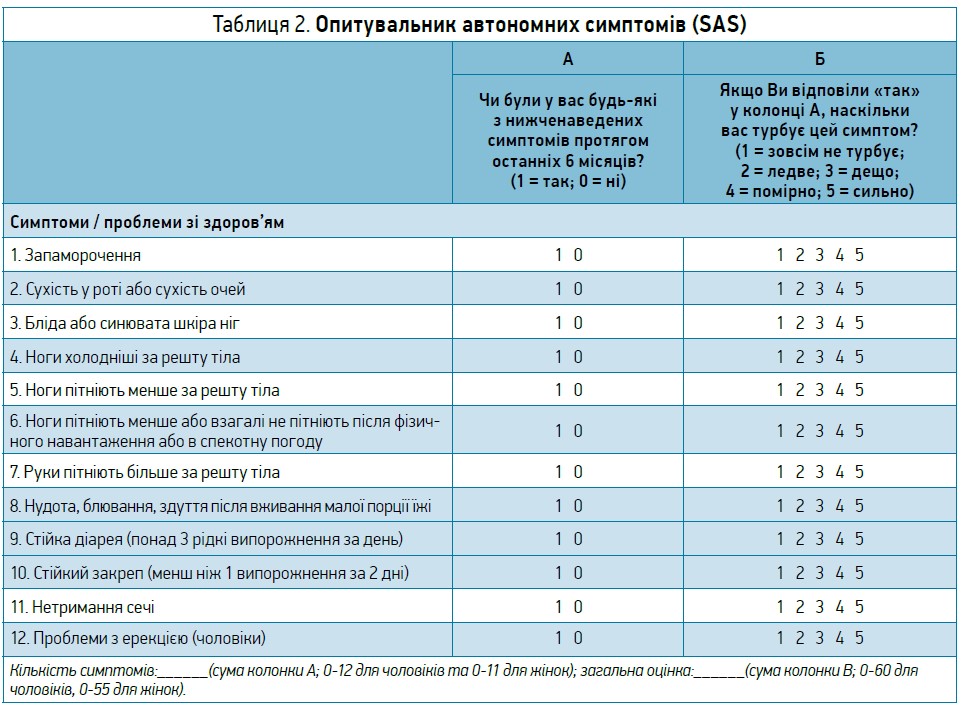
Діагностичних процедур для скринінгу ДАН не існує. Утім, є низка симптомів, котрі можуть вказувати на ДАН (хоча і з низькими чутливістю та специфічністю):
- тахікардія в спокої;
- гастроінтестинальні розлади (диспепсія, закреп, діарея, нетримання калу);
- порушення функції сечового міхура, сексуальна дисфункція;
- неусвідомлення гіпоглікемії;
- порушення потовиділення;
- коливання рівня глюкози крові, які неможливо пояснити іншими причинами.
Також для скринінгу можна використовувати опитувальник автономних симптомів (SAS) – простий валідований інструмент, що складається з 12 запитань (табл. 2).
Діагностика
Під час збору анамнезу пацієнта варто запитувати про симптоми автономної дисфункції. Слід пам’ятати, що повна клінічна картина симптомної ДАН з поліорганним ураженням зустрічається рідко.
Під час діагностики ДСПН завжди необхідно шукати прояви ДАН, оскільки ДКАН присутня приблизно в 50% випадків. Так само існує зв’язок між ДАН й іншими хронічними ускладненнями діабету (ретинопатією, нефропатією).
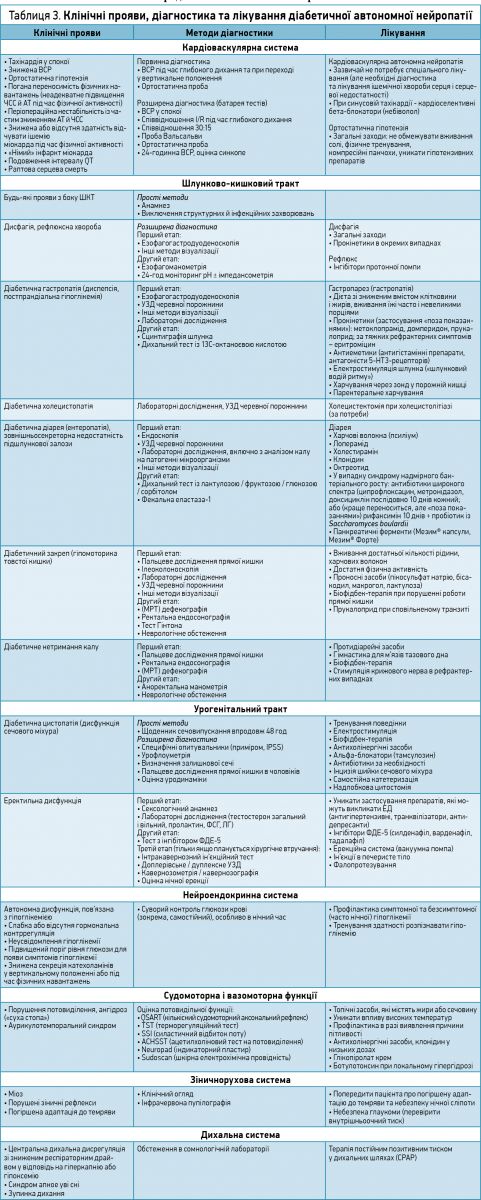
Уточнення діагнозу здійснюють так само, як для сенсомоторної нейропатії. Крім того, проводять тестування кардіоваскулярної автономної функції й обстеження окремих органів (табл. 3). Первинне обстеження виконує лікар загальної практики або діабетолог, спеціалізовані діагностичні процедури – невролог, кардіолог, гастроентеролог, уролог.
Діабетична кардіоваскулярна автономна нейропатія
ДКАН уражає близько 20% пацієнтів із діабетом і характеризується передусім зниженою варіабельністю серцевого ритму (ВСР), що є ранньою ознакою ураження блукаючого нерва. Знижену ВСР часто можна виявити до клінічної маніфестації інших симптомів із боку кардіоваскулярної й інших систем. На пізніх стадіях ДКАН спостерігають підвищення частоти серцевих скорочень (ЧСС) у спокої (ураження блукаючого нерва) та ортостатичну гіпотензію (ураження симпатичних нервів).
Відповідно до рекомендацій Торонтської консенсусної конференції, діагностика ДКАН має включати принаймні два тести ВСР та ортостатичну пробу. Інтерпретація результатів така:
- відхилення одного тесту ВСР: можлива або рання ДКАН, потребує підтвердження під час подальших обстежень;
- відхилення двох тестів ВСР: підтверджена ДКАН;
- ортостатична гіпотензія на додаток до відхилення тестів ВСР: тяжка ДКАН або ДКАН пізніх стадій.
Усі пацієнти із симптомами, в яких прості діагностичні тести не виявили відхилень, мають проходити спеціалізовані обстеження. Останні, крім підтвердження діагнозу, також дозволяють уточнити тяжкість і прогноз ДКАН.
Гастроінтестинальна автономна нейропатія
Скарги з боку шлунково-кишкового тракту (ШКТ) часто зустрічаються в пацієнтів із діабетом і суттєво погіршують якість їхнього життя. За наявності подібних скарг слід зібрати детальний анамнез щодо таких ознак і симптомів, як: дисфагія/одинофагія, біль у животі, нудота, блювання, здуття живота, метеоризм, діарея, закреп, нетримання калу, кров у калі, наявність т. зв. В‑симптомів (лихоманка, слабкість, схуднення).
За появи нових симптомів, які прогресують або супроводжуються тривожними ознаками (до останніх належать, зокрема, кровотеча, анемія, раннє насичення, непояснена втрата >10% ваги, дисфагія/одинофагія, стійке блювання, пухлини ШКТ в сімейному або особистому анамнезі, збільшені лімфатичні вузли, пальповані новоутворення, мальнутриція, кров у калі, парадоксальна діарея, вік >50 років), необхідно виключити структурні й інфекційні захворювання.
Необідно пам’ятати, що численні серйозні гастроінтестинальні захворювання на початкових стадіях можуть проявлятися незначними та/або неспецифічними симптомами. Це, зокрема, стосується усіх злоякісних новоутворень ШКТ, а також таких захворювань, як целіакція і пептична виразка.
Автономна нейропатія урогенітального тракту
Діабетичну цистопатію вважають переважно нейрогенною сенсомоторною дисфункцією. Кожного пацієнта з діабетом слід регулярно запитувати стосовно порушень сечовипускання (кількість сечовипускань на день, залишкова сеча, інфекції сечового тракту, нетримання сечі, необхідність натужуватися або залучати м’язи живота під час сечовипускання), а також щодо задоволеності статевим життям. Слід взяти до уваги препарати, які приймає пацієнт, оскільки певні лікарські засоби мають побічні ефекти з боку сечових шляхів. Простим методом діагностики є щоденник сечовипускання, який пацієнт заповнює впродовж 48 год (частота сечовипускання, об’єм сечі та об’єм вжитої рідини). У безсимптомних пацієнтів урологічний анамнез збирають раз на рік.
1. Варіабельність серцевого ритму під час глибокого дихання → методика обстеження
Пацієнт лежить на спині та дихає зі швидкістю 6 циклів дихання на хвилину протягом 1-2 хвилин. Кожен вдих і кожен видих тривають 5 секунд. Співвідношення E/I (R-Rmax / R-Rmin) обчислюють за циклом із найдовшим інтервалом R-R під час видиху (R-Rmax), поділеним на найкоротший інтервал R-R під час вдиху (R-Rmin).
Нормальні значення:
- вік 20-30 років: ≥1,12;
- вік 21-49 років: ≥1,11;
- вік 50-69 років: ≥1,10;
- вік ≥70 років: ≥1,09.
2. Варіабельність серцевого ритму у відповідь на перехід у вертикальне положення → методика обстеження
Після перебування в положенні лежачи пацієнт встає біля оглядової кушетки. Запис ЕКГ розпочинають у той момент, коли обстежуваний починає підніматися. Показник ВСР – співвідношення 30:15 (R-Rmax / R-Rmin) – визначають як найдовший інтервал R-R між ударами 20 і 40, поділений на найкоротший інтервал R-R між ударами 5 і 25.
Нормальні значення:
• вік 20-49 років: ≥1,10;
• вік 50-79 років: ≥1,09;
• вік ≥80 років: ≥1,08.
3. Ортостатична проба → методика обстеження
Артеріальний тиск вимірюють двічі протягом 1 хвилини в положенні лежачи, відразу після вставання і потім кожні 30 секунд протягом 3 хвилин. У нормі систолічний артеріальний тиск знижується не більше ніж на 27 мм рт. ст. Інші професійні товариства рекомендують діагностувати ортостатичну гіпотензію за наявності ортостатичних симптомів, коли зниження систолічного артеріального тиску становить ≥20 мм рт. ст.
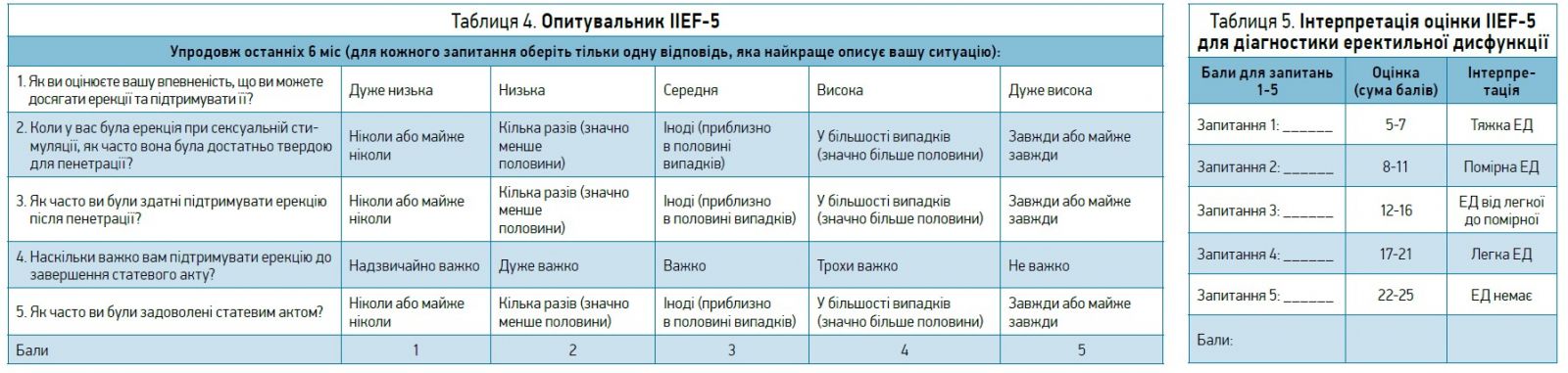
У випадку сексуальних розладів діагностичний підхід передбачає прицільний збір анамнезу пари. У чоловіків можна застосовувати опитувальник IIEF‑5 (міжнародний індекс еректильної функції‑5; табл. 4, 5). Показанням для направлення до уролога для подальшого обстеження пацієнтів із порушеннями сечовипускання є підвищений об’єм залишкової сечі (>20% об’єму сечового міхура або >100 мл) та рецидивувальні інфекції сечових шляхів (>3 епізодів протягом року).
Періопераційне ведення
Пацієнти з ДКАН мають вищу періопераційну захворюваність і смертність. Якщо втручання є плановим, для виявлення значимих автономних нейропатій перед операцією слід вжити таких заходів: з’ясувати особистий і пов’язаний із діабетом анамнез; оцінити фактори ризику та клінічні кореляти діабетичної сенсомоторної й автономної нейропатії; провести фізикальний огляд. Розширений моніторинг гемодинаміки в пацієнтів із діабетичною нейропатією не є обов’язковим навіть під час великих операцій. Як і хворим без нейропатії, пацієнтам із ДАН дозволено вживати тверду їжу не пізніше ніж за 6 год і пити прозору рідину не пізніше ніж за 2 год до анестезії.
Лікування
Вищезазначені принципи лікування та профілактики діабетичної сенсомоторної нейропатії так само відносяться і до ДАН (табл. 3). У пацієнтів із ДКАН слід уникати призначення бета-блокаторів із внутрішньою симпатоміметичною активністю (наприклад, піндололу) та трициклічних антидепресантів (амітриптилін, іміпрамін) через їхній несприятливий влив на ВСР і підвищений ризик серцевих аритмій.
Гастроінтестинальні розлади слід лікувати симптоматично за тими самими стандартами, що й у пацієнтів без діабету, однак варто зважати на специфічні ризики й протипоказання.
Пацієнтам із діабетичною гастропатією з прискореним спорожненням шлунка рекомендовано дотримуватися дієти: вживати їжу часто невеликими порціями, зменшити вживання жирів і клітковини. Крім того, корисно ретельно пережовувати їжу та залишатися у вертикальному положенні принаймні 30 хв після їди.
Лікування дисфункції сечового міхура (діабетичної цистопатії) має бути спрямованим на суб’єктивні скарги пацієнтів. Деякі наслідки діабетичної цистопатії (приміром, залишкова сеча з подальшим ураженням верхніх сечових шляхів) можуть прогресувати за незначних симптомів або за їхньої відсутності, тому запорукою раннього виявлення та лікування цих наслідків є детальний і прицільний анамнез. Як початкові заходи можна застосовувати тренування поведінки, як-от «сечовипускання за розкладом» або «подвійне сечовипускання» (два сечовипускання за короткий період часу), що може покращити функцію сечового міхура без фармакотерапії чи хірургічних втручань. У пацієнтів із ЦД, які мають нестабільний метаболічний стан або виражені ускладнення діабету, інфекції сечових шляхів вважають ускладненими, тому антибіотикотерапія має тривати принаймні 7 днів.
Від редакції
Діабетична нейропатія – часте ускладнення ЦД, пов’язане зі стійкою непрацездатністю, суттєвим погіршенням якості життя та підвищеною смертністю. На жаль, у пацієнтів із ЦД 2 типу, які становлять більшість хворих на діабет, навіть суворий глікемічний контроль не здатен запобігти розвитку нейропатії.
Більшість препаратів, котрі застосовуються для лікування больової діабетичної нейропатії, чинять лише симптоматичний ефект. Єдиним препаратом із патогенетичним впливом серед рекомендованих DDG засобів першої лінії є тіоктова кислота.
Рандомізовані плацебо-контрольовані дослідження та метааналізи свідчать, що тіоктова кислота ефективно полегшує біль, парестезію й інші симптоми діабетичної нейропатії (Ziegler et al., 2021). У пацієнтів із ДКАН лікування тіоктовою кислотою покращувало ВСР і зменшувало симптоми (Ziegler et al., 1997; Sol Jae Lee et al., 2017). У пацієнтів із безсимптомною ДСПН відзначали зменшення нейропатичного дефіциту після 4 років лікування; це вказує на здатність тіоктової кислоти змінювати природний перебіг діабетичної нейропатії (Ziegler et al., 2011).
За рекомендацією DDG, перевагу мають засоби з найнижчою органною токсичністю та найнижчим ризиком кардіоваскулярних і ниркових ускладнень. До таких засобів належить тіоктова кислота – її виключно сприятливий профіль безпеки підтверджений результатами 4-річного дослідження NATHAN1, а також післямаркетинговими спостереженнями.
Тіоктова кислота німецької якості є активною речовиною препарату Берлітіон®, представленого на фармацевтичному ринку компанією «Берлін-Хемі/А.Менаріні Україна ГмбХ». Берлітіон® випускається у вигляді двох лікарських форм: концентрати 300 ОД та 600 ОД для розчину інфузій та капсули. При виражених симптомах діабетичною полінейропатії доцільне внутрішньовенне введення препарату в дозі від 12 мл (1 ампула 300 ОД) до 24 мл (2 ампули 300 ОД або 1 ампула 600 ОД) на добу; таку терапію можна проводити в стаціонарі або денній амбулаторії. Для подальшого лікування застосовують пероральну форму в дозі 600 мг на добу, яку зручно приймати вдома.
Ziegler D., Keller J., Maier C., Pannek J. Diabetic Neuropathy. Exp Clin Endocrinol Diabetes. 2021 Aug;129(S 01):S70-S81.
Переклав з англ. Олексій Терещенко

Медична газета «Здоров’я України 21 сторіччя» № 10 (546), 2023 р.