25 лютого, 2021
Антиоксидантний захист щитоподібної залози – запорука здоров’я всього тіла
Щитоподібна залоза (ЩЗ) – унікальний ендокринний орган, який впливає на кожну клітину організму. Тиреоїдні гормони підтримують нормальну роботу травної, кардіоваскулярної, нервової, кістково-м’язової, репродуктивної та імунної систем, а в разі зміни рівнів можуть порушувати їх функціонування [1-5]. Особливістю ЩЗ є найвищий серед усіх внутрішніх органів уміст йоду та селену [6], а також високий рівень фізіологічних окислювальних реакцій і водночас висока сприйнятливість до окислювального пошкодження [7]. Зниження рівнів антиоксидантів й окислювальний стрес, які погіршуються за дефіциту селену, можуть пошкоджувати тканину ЩЗ із подальшою появою клінічного гіпер- або гіпотиреозу, розвитком супутніх захворювань і погіршенням якості життя [8-11].
Як окислювальний стрес пошкоджує ЩЗ?
Окислювальні реакції відбуваються в усіх органах і тканинах, але в ЩЗ вони є необхідними для синтезу гормонів [12]. Установлено, що в ЩЗ фізіологічно утворюється величезна кількість активних форм кисню (АФК), особливо перекису водню (H2O2); це пояснює вислів про те, що ЩЗ є органом «окисної природи» [13, 14]. Крім H2O2, в синтезі гормонів ЩЗ беруть участь також інші вільні радикали та реакційно активні речовини, утворені із залишків йоду чи тирозину [15, 16]. У фізіологічних умовах існує баланс між утворенням і детоксикацією вільних радикалів. Для підтримання цього балансу ЩЗ еволюційно виробила ефективні захисні механізми, що включають антиоксидантні молекули та процес компартменталізації потенційно токсичних молекул [17]. Однак за окислювального стресу, спричиненого екзогенними чи ендогенними прооксидантами (іонізуючим випромінюванням, дефіцитом антиоксидантів тощо), відбувається підвищене пошкодження макромолекул ЩЗ, що може зумовити різні захворювання ЩЗ (включно з раком) [18-21].
Окислювальний стрес ЩЗ невід’ємно пов’язаний із запаленням цього органа. АФК й інші вільні радикали чинять прозапальний ефект на ЩЗ, а також, навпаки, запалення внаслідок зміни рівнів тиреоїдних гормонів і цитокінів зумовлює окислювальний стрес, порушує функцію ЩЗ і пригнічує гіпофізарно-тиреоїдну вісь [22, 23]. На тканинному рівні гіпотиреоз підсилює окислювальний стрес, що, своєю чергою, погіршує гіпотиреоз через інгібування дейодинази, тобто утворюється хибне коло (рис. 1) [24].
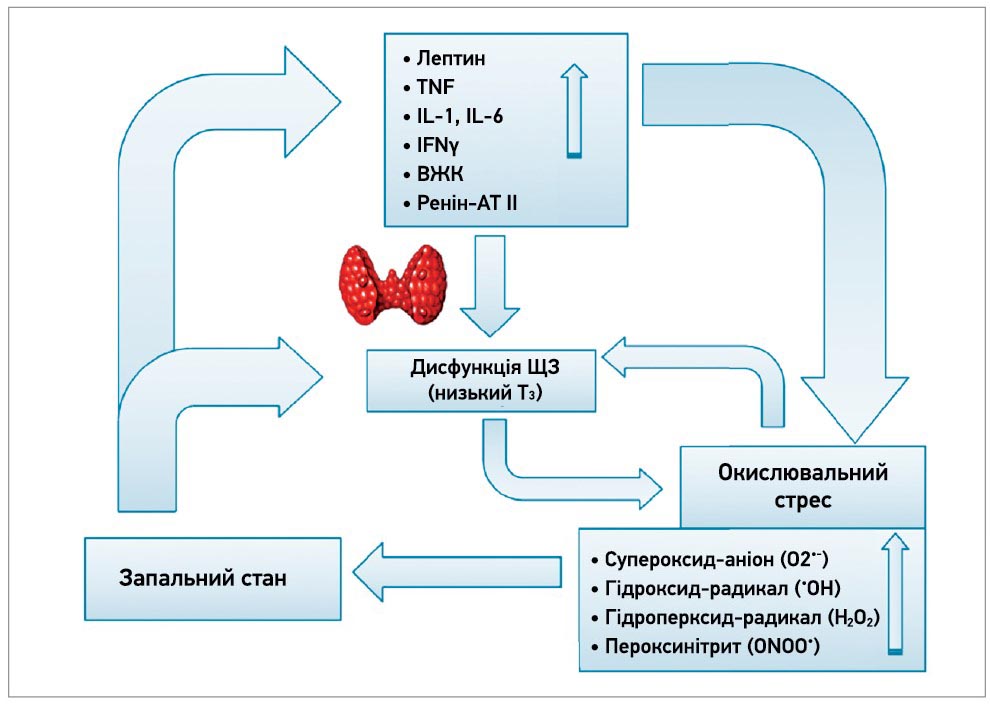 Рис. 1. Модель взаємозв’язку між окислювальним стресом, запаленням і порушенням функції ЩЗ
Рис. 1. Модель взаємозв’язку між окислювальним стресом, запаленням і порушенням функції ЩЗ
Примітки: АТ – ангіотензин; ВЖК – вільні жирні кислоти; IFN – інтерферон; IL – інтерлейкін; TNF – фактор некрозу пухлини.
Дефіцит селену
Окремим фактором окислювального стресу ЩЗ є дефіцит селену (Se) [25-27]. Cеленопротеїни мають вирішальне значення для антиоксидантного захисту ЩЗ, синтезу тиреоїдних гормонів і глобальної цілісності тироцитів, оскільки вони присутні в антиоксидантних ферментах, як-от глутатіонпероксидаза, тіоредоксинредуктаза й дейодиназа. За експериментального виснаження селенопротеїнів у ЩЗ очікувано з’являлося підвищене окислювальне пошкодження мембранних ліпідів, білків і ДНК [28].
Головна причина селенодефіцитних станів – недостатнє надходження цього мікроелемента з їжею через його низький уміст у ґрунті сільськогосподарських угідь [29]. Слід зазначити, що проблема дефіциту селену (як і йоду) характерна для всіх територій нашої планети, віддалених від Світового океану, що пов’язано з вимиванням цих мікроелементів із верхніх шарів ґрунту під час танення льодовиків [30]. Установлено, що в деяких регіонах із тяжким йододефіцитом супутній дефіцит Se підвищує тяжкість гіпотиреозу та спричиняє мікседематозний кретинізм [31, 32]. Водночас показано, що адекватне забезпечення Se захищає ЩЗ від пошкодження на тлі надлишку призначеного йоду в умовах співіснування обох дефіцитів [33, 34].
В Україні недостатнє забезпечення Se зареєстровано практично в усіх регіонах, але найвираженіший дефіцит спостерігають у Волинській, Сумській, Харківській і Київській областях [29, 35]. З огляду на це особливої актуальності набуває проблема забруднення довкілля. Зокрема, доведено, що підвищений вплив деяких токсикантів (свинець, кадмій, ртуть, миш’як, алюміній) спричиняє дефіцит Se через порушення його всмоктування (зокрема, в ланцюгу живлення ґрунт – рослина – тварина) [36]. Останнім часом дефіцит цього мікроелемента пов’язують також зі зміною структури харчування українців, меншим споживанням м’яса, риби й інших морських продуктів, які разом із зерновими є основним джерелом Se [37]. При цьому внаслідок технологічної переробки продуктів дефіцит Se в них посилюється [38].
Дефіцит антиоксидантних вітамінів
Доведено, що за більшості хвороб ЩЗ спостерігають низькі рівні антиоксидантних вітамінів А, С, Е [39].
Вітамін А є потужним антиоксидантом і діє як поглинач вільних радикалів (самостійно, а також у складі великої ферментної системи). Дефіцит вітаміну А чинить негативний вплив на функцію ЩЗ, зокрема може спричиняти розвиток гіпертиреозу – гіперметаболічного стану, що супроводжується збільшенням загального споживання кисню, утворенню АФК, а також інших вільних радикалів [40, 41].
Знижений рівень вітаміну Е при захворюваннях ЩЗ зумовлений його використанням для запобігання пошкодженню вільними радикалами, вираженому в пацієнтів із дисфункцією ЩЗ [42]. Також установлено, що вітамін Е діє як поглинач АФК при дисфункції фолікулярних клітин ЩЗ [43]. Інші дослідження продемонстрували, що АФК пригнічують активність ферменту, відповідального за перетворення Т4 на активний гормон Т3, і що достатній рівень вітаміну Е може пом’якшити цей ефект [44, 45].
Вітамін С – потужний природний антиоксидант, здатний знешкоджувати АФК шляхом їх відновлення до стабільніших сполук [46]. За окислювального стресу (особливо при гіпертиреозі) вітамін С надмірно окислюється та втрачає свої антиоксидантні властивості [40].
Синдром низького Т3
Сьогодні дедалі більшу увагу науковців привертає т. зв. еутиреоїдний хворобливий синдром, або синдром низького Т3 (СНТ3), – стан, який характеризується зниженою периферичною конверсією Т4 у Т3 за нормальної секреції тиреоїдних гормонів [24]. СНТ3 асоціюється з такими станами, як голодування, ожиріння, стресові розлади, синдром хронічної втоми, надмірні фізичні навантаження, депресія тощо [46-50]. СНТ3 також можуть зумовлювати певні лікарські засоби, зокрема кортикостероїди, естрогени, оральні контрацептиви, ацетилсаліцилова кислота тощо [51-53].
Згідно із сучасною концепцією, за своєю суттю СНТ3 є гіпотиреозом на тканинному рівні, спричиненим внутрішньоклітинним і системним окислювальним стресом (рис. 2).
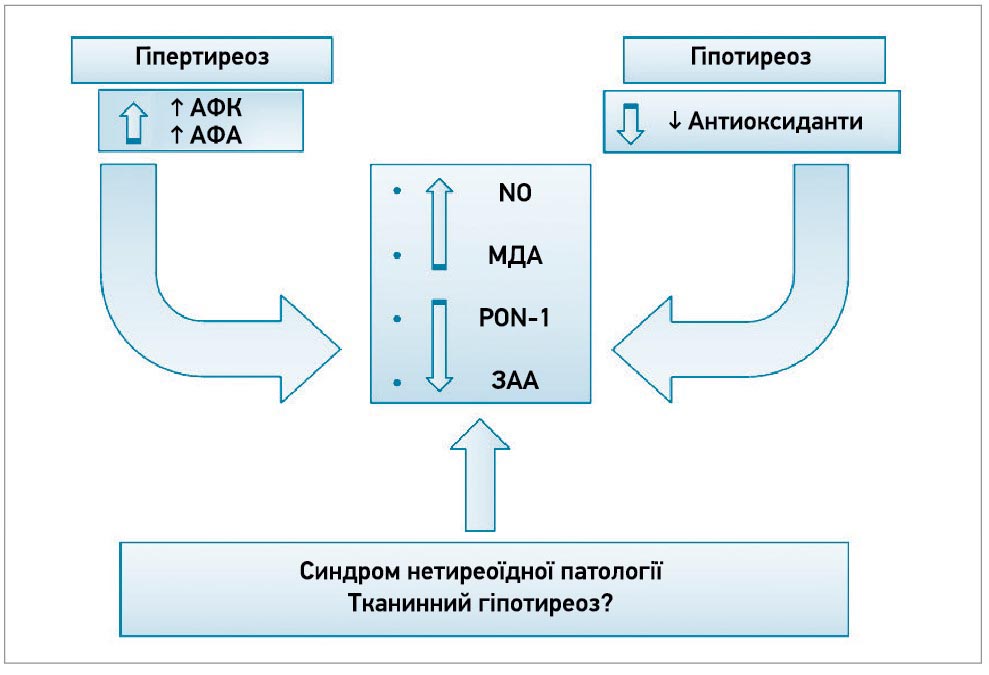 Рис. 2. Як гіпер-, так і гіпотиреоз можуть зумовлювати оксилювальний стрес із різними механізмами
Рис. 2. Як гіпер-, так і гіпотиреоз можуть зумовлювати оксилювальний стрес із різними механізмами
Примітки: АФК – активні форми кисню; АФА – активні форми азоту; NO – оксид азоту; МДА – малоновий діальдегід; PON‑1 – параоксоназа‑1; ЗАА – загальна антиоксидантна активність.
Оскільки тиреоїдні гормони підвищують продукцію АФК, при гострому окислювальному пошкодженні СНТ3 може бути адаптивним механізмом. Але якщо окислювальний стрес триває, СНТ3 швидко стає дезадаптивним і підтримує дисфункцію ЩЗ. На відміну від справжнього гіпотиреозу при СНТ3 замісна гормональна терапія зазвичай не потрібна, натомість доцільним є застосування вітамінно-мінеральних комплексів із Se [24].
Синергічна дія Se й антиоксидантних вітамінів
Завдяки визнанню ключової ролі окислювального стресу в патології ЩЗ останніми роками в тиреоїдології широко застосовують спеціальні дієтичні добавки – вітамінно-мінеральні комплекси, що містять Se, вітаміни-антиоксиданти (А, С, Е) й інші речовини, для захисту клітин ЩЗ, профілактики автоімунних порушень, гіпо- та гіпертиреозу, онкопатології ЩЗ [54]. Установлено, що за вираженого окислювального стресу Se-вмісні ферменти працюють на межі своїх можливостей; призначення Se не завжди забезпечує подальше підвищення їхньої активності. Водночас додавання до Se антиоксидантних вітамінів створює сприятливий «клімат» на рівні ферментів і в цей спосіб потенціює дію Se [55]. Крім того, вітамін Е разом із Se-вмісним ферментом глутатіонпероксидазою підтримує цілісність клітинних мембран і бере участь у відновлювальних реакціях із глутатіоном [56].
У нещодавньому дослідженні також було продемонстровано, що комбінація лікопіну (каротиноїд томатів), вітаміну Е, вітаміну С та β-каротину (провітаміну А) має антиоксидантні властивості, котрі перевищують такі арифметичної суми окремих компонентів, тобто досягається виражений синергічний ефект [57].
Додаткові джерела Se – органічні чи неорганічні?
У природі та живих організмах Se присутній в органічній і неорганічний формах; його головними органічними формами є селенометіонін і селеноцистеїн [58]. Неорганічні форми представлені селенітом, селенідом, селенатом і елементарним Se.
Серед харчових продуктів найбільше Se містять бразильські горіхи (6-8 горіхів = 989% добової норми), морепродукти (тунець, сардина, устриці), м’ясні субпродукти та яйця; менша кількість Se також присутня в інших горіхах, м’ясі (свинина, яловичина, курятина), цільнозернових і молочних продуктах, бобових [59-63]. Питна вода не є значущим джерелом Se в більшості регіонів світу [64, 65].
У західних країнах дуже популярними є дієтичні добавки із Se; наприклад, у США їх уживають 18-19% дорослих і дітей [66]. Ці добавки можуть містити органічний Se (часто у формі селенометіоніну чи збагачених Se дріжджів) або неорганічні солі Se – селенат або селеніт натрію. Вважають, що органічні форми Se всмоктуються краще, ніж неорганічні, проте наукові дані щодо порівняльної біодоступності різних форм Se в людини досить обмежені [67]. За даними Ради з питань продовольства та харчування Інституту медицини США (FNB), біодоступність селенометіоніну становить >90%, селеніту натрію – >50%, селенату натрію – близько 100% [68]. Водночас селенометіонін і селеніт натрію більшою мірою утримуються в організмі, а селенат натрію легше виводиться із сечею.
Se є мікроелементом із вузьким «терапевтичним вікном», що може нести як користь (за вживання в адекватних кількостях), так і шкоду (в разі перевищення дози чи накопичення в організмі) [69]. З огляду на це органічні форми Se можуть бути менш безпечними через ризик кумуляції. Ще однією проблемою є те, що зазвичай джерело селенометіоніну в дієтичних добавках – дріжджі, котрі вирощують у збагаченому Se середовищі [70]. У нещодавньому дослідженні в селенових дріжджах, окрім селенометіоніну, було виявлено додатково понад 60 різних Se-вмісних сполук, зокрема >20 метаболітів, про котрі раніше не повідомлялося [71]. Невідомо, які біологічні ефекти матимуть ці сполуки при вживанні людиною. Крім того, характер накопичення Se в різних штамах дріжджів дуже різний, тому продукти на їхній основі можуть значно відрізнятися за низкою параметрів, як-от термін зберігання, біодоступність і токсичність, і їх практично неможливо стандартизувати [70]. Загалом регуляторні органи, зокрема FNB [72] та EFSA (Європейський Союз) [73], у рекомендаціях щодо вживання Se не зазначають переваг певної форми, але з огляду на вищенаведені дані неорганічні форми (особливо селенат натрію) можна вважати безпечнішими. Між іншим, дитячі молочні суміші в більшості країн містять саме неорганічні форми Se [74].
Оксилік – антиоксидантна формула для захисту ЩЗ і всього організму
Дієтична добавка Оксилік – унікальний продукт німецької компанії Woerwag Pharma, спеціально розроблений для захисту клітин організму від окислювального стресу [75]. Оксилік містить Se (у формі селенату натрію), посилений іншими потужними антиоксидантами – вітамінами А, С, Е й лікопіном, завдяки чому захищає від окислювального стресу ЩЗ, підтримує природну захисну систему та сприяє здоров’ю всього тіла.
Дози компонентів Оксиліку підібрані для максимальної безпеки й за умови застосування відповідно до інструкції є значно нижчими від верхньої межі безпечного добового вживання (табл.). Форма Se (селенат натрію) характеризується високою біодоступністю й низьким ризиком кумуляції, а стандартизована доза цього мінералу (50 мкг, 71-91% від добової потреби) підібрана так, щоби забезпечувати організм Se з урахуванням Se, що надходить з їжею. Підвищені дози вітамінів С та Е узгоджуються з даними досліджень [76-79], у яких було продемонстровано позитивний вплив таких доз на функцію ЩЗ, і при цьому є цілком безпечними. Формула Оксиліку посилена лікопіном – найпотужнішим серед відомих каротиноїдів антиоксидантом із нейропротекторними, протипухлинними, протизапальними, гіпохолестеринемічними та прокогнітивними властивостями [80].
Оксилік рекомендовано вживати дорослим по 1 капсулі 1 р/добу під час прийому їжі, тривалість курсу становить 1-3 міс або за порадою лікаря.
Список літератури знаходиться в редакції.
Підготував Олексій Терещенко
Медична газета «Здоров’я України 21 сторіччя» № 2 (495), 2021 р.




