8 липня, 2022
Перехрест біліарної рефлюксної гастропатії та функціональної диспепсії: клініко-ендоскопічні особливості та підходи до лікування
 Згідно із сучасним уявленням, диспепсія – це будь-який серединний епігастральний біль / печіння / дискомфорт, відчуття переповнення після вживання їжі / раннього насичення / відрижки, а також печія, нудота/блювання, здуття в епігастрії, що свідчать про залучення верхніх відділів шлунково-кишкового тракту та тривають не менше 4 тиж [1]. Диспепсію слід трактувати двома способами – і як синдром (вторинна диспепсія внаслідок основного захворювання), і як самостійну нозологічну форму (функціональна диспепсія, ФД) [2]. Систематичні огляди свідчать, що симптоми диспепсії в усьому світі мають ≈20-25% населення; в різних країнах вони є причиною до 10% усіх звернень по медичну допомогу [3, 4].
Згідно із сучасним уявленням, диспепсія – це будь-який серединний епігастральний біль / печіння / дискомфорт, відчуття переповнення після вживання їжі / раннього насичення / відрижки, а також печія, нудота/блювання, здуття в епігастрії, що свідчать про залучення верхніх відділів шлунково-кишкового тракту та тривають не менше 4 тиж [1]. Диспепсію слід трактувати двома способами – і як синдром (вторинна диспепсія внаслідок основного захворювання), і як самостійну нозологічну форму (функціональна диспепсія, ФД) [2]. Систематичні огляди свідчать, що симптоми диспепсії в усьому світі мають ≈20-25% населення; в різних країнах вони є причиною до 10% усіх звернень по медичну допомогу [3, 4].
У ≈60-70% пацієнтів із диспепсією будь-яких структурних змін з боку гастродуоденальної зони при езофагогастродуоденоскопії (ЕГДС) немає; такі хворі розглядаються як пацієнти із ФД, що діагностується в них із наявністю ≥1 таких симптомів: відчуття переповнення після прийому їжі, швидка насичуваність, епігастральний біль або епігастральне печіння, котрі неможливо пояснити стандартними клінічними обстеженнями [5]. Згідно з Римськими критеріями IV, виокремлюють 2 основні субтипи ФД – епігастральний больовий синдром (ФД-ЕБС) і постпрандіальний дистрес-синдром (ФД-ПДС) [6]. ФД зустрічається в ≈7-12% усього населення розвинених країн, причому значно частіше хворіють особи молодого та середнього віку [1, 2, 5].
Етіологія ФД точно невідома. Як імовірні фактори ризику ФД розглядають зв’язок із перенесеними гострими гастроінтестинальними інфекціями (постінфекційна ФД), інфекцію H. pylori, алергію, генетичну схильність (поліморфізм гена GNB3), а як патофізіологічні фактори – дисмоторні розлади (сповільнення випорожнення, порушення акомодації шлунка), вісцеральну гіперчутливість до розтягнення шлунка чи дванадцятипалої кишки (ДПК), гіперчутливість ДПК до кислоти та ліпідів, низькоінтенсивне запалення й імунну активацію слизової оболонки, дуоденальну еозинофілію, психосоціальні розлади [5, 6].
Вагому роль у появі симптомів диспепсії мають різні шлункові іританти, потенційно здатні подразнювати слизову шлунка; вони містять солі жовчних кислот, суміш лужного панкреатичного та дуоденального секрету, лізолецитин, а також є наслідком прийому нестероїдних протизапальних препаратів (НПЗП) або інших гастротоксичних ліків. Усі ці агенти в разі потрапляння до шлунка, в т. ч. унаслідок ретроградного закидання жовчі (т. зв. дуоденогастрального рефлюксу, ДГР), можуть спричинити хімічне ушкодження слизової оболонки, що зумовлює затримку проксимального відтоку жовчі та розвиток реактивної чи хімічної гастропатії [7-9]. Така гастропатія тривалий час вважалася проблемою, що з’являлася після операцій на шлунку, особливо після гастректомії за Більротом II або після холецистектомії, адже після видалення жовчного міхура можуть з’являтися нерегульовані та посилені надходження жовчі до ДПК і ретроградно – до шлунка [10-12]. Однак, чи спричиняє ДГР симптоми диспепсії у пацієнта з нормальним неоперованим шлунком і збереженим жовчним міхуром, досі незрозуміло, а повідомлення в науковій літературі щодо цього питання є суперечливими. Крім того, точна причина ДГР і його зв’язок із симптомами є не зовсім зрозумілими [13].
Мета дослідження – вивчення частоти ДГР і його впливу на симптоми ФД на основі оцінки демографічних, клініко-ендоскопічних, патогістологічних даних та встановлення можливостей терапії.
Матеріали та методи
Було проведено ретроспективний когортний аналіз пацієнтів із різними субтипами ФД, що відповідали Римським критеріям IV її діагностики [6]. Всім хворим проводилася ЕГДС із біопсією, під час якої оцінювали ендоскопічні ознаки гастропатії, у т. ч. еритему, набряк, ерозії чи виразки. Окремо документувалася наявність ДГР жовчі та рефлюксної біліарної гастропатії (БГ), що визначалося як еритема слизової оболонки з гастритом, ерозіями або без них, поряд з наявністю жовчі в просвіті шлунка під час ендоскопії. До дослідження не залучали пацієнтів, котрі мали операцію на шлунку, якщо в анамнезі були наявні нелікована інфекція H. pylori, зловживання алкоголем, а також вагітних чи осіб, що мали тяжкі супутні захворювання, як-от хронічна ниркова недостатність, хронічне обструктивне захворювання легень, хронічна серцева недостатність, або перенесені інсульти. Всі ендоскопії виконував один досвідчений ендоскопіст, щоб унеможливити будь-які варіації в інтерпретації, вибірці чи документації. Зразки біопсії були взяті з антрального відділу та тіла шлунка й відправлені на гістопатологічне обстеження із фарбуванням гематоксиліном і еозином.
Усіх пацієнтів за результатами ЕГДС із гістопатологією було розподілено на 3 групи: група хворих із ДГР (45 хворих) і гістопатологічно ідентифікованою БГ; когорта хворих без ДГР (51 хворий), але з гістопатологічно ідентифікованою небіліарною гастропатією (НБГ); когорта хворих без гастропатії (НГ), що характеризувалася нормальною слизовою оболонкою шлунка без ДГР (35 пацієнтів).
Оцінка шлунково-кишкових симптомів проводилася за допомогою заповнення валідизованої анкети симптомів, що було частиною рутинного клінічного обстеження. В анкетах пацієнти оцінювали частоту, інтенсивність та тривалість 9 поширених шлунково-кишкових симптомів, як-от біль у животі, нудота та відчуття переповнення тощо, за шкалою Лікерта (від 0 до 3 балів кожний). Бали компонентів були підсумовані, щоб отримати загальний бал із максимально можливим діапазоном від 0 до 9. При загальній кількості балів <3 симптоми трактувалися як легкі, при 3-6 балах – вважалися помірними, а за кількості балів ≥7 – серйозними.
У 22 пацієнтів із БГ і 25 хворих із НБГ проводили визначення швидкості випорожнення шлунка за допомогою 13С-октаноєвого дихального тесту на аналізаторі стабільних ізотопів IRIS (Wagner, Німеччина). При дихальному тесті 13С-октаноєва кислота (100 мг), розчинена в яєчні, евакуюючись зі шлунка, потрапляє до тонкої кишки, де абсорбується і метаболізується з виділенням 13СО2, рівень якого надалі реєструється інфрачервоним аналізатором стабільних ізотопів. Цей тест дає можливість кількісного визначення швидкості випорожнення шлунка, при цьому відсутнє променеве навантаження; його можна проводити дітям, вагітним, післяопераційним хворим; дані легко відтворюються, тест може проводитися багаторазово. В нашому дослідженні методом інфрачервоної спектрометрії протягом 4 год у 9 дихальних пробах (через кожні 30 хв) визначали концентрацію 13СО2, на основі чого розраховували час напіввиведення субстрату зі шлунка та коефіцієнт випорожнення (як нормальні показники вважали час напіввиведення <75 хв і коефіцієнт випорожнення >3,1).
Окрім того, вивчено ефективність різних методів первинного емпіричного лікування хворих на ФД. Ретроспективний аналіз продемонстрував, що 67 пацієнтів (підгрупа 1; 51,1%) щодо диспепсичних симптомів приймали інгібітори протонної помпи (ІПП) (Омез 20 мг 1 р/добу протягом 2 тиж), 30 хворих (підгрупа 2; 22,9%) – прокінетики (домперидон 10 мг 3 р/добу протягом 2 тиж), 36 осіб (підгрупа 3; 26%) – фіксовану комбінацію омепразол 20 мг + домперидон 30 мг (Омез ДСР у капсулах 1 р/день протягом 2 тиж). Безпосередню ефективність лікування оцінювали через 2 тиж за динамікою показників шкали SAGIS (Structured Assessment of Gastrointestinal Symptom), яка оцінює 5 груп гастроінтестинальних симптомів, як-от біль у животі / дискомфорт (7 пунктів), рефлюксні симптоми / симптоми регургітації (4 пункти), нудоту/блювання (3 пункти), діарею/нетримання (5 пунктів), утруднене випорожнення і закреп (2 пункти). Оцінювали також переносимість лікування та частоту побічних явищ.
Для аналізу результатів дослідження використовувалися методи варіаційної статистики з розрахунком частотних характеристик досліджуваних показників, середніх величин (середньої арифметичної та середньої помилки відповідного показника) й оцінки їхньої варіабельності. Статистичну обробку всіх зазначених параметрів проводили за допомогою пакету статистичних програм Statistica 7.0.
Результати
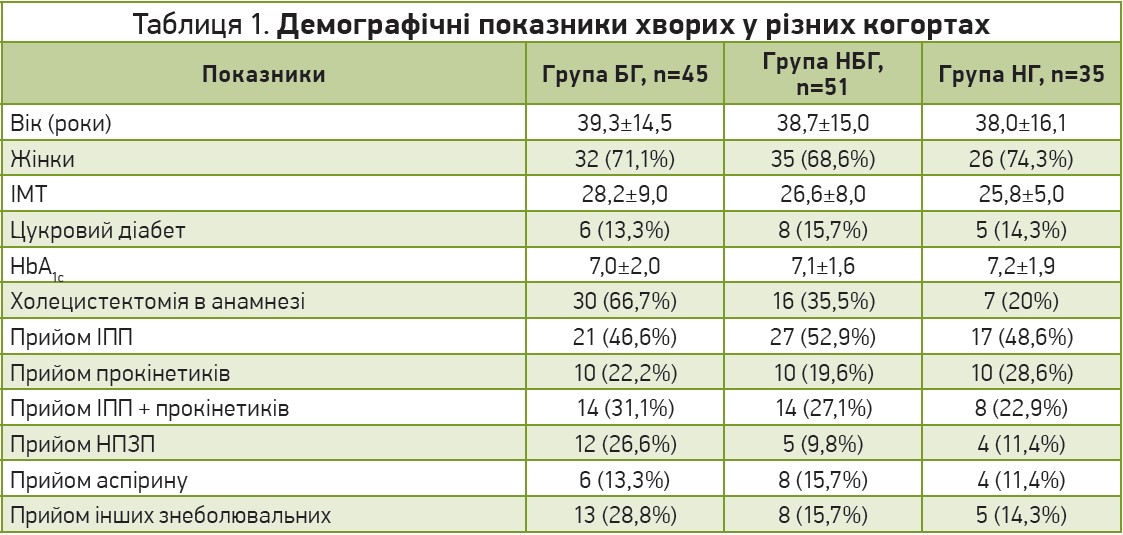
Усього до випробування було залучено 131 пацієнта із ФД. Діагноз ФД та її субтипів установлювали на основі клініко-анамнестичного обстеження згідно з Римськими критеріями ІV [6]. Пацієнти були переважно жіночої статі (92 особи; 70,25%), середнього віку (38,6 року) та мали надмірну масу тіла (середній індекс маси тіла (ІМТ) складав 27,4 кг/м2). Серед тяжких (≥7 балів за шкалою Лікерта) шлунково-кишкових симптомів найчастіше повідомлялося про здуття живота (80 хворих; 61,1%), відчуття переповнення (71 хворий; 54,2%) та біль у животі (68 осіб; 51,9%). Отже, демографічні дані в 3 когортах були схожими (табл. 1). Більшість пацієнтів отримували лікування ІПП (65 хворих; 49,6%) або комбінацією ІПП і прокінетиків (36 осіб; 27,5%). Окрім того, 21 хворий (15,2%) приймав НПЗП, а 26 пацієнтів (19,8%) – інші знеболювальні. В групі хворих із БГ відсоток осіб, котрі додатково приймали НПЗП або інші знеболювальні, був достовірно вищим.
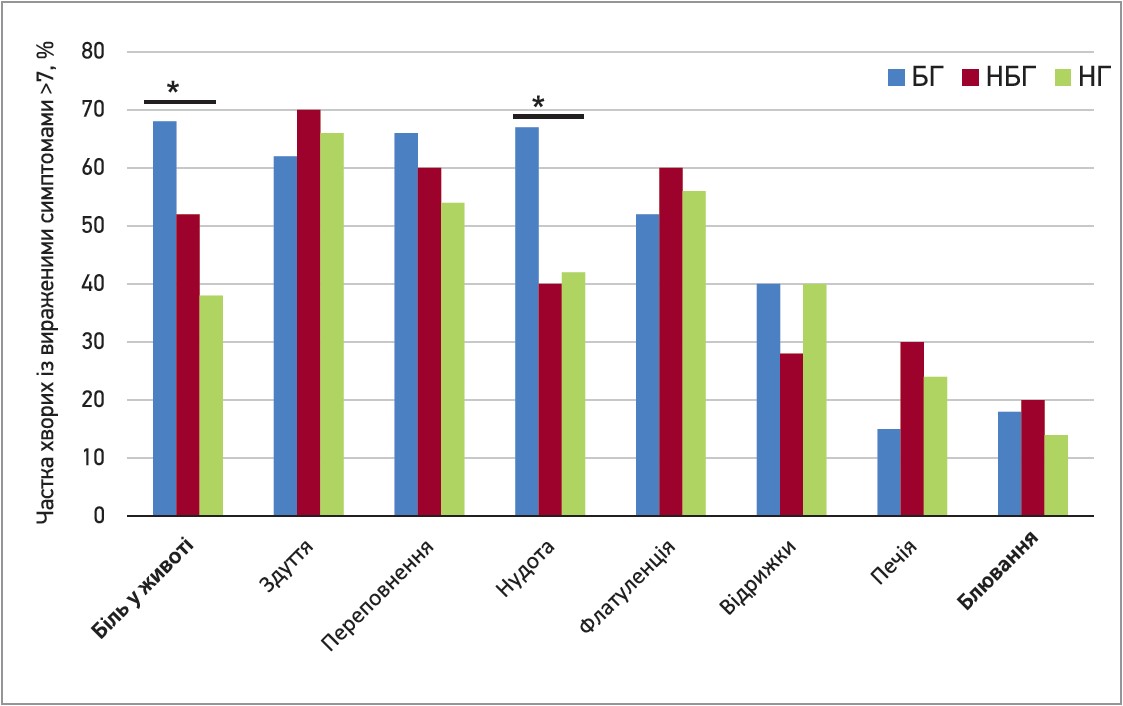
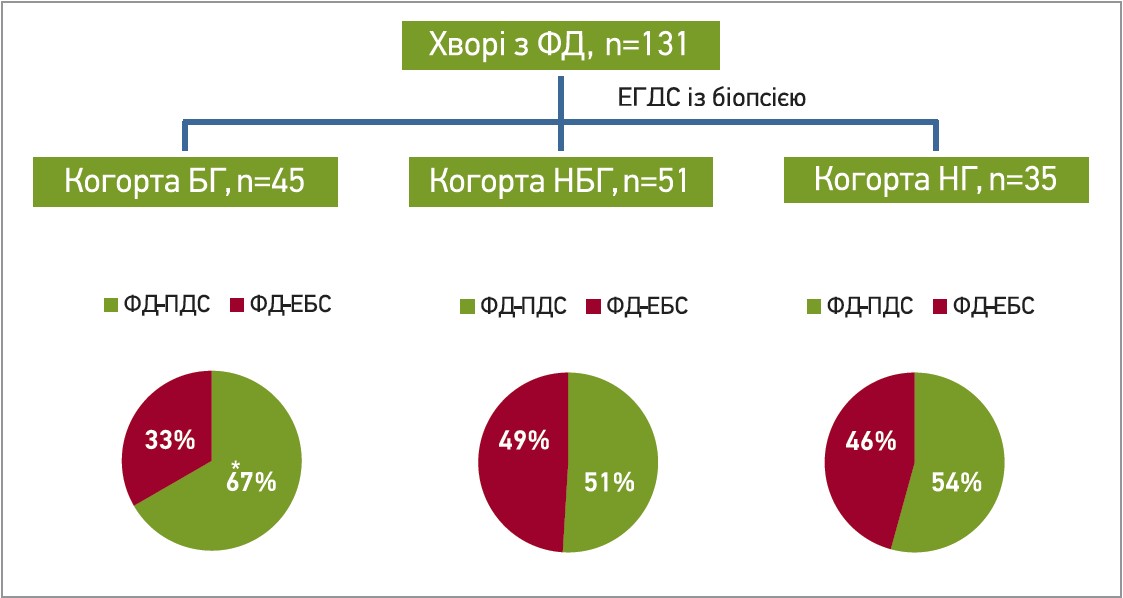
Окрім того, пацієнти із БГ мали в анамнезі значно більшу частоту холецистектомії (30 хворих; 66,7%), ніж пацієнти в групах НБГ (16 осіб; 35,5%) або НГ (7 хворих; 20%) відповідно. Водночас пацієнти із БГ повідомляли про значно вираженіші (>7 балів) біль у животі та нудоту, ніж пацієнти із групи НБГ або НГ (p<0,05; рис. 1). Тяжкість інших симптомів, як-от здуття живота, відчуття переповнення тощо, між групами достовірно не відрізнялася. Слід зауважити, що частота 2 субтипів ФД у різних когортах хворих ФД також була різною. Так, серед хворих із БГ частота ФД-ПДС була достовірно вищою, ніж частота ФД-ЕБС (67 проти 33%; p<0,05). В інших когортах хворих ФД достовірної різниці не було (рис. 2).
Рис. 1. Пропорція пацієнтів із ФД із вираженими (>7 балів) гастроінтестинальними симптомами
Примітка: * p<0,05.
Рис. 2. Частота субтипів ФД у різних когортах хворих
Примітка: * p<0,05..
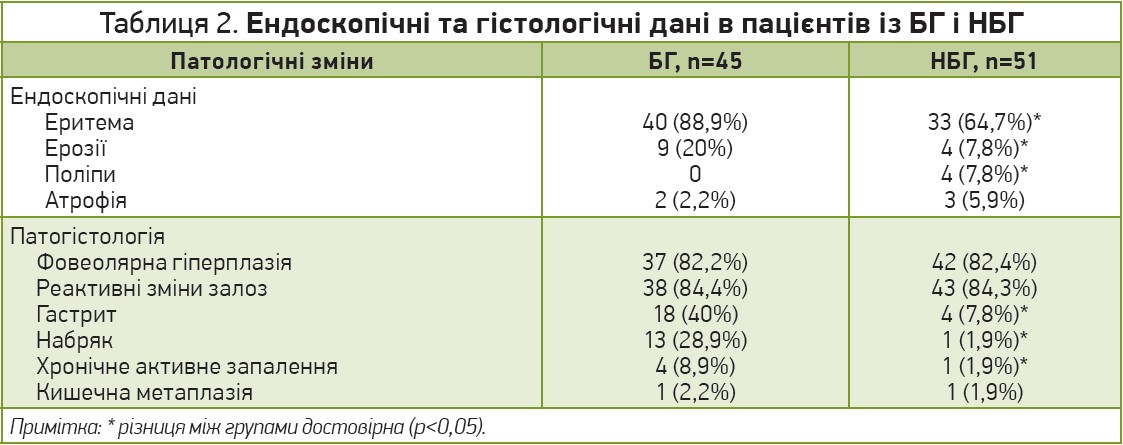
При узагальненні ендоскопічних даних для когорт БГ і НБГ було виявлено, що пацієнти із БГ мали значно більшу поширеність еритеми (88,9 проти 64,7%; p<0,001) та поверхневих ерозій (20 проти 7,8%; обидва p<0,05) порівняно із хворими із НБГ. Навпаки, в пацієнтів із НБГ була значно більшою поширеність поліпів шлунка (7,8 проти 0,0%). Локалізація гастропатії між групами достовірно не відрізнялася, хоча частіше зустрічалася переважно в антральному відділі та рідше – в тілі чи на дні шлунка. Результати гістопатології корелювали з даними ендоскопії, демонструючи, як і очікувалося, відсутність змін слизової оболонки в 95% хворих із НГ. Гастропатія була пов’язана з помітним збільшенням частоти фовеолярної гіперплазії (БГ – 82,2%, НБГ – 82,4%), а також із реактивними змінами з боку залоз (БГ – 84,4%, НБГ – 82,6%) (табл. 2). Однак у групі БГ (порівняно із НБГ) спостерігалося різке збільшення поширеності ознак гастриту (40 проти 7,8%), набряку (28,9 проти 0,8%) та хронічного активного запалення (7,8 проти 1,7%), а це надає змогу припустити, що ДГР пов’язаний з вираженішими змінами з боку слизової оболонки шлунка. Крім того, при аналізі даних гістопатології у групах із проведеною холецистектомією в анамнезі та без неї було виявлено, що в групі хворих після холецистектомії значно частіше зустрічалися еритема (83,3 проти 60,9%; p<0,05), гастрит (33,3 проти 5,2%; p<0,05), набряк слизової (30 проти 0,0%; p<0,05) та хронічне активне запалення (16,7 проти 4,3%; p<0,05).
Вивчення швидкості випорожнення шлунка за допомогою 13С-октаноєвого тесту продемонструвало, що в групі хворих із БГ вона була повільнішою, ніж у групі НБГ, про що свідчили збільшений час напіввиведення (101,1±10,8 проти 75,1±8,1 хв; p<0,05) та зменшення коефіцієнта випорожнення (2,8±0,2 проти 3,3±0,3; p<0,05). Отже, в когорті пацієнтів із БГ достовірно частіше спостерігали наявність ФД-ПДС і помірне уповільнення швидкості випорожнення шлунка.
Під час аналізу ефективності різних методів лікування виявилося, що через 2 тиж воно було ефективним у 35 хворих підгрупи 1 (54,8%), 12 осіб підгрупи 2 (40%), а також у 25 пацієнтів підгрупи 3 (69,4%; р<0,01 порівняно з підгрупами 1 і 2). Отже, ефективність комбінації ІПП + прокінетик (препарат Омез ДСР) була значно вищою, ніж застосування монотерапії ІПП або домперідоном, при цьому будь-яких значимих побічних ефектів зафіксовано не було. Слід також зазначити, що комбінація ІПП + прокінетик (препарат Омез ДСР) була найефективнішою саме в когорті БГ, де полегшення симптоматики спостерігалося в 11 із 14 хворих (78,6%), тоді як ефективність у когортах НБГ і НГ була достовірно нижчою (64,3; 62,5% відповідно; р<0,01).
Обговорення
ФД – гетерогенний полісимптоматичний функціональний розлад невідомої етіології, який досить складно піддається лікуванню. До сьогодні немає схвалених Управлінням з контролю за якістю продуктів харчування та лікарських засобів (FDA) методів лікування ФД, а емпірична терапія ефективна лише в частки таких пацієнтів. Нашою метою було з’ясувати, чи відіграє роль ДГР жовчі в патогенезі симптомів у пацієнтів із ФД; якщо так, то необхідно вивчити вплив фенотипових і клінічних факторів. У добре охарактеризованій популяції виявлено, що ДГР жовчі суттєво сприяв появі симптомів у більшості пацієнтів із ФД. Окрім того, ми виявили, що холецистектомія була значним сприятливим фактором ризику розвитку рефлюксу жовчі до шлунка та була пов’язана із серйознішими диспепсичними симптомами. Ці дані не лише підтверджують, а й розширюють попередні знання та свідчать про те, що холецистектомія значно збільшує ризик ДГР і спричиняє серйозніші симптоми ФД [11-13].
Виявлено, що конкретні симптоми, як-от біль у животі, відчуття переповнення шлунка та нудота, після холецистектомії у пацієнтів із ФД і БГ не тільки зустрічалися частіше, а й були складнішими за інтенсивністю. Це спостереження зумовлює особливу тривогу з огляду на те що кількість холецистектомій збільшується; вони нерідко проводяться за сумнівними показаннями, як-от дискінезія жовчовивідних шляхів або нез’ясований біль у правому верхньому квадранті з низькою фракцією викиду жовчного міхура чи без неї [10]. Як зазначено в нашому дослідженні, після холецистектомії симптоми диспепсії (замість очікуваного полегшення), ймовірно, загострилися.
Появі та посиленню ДГР, за якого дуоденальний вміст потрапляє до шлунка та спричиняє хімічну гастропатію, можуть сприяти декілька факторів [14]. Установлено, що ДПК слугує як ємнісний і резистивний резервуар, а у випадку порушень моторики це зумовлює затримку вмісту жовчі в ДПК та можливе її ретроградне закидання до шлунка. Крім того, навіть сама інфузія жовчі до ДПК знижує моторику ДПК у здорових суб’єктів, що спричиняє застій дуоденального вмісту [15-17].
Незалежно від сприятливих факторів тривалі та надмірні закидання жовчі до шлунка можуть зумовити пряме хімічне ушкодження слизової оболонки, що спричиняє виснаження муцину, приплив іонів водню до ентероцитів і зниження трансепітеліальної резистентності. Ступінь і тривалість впливу жовчі, необхідні для розвитку гастропатії, ще не повністю зрозумілі, але за їхньої появи це може проявлятися як набряк і гіперемія слизової оболонки шлунка поряд із симптомами ФД. Ендоскопічно це може спочатку проявлятися як еритематозна гастропатія, що прогресує до помірно тяжкого гастриту, а в більш занедбаних випадках можуть спостерігатися поверхневі ерозії, про що свідчать наші дослідження та дані літератури [15-17]. Не виключено, що частіше виявлення поверхневих ерозій у групі БГ у нашому дослідженні було також пов’язано із частішим застосуванням НПЗП у цій групі хворих. Хоча ці ендоскопічні та гістопатологічні особливості, ймовірно, спричинені надлишковим впливом жовчі, більшість лікарів лікують пацієнтів за допомогою пригнічення кислотоутворення [2, 5]. Ретроспективний аналіз довів, що майже половина наших пацієнтів (49,6%) приймали кислотосупресивну терапію ІПП, але вона була ефективною через 2 тиж лише в 54,8% хворих. Водночас комбінація ІПП із прокінетиком (препарат Омез ДСР), що спостерігалася в 27,5% випадків, демонструвала значно більшу клінічну ефективність та сприяла значному полегшенню симптомів ФД у 70,6% хворих. Отже, в хворих із перехрестом БГ і ФД комбінацію ІПП та прокінетика слід вважати найдоцільнішою.
Клінічна картина в пацієнтів із БГ порівняно з іншими хворими із ФД була схожою, за винятком більшої інтенсивності епігастрального болю та нудоти. Однак на основі лише одних симптомів точно диференціювати БГ від ФД неможливо, тому важливим кроком у діагностиці є усвідомлення та розпізнавання ендоскопічних особливостей, що може передбачати присутність значної кількості жовчі в шлунку натще, а також підвищену поширеність еритеми слизової оболонки й гастриту за участю антрального відділу чи тіла шлунка з ерозіями або без них, особливо після аспірації шлункового вмісту [14-16]. Ендоскопічне та гістопатологічне підтвердження хімічної гастропатії, індукованої жовчю, є важливим не лише для виключення інших причин гастриту, а й для визначення таких станів, як інфекція H. pylori та фізіологічний жовчний рефлюкс, який досить часто з’являється через блювальні рухи під час верхньої ендоскопії. За даними різних досліджень, еритема слизової оболонки разом із хімічною гастропатією при ендоскопії з біопсією не є рідкістю та спостерігається в ≈15% усіх рутинних скринінгових ендоскопічних процедур [16]. У більшості випадків ця гастропатія може бути вторинною щодо H. pylori чи прийому НПЗП. Хімічна гастропатія, спричинена НПЗП, гістологічно від БГ не відрізняється і є явним обмеженням, котре може погіршувати діагностику БГ [8, 17]. Ще одне обмеження полягає у тому, що багато ендоскопістів можуть не звертати уваги на документування ДГР, хоча він легко діагностується при ендоскопії. Це автоматично може зумовлювати те, що клініцисти недооцінюватимуть роль ДГР у виникненні симптоматики, отже, не призначатимуть препарати, що можуть зменшувати негативний вплив патологічного ДГР (прокінетики, препарати урсодеоксихолевої кислоти тощо).
Попередні дослідження хворих із ФД продемонстрували, що в ≈⅓ пацієнтів спостерігається затримка випорожнення шлунка, що є характерним для такого її субтипу, як ФД-ПДС [2, 5]. Це знайшло підтвердження і в нашому дослідженні, коли ми за допомогою 13С-октаноєвого тесту довели, що БГ достовірно частіше спостерігалася в пацієнтів із ФД-ПДС і помірним уповільненням швидкості випорожнення шлунка. Однак відсутність значної затримки випорожнення шлунка в групі БГ дозволяє припустити, що первинне порушення випорожнення шлунка як провідний механізм є малоймовірним, а ключовий фактор цієї проблеми – саме надлишковий ДГР жовчі [18].
Отже, ДГР жовчі та БГ у пацієнтів із симптомами ФД – досить розповсюджене явище, особливо після перенесеної холецистектомії в анамнезі, яка, ймовірно, є значним фактором ризику розвитку ДГР і БГ. Ендоскопічне та патогістологічне підтвердження біліарної рефлюксної гастропатії, а також її клінічні особливості мають значення для частки хворих із ФД, особливо для субтипу ФД-ПДС. У лікуванні хворих із перехрестом БГ і ФД найдоцільніше використовувати комбінацію ІПП із прокінетиком (наприклад, препарат Омез ДСР), яка демонструє найкращі результати. З огляду на зростання кількості випадків проведення холецистектомії за незрозумілого болю в животі в разі відсутності патології жовчного міхура рекомендуємо приділяти більше уваги усвідомленню частої асоціації БГ і ФД, що може впливати на ефективність діагностики та лікування таких хворих.
Список літератури знаходиться в редакції.