2 травня, 2023
Вірусний гепатит С (продовження)
Клінічна настанова, заснована на доказах
Продовження. Початок у № 3(65)-4(66), 2022 р., с. 16.
Протипоказання до терапії
Протипоказань до лікування противірусними ЛЗ прямої дії небагато. Використання певних ЛЗ, які індукують цитохром P450 (CYP)/P-глікопротеїн (P-gp) (такі як карбамазепін та фенітоїн), протипоказане в усіх схемах лікування через ризик значного зменшення концентрації противірусних ЛЗ, а тому, відповідно, високий ризик неефективності лікування. Про інші протипоказання, пов’язані з ЛЗ, йдеться нижче. Схеми лікування, що включають інгібітори протеази NS3-4A, такі як потенційовані за допомогою ритонавіру паритапревір, гразопревір, глекапревір або воксілапревір, не повинні використовуватися у пацієнтів із декомпенсованим ЦП, гепатитом B або C за Чайлдом – П’ю, через істотне підвищення концентрації інгібіторів протеаз у цих пацієнтів та пов’язаний із цим ризик токсичності.
Софосбувір слід використовувати з обережністю у хворих із вираженою нирковою недостатністю (ШКФ <30 мл/хв/1,73 м2), якщо немає альтернативного варіанту лікування, оскільки фармакокінетика та безпека метаболітів софосбувіру у пацієнтів із тяжкою дисфункцією нирок усе ще встановлюється.
Рекомендації
- Використання ЛЗ, які індукують цитохром P450 (CYP)/P-глікопротеїн (P-gp) (такі як карбамазепін та фенітоїн), протипоказано в усіх схемах лікування через ризик значного зменшення концентрації противірусних ЛЗ (A1).
- Схеми лікування, що містять інгібітори протеаз, не повинні використовуватися для лікування пацієнтів із декомпенсованим ЦП класу B або C за Чайлдом – П’ю, а також у пацієнтів з епізодами декомпенсації захворювання в минулому (А1).
- У пацієнтів із ШКФ <30 мл/хв/1,73 м2 софосбувір слід використовувати лише у випадках, якщо немає альтернативного варіанту лікування, який був затверджений для застосування у пацієнтів із тяжкими порушеннями функції нирок (В1).
Показання для лікування: кому слід його призначати?
Усі ВГС-інфіковані пацієнти («наївні» та із досвідом лікування), які бажають лікуватися і не мають протипоказань до лікування, повинні його отримувати.
Можливість термінового лікування слід розглядати у пацієнтів із вираженим фіброзом (за шкалою METAVIR F2 або F3) або ЦП (за шкалою МЕТАVIR F4), у тому числі з декомпенсованим ЦП; пацієнтів із клінічно вираженими позапечінковими проявами (наприклад, у випадку безсимптомного васкуліту, пов’язаного з ВГС- кріоглобулінемією, нефропатії, пов’язаної з ВГС-імунними комплексами і неходжкінською В- клітинною лімфомою); пацієнтів із рецидивом ВГС після трансплантації печінки; пацієнтів із ризиком швидкого розвитку захворювання печінки внаслідок супутніх захворювань (реципієнти трансплантатів інших органів, окрім печінки, або стовбурових клітин, ВГВ-коінфекція, цукровий діабет); а також осіб, які належать до групи ризику щодо передачі ВГС (люди, які вживають наркотики ін’єкційним шляхом (далі – ЛВІН), чоловіки, які мають статеві стосунки з чоловіками (далі – ЧСЧ), жінки репродуктивного віку, які планують вагітність, пацієнти, які перебувають на гемодіалізі, ув’язнені особи. ЛВІН та ЧСЧ повинні знати про ризик реінфікування і застосовувати профілактичні заходи після успішного лікування.
Пацієнтам із декомпенсованим ЦП, які мають показання до трансплантації печінки з оцінкою за шкалою MELD ≥18-20, перш за все необхідна трансплантація печінки з наступним противірусним лікуванням, тому що ймовірність значного покращення функції печінки та виключення пацієнта з переліку тих, хто потребує трансплантації, є низькою [55-60]. Однак пацієнтам з оцінкою за шкалою MELD ≥18-20 та ймовірною тривалістю очікування трансплантації більше 6 міс може бути призначено лікування ВГС.
Лікування, як правило, не рекомендовано пацієнтам з обмеженою очікуваною тривалістю життя у зв’язку із супутніми захворюваннями, які не пов’язані з печінкою.
Коментар робочої групи. В Україні до груп ризику щодо інфікування ВГС належать:
- реципієнти крові, її препаратів та тканин;
- ЛВІН (вживають зараз або робили це колись, включаючи тих, хто вживав наркотики ін’єкційним шляхом хоча б 1 раз);
- споживачі інтраназальних наркотиків;
- ЧСЧ;
- пацієнти, які перебувають на гемодіалізі;
- особи, які мали маніпуляції, пов’язані з контактом з кров’ю та порушенням цілісності шкіри в медичних та немедичних закладах, у випадку, якщо є підозра щодо недотримання заходів з інфекційного контролю;
- особи, що протягом року отримували стоматологічні втручання чи хірургічні маніпуляції, пов’язані із контактом з кров’ю, більше 1 разу;
- особи, які перебували у місцях позбавлення волі;
- медичні та інші працівники, які у зв’язку із виконанням службових обов’язків мали порізи, уколи предметами, які містять сліди крові, чи інший контакт з інфікованою ВСГ кров’ю чи рідинами;
- донори крові;
- особи з ВІЛ.
Рекомендації
- Лікування рекомендується усім пацієнтам із ВГС, у тому числі тим, хто раніше не отримував лікування, а також тим, хто не досягнув СВВ після попереднього лікування (A1).
- Можливість термінового лікування слід розглядати у пацієнтів із вираженим фіброзом (за шкалою METAVIR F2 або F3) або ЦП (за шкалою МЕТАVIR F4), у тому числі декомпенсованим; пацієнтів із клінічно вираженими позапечінковими проявами (наприклад, у випадку безсимптомного васкуліту, пов’язаного з ВГС-кріоглобулінемією, нефропатії, пов’язаної з ВГС-імунними комплексами, і неходжкінської В-клітинної лімфоми); пацієнтів із рецидивом ВГС після трансплантації печінки; пацієнтів із ризиком швидкого розвитку захворювання печінки внаслідок супутніх захворювань (реципієнти інших трансплантатів органів, окрім печінки, або стовбурових клітин, ВГВ-коінфекція, цукровий діабет); а також осіб, які належать до групи ризику щодо передачі ВГС (ЛВІН, ЧСЧ, жінки репродуктивного віку, які планують вагітність, пацієнти, що перебувають на гемодіалізі, ув’язнені особи) (A1).
- Пацієнтам із декомпенсованим ЦП, які мають показання до трансплантації печінки, з оцінкою за шкалою MELD ≥18-20, перш за все необхідна трансплантація печінки з наступним противірусним лікуванням (B1).
- Якщо час очікування трансплантації печінки перевищує 6 міс, пацієнтам із декомпенсованим ЦП (за шкалою Чайлда – П’ю B або С) та оцінкою за шкалою MELD ≥18-20 можна призначати лікування до трансплантації, хоча клінічна ефективність лікування у цих пацієнтів не була точно встановлена (В2).
- Лікування, як правило, не рекомендовано для пацієнтів з обмеженою очікуваною тривалістю життя у зв’язку із супутніми захворюваннями, які не пов’язані із захворюваннями печінки (В2).
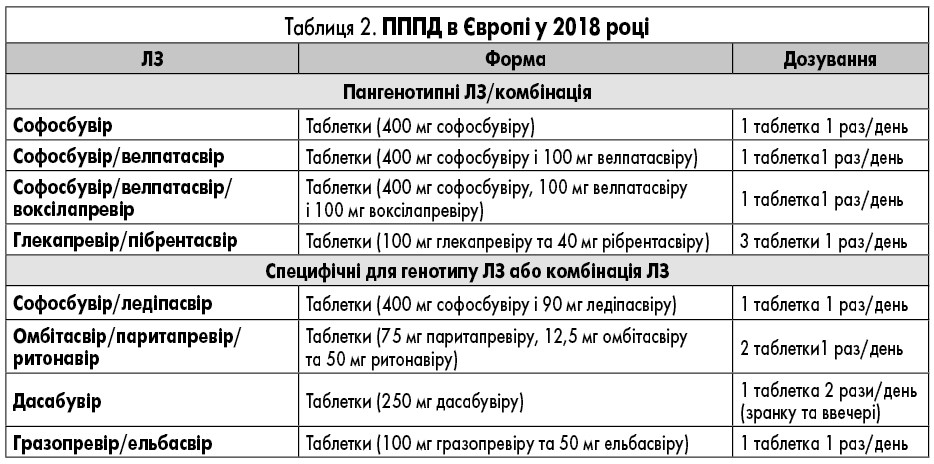
Наявні схеми лікування в Європі у 2018 році
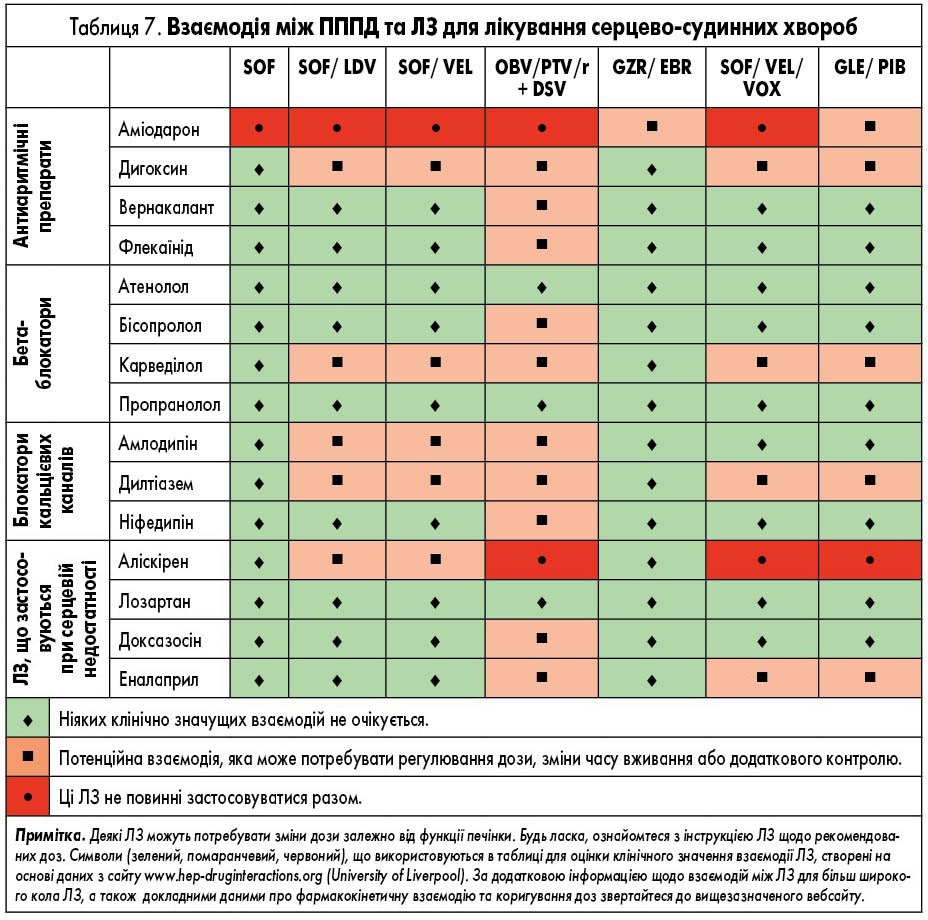
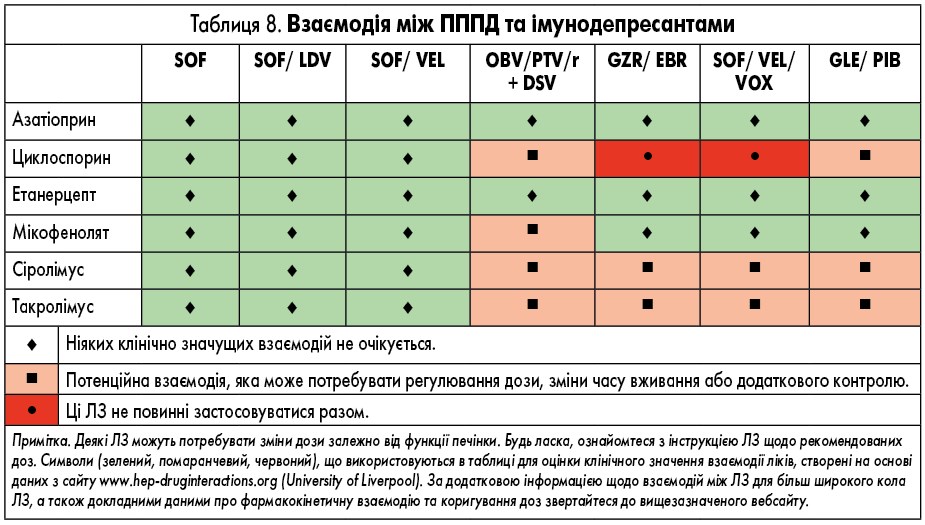
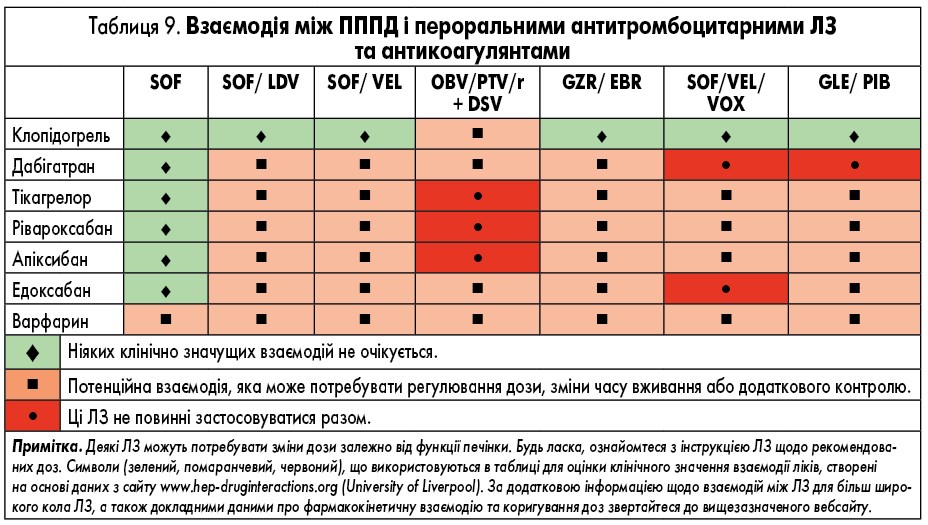
ЛЗ для лікування ВГС, які доступні в Європі, наведені у таблиці 2. У них представлені відомі фармакокінетичні профілі ЛЗ та їх взаємодія з іншими ЛЗ. Детальний опис взаємодій ЛЗ наведений у таблицях 3-9 та на сайті www.hep-druginteractions.org, де представлений загальний опис понад 700 ЛЗ. Для отримання додаткової інформації про окремі препарати прямої противірусної дії (ПППД) зверніться до резюме характеристик продукту.
Софосбувір
Софосбувір слід вживати у дозі 400 мг (1 таблетка) 1 раз/день незалежно від прийому їжі. Приблизно 80% софосбувіру виводиться нирками, тоді як 15% виділяється з калом. Більша частина дози софосбувіру, виявлена в сечі, – це метаболізм нуклеотидів GS-331007 внаслідок дефосфорилювання (78%), тоді як 3,5% відновлюється як софосбувір. Нирковий кліренс – основний шлях виведення GS-331007, причому значна частина активно секретується. Тому на даний час не існує рекомендацій щодо дози софосбувіру для пацієнтів з тяжкими порушеннями функції нирок (ШКФ <30 мл/хв/1,73 м2 або з термінальною стадією ниркової недостатності через високий рівень експозиції (до 20 разів) GS-331007. Проте існують докази щодо безпечного використання схеми лікування на основі софосбувіру у пацієнтів із ШКФ <30мл/хв/1,73 м2, у тому числі пацієнтів на гемодіалізі [61]. Експозиція софосбувіру непомітно змінюється у пацієнтів із легкою формою ниркової недостатності, але вона збільшується у 2,3 рази у пацієнтів із нирковою недостатністю середньої тяжкості.
Софосбувір добре переноситься протягом 12-24 тижнів прийому. Найбільш поширені побічні реакції (ПР; ≥20%), що спостерігалися при прийомі софосбувіру, були втома та головний біль. Також спостерігалося незначне підвищення креатинкінази, амілази та ліпази без клінічного впливу.
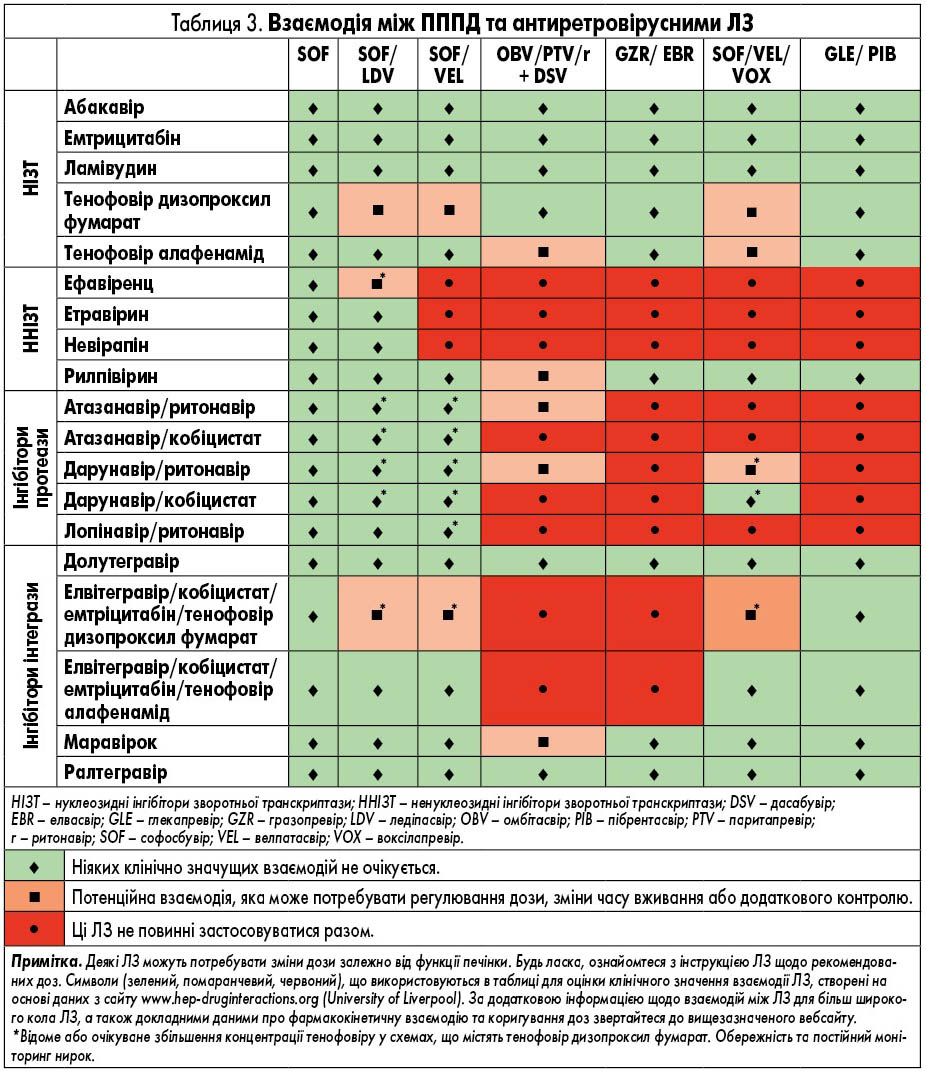
Софосбувір не метаболізується цитохромом Р450, але транспортується за допомогою P-gp. ЛЗ, що є сильними індукторами P-gp, суттєво знижують концентрацію софосбувіру в плазмі та можуть призвести до зниження терапевтичного ефекту. Таким чином, софосбувір не слід застосовувати разом з відомими індукторами P-gp, такими як рифампіцин, карбамазепін, фенітоїн чи звіробій. Інші потенційні взаємодії можуть спостерігатися з рифабутином, рифентином і модафінілом. У дослідженнях із застосуванням таких антиретровірусних ЛЗ, як емтрицитабін, тенофовір, рилпівірин, ефавіренц, дарунавір/ритонавір та ралтегравір, а також інших антиретровірусних ЛЗ, не спостерігалося жодних суттєвих взаємодій.
Схеми із застосуванням софосбувіру протипоказані пацієнтам, які лікуються антиаритмічним аміодароном, через ризик аритмії, що потенційно загрожує життю. Є дані, що брадикардія спостерігалася протягом від декількох годин до декількох днів після початку вживання ПППД, однак випадки спостерігалися протягом 2 тижнів після ініціації лікування ВГС. Механізм взаємодії та роль інших ЛЗ (наприклад, β-блокаторів) залишається незрозумілим, хоча пропонувався ряд потенційних механізмів, що включають інгібіцію P-gp, зміщення/заміну білкового зв’язування та прямий ефект софосбувіру та/або інших ПППД на кардіоміоцити або іонні канали. Токсичність, ймовірно, є результатом комбінації механізмів. Через тривалий період напіввиведення аміодарону взаємодія можлива протягом декількох місяців після припинення його вживання. Якщо пацієнт не має серцевого кардіостимулятора, рекомендується почекати 3 місяці після припинення прийому аміодарону перед тим, як розпочати лікування на основі софосбувіру. Існує ймовірність того, що схеми із застосуванням софосбувіру без аміодарону теж сприяють розвитку кардіотоксичності, утім це залишається спірним питанням. За відсутності конкретних даних про взаємодію ЛЗ слід обережно застосовувати антиаритмічні ЛЗ, крім аміодарону.
Софосбувір і ледіпасвір
Софосбувір і ледіпасвір доступні як комбінація двох ЛЗ із фіксованою дозою, що містять 400 мг софосбувіру та 90 мг ледіпасвіру в одній таблетці. Рекомендована доза комбінації – 1 таблетка, що приймається перорально 1 раз/день незалежно від прийому їжі. Біліарна екскреція є основним шляхом виведення незміненого ледіпасвіру, а ренальна є незначною (і становить приблизно 1%), тоді як софосбувір в основному виводиться нирками, як зазначено вище. Після початку прийому софосбувіру/ледіпасвіру середній період напіввиведення софосбувіру та його предомінантного метаболіту GS-331007 склав 0,5 та 27 годин відповідно. Ні софосбувір, ні ледіпасвір не є субстратами транспортерів печінкового захвату; GS-331007 не є субстратом для ниркових транспортерів.
Коментар робочої групи: в Україні застосування ЛЗ регламентоване Законом України «Про лікарські засоби», Законом України «Про захист прав споживачів», наказом МОЗ України № 651 від 26.07.2013. Відповідно до нормативно-правової бази, ЛЗ слід застосовувати відповідно до інструкції до медичного застосування.
Станом на 01.10.2020 р. в Україні комбіновані ЛЗ софосбувір/велпатасвір/воксілапревір (АТС-код J05AP56), гразопревір/ельбасвір (АТС-код: J05AP54) не зареєстровані.
Експозиція ледіпасвіру в плазмі крові (ділянка під кривою (AUC) була подібною у пацієнтів із тяжкими порушеннями функції печінки та пацієнтів із групи контролю з нормальною печінковою функцією. Аналіз фармакокінетики у хворих із ВІЛ-інфекцією показав, що ЦП (включаючи декомпенсований) не мав клінічно значущого впливу на експозицію ледіпасвіру.
Незважаючи на те, що для пацієнтів із легким або середнім ураженням нирок не потрібна корекція дози софосбувіру і ледіпасвіру, безпека комбінації софосбувір + ледіпасвір не була оцінена у хворих із тяжкими порушеннями функції нирок (ШКФ <30 мл/хв/1,73 м2) або термінальними стадіями захворювання нирок, що потребують гемодіалізу, але спостерігається все більша кількість доказів прийнятності з точки зору шкоди та користі [62]. Відносно пацієнтів із нормальною функцією нирок (ШКФ >80 мл/хв/1,73 м2), AUC софосбувіру була на 61, 107 та 171% вищою у хворих із легким, помірним та тяжким захворюванням нирок, тоді як AUC GS-331007 становила 55, 88 та 451% відповідно. Таким чином, пацієнти з легким або середньої тяжкості захворюванням нирок не потребують корекції дози, проте немає рекомендацій щодо дозування для пацієнтів із тяжкими порушеннями функції нирок (ШКФ <30 мл/хв/1,73 м2) або термінальною стадією ниркової недостатності. Сьогодні доступні пангенотипні комбінації ЛЗ, які не виводяться нирками. Таким чином, виключається необхідність у схемах, заснованих на софосбувірі.
Найбільш поширеними ПР, про які повідомлялося при прийомі цієї комбінації, були втома та головний біль. Оскільки комбінація містить ледіпасвір і софосбувір, будь-які взаємодії, виявлені з окремими ЛЗ, будуть застосовуватися до цієї комбінації. Потенційні (обмежені) взаємодії з софосбувіром були описані раніше. Будь-які ЛЗ, що вживаються одночасно і які є потужними інгібіторами P-gp, не тільки зменшують концентрацію софосбувіру в плазмі крові, але також призводять до зниження терапевтичного ефекту ледіпасвіру. Хоча спільний прийом з ЛЗ, що інгібують P-gp і/або білок стійкості раку молочної залози (breast cancer resistance protein, BCRP), може збільшити експозицію софосбувіру та ледіпасвіру, клінічні наслідки є малоймовірними.
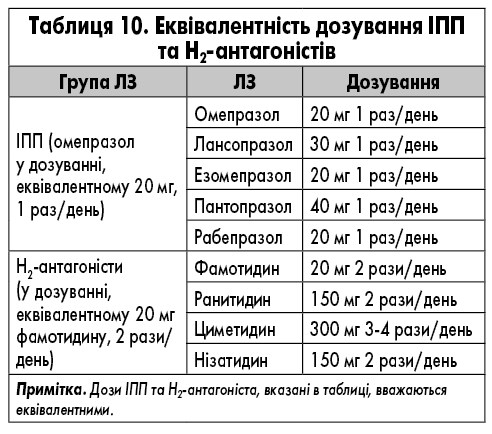
Ледіпасвір також може взаємодіяти з іншими ЛЗ шляхом інгібування P-gp та/або BCRP, що потенційно збільшує кишкове всмоктування супутніх ЛЗ. Таким чином, обережність є виправданою щодо добре вивчених P-gp субстратів, таких як дигоксин і дабігатран, але також можливо, з іншими ЛЗ, які, зокрема, транспортуються цими білками (наприклад, аліскірен, амлодипін, бупренорфін, карведилол, циклоспорин). Спільне введення аміодарону з софосбувіром/ледіпасвіром протипоказане через серйозний ризик симптоматичної або навіть смертельної брадикардії або асистолії (див. вище); механізм взаємодії ЛЗ невідомий. Застосування розувастатину також не рекомендовано (через потенційне інгібування поліпептиду, який транспортує органічні аніони (ОАТР) ледіпасвіром), і взаємодія з іншими статинами не може бути виключеною. Важливо уважно стежити за ПР, пов’язаними із статинами. Оскільки розчинність ледіпасвіру зменшується при підвищенні рН, ЛЗ, які підвищують рівень рН шлунку (антациди, антагоністи Н2-рецепторів, інгібітори протонної помпи – ІПП), можуть зменшити концентрацію ледіпасвіру. Антагоністи Н2-рецепторів можна приймати одночасно або через 12 год один від одного в дозі, що не перевищує 40 мг фамотидину, а ІПП одночасно в дозі, порівняній з 20 мг омепразолу (табл. 4). Реальні дані демонструють дещо зменшену частоту СВВ у пацієнтів, які отримують високі дози ІПП, що посилює необхідність бути обережними при застосуванні таких ЛЗ у пацієнтів, які приймають софосбувір та ледіпасвір [63].
Софосбувір/ледіпасвір можна приймати з усіма антиретровірусними ЛЗ. Проте через збільшення концентрації тенофовіра, коли фармакокінетичний підсилювач (ритонавір або кобіцистат) присутній в антиретровірусній схемі, ці комбінації (тобто атазанавір/ритонавір, дарунавір/ритонавір, лопінавір/ритонавір, елвітегравір/кобіцистат, атазанавір/кобіцистат, дарунавір/кобіцистат, все в поєднанні з тенофовір дизопроксілу фумаратом/емтрицитабіном) слід використовувати з обережністю, з частим моніторингом функції нирок, якщо інші альтернативи недоступні. Взаємодія не пом’якшується прийомом ЛЗ через 12 год. Оскільки рівень тенофовіру також збільшується при прийомі схем, що містять ефавіренц, необхідна обережність. Нещодавнє схвалення тенофовіру алафенаміду (TAF), що призводить до значного зниження рівня тенофовіру в плазмі, зменшує побоювання щодо взаємодії в результаті підвищення рівня тенофовіру.
Софосбувір і велпатасвір
Софосбувір і велпатасвір доступні в комбінації з фіксованою дозою двух ЛЗ, що містять 400 мг софосбувіру і 100 мг велпатасвіру в одній таблетці. Рекомендована доза цієї комбінації – 1 таблетка на день незалежно від прийому їжі. Велпатасвір метаболізується in vitro ізоферментами CYP2B6, CYP2C8 і CYP3A4. Проте через повільний метаболізм переважна більшість ЛЗ у плазмі крові є основною субстанцією ЛЗ. Важливо відзначити, що велпатасвір транспортується P-gp і BCRP і в обмеженій мірі органічним аніоном, що транспортує поліпептид (OATP) OATP1B1. Біліарна екскреція (з жовчю) ЛЗ є основним шляхом виведення. Середній період напіввиведення велпатасвіру при адсорбції софосбувіру і велпатасвіру становить приблизно 15 год.
Експериментальна експозиція велпатасвіру з плазми крові (AUC) була однаковою у пацієнтів із помірними та тяжкими порушеннями печінки та у пацієнтів з контрольної групи, що мали нормальну печінкову функцію. Аналіз фармакокінетики у ВІЛ-інфікованих пацієнтів показав, що ЦП (включаючи декомпенсований) не має клінічно значущого впливу на дію велпатасвіру.
Фармакокінетика велпатасвіру вивчалася у хворих ВГС-негативних пацієнтів із тяжкими порушеннями функції нирок (ШКФ <30 мл/хв/1,73 м2). В осіб із нормальною функцією нирок AUC велпатасвіру була на 50% вище, що не вважалося клінічно значущим.
Оцінка безпеки софосбувіру та велпатасвіру була заснована на кінцевих даних III фази дослідження. Головний біль, втома та нудота були найбільш частими ПР, але траплялися з такою ж частотою, що і у пацієнтів із групи плацебо.
З огляду на фармакокінетичний профіль велпатасвіру, існують деякі протипоказання щодо одночасного прийому ЛЗ. Протипоказані засоби, які є сильними P-gp або сильними індукторами CYP (наприклад, рифампіцин, рифабутин, карбамазепін, фенобарбітал, фенітоїн, звіробій) через зменшення експозиції софосбувіру та/або велпатасвіру з потенційною втратою ефективності. Однак існують також ЛЗ, які є помірними інгібіторами P-gp або CYP (такі як модафініл), які можуть зменшувати вплив велпатасвіру. На даний час ця комбінація не рекомендована для застосування з такими ЛЗ.
Як і з ледіпасвіром, існує деяке занепокоєння щодо пригнічення P-gp та/або BCRP велпатасвіром, через що відбувається збільшення експозиції ЛЗ, що є субстратом для цих транспортерів. Комбінацію софосбувіру і велпатасвіру можна застосовувати спільно з субстратами P-gp, BCRP, OATP та CYP, проте слід проявляти певну обережність при застосуванні супутніх ліків, що мають вузьке терапевтичне вікно, в якому збільшення експозиції ЛЗ може мати клінічні наслідки.
Кольорове кодування для софосбувіру/велпатасвір в табл. 3-9 відображає це (наприклад, для дигоксину, дабігатрану, тикагрелору, карведилолу, амлодипіну, дилтіазему, аліскірену).
Розчинність велпатасвіру, як і ледіпасвіру, зменшується при підвищенні рН. Тому важливо володіти інформацією щодо спільного введення антацидів, антагоністів Н2-рецепторів та інгібіторів протонної помпи. Більшості пацієнтів слід уникати прийому ІПП під час терапії софосбувіром/велпатасвіром. За необхідності софосбувір/велпатасвір слід приймати разом з їжею за 4 год до прийому ІПП при максимальній дозі, що співставна омепразолу 20 мг (табл. 10).
Пацієнтам із коінфекцією ВІЛ/ВГС можна приймати софосбувір/велпатасвір разом з більшістю антиретровірусних ЛЗ, за винятком ефавіренцу, етравірину та невірапіну. Ефавіренц призводить до 50% зменшення ефективності велпатасвіру. Софосбувір/велпатасвір також підвищує експозицію тенофовіру, інгібуючи P-gp. Це означає, що у пацієнтів, які отримують TDF, необхідно здійснювати контроль за функцією нирок.
Софосбувір, велпатасвір і воксілапревір
Софосбувір, велпатасвір і воксілапревір доступні у комбінації з фіксованою дозою трьох ЛЗ, що містять 400 мг софосбувіру, 100 мг велпатасвіру та 100 мг воксілапревіру в одній таблетці. Рекомендована доза цієї комбінації – 1 таблетка раз на добу з їжею, оскільки експозиція в плазмі крові (AUC) і максимальна концентрація (Cmax) воксілапревіру становили від 112 та 435% і, відповідно, від 147 до 680% під час прийому їжі.
Специфічна фармакокінетична інформація, що стосується софосбувіру і велпатасвіру, обговорюється в попередніх розділах. Воксілапревір метаболюється in vitro через CYP3A4, з переважною більшістю ЛЗ у плазмі крові. Велпатасвір та воксілапревір транспортуються P-gp, BCRP, OATP1B1 та OATP1B3. Біліарна екскреція основного ЛЗ є основним шляхом виведення воксілапревіру. Середній період напіввиведення воксілапревіру після введення софосбувіру, велпатасвіру та воксілапревіру становить приблизно 33 год.
 Популяційний фармакокінетичний аналіз воксілапревіру у пацієнтів із ВГС показав, що у пацієнтів із компенсованим ЦП (A за Чайлдом – П’ю) виявлявся на 73% більш високий рівень експозиції воксілапревіру порівняно з тим, хто не мав ЦП. Таким чином, для пацієнтів із компенсованим ЦП не потрібна корекція дози софосбувіру, велпатасвіру та воксілапревіру. Фармакокінетика однієї дози воксілапревіру також вивчалася у пацієнтів із помірними та тяжкими порушеннями печінки (B та C за Чайлдом – П’ю відповідно). AUC воксілапревіру була у 3 та 5 разів вище у пацієнтів із помірними та тяжкими порушеннями функції печінки відповідно, ніж у пацієнтів із нормальною печінковою функцією. Таким чином, комбінація софосбувіру, велпатасвіру та воксілапревіру не рекомендується пацієнтам із помірним порушенням печінки (B за Чайлдом – П’ю) та протипоказана тим, хто має тяжкі порушення функції печінки (C за Чайлдом – П’ю).
Популяційний фармакокінетичний аналіз воксілапревіру у пацієнтів із ВГС показав, що у пацієнтів із компенсованим ЦП (A за Чайлдом – П’ю) виявлявся на 73% більш високий рівень експозиції воксілапревіру порівняно з тим, хто не мав ЦП. Таким чином, для пацієнтів із компенсованим ЦП не потрібна корекція дози софосбувіру, велпатасвіру та воксілапревіру. Фармакокінетика однієї дози воксілапревіру також вивчалася у пацієнтів із помірними та тяжкими порушеннями печінки (B та C за Чайлдом – П’ю відповідно). AUC воксілапревіру була у 3 та 5 разів вище у пацієнтів із помірними та тяжкими порушеннями функції печінки відповідно, ніж у пацієнтів із нормальною печінковою функцією. Таким чином, комбінація софосбувіру, велпатасвіру та воксілапревіру не рекомендується пацієнтам із помірним порушенням печінки (B за Чайлдом – П’ю) та протипоказана тим, хто має тяжкі порушення функції печінки (C за Чайлдом – П’ю).
Фармакокінетика воксілапревіру вивчалася серед ВГС-негативних пацієнтів із тяжкими порушеннями функції нирок (ШКФ <30 мл/хв/1,73 м2). AUC у пацієнтів із серйозним порушенням функції нирок був на 71% вищим, ніж в осіб із нормальною функцією нирок, що не вважається клінічно значущим.
Дані про безпеку софосбувіру, велпатасвіру та воксілапревіру базувалися на даних II і III фази клінічних досліджень. Головний біль, діарея та нудота були найчастішими ПР. Ризик ПР з боку ШКТ є більшим, ніж при комбінації софосбувіру і велпатасвіру без воксілапревіру.
Оскільки велпатасвір і воксилапревір є інгібіторами P-gp, BCRP, OATP1B1 та OATP1B3, одночасне введення софосбувіру, велпатасвіру та воксілапревіру з ЛЗ, які є субстратами цих транспортерів, може збільшити експозицію додаткових ЛЗ, що застосовуються. Це означає, що ті ЛЗ, підвищені рівні яких у плазмі пов’язані з ПР, протипоказані, а інші можуть потребувати корекції дози або додаткового контролю.
Одночасне застосування з ЛЗ, які є сильними P-gp та/або сильними індукторами CYP, такими як рифампіцин, рифабутин, іваролі, карбамазепін, фенобарбітал або фенітоїн, протипоказані через зменшення експозиції софосбувіру, велпатасвіру та/або воксілапревіру з потенційною втратою ефективності. Однак і помірні інгібітори P-gp або CYP (такі як модафініл, ефавіренц, окскарбазепін тощо), які також можуть зменшити вплив цієї комбінації ПППД, наразі не рекомендовані.
Для жінок репродуктивного віку одночасне застосування контрацептивів, що містять етинілестрадіол, протипоказане через ризик підвищення AUC. Контрацепція з ЛЗ, що містять прогестоген, є допустимою.
Розчинність велпатасвіру зменшується при збільшенні рівня рН. Тому важливо ознайомитися з рекомендаціями щодо спільного введення антацидів, антагоністів H2-рецепторів та ІПП. ІПП можуть бути введені з софосбувіром/велпатасвіром/воксілапревіром у дозуванні, що не перевищує дози у порівнянні з омепразолом 20 мг (табл. 10). Софосбувір/велпатасвір/воксілапревір слід приймати разом з їжею і, якщо це можливо, за 4 год до прийому ІПП.
У пацієнтів із коінфекцією ВІЛ/ВГС софосбувір/велпатасвір/воксілапревір не рекомендується застосовувати з ефавіренцом, етравірином та невірапіном, а також з інгібіторами протеази атазанавіром/ритонавіром та лопінавіром/ритонавіром. Дарунавір/ритонавір, дарунавір/кобіцистат та атазанавір/кобіцистат двічі на день необхідно приймати з обережністю, оскільки немає даних щодо сумісного прийому цих препаратів. Ефавіренц призводить до 50% зменшення експозиції велпатасвіру і атазанавіру, викликає 4-кратне збільшення експозиції воксілапревіру. Софосбувір/велпатасвір/воксілапревір також збільшує вплив тенофовіру шляхом блокування P-gp. Це означає, що у пацієнтів, які приймають TDF, необхідно здійснювати контроль за функцією нирок.
Омбітасвір, паритапревір, ритонавір і дасабувір
Паритапревір – це інгібітор протеази, який метаболізується в першу чергу CYP3A4 і приймається з низькою дозою ритонавіру (інгібітора CYP3A), який діє як фармакокінетичний підсилювач. Це дає можливість приймати ЛЗ 1 раз на день у меншій дозі, ніж потрібно було б без ритонавіру. Омбітасвір є інгібітором NS5A, який призначається у фіксованій дозі у комбінації з паритапревіром/ритонавіром. Рекомендована доза цієї комбінації – 2 таблетки (12,5 мг/75 мг/50 мг на таблетку), що приймають перорально 1 раз/день з їжею. Дасабувір є нуклеозидним інгібітором РНК-залежної полімерази ВГС, що вводяться в таблетках по 250 мг двічі на день у комбінації з омбітасвіром/паритапревіром/ритонавіром у пацієнтів з генотипом 1.
Паритапревір виводиться переважно з фекаліями. Омбітасвір демонструє лінійну кінетику і переважно виводиться з фекаліями. Дасабувір метаболізується в печінці, і його домінантний метаболіт переважно виводиться з жовчю та калом із мінімальним кліренсом у нирках.
Фармакокінетичні результати досліджень показали, що у пацієнтів із тяжкими порушеннями печінки (C за Чайлдом – П’ю) AUC паритапревіру збільшувався в 9,5 разів, тоді як омбітаcвіру знизився на 54%, а дасабувіру – у 3,3 рази. У пацієнтів із B за Чайлдом – П’ю спостерігається збільшення експозиції паритапревіру на 62% при зменшенні омбітасвіру на 30%. Таким чином, для пацієнтів із легким порушенням печінкової функції (A за Чайлдом – П’ю) коригування дози не потрібно, однак комбінація ЛЗ не повинна застосовуватися у пацієнтів із помірними порушеннями печінки (B за Чайлдом – П’ю) або у пацієнтів із тяжкими порушеннями печінки (C за Чайлдом – П’ю).
AUC паритапревіру збільшилася на 45% у пацієнтів із тяжкими порушеннями функції нирок (кліренс креатиніну 15-29 мл/хв), на відміну від ритонавіру – 114% та дасабувіру – 50%. На даний час для пацієнтів із легкою, середньою або важкою печінковою недостатністю корекція дози не потрібна. Паритапревір, омбітасвір, ритонавір та дасабувір також можуть використовуватися для пацієнтів, які перебувають на діалізі.
Найпоширенішими ПР, про які повідомлялося під час застосування комбінації омбітасвіру, паритапревіру, ритонавіру та дасабувіру, були нудота та втома.
Паритапревір в основному метаболізується CYP3A4, тоді як дасабувір – CYP2C8, а омбітасвір піддається гідролізу. Проте обидва ЛЗ – омбітасвір та дасабувір – можуть метаболізуватися за допомогою CYP3A4. Схоже, що транспортери відіграють важливу роль у розподілі цих ЛЗ, при цьому паритапревір інгібує OATP1B1/B3, P-gp і BCRP. Дасабувір і ритонавір також можуть інгібувати P-gp і BCRP. Враховуючи метаболічний профіль цих ЛЗ та наявність ритонавіру, існує потенціал для багатьох взаємодій між ЛЗ. Була проведена комплексна оцінка взаємодії ЛЗ на підставі нормативних рекомендацій Європейського агентства з ЛЗ та Адміністрації США з питань харчування і медикаментів. Важливо враховувати профіль взаємодії ЛЗ у вигляді комбінації (з використанням або без дасабувіру), оскільки самі ЛЗ взаємно впливають один на одного.
Ритонавір є сильним інгібітором CYP3A4; таким чином, спільне введення ЛЗ, що метаболізуються цим ферментом, може призвести до значного підвищення концентрації в плазмі крові. Наступні ЛЗ протипоказані, оскільки підвищена концентрація в плазмі може призвести до серйозних ПР: альфузозин, аміодарон, астемізол, терфенадин, цизаприд, похідні ергота, ловастатин, симвастатин, аторвастатин, пероральний мієзолам, триазолам, кетіапін, хінідин, сальметерол, силденафіл при використанні легеневої артеріальної гіпертензії. Також протипоказані ферменти-індуктори, які можуть поставити під загрозу вірусологічну ефективність, наприклад, карбамазепін, фенітоїн, фенобарбітал, рифампіцин, іоносверд, ензалутамід, та інгібітори ферментів, які можуть збільшити концентрацію паритапревіру, наприклад, азольні протигрибкові ЛЗ, деякі макролідні антибіотики.
На додаток до протипоказань, існують інші ЛЗ, з якими потрібно бути обережними, і може бути необхідно змінити дозування, час прийому або потрібен додатковий контроль. Взаємодію між ЛЗ треба обов’язково брати до уваги у випадку супутньої коінфекції ВІЛ. Схеми, що містять кобіцистат, не слід застосовувати через додатковий ефект підсилення.
Гразопревір та ельбасвір
Гразопревір та ельбасвір доступні у фіксованій дозі двох ЛЗ, що містять 100 мг гразопревіру та 50 мг ельбасвіру в одній таблетці. Рекомендована доза комбінації – 1 таблетка 1 раз на добу незалежно від прийому їжі.
Гразопревір та ельбасвір частково метаболізуються CYP3A4, але в плазмі крові не виявляються циркулюючі метаболіти. Основний шлях елімінації – біліарний і фекальний, <1% виводиться з сечею у вигляді відновлених продуктів. Гразопревір транспортується за допомогою P-gp і OATP1B1, тоді як ельбасвір є субстратом для P-gp. Обидва препарати – ельбасвір (>99,9%) і гразопревір (98,8%) – широко зв’язуються з білками плазми. Кінцеві періоди напіврозпаду складають приблизно 24 і 31 год відповідно.
Фармакокінетичні дані досліджень щодо порушень функції печінки серед неінфікованих ВГС пацієнтів продемонстрували зниження AUC ельбасвіру у хворих з ЦП A за Чайлдом – П’ю (40%), B за Чайлдом – П’ю (28%) та C за Чайлдом – П’ю (12%). Водночас експозиція гразопревіру збільшується у хворих з ЦП A за Чайлдом – П’ю (70%), B за Чайлдом – П’ю (у 5 разів) та C за Чайлдом – П’ю (у 12 разів). На підставі цих даних існує протипоказання до застосування ельбасвіру/гразопревіру у пацієнтів із помірними (B за Чайлдом – П’ю) або тяжкими (C за Чайлдом – П’ю) печінковими порушеннями.
Пацієнти з легкими, помірними або тяжкими порушеннями функції нирок (включаючи пацієнтів на гемодіалізі або перитонеальному діалізі) не потребують корекції дози. Спостерігається збільшення експозиції ельбасвіру (65%) та гразопревіру (86%) в осіб, неінфікованих ВГС, із ШКФ <30 мл/хв/1,73 м2, але це не вважається клінічно значущим.
Безпека ельбавіру/гразопревіру ґрунтується на II та III фазі клінічних досліджень. Найбільш часто зустрічаються такі ПР, як втома та головний біль. Зареєстровані рідкісні випадки (0,8%) значного підвищення рівня АЛТ, трохи частіше – у жінок, пацієнтів азіатської раси та літніх пацієнтів. Менше 1% пацієнтів, які отримували ельбавір/гразопревір з або без рибавірину, припинили лікування через ПР.
Оскільки ельбасвір та гразопревір є субстратами CYP3A та P-gp, індуктори цих білків, такі як ефавіренц, етравірин, фенітоїн, карбамазепін, босентан, модафініл та звіробій, можуть суттєво знизити вміст обох ЛЗ у плазмі крові, вони протипоказані. Сильні інгібітори CYP3A (наприклад, інгібітори протеази, деякі азольні протигрибкові ЛЗ), які можуть суттєво підвищувати концентрацію в плазмі крові, або протипоказані, або не рекомендуються. Окрім інгібіції CYP3A, концентрації гразопревіру в плазмі крові також можуть бути значно підвищені інгібіторами OATP1B1 (включаючи інгібітори протеази, кобіцистат, циклоспорин, рифампіцин). Проте засоби, що знижують кислотність, не впливають на абсорбцію гразопревіру та ельбасвіру.
Потенціал взаємодії гразопревіру та ельбасвіру з іншими ЛЗ є відносно низьким, хоча гразопревір є слабким інгібітором CYP3A (приблизно на 30% збільшення експозиції мідазоламу), а ельбасвір є слабким інгібітором P-gp. Необхідно бути обережними при застосуванні ЛЗ, які використовують ізоферменти CYP3A та P-gp (наприклад, такролімус, деякі статини, дабігатран, тикагрелор), при цьому можуть знадобитися додаткові спостереження, зниження дози та/або ЕКГ.
На підставі вищезазначених висновків існують обмеження щодо застосування антиретровірусних ЛЗ з ельбавіром/гразопревіром. На даний час можна використовувати антиретровірусні ЛЗ, які є інгібіторами нуклеотидної зворотної транскриптази: абакавір, ламівудин, тенофовір (TDF або TAF), емтрицитабін, рилпівірин, ралтегравір, долутегровір та маравірок (табл. 4).
Глекапревір і пібрентасвір
Глекапревір і пібрентасвір доступні у фіксованому дозуванні комбінації з двома ЛЗ, що містить 100 мг глекапревіру та 40 мг пібрентасвіру. Рекомендована доза – 3 таблетки 1 раз на день з їжею, оскільки експозиція в плазмі крові глекапревіру збільшується на 83-163% за наявності їжі, порівнюючи з прийомом натще.
Екскреція через жовчовивідні шляхі є основним шляхом виведення глекапревіру і пібрентасвіру. Період напіввиведення глекапревіру і пібрентасвіру становить відповідно 6 і 23 год.
Популяційний фармакокінетичний аналіз серед ВГС-інфікованих пацієнтів показав, що після введення глекапревіру і пібрентасвіру серед ВГС-інфікованих пацієнтів із компенсованим ЦП (A за Чайлдом – П’ю), експозиція глекапревіру була приблизно в 2 рази вищою, тоді як вплив пібрентасвіру був подібним до пацієнтів без ЦП. Порівнюючи з пацієнтами з нормальною печінковою функцією, AUC глекапревіру був на 33% вищий у пацієнтів із компенсованим ЦП (A за Чайлдом – П’ю), на 100% вищий у тих, хто мав помірну печінкову недостатність (B за Чайлдом – П’ю), і збільшився до 11 разів у пацієнтів із тяжкими порушеннями печінки (C за Чайлдом – П’ю). Таким чином, глекапревір і пібрентасвір протипоказаний пацієнтам із ЦП класу B або C за Чайлдом – П’ю.
Застосування глекапревіру/пібрентасвіру вивчали у ВГС-негативних осіб із легкою, середньою, тяжкою або термінальною стадією ниркової недостатності, які не знаходилися на діалізі, у порівнянні з тими, що мають нормальну функцію нирок. AUC була збільшена майже у 56% пацієнтів, що не було клінічно значущим. AUC глекапревіру/пібрентасвіру була схожа у пацієнтів на діалізі та без нього.
Безпека глекапревіру та пібрентасвіру була оцінена в II і III фазах клінічних дослідженнях. Головний біль та втома були найчастішими ПР.
Глекапревір та пібрентасвір є інгібіторами P-gp, BCRP і OATP1B1 і OATP1B3. Спільне введення глекапревіру/пібрентасвіру може збільшити концентрацію ЛЗ, які є субстратами P- gp (наприклад, дабігатран-етексилат протипоказаний через збільшення у 2,4 рази при експозиції дабігатрану), BCRP (наприклад, розувастатин вимагає зменшення дози) або OATP1B1/3 (наприклад, аторвастатин або симвастатин протипоказані). Для інших субстратів P-gp, BCRP або OATP1B1/3 слід розглядати можливість коригування дози.
Концентрації глекапревіру/пібрентасвіру можуть знижуватися сильними ЛЗ, що індукують P-gp та CYP3A, такими як рифампіцин, карбамазепін, звіробій або фенітоїн, що призводить до зниження терапевтичного ефекту або втрати вірусологічної відповіді. Спільне введення цих чи інших потужних індукторів протипоказане. Подібний ефект не можна виключати з помірними індукторами, такими як окскарбазепін та еслікарбазепін, і одночасне введення цих ЛЗ не рекомендується. Супутні ЛЗ, які інгібують P-gp та BCRP, можуть посилювати експозицію глекапревіру/пібрентасвіру. Аналогічно, інгібітори OATP1B1/3, такі як циклоспорин, дарунавір та лопінавір, також можуть збільшувати концентрації глекапревіру.
Потенційний вплив глекапревіру/пібрентасвіру на інших ЛЗ є відносно низьким, хоча глекапревір є слабким інгібітором CYP3A (приблизно на 27% збільшення експозиції мідазоламу). При сумісному застосуванні ЛЗ, що використовують CYP3A (наприклад, такролімусу), необхідно проявляти деяку обережність через вузький терапевтичний індекс, так само як і з ЛЗ, такими як кветиапін, тоді як пацієнтам із більш високими дозами може знадобитися додатковий контроль, зменшення дози та/або ЕКГ.
Для жінок репродуктивного віку одночасне застосування контрацептивів, що містять етинілестрадіол, протипоказане через ризик підвищення АЛТ. Прогестоген-контрацепція допускається.
Як і в інших ПППД, розчинність глекапревіру зменшується при збільшенні рН. Cmax глекапревір зменшується в середньому на 64% при одночасному застосуванні з омепразолом у дозуванні 40 мг. Інструкція зазначає, що не рекомендується змінювати дозу. Проте призначення дозування омепразолу, що перевищує 40 мг або еквівалентного (табл. 10), з глекапревіром та пібрентасвіром ще не вивчене і може призвести до більшого зниження концентрації глекапревіру.
У пацієнтів із коінфекцією ВІЛ-ВГС через механізми, описані вище, глікапревір/пібрентасвір протипоказані зі схемами, що містять атазанавір, і не рекомендуються з іншими інгібіторами протеази ВІЛ. Подібним чином ННІЗТ, ефавіренц, етруїн і невірапін не рекомендуються через очікуване зменшення AUC глекапревіру/пібранасвіру. Всі інші антиретровірусні ЛЗ можна приймати разом, у тому числі кобіцистат при застосуванні з інгібітором інтегрази елвітегравіром.
Рекомендації
- Можливі численні та комплексні взаємодії між ПППД та іншими ЛЗ. Отже, для усіх пацієнтів, які проходять лікування з ПППД, необхідно проводити ретельну оцінку ризику взаємодії між ЛЗ до початку терапії та перед початком прийому інших ЛЗ, виходячи з інформації щодо кожного окремого ЛЗ (зведені дані про основні взаємодії можна знайти в таблицях 3-9 цього документа; ключовим вебресурсом є сайт www.hep-druginteractions.org, де рекомендації оновлюються регулярно) (A1).
- Взаємодія ЛЗ є ключовим фактором у лікуванні хворих з коінфекцією ВІЛ/ВГС, і потрібно приділяти пильну увагу ПППД, які протипоказані, не рекомендовані або вимагають корекції дози у випадку використання інших ЛЗ (A1).
- Пацієнти повинні бути поінформовані щодо важливості дотримання терапії, рекомендацій щодо дозування і необхідності повідомляти про застосування інших ЛЗ і наркотиків (A1).
Друкується у скороченні.
Текст адаптовано та уніфіковано відповідно до стандартів тематичного випуску медичної газети «Здоров’я України».
Повний текст Клінічної настанови «Вірусний гепатит С» за посиланням https://www.dec.gov.ua/wp-content/uploads/2021/01/2021_50_51_kn_vgc.pdf
Тематичний номер «Гастроентерологія. Гепатологія. Колопроктологія» № 1 (67) 2023 р.