21 листопада, 2020
Неврологічні прояви COVID-19
Коронавірус тяжкого гострого респіраторного синдрому 2 (SARS-Cov2) – новий бета-коронавірус, що викликає різноманітні симптоми захворювання, нині широко відомого як COVID‑19. Зокрема, зростає кількість клінічних оцінок неврологічних проявів цієї інфекції. На початку пандемії увагу медиків було прикуто до симптомів респіраторної інфекції, як-от гарячка, кашель, утруднене дихання та дихальна недостатність. Згодом з’явилися повідомлення про розлади з боку нервової системи – аносмію, судоми, інсульти, порушення свідомості, енцефалопатію, паралічі. До 20% пацієнтів із COVID‑19, які потребують інтенсивної терапії через неврологічний дефіцит, потрапляють до категорії високого ризику смерті. Ті ж, що вижили і відновлюються після гострого респіраторного синдрому, потенційно страждатимуть від віддалених нейропсихіатричних та нейрокогнітивних наслідків, таких як депресія, обсесивно-компульсивний розлад, психоз, паркінсонізм та хвороба Альцгеймера. M. Fotuhi et al. виконали клінічну оцінку різних неврологічних проявів COVID‑19, розглянули патофізіологію уражень центральної та периферичної нервових систем і можливі механізми стійкості до вірусу, що становлять особливий інтерес у контексті пошуку засобів терапії та профілактики (Journal of Alzheimer’s Disease, 2020; 76: 3‑19). Пропонуємо до вашої уваги огляд результатів проведеної роботи.
Епідеміологічні паралелі
У 2002 р. людство вже мало справу з епідемією коронавірусної інфекції, яка викликала тяжкий гострий респіраторний синдром (SARS-Cov, далі SARS-Cov1), а також низку неврологічних станів, зокрема енцефалопатію, судоми, інсульти, паралічі черепних нервів, периферичну невропатію та міопатію [12]. Рівень смертності сягав 10%, що частково обмежувало поширення хвороби [12, 13]. У 2012 р. інший коронавірус розвинувся на Середньому Сході, внаслідок чого і отримав свою назву – середньосхідний респіраторний вірус (MERS) [13]. Обидва віруси вражали численні органи і системи, включно з мозком, нервами та м’язами [14].
SARS-Cov2, що має високий ступінь спорідненості з SARS-Cov1 та MERS, також здатний викликати патологічні зміни в центральному та периферичному відділах нервової системи, за рахунок як прямого інфікування нейронів, так і опосередковано, через імунні та запальні механізми [4, 11, 15]. Зважаючи на глобальний масштаб наслідків пандемії COVID‑19 для здоров’я та економіки, неврологічні прояви хвороби стали предметом ретельного клінічного вивчення.
Клінічні спостереження за хворими на COVID‑19 із неврологічними проявами
Аносмія і порушення смакового відчуття
При аналізі перших повідомлень виявлено, що на магнітно-резонансній томографії (МРТ), зробленій пацієнтові з COVID‑19 із гострим початком аносмії з Ірану, не спостерігалося порушень структури назальної слизової оболонки (зокрема скарг на закладеність носа) та нюхових цибулин [16]. Про гірше сприйняття запахів і смаків в осіб із COVID‑19 повідомлялося в багатьох європейських клініках [17‑19]. Lechien et al. при наданні допомоги 417 хворим із м’яким та помірно тяжким перебігом інфекції виявили розлади нюху в 85,6% випадків, смакового відчуття – у 88% [19].
Із 59 госпіталізованих осіб в лікарню Італії у 33,9% відмічалися порушення нюху або смаку, а у 18,6% – обох відчуттів одразу [20]. Серед 202 пацієнтів із помірно вираженими симптомами COVID‑19 в іншій італійській клініці 64,4% скаржилися на порушення нюху або смаку [18]. Водночас із 214 хворих, госпіталізованих у китайському місті Ухань, лише 5,1 та 5,6% мали погіршення нюху та смаку відповідно, причому частіше вони спостерігалися в осіб із легким, ніж тяжким перебігом інфекції (6‑7 та 3% відповідно) [6].
Цереброваскулярна патологія
У значної частини пацієнтів із COVID‑19 відбувається тромбоутворення у дрібних і великих судинах головного мозку та інших органів. За спостереженням Li et al. у 13 із 221 хворого на COVID‑19 нейровізуалізація підтвердила наявність цереброваскулярної патології [21]. Здебільшого це були ішемічні інфаркти в басейнах як дрібних, так і великих артерій. В одного пацієнта було виявлено мозковий венозний тромбоз, що підтвердила комп’ютерно-томографічна (КТ)-венографія, ще в одного – внутрішньочерепний крововилив.
У дослідженні Mao et al. у 5 із 214 осіб діагностували ішемічні інсульти, в одного – внутрішньочерепний крововилив [6]. Більшість пацієнтів із цереброваскулярною патологією (та іншими неврологічними проявами) в цьому випробуванні мали тяжкий перебіг інфекції. Проте 2 з 6 учасників були госпіталізовані з ознаками інсульту без респіраторних симптомів, які б дали змогу запідозрити COVID‑19 [6]. Oxley et al. також підкреслили той факт, що у молодих здорових осіб раптово може трапитися великий інсульт за відсутності інших симптомів COVID‑19, таких як кашель або лихоманка [22]. Автори повідомили про два таких випадки тяжкого інсульту з геміплегією – в осіб віком 39 і 37 років.
Судоми та енцефалопатія
Опубліковано серію клінічних випадків COVID‑19, коли пацієнтів госпіталізували з лихоманкою, ригідністю шийних м’язів, порушенням свідомості чи психічного статусу, судомами. За даними Filtov et al., 74-річна жінка поступила до стаціонара з лихоманкою, кашлем та сплутаною свідомістю [23]. КТ голови виявила у лівій скроневій частці одне велике вогнище інсульту, перенесеного в минулому, але не було знайдено нових ознак патології мозку.
Moriguchi et al. описали випадок 24-річного чоловіка, який був доставлений у відділення невідкладної допомоги з головним болем, ригідністю шиї, судомами та порушенням свідомості [24]. На МРТ мозку виявлено гіперінтенсивність сигналу від мезіальної ділянки правої скроневої частки й гіпокампа, а також стінки нижнього рогу правого шлуночка мозку. Назальний мазок і спинномозкова рідина (СМР) виявилися позитивними на SARS-Cov2 за результатами полімеразної ланцюгової реакції. Пацієнт отримував лише підтримувальне лікування у відділенні інтенсивної терапії (ВІТ) і повністю одужав. Проте згодом у хворого розвинулася ретроградна амнезія, і він не міг пригадати подій, які відбувалися до початку пандемії COVID‑19.
Poyiadji et al. повідомили про неврологічні прояви COVID‑19 у 58-річної жінки, яку госпіталізували до лікарні м. Детройт (США) з кашлем, гарячкою та сплутаною свідомістю. За результатами МРТ встановили діагноз гострого некротизувального (з геморагічним компонентом) енцефаліту [25]. Duong et al. представили випадок 41-річної жінки з COVID‑19, яка мала такі симптоми під час госпіталізації, як головний біль, гарячка, дезорієнтація, судоми й галюцинації [26]. КТ голови та аналіз СМР не виявили патологічних відхилень. Так само негативними виявилися результати обстеження 64-річного чоловіка, в якого коронавірусна інфекція проявлялася летаргією, дратівливістю, дисоціацією мовлення та дезорієнтацією [27].
За даними спостереження Mao et al., серед 214 пацієнтів, яких госпіталізували з тяжким перебігом COVID‑19, у 14,8% відзначали порушення свідомості різного ступеня, а в одному випадку – судоми [6]. При обстеженні 58 хворих ВІТ із тяжким перебігом COVID‑19 та гострим респіраторним дистрес-синдромом (ГРДС) було виявлено, що 65% мали порушення свідомості, а в 69% випадків неврологічні розлади проявлялися ажитацією [28]. Серед 13 пацієнтів, яким виконали МРТ через непояснену енцефалопатію, в 62% (8/13) спостерігали лептоменінгеальне посилення сигналу, у 23% (3/13) – ішемічні інсульти, а в усіх 11 осіб, яким додатково виконували перфузійну нейровізуалізацію, – двобічну фронтотемпоральну гіпоперфузію. Цікаво, що у двох хворих на дифузійно-зважених МР-зображеннях були виявлені вогнища раніше перенесених малих інсультів, які не очікувалося знайти з огляду на неврологічний статус. В одного пацієнта був асимптомний ішемічний інсульт у ділянці мозочка [28].
Ураження периферичної нервової системи
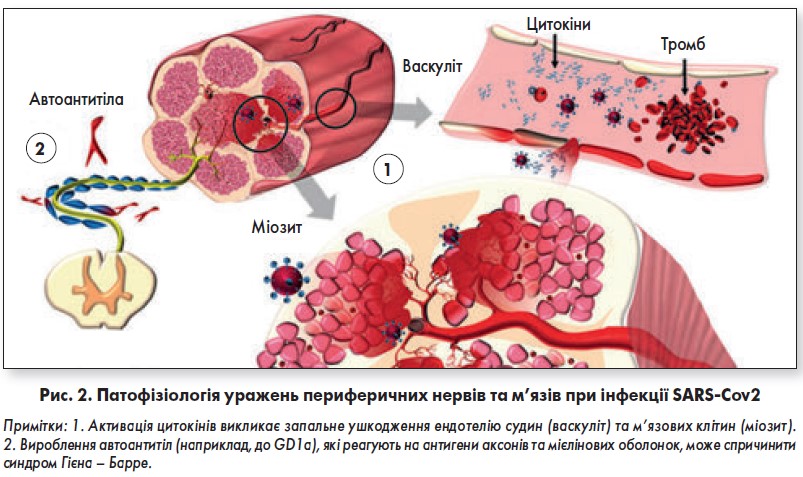
SARS-Cov2, подібно до свого попередника SARS-Cov1, здатний викликати серйозні ушкодження черепних нервів, периферичних нервів та м’язів. Слабкість м’язів обличчя, утруднене дихання, втрата здатності стояти або ходити можуть бути частково пояснені розвитком синдрому Гієна – Барре (СГБ) при COVID‑19. Gutierrez-Ortiz описав двох пацієнтів із порушеннями окорухової функції, що відповідали діагнозу синдрому Міллера – Фішера, та поліневритом черепних нервів. Їхні симптоми включали аносмію, агевзію, арефлексію, атаксію, між’ядерну офтальмоплегію та фасцикулярний параліч окорухових м’язів [29]. В одного хворого виявився позитивним аналіз крові на антитіла до гангліозиду GD1b. Пацієнти, яким негайно був призначений внутрішньовенний імуноглобулін, у результаті лікування швидко одужали.
В іншого хворого на COVID‑19 Toscano et al. спостерігали виразну слабкість мімічних м’язів та сенсорну атаксію [30]. На МРТ голови виявляли посилення сигналу від лицьового нерву. Цей пацієнт також добре відповідав на терапію внутрішньовенним імуноглобуліном і мав відчутне покращення вже за тиждень [30]. Чотири інших пацієнти з цього спостереження мали типовіший перебіг СГБ і основні симптоми COVID‑19 різного ступеня виразності. Загалом в усіх осіб із COVID‑19, що мали ураження черепних нервів різного ступеня тяжкості та слабкість у кінцівках, в яких швидко діагностували СГБ, подальший перебіг захворювання був сприятливим.
За даними обсерваційного дослідження Mao et al., пацієнти ВІТ із COVID‑19 мали різну етіологію летаргії, м’язової атрофії та слабкості [6]. Проте їхні м’язові симптоми були виразнішими, ніж можна пов’язати з перебуванням у ВІТ. Автори зазначають, що 19,3% хворих із тяжким перебігом COVID‑19 мали ознаки тяжкого ураження м’язів [6]. Подібні показники отримували також в інших ВІТ [31].
Патофізіологія уражень нервової системи
Цитокіновий шторм, гіперкоагуляція і психологія
Зв’язування SARS-Cov2 з ангіотензинперетворювальним ферментом 2 (АПФ2) на поверхні клітин вважається критичним етапом у патогенезі COVID‑19 [32]. У фізіологічному стані функція АПФ2 полягає в регулюванні артеріального тиску через пригнічення ангіотензин-ренін-альдостеронової системи [33]. АПФ2 зумовлює перетворення вазоконстрикторного ангіотензину ІІ на вазопротективний ангіотензин (1‑7) [33]. Високий рівень ангіотензину ІІ пов’язаний зі звуженням судин, нирковою дисфункцією, захворюваннями серця, апоптозом та посиленням окислювальних процесів, які прискорюють старіння і сприяють нейродегенерації [33].
Деякі серцево-судинні препарати, зокрема блокатори рецепторів ангіотензину та статини, чинять свої ефекти за посередництва АПФ2 [34]. Цей ферментний білок, що розташовується на клітинних мембранах багатьох органів, водночас є рецептором для вірусу SARS-Cov2 [32]. Дефіцит АПФ2 обмежує вплив інфекції SARS-Cov2 [32]. Тому АПФ2 теоретично може слугувати мішенню для засобів проти SARS-Cov2 [35]. АПФ2 поширений у численних органах, зокрема на слизовій оболонці носової порожнини, в легенях, нирках, кровоносних судинах, на поверхнях клітин імунної системи, а також у головному мозку [36, 37].
Після зв’язування з АПФ2 на поверхні респіраторного епітелію і потім на ендотеліоцитах судин вірус SARS-Cov2 викликає «цитокіновий шторм» – бурхливе вивільнення прозапальних медіаторів, таких як інтерлейкін‑1/-6, фактор некрозу пухлин (ФНП) тощо [38, 39]. Високий рівень зазначених цитокінів підвищує проникність судинної стінки, спричиняє набряк та поширення реакції запалення з наступним ураженням органів [40]. Цитокіновий шторм також запускає каскад гіперкоагуляції, внаслідок чого утворюються дрібні й великі тромби [39].
У поєднанні гіперактивація прозапальних факторів, ураження судин та гіперкоагуляція можуть спричиняти ГРДС, ниркову, серцеву недостатність, ураження печінки, інфаркт міокарда (ІМ), а також численні неврологічні порушення, патогенез яких буде розглянуто детальніше. Пряме проникнення вірусу SARS-Cov2 до головного мозку, що було описано для інших коронавірусів, може впливати на процеси демієлінізації та нейродегенерації [2, 12].
Пацієнти з COVID‑19, особливо ті, яких госпіталізують та ізолюють від сімей, переживають потужний психологічний стрес [41]. При екстремальному стресі також підвищуються рівні цитокінів, що може робити свій внесок у розвиток ускладнень інфекції, особливо якщо органи вже уражені внаслідок цитокінового шторму [42]. Крім того, тривалий стрес і запальна відповідь можуть надалі спричиняти довгострокові нейропсихіатричні та нейрокогнітивні порушення у пацієнтів, які одужали після COVID‑19 [43].
Стадіювання нейроCOVID: від аносмії до енцефалопатії
Внаслідок аналізу потенційних патофізіологічних механізмів розвитку неврологічних проявів інфекції SARS-Cov2 було запропоновано концепцію стадіювання уражень нервової системи при COVID19, яка може отримати розвиток у клінічних дослідженнях.
Стадія I
SARS-Cov2 зв’язується з АПФ2 на мембранах епітеліальних клітин, інфікування обмежується носовою і ротовою порожнинами. Спостерігається незначне контрольоване підвищення рівня прозапальних цитокінів, активованих вірусом. Пацієнти мають лише порушення відчуття смаків і запахів, не потребують спеціальних втручань.
Стадія ІІ
SARS-Cov2 викликає посилену імунну відповідь із високими рівнями цитокінів – цитокіновий шторм, що спричиняє підвищення рівня феритину, С-реактивного білка та D-димеру. Внаслідок гіперкоагуляції утворюються кров’яні тромби, що можуть стати причиною інсульту. Активна імунна відповідь також здатна викликати васкуліт судин, які живлять м’язи та нерви. На додачу, молекулярна мімікрія вірусу спричиняє вироблення автоантитіл, які ушкоджують черепні й периферичні нерви та м’язи.
Стадія ІІІ
Цитокіновий шторм прориває ГЕБ, відбуваються інфільтрація мозкової тканини прозапальними факторами, елементами крові, безпосереднє проникнення вірусних часток до нейронів. Унаслідок набряку мозку і прямого нейронального ураження можуть розвиватися делірій, енцефалопатія та/або судомний синдром. Високе вірусне навантаження призводить до зв’язування значної частини АПФ2 у крові, що зумовлює суттєве зростання рівня ангіотензину ІІ. Ангіотензин-залежними наслідками є підвищений опір периферичних судин та АГ, що підвищує ризик внутрішньочерепних крововиливів.
Аносмія та агевзія
Аносмію у хворих на COVID‑19 частково можна пояснити неспецифічними симптомами інфекції верхніх дихальних шляхів, зокрема закладеністю носа. Проте в літературі повідомляється, що назальні симптоми, типові для грипу та риновірусної застуди, часто відсутні у пацієнтів із COVID‑19 [44]. Фактично у них не спостерігається значної закладеності або ринореї [44, 45]. Особи з аносмією інколи мають хибне відчуття зниження або втрати сприйняття смаків [46]. Через тісну спорідненість функцій нюху і смакового відчуття хворі на респіраторні інфекції вважають, що втратили здатність сприймати смаки, хоча насправді в них лише порушилася нюхова функція [46].
Однак дані деяких досліджень показали, що смакова дисфункція у пацієнтів із COVID‑19 трапляється частіше, ніж порушення нюху, і що в 10,2‑22,5% випадків COVID‑19 супроводжується втратою смакового сприйняття без порушення нюху [17, 19, 45, 47, 48]. Таким чином, агевзія є специфічним симптомом COVID‑19, що відрізняється від грипоподібних симптомів (закладеності) та хибного відчуття втрати смаку внаслідок втрати лише нюху при інших респіраторних інфекціях [47].
Порушення відчуття запахів і смаків при COVID‑19, імовірно, зумовлені інфікуванням епітеліальних клітин слизових оболонок (рис. 1) [17, 47]. АПФ2 у значній кількості наяявний на сенсорних клітинах носоглотки і ротової порожнини [49, 50]. Зв’язуючись з АПФ2, вірус SARS-Cov2 може пригнічувати функцію сенсорних клітин. Ретроградне поширення вірусу з назальної слизової оболонки до головного мозку було описане для SARS-Cov1 [51, 52]. Можливо, що SARS-Cov2 також здатний проникати крізь решітчасту пластину й інфікувати нейрони нюхової цибулини – центральний механізм втрати відчуття запахів [53]. Подібним чином, ретроградне поширення вірусу з рецепторних клітин на язику до нейронів одиночного ядра довгастого мозку може пояснювати втрату відчуття смаку в осіб із COVID‑19 [54].
Тож необхідні додаткові нейропатологічні та візуалізаційні дослідження, щоб довести існування цих шляхів міграції вірусу із безпосереднім ураженням структур ЦНС. Враховуючи той факт, що втрата нюху і смаку дуже поширена серед пацієнтів із COVID‑19 і повністю зникає впродовж тижнів, центральна етіологія даних порушень поки що виглядає малоймовірною.
На додачу, потребує відповіді запитання, чому між популяціями пацієнтів з Азії та Європи настільки значні відмінності за частотою порушень нюху і смаку? В китайському дослідженні серед госпіталізованих пацієнтів у м. Ухань таких було 5%, тоді як за результатами трьох європейських випробувань цей показник становив від 33,9 до 88% [6, 9, 17, 18]. Можливим поясненням є поліморфізм генів, які кодують АПФ2. За попередніми даними, в азіатській популяції трапляються різні алельні варіанти АПФ2, і деякі з них кодують білок, що має нижчу сприйнятливість до вірусу SARS-Cov1 [56, 57]. Якщо це дійсно так, симптоми і наслідки інфекції COVID‑19 можуть значно варіювати залежно від того, який варіант АПФ2 представлений у різних тканинах і органах. Вочевидь, це питання потребує подальшого вивчення.
Цереброваскулярна патологія
Пацієнти з COVID‑19, у яких розвиваються цереброваскулярні захворювання, нерідко мають артеріальну гіпертензію (АГ) [58]. Інсульти та інші неврологічні стани також частіше трапляються в осіб із COVID‑19, які хворіють на цукровий діабет [12, 21, 58, 59]. З’являються все нові докази того, що високий індекс маси тіла пов’язаний із тяжчим перебігом COVID‑19, смертність вища у пацієнтів з ожирінням, а останнє, зокрема, саме по собі є фактором ризику захворіти на COVID‑19 [60, 61]. Таким чином, АГ, цукровий діабет та ожиріння є значущими факторами ризику серцево-судинних та цереброваскулярних подій в осіб із COVID‑19 [62].
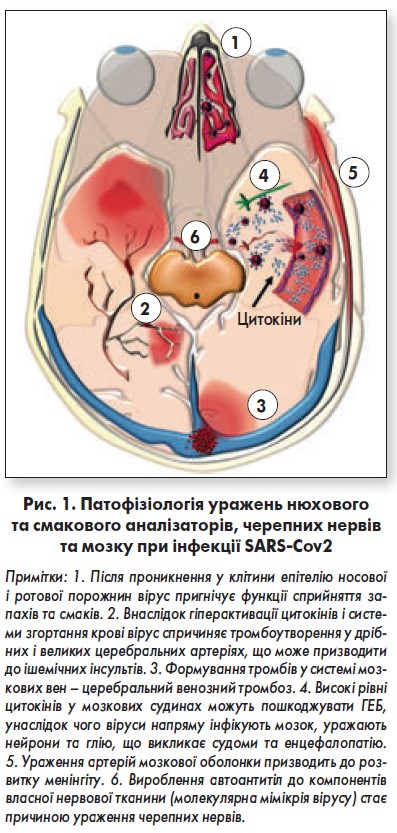 Наразі переконливо доведено, що при коронавірусній інфекції підвищується ризик гіперкоагулопатії [40]. Кров’яні тромби можуть формуватися як в артеріях, та і венозній системі головного мозку (рис. 1) [21, 63]. Тромбоз також буває причиною ІМ, легеневої емболії, ниркової недостатності [40, 64]. Повідомлялося про випадки одночасного розвитку ішемічного інсульту та тромбозу глибоких вен у пацієнтів із COVID‑19 [59]. Стан гіперкоагуляції може поєднуватися з високими концентраціями прозапальних маркерів, таких як С-реактивний білок, феритин, інтерлейкін‑1/-6, ФНП-α та D-димер [65]. Потрібно дослідити, яким чином зв’язування вірусу з АПФ2 запускає цитокіновий шторм та вторинну гіперкоагуляцію.
Наразі переконливо доведено, що при коронавірусній інфекції підвищується ризик гіперкоагулопатії [40]. Кров’яні тромби можуть формуватися як в артеріях, та і венозній системі головного мозку (рис. 1) [21, 63]. Тромбоз також буває причиною ІМ, легеневої емболії, ниркової недостатності [40, 64]. Повідомлялося про випадки одночасного розвитку ішемічного інсульту та тромбозу глибоких вен у пацієнтів із COVID‑19 [59]. Стан гіперкоагуляції може поєднуватися з високими концентраціями прозапальних маркерів, таких як С-реактивний білок, феритин, інтерлейкін‑1/-6, ФНП-α та D-димер [65]. Потрібно дослідити, яким чином зв’язування вірусу з АПФ2 запускає цитокіновий шторм та вторинну гіперкоагуляцію.
Хоча у більшості опублікованих випадків порушень мозкового кровообігу з-поміж пацієнтів із COVID‑19 описані ішемічні інсульти, повідомлялося також про внутрішньочерепні крововиливи [12, 21, 66]. Точний механізм їхнього розвитку залишається невідомим. Одне з імовірних пояснень полягає в тому, що за рахунок пригнічення функції АПФ2 вірус SARS-Cov2 сповільнює конверсію ангіотензину ІІ в ангіотензин (1‑7) [33]. Вазоконстрикція, асоційована із пригніченням АПФ2, здатна сприяти розриву судин головного мозку. Інша можливість пов’язана з генним поліморфізмом АПФ, що, вірогідно, зумовлює підвищений ризик внутрішньочерепних крововиливів, особливо в азійській популяції [67].
Судоми та енцефалопатія
У пацієнтів, які перебувають у ВІТ в тяжкому стані і отримують інтенсивну медикаментозну терапію, можуть відбуватися втрата пам’яті, сповільнення розумової діяльності та навіть розвиватися делірій або кома [68]. Тому когнітивні порушення серед осіб із тяжким COVID‑19 не обов’язково відображають ураження мозку вірусом. Проте у хворих на COVID‑19 частота енцефалопатії та делірію є значно вищою, ніж можна пояснити перебуванням у ВІТ [6, 69].
Аналіз обмеженої кількості публікацій із проблеми COVID‑19 дозволяє припустити, що SARS-Cov2 частіше спричиняє імунно-опосередковану енцефалопатію, ніж пряме вірусне пошкодження мозку [12]. Внаслідок активації вірусом цитокінів ушкоджується гематоенцефалічний бар’єр (ГЕБ) [12]. Проникний ГЕБ пропускає цитокіни до мозкової паренхіми, особливо у скроневих частках, де ГЕБ слабший [70, 71]. Бурхлива запальна відповідь та проникнення елементів крові до мозку спричиняють судоми й енцефалопатію [12]. Пряме інфікування вірусом нейронів також не виключається (рис. 1).
Відомо, що нейрони несуть на своїх мембранах АПФ2, і посмертні патогістологічні дослідження виявили SARS-Cov1 (методом електронної мікроскопії) у нейронах за даними пацієнтів із ГРДС 2002 р. [72]. Проте під час епідемії сьогодення, за виключенням двох випадків позитивної ПЦР на SARS-Cov2 у спинномозковій рідині хворих на менінгіт/енцефаліт, усі інші дослідження, в яких СМР піддавали аналізу, не виявили слідів вірусу SARS-Cov2 [23, 24, 27, 28, 73, 74]. Обговорюється, що негативні результати могли бути зумовлені недостатнім відпрацюванням техніки проведення аналізу СМР або меншим вірусним навантаженням у СМР/ЦНС [75].
В осіб із COVID‑19, у клінічній картині яких спостерігаються гострий головний біль, ригідність шийних м’язів, судоми та порушення свідомості, слід запідозрити менінгіт [24]. Мозкова оболонка багата на судини і у значній кількості експресує АПФ2 [37]. Ураження менінгеальних судин і запалення оболонки спричиняють симптоми менінгіту [12].
Черепні нерви, периферичні нерви та м’язи
Синдром Гієна – Барре, який проявляється висхідним паралічем і втратою чутливості різного ступеня внаслідок ураження черепних нервів, зазвичай виникає після бактеріальних або вірусних інфекцій. Повідомлялося про випадки СГБ у пацієнтів із коронавірусною інфекцією SARS-Cov1 у 2002‑2003 рр. [12]. Наразі вже опубліковано декілька спостережень СГБ із типовою аксональною невропатією, демієлінізацією або паралічем черепних нервів у хворих на COVID‑19 [6, 29, 30, 76, 77].
Вважається, що СГБ розвивається за механізмом «молекулярної мімікрії», тобто внаслідок перехресного реагування натуральних імуноглобулінів, які виробляються для боротьби з бактеріальними або вірусними збудниками, на специфічні білки, що входять до складу мієліну, аксону або нервово-м’язових з’єднань [78]. Цитокіни, активовані вірусом SARS-Cov2, також здатні ініціювати васкуліт у судинах, які живлять нерви та м’язи, з/без залучення механізму молекулярної мімікрії (рис. 2) [78]. Пряма інвазія вірусу в периферичні нерви теоретично можлива, але малоймовірна, враховуючи негативні результати пошуку SARS-Cov2 у СМР [29, 30]. Поки що описані клінічні випадки зі швидкою відповіддю на внутрішньовенний імуноглобулін свідчать на користь імунно-опосередкованої етіології невропатії черепних і периферичних нервів у пацієнтів із COVID‑19.
Ураження м’язів і високі рівні креатинкінази в осіб із COVID‑19, які лікуються у ВІТ, можуть бути пов’язані з невропатією та/або міопатією критичних станів [79]. Седативні засоби та міорелаксанти також здатні порушувати моторні функції. Проте виразна м’язова слабкість у пацієнтів із COVID‑19 буває проявом васкуліту або міозиту (рис. 2) [79]. Водночас відомо, що SARS-Cov2 може викликати міокардит та ІМ внаслідок цитокінового шторму, гіперкоагулопатії та ішемії [64]. Інвазію вірусу в нейрони стовбура головного мозку також вивчають як імовірний механізм м’язової слабкості [52, 80‑82].
Віддалені ускладнення: нейрокогнітивні та психіатричні стани
Нейрони у великій кількості містять АПФ2, тому SARS-Cov2 здатний проникати в них і порушувати важливі внутрішньоклітинні процеси, такі як вироблення енергії в мітохондріях та конформація білків [83]. SARS-Cov2, як, зокрема, інші коронавіруси, може лишатися всередині деяких нейронів, не завдаючи їм значної шкоди [11]. Порушення конформації та агрегації білків у пацієнтів, які вижили і одужали після гострої інфекції, теоретично можуть призводити до дегенерації мозку впродовж наступних десятиліть [83].
Оскільки деякі ефекти SARS-Cov2 маніфестують через місяці або й роки після інфікування, важливо організувати подальше спостереження за пацієнтами, які одужують. Ведення реєстрів хворих, які перенесли COVID‑19 із неврологічними ускладненнями, допоможе встановити кореляції з вік-залежними та нейродегенеративними патологіями, як-от хвороба Паркінсона. Це цілком можливо, оскільки раніше було виявлено зв’язок між SARS-Cov1 і підвищеним ризиком розвитку хвороби Паркінсона та розсіяного склерозу [84, 85].
На сьогодні пандемія все ще перебігає на ранніх стадіях, і лікарі концентрують зусилля на лікуванні гострих наслідків COVID‑19, що загрожують життю, таких як легенева емболія, ГРДС, ІМ, енцефаліт, ниркова недостатність, параліч, кома тощо. Однак існує висока імовірність того, що цитокіновий шторм, великі й малі інсульти, ушкодження ГЕБ та високий рівень запалення у мозковій речовині спричиняють довготривалі нейропсихіатричні розлади.
Системи охорони здоров’я в усьому світі вже найближчими роками можуть бути завантажені напливом осіб із депресією, посттравматичними стресовими розладами, тривогою, інсомнією, психозами, когнітивними порушеннями. Як і під час епідемій SARS-Cov1 та MERS, не всім пацієнтам з інфекцією SARS-Cov2 після виписки з лікарні на 100% вдасться відновити дохворобливий рівень нейрокогнітивного та емоційного функціонування. За даними дослідження нейропсихіатричних наслідків SARS-Cov1 при повторному обстеженні хворих через 31‑50 місяців після гострої інфекції, були знайдені ознаки посттравматичного стресового розладу в 39% випадків, депресії – 36,4%, обсесивно-компульсивного – 15,6%, панічного розладу – 15,6% [10].
Цитокіновий шторм може спричинити серію дрібних інсультів без відчутного неврологічного дефіциту [28]. Дрібні ураження мозку мають ефект накопичення, що інколи проявляється вже після виписки з лікарні порушеннями пам’яті, уваги, сповільненням обробки інформації. Тому таким пацієнтам доцільно звернутися до невролога для проведення нейрокогнітивного обстеження через 6‑8 місяців після виписки з лікарні, якщо зберігаються скарги на відповідні порушення. Особам із низькими оцінками у певних когнітивних доменах може бути призначено мозкову реабілітацію. Таким чином є нагода знизити ризик прогресування когнітивних порушень до деменції [86, 87].
Одним із найчастіше згадуваних фактів про COVID‑19 є те, що хворі з судинними чинниками ризику, такими як ожиріння, АГ і цукровий діабет, мають гірші наслідки порівняно зі здоровими та фізично активними індивідами, які інфіковані SARS-Cov2. Як наслідок, рекомендації регулярних фізичних вправ, здорового харчування, зменшення стресових факторів, покращення умов для сну набувають ще більшого значення у контексті попереджання серцевих нападів та інсультів під час пандемії [86, 87]. Здатність здорового організму опиратися вірусу SARS-Cov2 підвищує шанси на швидке і повне одужання після зустрічі з інфекцією.
Значення для неврологічної практики і питання для майбутніх досліджень
Зважаючи на цитокініндуковану гіперкоагуляцію та схильність до формування тромбів у легенях, серці, нирках і мозку, що суттєво ускладнюють перебіг COVID‑19 і загрожують життю пацієнтів, необхідні подальші дослідження ефективності антикоагулянтів і антитромбоцитарних засобів. Заходи профілактики судинних подій можуть знизити частоту легеневої емболії, серцевих нападів, ниркової недостатності та емболічних інсультів в осіб із COVID‑19. Наразі стартують клінічні випробування, в яких перевірятиметься ця гіпотеза.
Також є потреба у проведенні клінічних досліджень, які фіксуватимуть гострий початок неврологічних симптомів, результати детальних неврологічних обстежень, темпи прогресування та довгострокові наслідки розладів із боку нервової системи у хворих на COVID‑19. Оскільки деякі пацієнти з COVID‑19 можуть звертатися до лікарень і амбулаторій лише з неврологічними симптомами, не маючи типових симптомів гострої інфекції дихальних шляхів, слід враховувати небезпеку інфікування оточуючих та медперсоналу внаслідок нерозпізнаного випадку COVID‑19 [2].
Можливо, є потреба в розробці довізитного скринінгу, який включав би питання про аносмію, агевзію, гарячку, кашель, задишку, контакти із хворими на COVID‑19. Також доцільно ввести для всіх відвідувачів неврологічних відділень обов’язкові вимірювання температури, артеріального тиску, частоти серцевих скорочень та насичення крові киснем.
Важливо зазначити, що, хоча COVID‑19 має численні неврологічні прояви – від аносмії, черепних і периферичних паралічів до інсульту й енцефалопатії, ці самі симптоми нерідко зумовлені не інфекцією, а іншими гострими чи хронічними неврологічними станами. Дебют однобічної слабкості, судом або диплопії може мати некоронавірусну етіологію, навіть якщо пацієнт нещодавно переніс інфекцію SARS-Cov2.
Ясно одне – COVID‑19 вже сьогодні слід додати до переліку диференційної діагностики у неврологічній практиці. Ймовірно, найближчими роками неврологам доведеться ближче познайомитися з такими лабораторними аналізами, як цитокіни, D-димер, СРБ, феритин, лейкоцитарна формула, а також ПЦР та серологічними тестами на SARS-Cov2 [7].
Підготував Сергій Романюк
Список літератури доступний в оригінальній публікації
Тематичний номер «Неврологія, Психіатрія, Психотерапія» № 3 (54) 2020 р.