24 квітня, 2021
Інгаляційні кортикостероїди в лікуванні COVID-19: передумови та докази
 На початку пандемії коронавірусної хвороби (COVID-19) лікарі насамперед хвилювалися за пацієнтів із хронічними захворюваннями легень. Теоретично хворі на бронхіальну астму (БА) повинні були мати підвищену сприйнятливість до інфекції SARS-CoV-2, тяжчий її перебіг і високий ризик загострення астми через дефіцит противірусного захисту. Проте на практиці все виявилося з точністю до навпаки: пацієнти з БА значно легше переносили COVID-19 порівняно із загальною популяцією. Останнім часом з’являється дедалі більше робіт, автори яких припускають, що БА не лише не спричиняє тяжкого перебігу нової коронавірусної інфекції, але й може надавати певний протекторний ефект. За рахунок чого досягається цей ефект і яке значення він може мати в клінічній практиці?
На початку пандемії коронавірусної хвороби (COVID-19) лікарі насамперед хвилювалися за пацієнтів із хронічними захворюваннями легень. Теоретично хворі на бронхіальну астму (БА) повинні були мати підвищену сприйнятливість до інфекції SARS-CoV-2, тяжчий її перебіг і високий ризик загострення астми через дефіцит противірусного захисту. Проте на практиці все виявилося з точністю до навпаки: пацієнти з БА значно легше переносили COVID-19 порівняно із загальною популяцією. Останнім часом з’являється дедалі більше робіт, автори яких припускають, що БА не лише не спричиняє тяжкого перебігу нової коронавірусної інфекції, але й може надавати певний протекторний ефект. За рахунок чого досягається цей ефект і яке значення він може мати в клінічній практиці?
Спробуємо докладніше розібратися з цими питаннями.
Зв’язування вірусу SARS-CoV-2 із рецептором клітин людини
Інокуляція SARS-CoV-2 у дихальні шляхи людини зумовлює пригнічення активності мукоциліарного кліренсу епітелію та супроводжується загибеллю епітеліоцитів. Вірус SARS-CoV-2 через слизову оболонку носа, гортані, бронхіального дерева проникає в периферичну кров і надалі може проникати в клітини так званих цільових органів (легені, кишечник, серце, нирки).
Основним рецептором клітин, з яким зв’язується шипуватий протеїн S (spike protein) вірусу SARS-CoV-2, є рецептор ангіотензинперетворювального ферменту-2 (angiotensin-converting enzyme 2 – ACE2). У результаті зв’язування S-протеїну з рецептором ACE2 відбувається проникнення вірусу SARS-CoV-2 до клітини (рис. 1). Оскільки найбільша щільність зазначеного рецептора характерна для альвеолоцитів, легенева тканина уражається наймасштабніше. Крім того, рецептори ACE2 широко представлені в кишечнику, нирках і серці.
Слід зазначити, що для подальшого проникнення вірусу до клітини необхідне розщеплення протеїну ACE2, що здійснюється за допомогою трансмембранної серинової протеази-2 (transmembrane protease serine 2 – TMPRSS2) (Mao L. et al., 2020).
Після проникнення вірусу в клітину відбувається його «роздягання», вивільнення вірусної РНК у цитоплазму та починається реплікація вірусного генома. З вірусної РНК транслюються й структурні протеїни SARS-CoV-2. Сформовані глікопротеїни оболонки вірусу вбудовуються в мембрану ендоплазматичного ретикулуму чи комплексу Гольджі. Надалі везикули, котрі містять сформовані віріони, зливаються з мембраною клітини та вивільняються назовні (Li X. et al., 2020).
Перебіг COVID‑19 у пацієнтів із БА
Спалах SARS-CoV‑2, що виник у м. Ухань (Китай) наприкінці 2019 р., став місцевим осередком коронавірусної інфекції. Місцеві лікарі, котрі першими зустріли епідемією, почали виявляти певні закономірності перебігу захворювання. Цілком прогнозовано пацієнти із супутньою патологією мали тяжчий перебіг COVID‑19. За даними метааналізу семи клінічних досліджень, який включив 1527 госпіталізованих пацієнтів із коронавірусною інфекцією, найпоширенішими супутніми захворюваннями були артеріальна гіпертензія – 21,1%, цукровий діабет – 9,7%, серцево-судинні захворювання – 8,4%, захворювання дихальної системи – 1,5% (Yang J. еt al., 2020).
За попередніми прогнозами науковців, пацієнти з БА повинні були б мати підвищену сприйнятливість до інфекції SARS-CoV‑2 й тяжчий її перебіг. Усупереч цим побоюванням БА не лише не підвищувала ризик госпіталізації та тяжкого перебігу коронавірусної інфекції порівняно із загальною популяцією, а й навіть дещо знижувала його. З усіх пацієнтів, госпіталізованих у м. Ухань із діагнозом COVID‑19, лише в 5 (0,9%) відзначалася БА. Показник поширеності БА серед пацієнтів, госпіталізованих із приводу COVID‑19, виявився значно нижчим за показник захворюваності на БА серед дорослого населення міста (0,9% проти 6,4%). Отже, в пацієнтів із БА інфекція, спричинена SARS-CoV‑2, мала легший перебіг. Такі неочікувані показники змусили науковців заговорити про «китайський феномен». Згодом подібні результати було отримано в Італії та низці інших країн.
Досить швидко з’явилося припущення, що зниження частоти тяжких випадків CОVID‑19 серед пацієнтів із БА пов’язане з прийомом певних лікарських засобів, які застосовуються в терапії цього захворювання. Найрозповсюдженішою схемою лікування БА в Китаї є інгаляційні кортикостероїди (ІКС), які використовують 76% пацієнтів у вигляді монотерапії чи в комбінації з β2-агоністами тривалої дії (45,6 та 30,4% пацієнтів відповідно). Тож саме ІКС стали першими «підозрюваними».
Ще однією причиною легшого перебігу COVID-19 у пацієнтів з атопічною астмою й алергічною сенсибілізацією є зниження експресії ACE2 у верхніх дихальних шляхах, що зменшує можливість одночасного проникнення великої кількості вірусних часток, тобто сприяє зменшенню вірусного навантаження. Зворотна залежність експресії ACE2 у носовому епітелії від тяжкості атопічної астми та рівня IgE була продемонстрована в дослідженні D.J. Jackson і співавт. (2020) (рис. 2).
Протекторні властивості ІКС у пацієнтів із гострим ушкодженням легень
Слід зазначити, що ІКС і раніше демонстрували високу ефективність у лікуванні пацієнтів з ушкодженням легень різноманітної етології. Про це свідчать результати об’єднаного вторинного аналізу оцінки 5584 пацієнтів, які були госпіталізовані у відділення невідкладної допомоги (22 лікарські заклади) з принаймні одним фактором ризику розвитку гострого респіраторного дистрес-синдрому (ГРДС). Пацієнти, котрі отримували системні кортикостероїди, були виключені з дослідження.
Надалі учасники дослідження були згруповані залежно від механізму ушкодження легень (пряме чи непряме). Загалом 1513 пацієнтів мали пряме ушкодження (аспірація, пневмонія, контузія легені тощо), інші – непряме (сепсис, тяжка травма тощо). Однофакторний аналіз показав, що попереднє застосування ІКС перед госпіталізацією асоціювалося з достовірним зниженням ризику ГРДС у всіх пацієнтів (p=0,05), особливо з прямим ушкодженням легень (p<0,007) (Ortiz-Diaz E. et al., 2011).
За даними інших дослідників, використання ІКС у пацієнтів із ризиком розвитку ГРДС знижувало рівні запальних маркерів і сприяло покращенню функції легень (Artigas A. et al., 2017).
Ефекти ІКС при СOVID-19
Вивчення особливостей перебігу грипу A/H1N1 серед 1520 госпіталізованих пацієнтів у Великій Британії показало, що хворі на астму на 49% рідше потребували підтримувальної інтенсивної терапії та мали нижчий ризик смерті порівняно з пацієнтами без астми. Дослідники пов’язують такі розбіжності із застосуванням ІКС. Це вказує на потенційний класовий ефект ІКС, можливо, внаслідок пригнічення цитокінів.
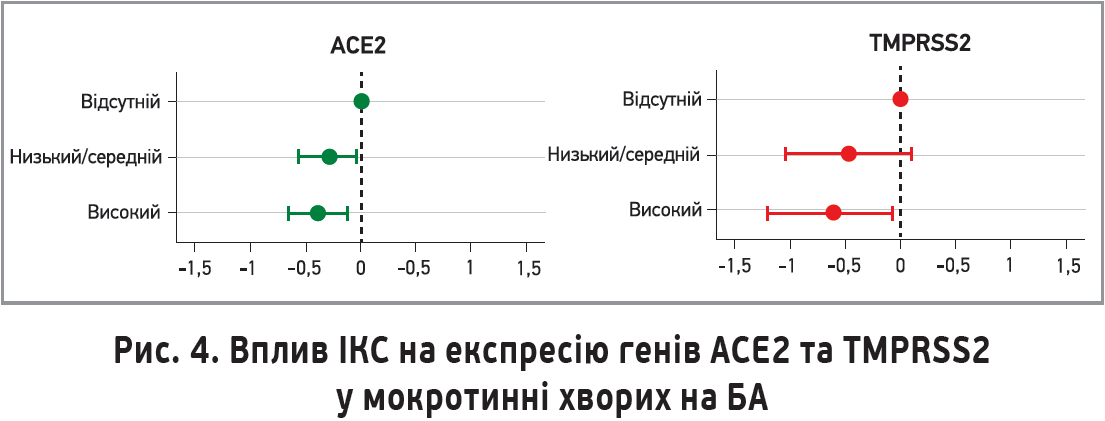
На користь цієї гіпотези вказує супресивний вплив будесоніду in vitro на продукцію цитокінів (зокрема, IL-6 та IL-8) у культурах клітин носового та трахеального епітелію людини (Yamaya M. et al., 2020). Це може бути особливо актуальним, оскільки підвищений рівень IL-6 тісно пов’язаний із гіршими наслідками в пацієнтів із тяжкою пневмонією й ознаками гіперзапалення, спричиненими SARS-CoV-2. Також було встановлено, що застосування ІКС у хворих на астму пов’язане зі зниженою експресією генів ACE2 та TMPRSS2, які беруть участь у проникненні SARS-CoV-2 до клітин хазяїна (рис. 3).
Відомо, що збільшення експресії генів АСЕ2 і трансмембранної серинової протеїнази‑2 (TMPRSS2) у клітинах легень підвищує сприйнятливість до інфекції SARS-CoV‑2, а також призводить до тяжчого перебігу захворювання.
ІКС зменшують експресію генів ACE2 та ТMPPSS2
Експресія генів є процесом, за якого спадкова інформація у вигляді нуклеотидної послідовності генів використовується для синтезу відповідного функціонального білка. Експресія генів у багатьох випадках активно регулюється внутрішньоклітинними механізмами.
Потужними регуляторами експресії генів є кортикостероїди, котрі здатні проникати в клітинне ядро, впливаючи на швидкість синтезу білка.
Одним з ефектів кортикостероїдів є зменшення представленості мембранних білків ACE2 та ТMPPSS2, які беруть безпосередню участь у проникненні вірусу SARS-CoV-2 до клітини.
M. Peters і співавт. (2020) продемонстрували, що застосування ІКС у пацієнтів із БА супроводжується зниженням експресії генів ACE2 та TMPRSS2 у мокротинні порівняно з контрольною групою осіб, які ІКС не застосовували. Простежувалася чітка кореляція між дозою ІКС і силою експресії генів. Найефективнішими виявилися високі дози кортикостероїдів (рис. 4).
Використання ІКС із метою лікування COVID-19
Щоб перевірити, чи будуть ІКС ефективними засобами раннього лікування коронавірусної інфекції, було проведено рандомізоване відкрите дослідження STOIC (STerOids in COVID‑19 Study). У ньому взяли участь 146 дорослих пацієнтів із підтвердженим діагнозом COVID‑19 на етапі розвитку перших симптомів захворювання. У дослідження не включали осіб, які потребували госпіталізації на момент обстеження; з алергією на будесонід в анамнезі й іншими протипоказаннями до прийому цього препарату; пацієнтів, які продовжували приймати інгаляційні чи системні кортикостероїди чи приймали їх протягом останніх 7 днів.
Пацієнти, котрі відповідали критеріям включення, надавали письмову згоду на участь у дослідженні. Вони були рандомізовані на дві групи: звичайного лікування (n=73) чи додаткового застосування будесоніду за допомогою сухопорошкового інгалятора в дозі 800 мкг двічі на день (n=73). Кожен учасник отримав паперовий щоденник симптомів, калібрований пульсоксиметр і термометр для щоденного моніторингу симптомів. До всіх учасників телефонували щодня для реєстрації сатурації крові киснем, температури й оцінки будь-яких несприятливих явищ у ході дослідження. Пацієнтам, яким призначили будесонід, було запропоновано припинити використання інгалятора, коли вони відчують, що одужали. На 28-й день дослідження всіх учасників тестували на наявність антитіл до SARS-CoV‑2 в сироватці крові.
Як первинну кінцеву точку було обрано кількість випадків госпіталізації до відділень інтенсивної терапії. Вторинні кінцеві точки включали середній час одужання; тривалість залишкових симптомів після COVID‑19; температуру тіла (1-14-й день); насичення крові киснем (1-14-й день); симптоми, оцінені за допомогою опитувальника застуди; симптоми, оцінені за допомогою опитувальника FluPro.
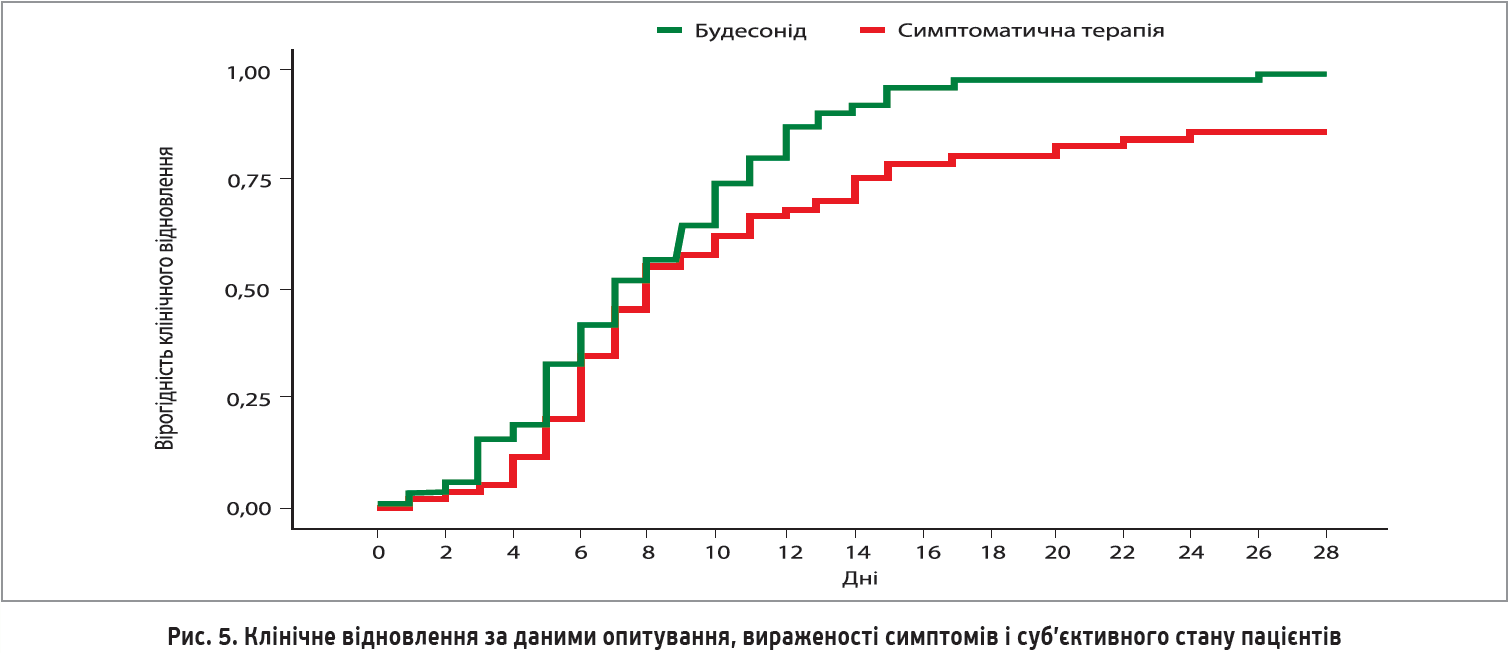
Серед осіб, які приймали будесонід, лише 1 пацієнт потребував невідкладної допомоги проти 10 пацієнтів у групі симптоматичного лікування. Отже, на тлі застосування ІКС потреба в невідкладній допомозі зменшилася на 90%.
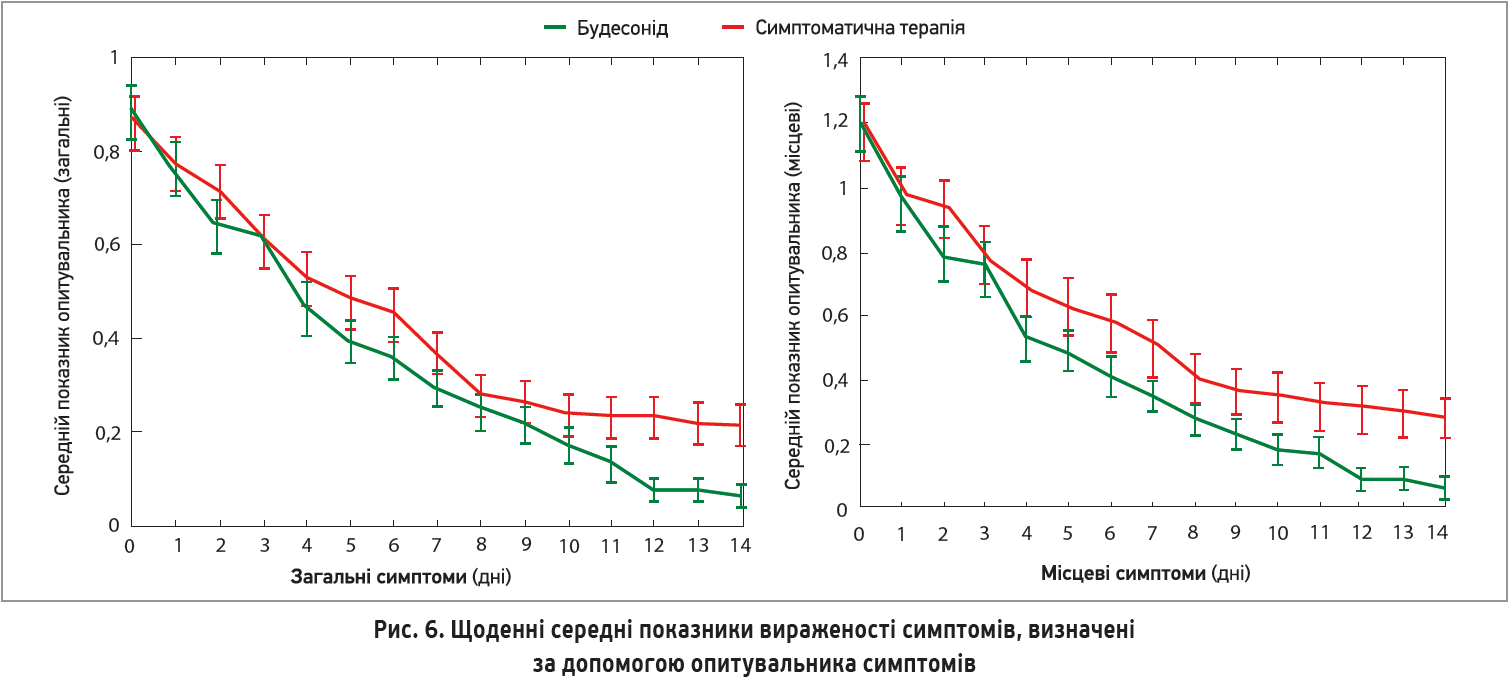
Клінічне одужання, про яке пацієнти повідомляли самостійно, було швидшим на 1 день у групі ІКС порівняно зі стандартним лікуванням (медіана – 7 проти 8 днів). Середній час відновлення в цих групах становив 8 і 11 днів відповідно (рис. 5).
На 14-й день симптоми, про які учасники повідомляли самостійно, були присутні в 10% (n=7) осіб, рандомізованих на прийом ІКС, порівняно з 30% (n=21) осіб, рандомізованих на отримання стандартного лікування (відношення ризиків 0,204; p=0,003).
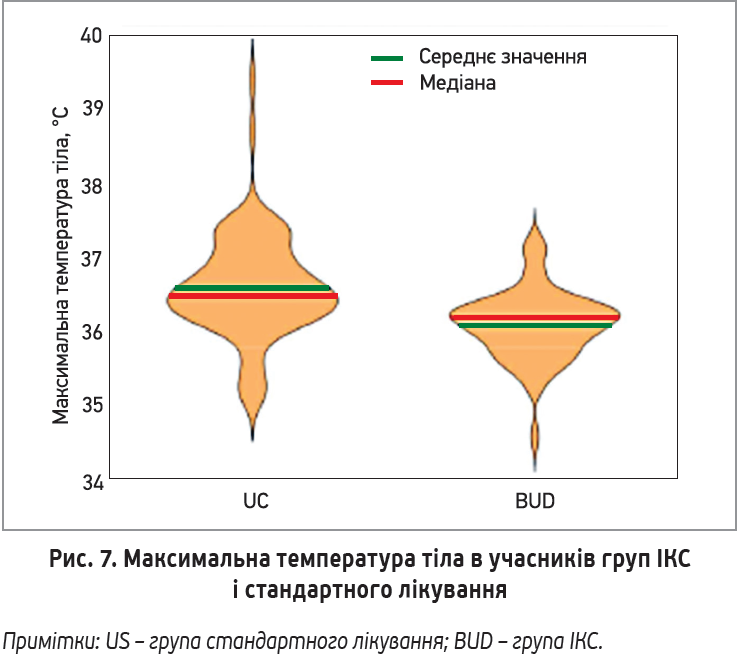
Середня частка днів із задокументованою лихоманкою (≥37,5 °C) протягом перших 14 днів становила 2,1% у групі ІКС і 7,7% у групі порівняння (тест Вілкоксона; р=0,051). Частка пацієнтів із принаймні 1 добою лихоманки становила 11 і 23% відповідно.
Об’єднані графіки стосовно розподілу найвищих температур демонструють, що температура тіла в групі ІКС знижувалася швидше (рис. 6).
Медіана від загальної кількості днів, протягом яких учасники потребували прийому антипіретиків (парацетамол, аспірин, ібупрофен), у групах отримання ІКС і стандартного лікування становила 27% (0-50) і 50% (15-171) відповідно (рис. 7).
Розрішення симптомів на 14-й день, як визначено в посібнику користувача, спостерігалося у 82% пацієнтів групи ІКС і 72% пацієнтів групи стандартного лікування.
Частка днів із насиченням крові киснем ≤94% протягом перших 14 днів становила 19 і 22% у групах ІКС і стандартного лікування відповідно.
Отже, попередні результати дослідження STOIC продемонстрували, що раннє призначення інгаляційного будесоніду достовірно знижує ризик госпіталізації та термінової медичної допомоги, зменшує тривалість COVID-19 і час відновлення після перенесеного захворювання. Утім, досить незначна вибірка пацієнтів не дає змоги говорити про високий ступінь доказовості. Тому можливість застосування ІКС як терапевтичного втручання при COVID‑19 потребує глибшого вивчення.
ІКС у пацієнтів з астмою
T. Maes і співавт. (2020) вважають, що пацієнти з астмою обов’язково повинні продовжувати використовувати «свої» ІКС як контролювальну терапію при COVID‑19. На їхню думку, застосування ІКС дасть змогу:
- забезпечити оптимальний контроль астми;
- створити певний захист від вірусних тригерів, можливо, включаючи навіть гострий респіраторний синдром, зумовлений вірусом SARS-CoV‑2.
Використання системних кортикостероїдів як контролювальної терапії в пацієнтів з астмою
Ризик смерті від COVID-19 був підвищений в осіб, які нещодавно отримували пероральні кортикостероїди для лікування астми (Williamson, 2020). Тому важливо продовжувати лікування астми зі стратегіями для забезпечення належного контролю симптомів, зменшення ризику серйозних загострень і мінімізації потреби в пероральних кортикостероїдах (Global Initiative for Asthma, INTERIM GUIDANCE, оновлення від 20.12.2020).
ІКС і доставкові пристрої
Добре відомим ІКС із доведеною клінічною ефективністю та вираженими протизапальними властивостями є будесонід. Сьогодні найдоступнішим інгаляційним препаратом будесоніду в Україні є сухопорошковий інгалятор Будесонід Ізіхейлер 200 мкг / 200 доз. Пацієнти з БА можуть отримувати Будесонід Ізіхейлер за рецептом згідно з урядовою програмою «Доступні ліки». Для цього лікарю в програмі виписки рецептів потрібно обрати сухопорошковий будесонід 200 мкг / 200 доз.
Доставковий пристрій Ізіхейлер забезпечує надходження достатньої дози ІКС у легені, покращує контроль БА при переведенні з аерозольних інгаляторів. Порівняно з аерозольними інгаляторами доставковий пристрій Ізіхейлер забезпечує вдвічі вищий відсоток доставки препарату в легені та на 35% збільшує осадження дози ІКС у легенях.
Інгалятор Ізіхейлер характеризується низкою переваг порівняно не тільки з аерозольними, але й з іншими сухопорошковими інгаляторами, як-от Турбухалер і Дискхaлер. Відомо, що сухопорошкові інгалятори можуть вводити не всю дозу препарату внаслідок недостатньої сили повітряного інспіраторного потоку. Тобто при виконанні інгаляції існує ризик, що доставлена доза не відповідатиме відміряній дозі інгалятора.
Ізіхейлер має високий внутрішній опір. Повітря під час вдиху стискається зі значним опором, зумовленим невеликим розміром вентиляційного отвору, що створює турбулентний повітряний потік у дозувальній чаші. Турбулентний потік повітря забезпечує дезагрегацію частинок лікарського засобу та викид достатньої дози навіть за низького інспіраторного потоку.
Згідно з даними A. Palander і співавт., Ізіхейлер доставляє точнішу дозу препарату, ніж Турбухалер і Дискус, навіть за низького інспіраторного потоку, що сприяє покращенню контролю БА (рис. 8). Також варто відзначити простоту та легкість застосування інгалятора Ізіхейлер®. Більшість пацієнтів навчаються використовувати Ізіхейлер® менш ніж за 5 хв. Застосування інгалятора відбувається в три основні кроки (рис. 9).
Окремо слід розглянути особливості ведення пацієнтів із неконтрольованим і тяжким перебігом БА в умовах пандемії COVID‑19. Такі пацієнти потребують призначення пероральних кортикостероїдів, але їх використання асоціюється з підвищенням ризику несприятливого перебігу COVID‑19 поряд із такими факторами, як ожиріння, цукровий діабет, артеріальна гіпертензія.
Альтернативою системним кортикостероїдам у разі загострення астми, хронічного обструктивного захворювання легень (ХОЗЛ) є небулізований флютиказону пропіонат (Manjra A. I. et al., 2000; Melani A. S., 2012).
Флютиказону пропіонат має високу спорідненість і тривалий зв’язок із ГКС‑рецепторами людини, що забезпечує потужну протизапальну дію в легенях. Флютиказону пропіонат є ефективним у дозі, що становить половину дози інших ІКС. Наприклад, відповідно до інструкції із застосування, 100 мкг флютиказону пропіонату приблизно еквівалентно 200 мкг дози беклометазону дипропіонату чи будесоніду. Відповідно, небулізований флютиказон має найвираженішу місцеву протизапальну дію в легенях з усіх небулізованих гормонів в Україні; його ефективність і безпека підтверджені результатами досліджень (Corren J., Berkowitz R., Murray J.J. et al., 2003; Kovalenko S.V., 2014).
У нашій країні в щоденній клінічній практиці для терапії загострень і досягнення контролю БА та ХОЗЛ широко використовується небулізований флютиказону пропіонат Небуфлюзон® («Юрія-Фарм»). Застосування препарату за допомогою небулайзера забезпечує високий показник потрапляння флютиказону пропіонату в легені та створення високих його концентрацій.
Усім пацієнтам з астмою потрібно знати, що добре контрольована астма не пов’язана з підвищеним ризиком виникнення чи тяжкого перебігу COVID-19. Відтак, хворі на астму мають продовжувати її адекватне базисне лікування й під час пандемії.
Отже, ІКС можуть бути перспективними препаратами як терапевтичне втручання при COVID‑19. Утім, це питання потребує глибшого вивчення. Наразі тривають численні клінічні випробування, що оцінюють ефективність застосування ІКС при COVID‑19 в Іспанії, США, Ірані, Південній Кореї; у Великій Британії дослідження вже завершилося. Сподіваємося, що їхні результати зможуть стати підґрунтям для втілення в практичні рекомендації.
На жаль, сьогодні не існує засобів специфічної етіотропної терапії інфекції SARS-CoV-2, але лікарі мають використовувати всі потенційно можливі заходи щодо зниження ризику тяжкого перебігу цього захворювання. Одним із таких заходів вважається застосування ІКС.
Медична газета «Здоров’я України 21 сторіччя» № 6 (499), 2021 р.