29 травня, 2021
Постковідний синдром: практичні запитання сімейних лікарів і відповіді спеціалістів
 Під час практичного тренінгу «Постковідний синдром (ПКС): практичні запитання сімейних лікарів і відповіді спеціалістів», який відбувся 3 березня у форматі онлайн, на найактуальніші запитання відповіла завідувачка кафедри педіатрії 4 Національного медичного університету ім. О. О. Богомольця (м. Київ), доктор медичних наук, професор Інга Олександрівна Мітюряєва.
Під час практичного тренінгу «Постковідний синдром (ПКС): практичні запитання сімейних лікарів і відповіді спеціалістів», який відбувся 3 березня у форматі онлайн, на найактуальніші запитання відповіла завідувачка кафедри педіатрії 4 Національного медичного університету ім. О. О. Богомольця (м. Київ), доктор медичних наук, професор Інга Олександрівна Мітюряєва.
Відповідно до вітчизняних статистичних даних, захворюваність на коронавірусну хворобу (COVID‑19) у зимово-весняний сезон 2021 р. не лише не зменшується, а й продовжує зростати. Наразі відомі дві основні патогенетичні ланки COVID‑19: потужна запальна відповідь та активація системи згортання крові. Надмірне запалення асоціюється з поліорганним ураженням, активація коагуляції – з ризиком розвитку тромбозів. Вважається, що імунітет до коронавірусної інфекції асоціюється не стільки з виробленням антитіл (АТ), скільки з функціонуванням Т-клітинної ланки.
Сімейних лікарів часто турбують такі питання, як тривале (2-3 тиж) збереження субфебрилітету, хронічної втоми, слабкості після COVID‑19; стійкий кашель на тлі нормального самопочуття й нормальних результатів лабораторних та інструментальних досліджень; поява нереспіраторної симптоматики (біль у суглобах і хребті, скутість у рухах, гіперестезії, серцебиття, болі в животі, нудота тощо). Таку клінічну картину узагальнюють терміном ПКС, який являє собою синдром мультисистемного запалення, що, очевидно, пов’язаний із попереднім впливом COVID‑19 (Mirza A. et al., 2021; Coffey D., 2021; Goodman B., 2021). Перші випадки ПКС було зафіксовано ще навесні 2020 р.
За даними літератури, клінічними проявами ПКС (або багатосистемного запального синдрому) є гарячка, значна слабкість, невралгії, головний біль, запаморочення, парестезії, зміни чутливості, висипи, кон’юнктивіт, легкі набряки повік, пальців стоп, кистей, поліартралгії, міалгії, біль у животі, діарея, блювання, міокардит, лівошлуночкова дисфункція, шок, лімфаденопатія. У лабораторних аналізах може спостерігатися значне підвищення маркерів запалення, тропоніну, D-димерів (Mirza A. et al., 2021; Coffey D., 2021; Goodman B., 2021; Henderson L.A. et al., 2020).
В основі патогенезу ПКС лежать два провідні механізми: утворення автоантитіл до інтерферону, клітин м’язів і сполучної тканини (особливо в осіб із генетичною схильністю до надмірної імунної відповіді), а також імунна дисрегуляція, що включає активацію інтерлейкіну‑1, порушення інтерферонової відповіді, сповільнення вірусного кліренсу й АТ-залежне посилення інфекції (Mirza A. et al., 2021; Coffey D., 2021; Goodman B., 2021; Henderson L.A. et al., 2020).
Американською колегією ревматології запропоновано алгоритм діагностики ПКС, згідно з яким на першому етапі проводяться загальноклінічний аналіз крові з лейкоцитарною формулою та визначенням швидкості осідання еритроцитів, визначення показників метаболічної панелі, С-реактивного білка, полімеразно-ланцюгова реакція (ПЛР) або серологічне обстеження для виявлення COVID‑19. Серологічне обстеження підтверджує коронавірусну інфекцію в 90% пацієнтів із ПКС, але ПЛР є позитивною лише у 20-40% таких хворих. Другий етап включає електро- та ехокардіографію, магнітно-резонансну томографію серця, визначення тропонінів і D-димерів, феритину, прокальцитоніну, лактатдегідрогенази, цитокінів (інтерлейкінів‑6 та -10, фактора некрозу пухлини) (Henderson L.A. et al., 2020).
Схема лікування ПКС продовжує обговорюватися. Із цією метою застосовуються метилпреднізолон, внутрішньовенне введення імуноглобулінів, аспірин, тоцилізумаб, антагоністи рецепторів до інтерлейкіну‑1 тощо (Cirks B.T. et al., 2021). Проте слід зауважити, що проблема полягає не лише в самому ПКС, а й у загостренні хронічних запальних захворювань унаслідок цитокінового шторму, опосередкованого коронавірусною інфекцією. Імунна система осіб із рецидивуючими респіраторними захворюваннями, хоча й не має грубих первинних і набутих порушень, характеризується високою напруженістю процесів імунного реагування, порушенням міжклітинної кооперації та недостатністю резервних можливостей. У таких пацієнтів у гострому періоді всіх гострих респіраторних інфекцій спостерігається своєрідна декомпенсація імунітету, а в період реконвалесценції – відновлення резервних можливостей системи інтерферону та лімфопоезу (Абатуров А.Е., 2020).
При обговоренні лікування COVID‑19 і ПКС у лікарів загальної практики нерідко постають такі запитання: чи доцільно призначати антибіотикотерапію при вірусній пневмонії, спричиненій коронавірусом; чи потрібні муколітики при сухому кашлі в разі такої пневмонії. На сьогодні провідними патогенами є мікст-інфекції. Наприклад, в етіологічній структурі гострих фарингітів бактеріальні моноінфекції становлять 26%, вірусні моноінфекції – 33%, мікст-інфекції «бактерія + вірус» – 20%, «типова + атипова флора» – 20%, «вірус + вірус» – 12% (Esposito S. et al., 2004). Така поширеність бактеріальних і мікст-інфекцій зумовлює доцільність застосування антибіотикотерапії. Що стосується муколітиків, то їх застосування покращує мукоциліарний кліренс і сприяє відновленню слизової оболонки дихальних шляхів після інфекції.
На жаль, наявні клінічні рекомендації та протоколи не пропонують протирецидивного лікування гострих респіраторних захворювань (NICE, 2018; Windfuhr J.P. et al., 2016). Цю функцію можуть виконувати препарати АТ, які вже активно використовуються в онкології, імунології, трансплантології та інших галузях медицини. Широке використання препаратів на основі АТ обмежується у зв’язку з високою вартістю виробництва та через часті побічні ефекти. Подолати ці обмеження можна шляхом застосування високих розведень АТ, які отримують шляхом поступового зниження концентрації АТ до надзвичайно низького рівня. Доклінічні та клінічні дослідження продемонстрували, що сильно розбавлені АТ до інтерферону-γ ефективні проти грипу й інших респіраторних інфекцій. Установлено також, що високі розведення АТ до інтерферону-γ спричиняють конформаційні зміни останнього та покращують зв’язування інтерферону-γ з відповідним рецептором. В експериментальному дослідженні з’ясувалося, що застосування високих розведень АТ до інтерферону-γ збільшує виживаність мишей, інфікованих грипом А (Tarasov S. A. et al., 2020).
Інтерферон-γ являє собою протизапальний цитокін, який індукує такі імунні реакції, як активація фагоцитів і диференціювання T-хелперів 1 типу, забезпечуючи високу опірність імунної системи до інфекцій. Вплив на інтерферон-γ є універсальним імуномодулювальним, оскільки цей інтерферон впливає і на вроджений, і на набутий імунітет, а також він ефективний як за вірусних, так і за бактеріальних інфекцій (Camilli G. et al., 2018).
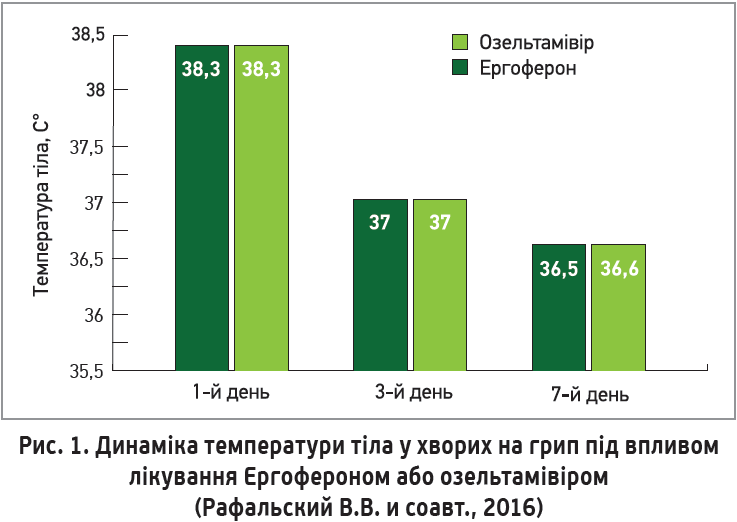
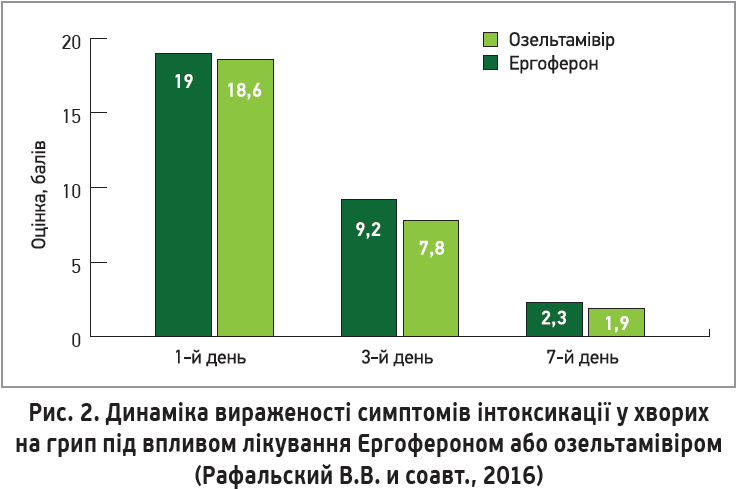
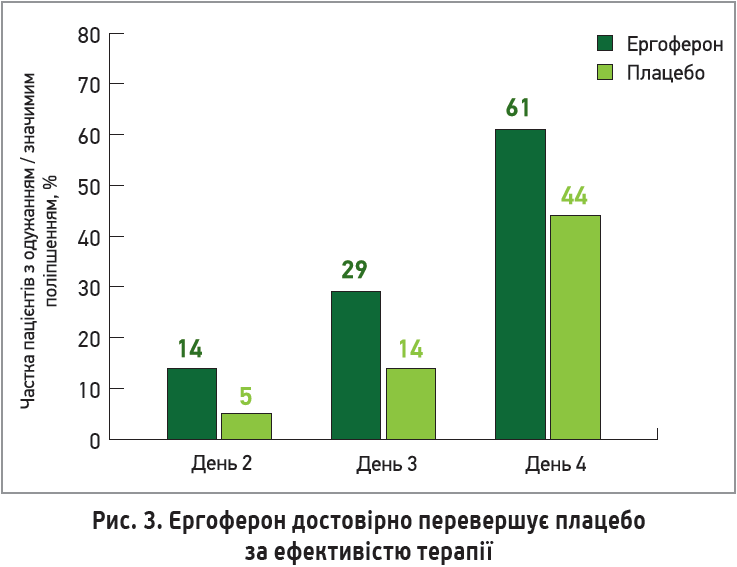
Препарат Ергоферон – комплексний лікарський засіб на основі високих розведень АТ до інтерферону-γ, рецепторів CD4 та гістаміну. АТ до інтерферону-γ та рецепторів CD4 забезпечують противірусну й імуномодулювальну дії, а АТ до гістаміну – противірусний та антигістамінний ефекти. Перевагами Ергоферону є висока ефективність, яку можна порівняти з еталонними фармакологічними препаратами; адаптивний фізіологічний характер дії в організмі; відсутність токсичності та розвитку толерантності чи звикання; можливість поєднання з будь-якими іншими препаратами без небажаної лікарської взаємодії. Важливо, що Ергоферон реалізує водночас етіотропну, патогенетичну та симптоматичну дії при грипі та гострих респіраторних вірусних захворюваннях; йому притаманний широкий спектр активності, який охоплює всі респіраторні віруси та мікст-інфекції. За ефектівністю Ергоферон зіставний з озельтамівіром (рис. 1, 2). Препарат має потужну доказову базу, що включає 7 Кокранівських оглядів, 1 міжнародне наглядове дослідження за участю 8411 пацієнтів, 6 рандомізованих контрольованих досліджень. Проведені клінічні випробування продемонстрували, що Ергоферон знижує тривалість захворювання та відновлює нормальний рівень інтерферону-γ в осіб із вихідними низькими його показниками (Геппе Н. А. и соавт., 2014; Крамарьов С. О., Закордонець Л. В., 2014) (рис. 3). Включення препарату до комплексної терапії позалікарняних пневмоній дозволяє зменшити тривалість основних симптомів захворювання (температурна реакція, біль у грудній клітці, продуктивний кашель, аускультативні зміни), а також скоротити тривалість антибактеріальної терапії та термін стаціонарного лікування. Порівняно з групою контролю на тлі лікування Ергофероном у пацієнтів із бронхіальною астмою зменшуються лихоманка, кашель і вираженість інфекційного токсикозу (Сабитов А. У., Ершова А. В., 2015).
Ергоферон може призначатися для профілактики та лікування грипу А та В; гострих респіраторних вірусних інфекцій, зумовлених вірусом парагрипу, аденовірусами, респіраторно-синцитіальним вірусом, коронавірусами; герпесвірусних інфекцій (лабіальний герпес, офтальмогерпес, генітальний герпес, вітряна віспа, оперізуючий герпес, інфекційний мононуклеоз); гострих кишкових інфекцій вірусної етіології (спричинених каліцивірусами, аденовірусом, коронавірусами, ротавірусом, ентеровірусами); ентеровірусного та менінгококового менінгіту; геморагічної лихоманки з нирковим синдромом; кліщового енцефаліту. Профілактична схема прийому Ергоферону (по 1 таблетці 1 р/день) сприяє підтримці високої готовності організму до зустрічі з вірусами, підвищує чутливість рецепторів до інтерферонів і вибірково збільшує здатність клітин виробляти інтерферон-γ у відповідь на інфекцію. Оскільки при коронавірусній інфекції кліренс вірусу сповільнений, є доцільним тривале застосування профілактичних доз Ергоферону. Рекомендований термін профілактичного курсу визначається індивідуально й може становити 1-6 міс.
Якщо метою призначення препарату є не профілактика, а лікування, в перші 2 год терапії Ергоферон приймають кожні 30 хв, потім – іще 3 таблетки через рівні проміжки часу. Починаючи з 2-ї доби та надалі препарат приймають по 1 таблетці 3 р/добу до повного одужання.
Терапевтичний ефект Ергоферону розвивається вже після 1-го дня лікування, що проявляється нормалізацією температури тіла в третини пацієнтів. За даними міжнародної спостережної програми «ЕРМІТАЖ», уже на 1-й день лікування частка пацієнтів із нормальною температурою тіла (≤37 °C) становила 29%, на 2-й – 78%, на 3-й – 95% (Геппе Н. А. и соавт., 2017). Оскільки Ергоферону властива багатофакторна противірусна, протизапальна й антигістамінна дія, цей препарат ефективний навіть при пізньому (після 48 год від початку захворювання) початку лікування. У разі раннього початку лікування (протягом 1-ї доби від появи симптомів) тривалість симптоматики зменшується максимально на 9 год порівняно з більш пізнім призначенням Ергоферону. Це вигідно відрізняє Ергоферон від синтетичних противірусних препаратів, які мають належну ефективність лише на початку хвороби.
Важливо, що Ергоферону властивий відмінний профіль безпеки. Так, у жодному контрольованому дослідженні цього препарату не було відзначено значимих небажаних явищ. Система фармаконагляду також не зареєструвала значущих побічних ефектів, у т. ч. відтермінованих. Експериментально та клінічно доведено, що Ергоферон сприяє формуванню адекватного противірусного ефекту щодо широкого спектра вірусів без ризику розвитку резистентності, тому частота курсів лікування не обмежена.
Хоча COVID-19 у дітей зазвичай має легкий перебіг, унаслідок анатомо-фізіологічних особливостей дитячого організму висока ймовірність виснаження адаптаційних можливостей із подальшим розвитком астеновегетативного синдрому. Останній зазвичай проявляється астенією, функціональними соматовегетативними розладами: порушенням сну (збільшення потреби в сні, тривале засинання, поверхневий сон, часті пробудження), зниженням апетиту, пітливістю, стійким дермографізмом.
Після COVID‑19 у дітей нерідко розвивається вегетативна дисфункція з артеріальною гіпертензією, а також частіше спостерігаються випадки появи енурезу. Патогенетичними ланками вегетативної дисфункції при ПКС є мінімальна мозкова дисфункція, психоемоційні порушення, гіперкатехоламінемія, гіпоксія й окисний стрес, дисциркуляторні розлади. У таких випадках для лікування можна застосовувати препарат Тенотен, який містить АТ до мозкоспецифічного білка S‑100. Тенотену притаманні ноотропний, вегетотропний, нейропротекторний (антигіпоксичний) і заспокійливий ефекти. Заспокійливій дії Тенотену властива відсутність надмірної седації, а також антиастенічний, протитривожний, антидепресивний і стресопротекторний компоненти.
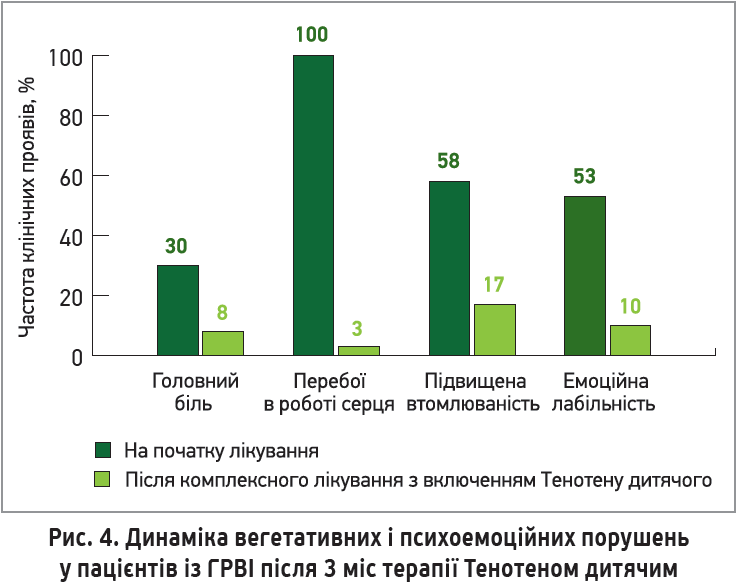
У госпіталізованих дітей із ГРВІ Тенотен продемонстрував статистично значимі переваги, які свідчать про позитивний вплив препарату на нормалізацію стану ВНС і на адаптаційно-компенсаторні реакції. Так, у більшості дітей після закінчення курсу терапії Тенотеном дитячим відзначалися статистично значиме зменшення вираженості астеноневротичних скарг, головного болю, неприємних відчуттів і відчуттів перебоїв у ділянці серця, зниження рівня тривожності, ослаблення проявів емоційної лабільності, поліпшення показників концентрації уваги (р<0,01) (рис. 4) (Хлиповка Ю.Н. і співавт., 2017).
В експерименті було з’ясовано, що анксіолітична дія Тенотену є зіставною з діазепамом (Коплик Е.В. и соавт., 1995), а ноотропна дія перевищує аналогічну ефективність пірацетаму (визначено за впливом на процес навчання) (Воронина Т.А. и соавт., 2009). Введення Тенотену також зменшує площу ішемічного ушкодження мозку в експериментальних умовах, що свідчить про його нейропротекторну й антигіпоксичну дію. Це особливо важливо в аспекті ПКС, який супроводжується неврологічними розладами. Після застосування цього препарату спостерігається достовірне зменшення систолічного та діастолічного артеріального тиску. Така здатність знижувати патологічну гіпертензивну відповідь сприятливо впливає на самопочуття пацієнтів і перебіг ПКС. При виражених симптомах Тенотен необхідно приймати по 2 таблетки 3 р/добу, а при помірно виражених – по 1 таблетці 3 р/добу. Середня тривалість курсу терапії становить 1-3 міс, максимальна – 6 міс.
Отже, до комплексної схеми лікування ПКС доцільно включати Ергоферон, який запобігає виснаженню імунної системи, та Тенотен, що чинить виражену антиастенічну дію, протидіє погіршенню функції центральної нервової системи, запобігає гіпоксії.
Підготувала Лариса Стрільчук
Медична газета «Здоров’я України 21 сторіччя» № 8 (501), 2021 р.