23 жовтня, 2021
Порівняння переваг і ризиків подвійної та однокомпонентної антитромбоцитарної терапії для вторинної профілактики інсульту
Лікування антиагрегантами є основою вторинної профілактики інсульту в осіб, що перенесли некардіоемболічний ішемічний інсульт та транзиторну ішемічну атаку (ТІА). Подвійна антитромбоцитарна терапія (ПАТТ) у пацієнтів після ішемічного інсульту або ТІА знижує частоту повторних епізодів, але також може асоціюватися зі збільшенням великих кровотеч порівняно з однокомпонентною антитромбоцитарною терапією (ОАТТ). За дорученням Американської асоціації серця та Американської асоціації з вивчення інсульту (AHA/ASA) D.L. Brown et al. виконали систематичний огляд та метааналіз переваг і ризиків застосування ПАТТ порівняно з ОАТT у межах вторинної профілактики ішемічного інсульту. Отримані результати опубліковані у виданні Stroke (2021; 52: 00‑00).
ПАТТ може забезпечити додаткове зменшення ймовірності інсульту порівняно з ОАТТ за рахунок потужнішого інгібування шляхів активації тромбоцитів. Однак клінічні випробування, присвячені зіставній ефективності й безпеці ПАТТ та ОАТТ для вторинної профілактики, не показали послідовного зниження частоти повторного інсульту, до того ж наявні повідомлення про збільшення кількості кровотеч у хворих (Patti et al., 2019).
Група AHA/ASA з розробки клінічних рекомендацій 2021 р. щодо профілактики повторного епізоду в пацієнтів з інсультом та ТІА доручила Незалежному комітету з розгляду доказів проаналізувати актуальні дані рандомізованих контрольованих досліджень (РКД) стосовно відносної ефективності та безпеки застосування ПАТТ порівняно з ОАТT у межах вторинної профілактики інсульту.
Методи
Проведені систематичний огляд та метааналіз відповідали вимогам PRISMA (параметри звітності для систематичних оглядів та метааналізів). У процесі роботи було поставлене таке запитання в форматі PICOTS (популяція, втручання, порівняння, результати, час та умови): «Якими є переваги та ризики ПАТТ порівняно з ОАТT у пацієнтів з ішемічним інсультом або TIA протягом п’яти років для профілактики повторного інсульту?» (Moher et al., 2009).
Критерії відповідності та оцінка якості
Було виконано пошук літератури англійською мовою, опублікованої з 1999 по 2019 рр., у базах даних PubMed, Embase, Кокранівській базі даних систематичних оглядів та Кокранівському реєстрі контрольованих випробувань. Внаслідок огляду літератури робоча група виявила 179 статей, з яких за відповідними критеріями було відібрано 13 звітів із даними семи випробувань.
Критеріями включення були РКД III або IV фази з використанням ПАТТ порівняно з ОАТT, які включали щонайменше 100 пацієнтів із ТІА або ішемічним інсультом. Якщо у випробування були залучені змішані популяції хворих, приміром особи з інсультом/ТІА та пацієнти з інфарктом міокарда (ІМ), враховували лише ті, в яких проводили стратифіковану рандомізацію за інсультом/ТІА. Про відповідні клінічні результати повідомлялося протягом п’яти років після рандомізації. Не розглядалися антиагреганти, застосовувані внутрішньовенно, не схвалені Управлінням з контролю за якістю продуктів харчування та медикаментів США (FDA), не доступні у США, або ж якщо вони мали інші гіпотетичні механізми дії, що могли сприяти профілактиці інсульту на додаток до антитромбоцитарних ефектів (наприклад, дипіридамол, цилостазол) (Gamboa et al., 2005).
Кожне РКД оцінювали на предмет потенційного ризику викривленнях даних за допомогою переглянутого інструменту Кокранівського товариства для оцінки систематичної похибки (Sterne et al., 2019).
Екстракція даних
Для кожного РКД вилучені дані включали деталі дослідження, результати ефективності та безпеки. За можливості інформація стосувалася таких показників, як повторний ішемічний інсульт (первинний результат), внутрішньомозковий крововилив (ВМК) (або внутрішньочерепна кровотеча та геморагічний інсульт, якщо таке визначення було відсутнє), усі рецидиви інсультів (ішемічний інсульт чи ВМК), ІМ, серйозні серцево-судинні події (MACE), шо включали кардіоваскулярну смерть, нефатальний ІМ/інсульт, а також летальні випадки від усіх причин, судинна смерть і велика кровотеча.
Окрім того, були зібрані дані щодо таких підгруп (за наявності): рандомізація протягом 72 год після початку інсульту/ТІА, великий інсульт, внутрішньочерепний, екстракраніальний стеноз, фібриляція передсердь, коли антикоагулянтна терапія протипоказана, та тривалість лікування ПАТТ/ОАТТ.
З огляду на тривалість терапії ретроспективні дослідження були розподілені на коротко- (≤90 днів) та довгострокові (>90 днів). Короткочасні випробування включали суб’єктів, рандомізованих протягом семи днів з моменту розвитку інсульту/ТІА.
Метааналіз
Експерти оцінили підсумкові ефекти лікування з використанням метааналізу випадкових ефектів для досліджень із подібними тривалістю терапії та термінами оцінки результатів. Для кожного РКД було розраховано некорегований відносний ризик (ВР) ішемічного інсульту та вторинні клінічні наслідки. При аналізі чутливості виключали будь-яке дослідження з високим ризиком систематичної похибки. Для кожного метааналізу за допомогою індексу I2 було кількісно визначено гетерогенність (25% – свідчило про низьку, 50% – помірну, 75% – високу) (Higgins et al., 2003). Для всіх аналізів показник р<0,05 вважався статистично значущим без корегування за множинними порівняннями.
Результати
Короткострокові дослідження
Було виявлено п’ять РКД, в яких вивчали призначене випадковим чином лікування строком на 14‑90 днів. У всіх випробуваннях учасників зараховували в період від 12 год до 7 днів після перенесеного інсульту/ТІА.
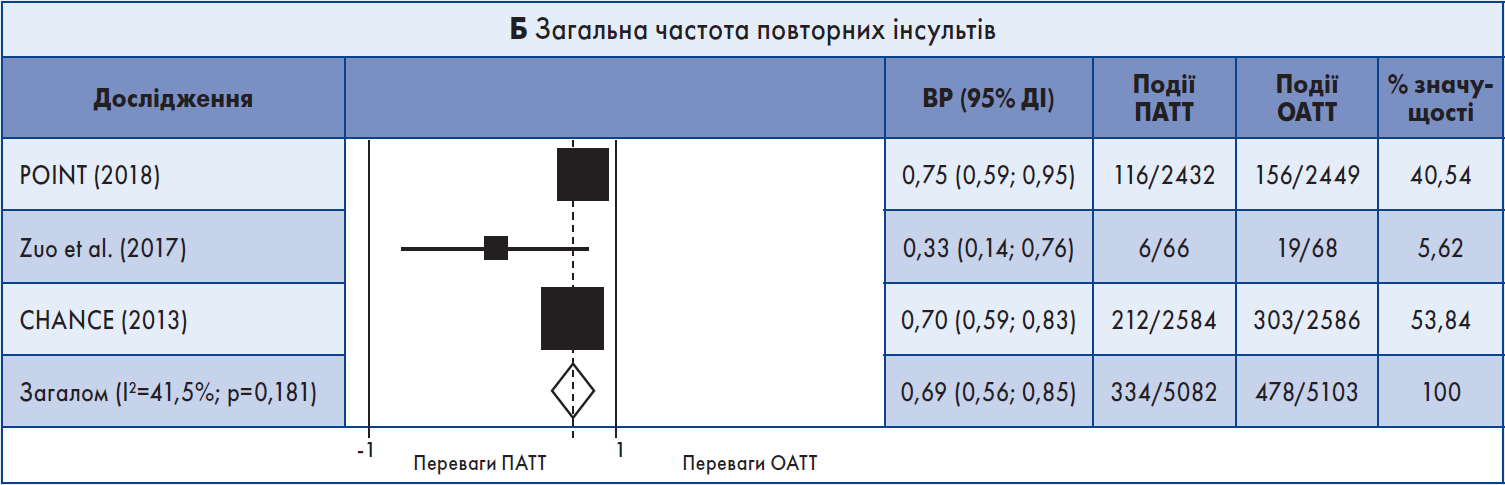
У двох масштабних дослідженнях – POINT, присвяченому вивченню інгібування тромбоцитів в осіб із новим епізодом TIA або малим ішемічним інсультом, та CHANCE, де оцінювали ефект клопідогрелю у пацієнтів групи високого ризику із гострими неінвалідизувальними порушеннями кровообігу, ризик повторного ішемічного інсульту був значно нижчим у хворих, які отримували ПАТТ, ніж ОАТТ; в обох РКД хворі були включені у випробування у межах 12 та 24 год відповідно з моменту появи симптомів (Johnston et al., 2018; Wang et al., 2013). У трьох невеликих дослідженнях також спостерігалися переваги ПАТТ порівняно з ОАТТ щодо нижчої частоти рецидивів ішемічного інсульту (Zuo et al., 2017; He et al., 2015; Wang et al., 2015).
Результати метааналізу. До метааналізу увійшли три короткотривалих РКД, які включали переважно пацієнтів із малим інсультом або ТІА високого ризику (Johnston et al., 2018; Wang et al., 2013; Zuo et al., 2017). Звіти про отримані результати були надані у період ≤90 днів. ПАТТ порівняно з ОАТТ асоціювалася з меншою імовірністю повторного ішемічного інсульту протягом 90 днів: об’єднаний ВР 0,68; 95% довірчий інтервал (ДІ) 0,55‑0,83 (рис. 1А). При повторному аналізі результати були зіставними, за винятком одного РКД з високим ризиком систематичної похибки (Zuo et al., 2017). Слід зауважити, що два інші дослідження включали пацієнтів, у яких минуло 12‑24 год від початку симптомів.
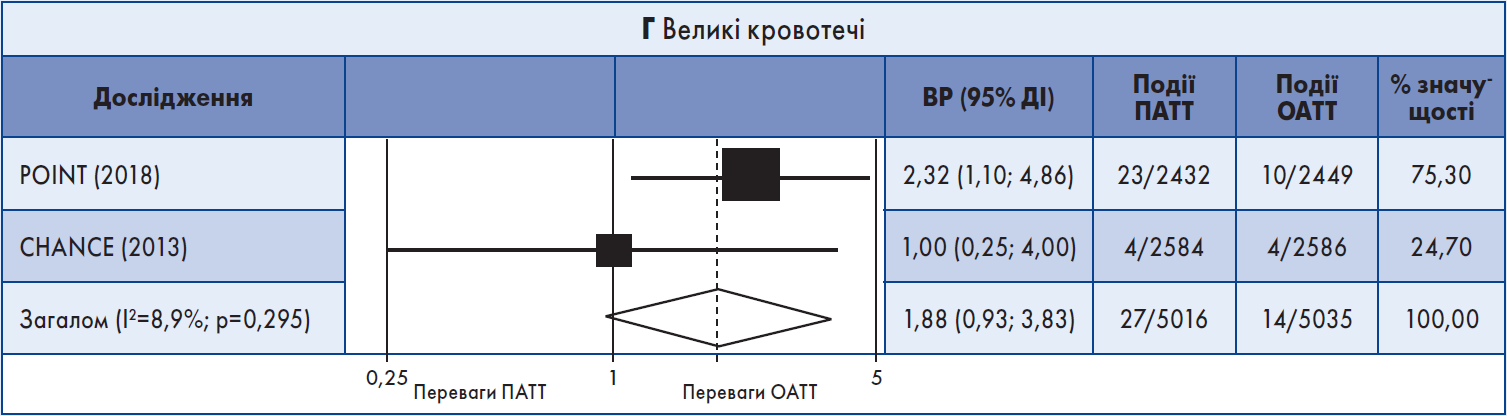
У трьох випробуваннях ПАТТ асоціювалася зі зниженням загальної частоти рецидивного інсульту, що передбачав ішемічний інсульт + ВМК: кумулятивний ВР 0,69; 95% ДІ 0,56‑0,85 (рис. 1Б). Також було виявлено зменшення кількості MACE (об’єднаний ВР 0,76; 95% ДІ 0,64‑0,92). Не спостерігалося різниці між схемами антитромбоцитарної терапії щодо ВМК (n=2; рис. 1В), ІМ, летальних випадків від усіх причин (n=2), судинної смерті (n=2) та великої кровотечі (n=2): кумулятивний ВР 1,88; 95% ДІ 0,93‑3,83 (рис. 1Г).
Три кінцеві точки – частота MACE, повторного ішемічного та загального рецидивного інсульту – мали помірний ступінь гетерогенності. Хоча результати щодо великої кровотечі різнилися, показник I2 не вказував на значну неоднорідність.
Рис. 1. Форест-діаграма даних короткочасних випробувань
Примітка: Для аналізу даних використовували модель рандомних ефектів.
Довгострокові дослідження
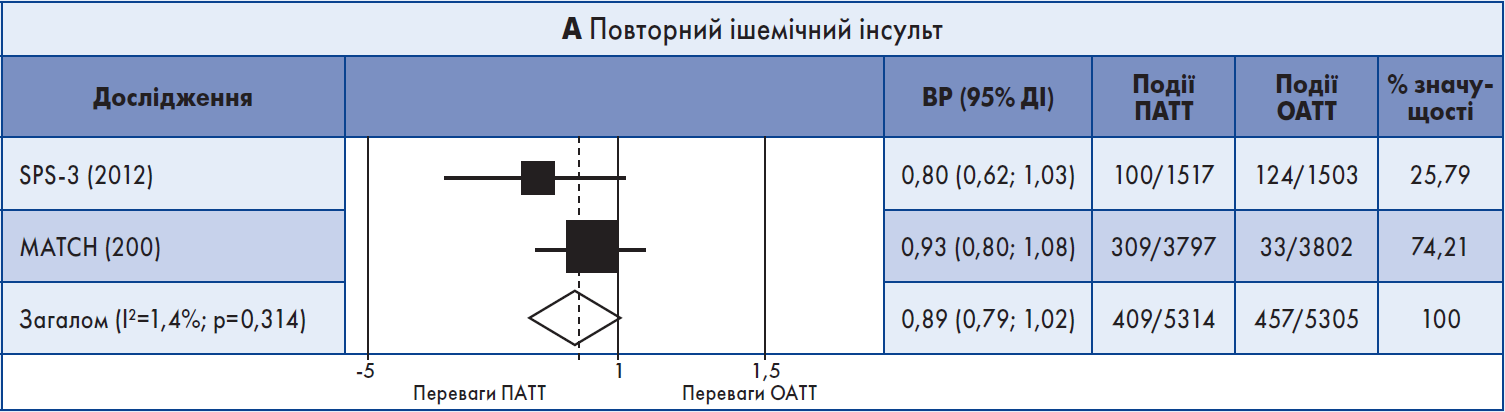
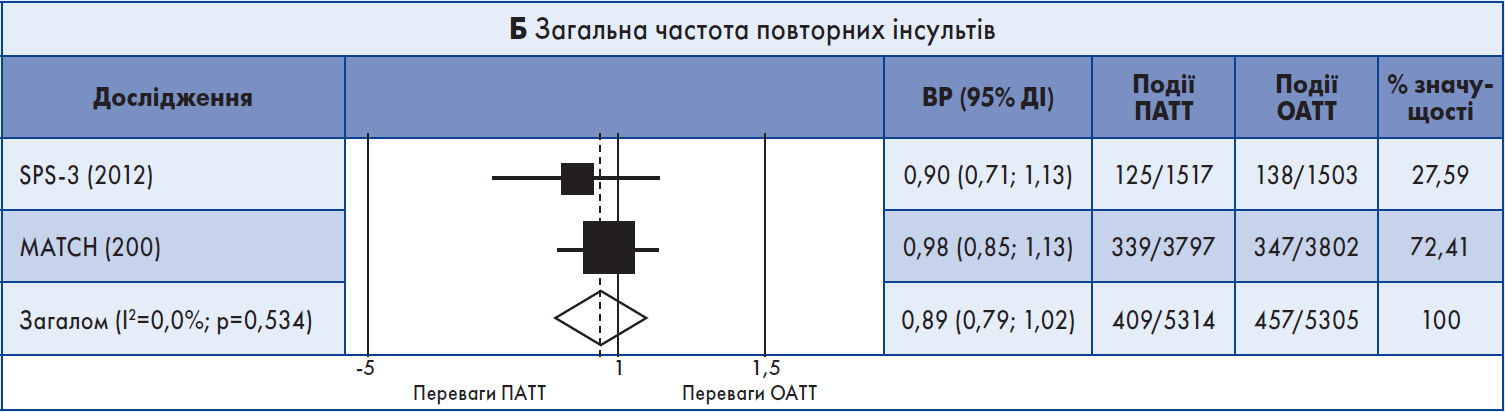
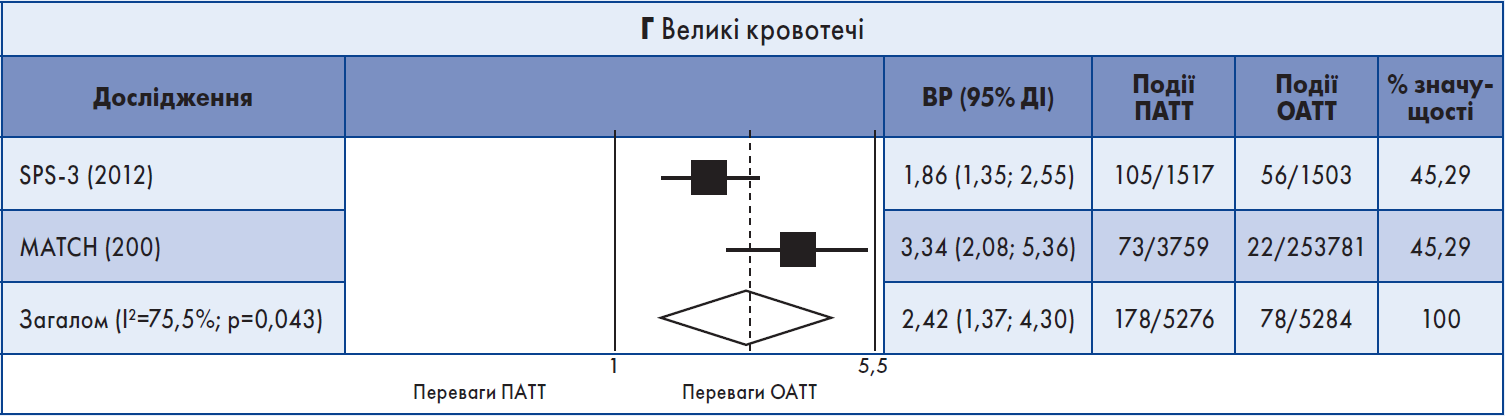
У систематичний огляд було включено два випробування – MATCH, до якого були залучені хворі на атеротромбоз із високим ризиком, та SPS‑3, присвячене вторинній профілактиці малих підкіркових інсультів. В обох РКД учасників випадковим чином розподілили для отримання клопідогрелю + аспірин або ОАТТ на період від 18 до 40 місяців. Пацієнти були зараховані протягом перших трьох місяців після інсульту/ТІА до MATCH (середній час до рандомізації – 26,5 днів) та впродовж перших шести місяців після лакунарного інсульту – до SPS‑3 (середній час до рандомізації – 62 дні).
Не було показано переваг тривалої ПАТТ порівняно з ОАТТ щодо повторного ішемічного інсульту. Частота великих крововиливів була вищою у групі ПАТТ в обох РКД.
Результати метааналізу. Обидва довгострокові дослідження були включені в метааналіз. ПАТТ порівняно з ОАТT не асоціювалася зі значним зменшенням випадків повторного ішемічного інсульту (кумулятивний ВР 0,89; 95% ДІ 0,79‑1,02) (рис. 2А). Також ПАТТ не корелювала із загальним рецидивним інсультом (ішемічним + ВМК), ІМ, MACE, летальністю від усіх причин або судинною смертю (рис. 2Б). Але ПАТТ була пов’язана з вищим ризиком ВМК (кумулятивний ВР 1,76; 95% ДІ 1,13‑2,76) та великої кровотечі (кумулятивний ВР 2,42; 95% ДІ 1,37‑4,30) (рис. 2В, Г). Значний ступінь гетерогенності між результатами досліджень мав місце щодо смерті від усіх причин (I2=78,5%) та великої кровотечі (I2=75,5%).
Рис. 2. Форест-діаграма даних довгострокових випробувань
Примітка: Для аналізу даних використовували модель рандомних ефектів.
Результати, отримані у субпопуляціях
Для метааналізу не було виявлено жодної прийнятної субпопуляції. Тож автори представили результати окремих досліджень.
Було відібрано чотири випробування з випадковим розподілом суб’єктів на групи лікування протягом 72 год від початку симптомів (He et al., 2015; Wang et al., 2015; Yi et al., 2014; Johnston et al., 2018). В усіх РКД повідомлялося про нижчий ризик повторного ішемічного інсульту на тлі ПАТТ, ніж ОАТТ. У дослідженнях F. He et al. (2015) та C. Wang et al. (2015) зафіксовано значущу ймовірність систематичної похибки.
На додачу, було виявлено два випробування, що включали лише пацієнтів з атеросклерозом великих артерій (ураження інтра- або екстракраніальних артерій). У дослідженнях С. Wang et al. (2015) та F.T. Zuo et al. (2017) взяли участь хворі після інсульту протягом перших 48 год або 7 днів, а результати оцінювали через 30 або 90 днів відповідно. У двох випробуваннях спостерігався нижчий ризик повторного ішемічного інсульту при використанні ПАТТ порівняно з ОАТТ, але також вважалося, що для них була характерна значна ймовірність систематичної похибки.
Обговорення
Систематичний огляд та метааналіз досліджень D.L. Brown et al. (2021), в яких порівнювали ПАТТ та ОАТТ для вторинної профілактики інсульту, дозволив зробити кілька висновків. Так, на основі трьох випробувань із раннім початком (<1 тижня) та короткочасним лікуванням (<90 днів) було продемонстровано, що ПАТТ перевершувала ОАТТ у межах профілактики повторного ішемічного інсульту, будь-якого рецидиву інсульту та MACE в осіб із малим інсультом або значною ймовірністю ТІА, які мали низький ризик кровотечі.
У дослідженні POINT було виявлено підвищений ризик великої кровотечі на тлі ПАТТ порівняно з ОАТТ, тоді як у CHANCE – ні. В останньому спостерігалася незначна кількість тяжких кровотеч (по чотири в кожній групі лікування), але більше ВМК (20 на тлі ПАТТ та 16 – ОАТТ) (Wang et al., 2016).
Таким чином, при застосуванні ПАТТ на ранніх стадіях після перенесеного ТІА високого ризику або малого ішемічного інсульту слід враховувати можливе зростання ризику кровотечі. У межах тривалої вторинної профілактики ПАТТ не перевершувала ОАТТ щодо запобігання повторному ішемічному інсульту, але асоціювалася з підвищеним ризиком розвитку ВМК та великої кровотечі.
Причини суттєвішої користі ПАТТ порівняно з ОАТТ у короткочасних, але не у тривалих випробуваннях можуть бути пов’язані з термінами початку терапії. У короткострокових дослідженнях лікування було розпочате незабаром після інсульту – протягом 12 або 24 год у великих дослідженнях (Johnston et al., 2018; Wang et al., 2013), та 72 год або 7 днів – у менш масштабних (Zuo et al., 2017; He et al., 2015; Wang et al., 2015; Yi et al., 2014).
У тривалих випробуваннях терапію ініціювали протягом 3 або 6 місяців від початку інсульту (Benavente et al., 2012; Diener et al., 2004). Як відомо, абсолютний ризик рецидиву є найвищим (хоча й помірним) у перші кілька місяців після інсульту (Hoshino et al., 2017). Тому користь у зменшенні ймовірності повторного інсульту краще простежується в РКД, де лікування розпочинали незабаром після інсульту. Подібним чином, на тлі тривалішої ПАТТ пацієнти могли бути уразливішими до кровотеч.
Висновки
Згідно з отриманими даними, ПАТТ є ефективнішою за ОАТТ щодо зменшення ймовірності повторного ішемічного інсульту, якщо її розпочинати незабаром після перенесеної ТІА високого ризику або малого інсульту і продовжувати протягом 21‑90 днів. Тому автори зауважують, що ПАТТ відіграє певну роль у ранній вторинній профілактиці інсульту. Однак у разі тривалішого лікування та більш пізнього початку після інсульту або ТІА, ПАТТ не є дієвішою порівняно з ОАТТ щодо профілактики ішемічного інсульту і корелює з вищим ризиком кровотечі.
Необхідні додаткові дослідження, щоб визначити найліпші терміни початку лікування залежно від клінічної події, оптимальну тривалість ПАТТ для збалансованого співвідношення ризику й користі. Крім того, важливо встановити, чи можуть популяції хворих, виключені з аналізованих досліджень, приміром після тяжкого інсульту, мати переваги від ранньої ПАТТ, а також чи впливають певні генетичні профілі на ефективність ранньої ПАТТ.
Підготувала Олена Коробка
Тематичний номер «Неврологія, Психіатрія, Психотерапія» № 3 (58) 2021 р.