31 січня, 2022
Тромболітична терапія при ішемічному інсульті: вплив різних факторів на ефективність та несприятливі результати
Успіх – не остаточний, невдачі – не фатальні, значення має лише мужність продовжувати
Вінстон Черчилль
У структурі смертності від хвороб системи кровообігу в Україні церебральний інсульт посідає друге місце після інфаркту міокарда (ІМ) і становить 175 випадків на 100 тис. населення за рік. Інсульт є провідною причиною інвалідизації населення: 31% пацієнтів, які перенесли інсульт, потребують сторонньої допомоги, 20% не  можуть самостійно пересуватися і лише 8% можуть повернутися до роботи. Найефективнішим патогенетичним методом лікування ішемічного інсульту є системна тромболітична терапія (ТЛТ), яку проводять у перші 4,5 год від початку інсульту.
можуть самостійно пересуватися і лише 8% можуть повернутися до роботи. Найефективнішим патогенетичним методом лікування ішемічного інсульту є системна тромболітична терапія (ТЛТ), яку проводять у перші 4,5 год від початку інсульту.
У світлі останніх досягнень мультимодальної нейровізуалізації очевидно, що потенціал ТЛТ ще повністю не розкритий. Однак відомо, що у значної частки пацієнтів дана реперфузійна технологія не дозволяє досягти бажаного клінічного ефекту і часто пов’язана з підвищенням імовірності розвитку геморагічної трансформації вогнища інфаркту та летального наслідку. Цей факт набуває особливого значення у суперечливих клінічних ситуаціях, коли потенційна користь від ТЛТ невелика, тоді як супутні патології та інші чинники визначають високий ризик системних ускладнень і смерті.
Без сумніву, лікарі-неврологи, які надають медичну допомогу пацієнтам із гострим порушенням мозкового кровообігу (ГПМК), потребують чітких критеріїв потенційної ефективності реперфузійної стратегії, що ґрунтуються на рутинній клінічній практиці (насамперед оцінці демографічних, клініко-лабораторних і часових параметрів). У звязку з цим, важливим науковим завданням є вивчення чинників, які достовірно впливають на несприятливі результати ТЛТ, зокрема летальні наслідки і розвиток геморагічної трансформації.
Вплив різноманітних чинників на результати ТЛТ
Демографічні фактори
Вік – незалежний чинник, що визначає ймовірність несприятливих або успішних наслідків тромболізису. J.E. Simon et al. (2004) вивчали безпеку виконання ТЛТ при гострому ішемічному інсульті у 62 пацієнтів віком від 80 років [4]. Було показано, що:
- Частота симптоматичних і фатальних внутрішньочерепних крововиливів (ВЧК) у літніх осіб після інсульту не відрізнялася від такої у пацієнтів молодшого віку.
- ТЛТ у хворих похилого віку не супроводжувалася збільшенням смертності.
- У літніх пацієнтів предиктором несприятливого результату найчастіше була початкова тяжкість інсульту, а не вік хворого.
- Загалом наслідки інсульту в літніх осіб частіше залишалися несприятливими, що автори пояснили високою вихідною тяжкістю інсульту в даній віковій категорії: на момент госпіталізації 59,7% пацієнтів мали >15 балів за шкалою тяжкості інсульту Національних інститутів здоров’я США (NIHSS). Пізніше ці результати були підтверджені в роботах інших авторів [5].
Під час проведення об’єднаного аналізу даних трьох досліджень внутрішньовенного введення тканинного активатора плазміногену альтеплази при ішемічному інсульті було зроблене припущення щодо наявності можливого взаємозв’язку між статтю пацієнта і функціональним результатом лікування ГПМК [6‑8]. Цей факт автори пояснили відмінністю наслідків ішемічного інсульту в чоловіків і жінок. Своєю чергою раніше були отримані дані про те, що несприятливий функціональний результат інсульту більш характерний для жінок. Науковці припустили, що проведення внутрішньовенної ТЛТ нівелює негативний вплив жіночої статі на функціональні наслідки ішемічного інсульту.
Аналіз Канадського реєстру вивчення ефективності введення альтеплази (CASES) не виявив різниці в результатах лікування залежно від статі, за винятком нижчого ризику симптомного внутрішньомозкового крововиливу в жінок [7]. Натомість у двох інших дослідженнях було показано статеву відмінність на користь жінок: у першому розбіжності стосувалися неврологічного поліпшення, а в другому – частоти реканалізації артерії [9‑10].
D.M. Kent et al. (2008) спробували узагальнити наявні відомості щодо впливу статі на наслідки ТЛТ при ішемічному інсульті, а також проаналізували дані власного клінічного реєстру, що включав 274 хворих [7]. Систематичний огляд не виявив кореляції статевого фактора та результатів інсульту, хоча у пацієнтів, які не отримували терапію, гендерні відмінності були чітко вираженими. За даними реєстру, відсоток сприятливих наслідків у чоловіків був таким самим, як у жінок, незважаючи на те, що рівень смертності в останніх був удвічі вищим (10 і 20% відповідно). Різницю щодо частоти летальних наслідків було усунуто після корегування можливих початкових чинників-конфаундерів, таких як вища оцінка за NIHSS, літній вік, частіші артеріальна гіпертензія (АГ) і фібриляція передсердь (ФП), а також рідший ІМ у жінок. Відомо, що ці фактори значною мірою визначають прогноз функціонального відновлення пацієнта [11].
Таким чином, за даними систематичного огляду літератури і реєстру, гендерний вплив на основні результати захворювання після внутрішньовенного введення альтеплази при ішемічному інсульті відсутній.
Анамнестичні фактори
Відомо, що куріння є незалежним чинником ризику розвитку раннього атеросклерозу, ІМ та ішемічного інсульту [12]. Проте у деяких дослідженнях показано, що для курців характерна нижча смертність після тромболізису при ІМ, ніж для тих, хто не має цієї звички [13‑16].
Поліпшення тканинної реперфузії на тлі куріння можна пояснити деякими особливостями системи згортання крові, які характерні для осіб, що курять. Відомо, що куріння порушує синтез та вивільнення ендогенного тканинного активатора плазміногену, що спричиняє підвищення рівня фібрину, який циркулює у крові [17]. Утворювані тромби містять більшу кількість фібрину і стають чутливішими до впливу тканинного активатора плазміногену, що підвищує ймовірність успішного результату тромболізису і «врівноважує» ефект куріння як прогностичного чинника несприятливих наслідків інсульту.
Вивчення впливу куріння на частоту реканалізації та наслідки тромболізису при ішемічному інсульті показало, що для курців характерний кращий функціональний результат через три місяці після інсульту [18]. Вочевидь, це пов’язано з молодшим віком розвитку інсульту та початково меншою тяжкістю інсульту (відповідно до оцінки за NIHSS при госпіталізації). Крім того, автри виявили, що у курців порівняно з тими, хто не має цієї звички, інфаркт-асоційована оклюзія частіше реканалізується. Даний феномен описаний також у кількох ангіографічних дослідженнях у пацієнтів з ІМ.
Фонові захворювання
Фібриляція передсердь
ФП є одним із найважливіших модифікованих чинників ризику ішемічного інсульту, що призводить до підвищення частоти його розвитку в 4‑5 разів за рахунок кардіоемболічного характеру інсульту. На додачу, за даними проспективного фремінгемського дослідження, в якому взяли участь 5209 осіб, ФП є незалежним фактором підвищення ризику смерті й виразності неврологічного дефіциту при ішемічному інсульті [19, 20].
Цей взаємозв’язок зумовлений впливом кількох чинників. По-перше, частота ФП зростає з віком, а, як відомо, у літніх хворих тяжкість інсульту та ризик летальних наслідків підвищуються. Крім того, пацієнти із ФП частіше страждають на інші супутні захворювання, що є додатковими чинниками ризику інсульту, серед яких:
- цукровий діабет (ЦД);
- АГ;
- ішемічна хвороба серця.
Деякі автори висловлюють гіпотезу про те, що хворі на ФП частіше мають застійну серцеву недостатність із закономірним зниженням серцевого викиду. В умовах ішемічного пошкодження мозкової тканини та порушення механізмів авторегуляції це може бути вирішальним чинником, який визначає розміри вогнища ішемії. До того ж в осіб із порушенням церебрального кровотоку, яке раптово виникає на тлі кардіальної емболії, менш розвинений колатеральний кровообіг порівняно з пацієнтами із хронічним атеросклеротичним ураженням судин. Взаємодоповнювальний вплив цих двох факторів може призводити до збільшення розмірів вогнища ішемії та ускладнення функціонального відновлення після інсульту, який розвинувся на тлі ФП [20, 21]. Крім того, коморбідність, характерна для ФП, може визначати доцільність проведення реабілітаційних методик у ранньому і пізньому періодах інсульту, а також спричиняти розвиток ускладнень.
У літературі продовжується обговорення потенційного негативного впливу ФП на наслідки ТЛТ. Так, B. Frank et al. (2012) висловили припущення про те, що причиною ішемічного інсульту в пацієнтів із ФП у деяких випадках можуть бути тромби, які утворилися протягом тривалого часу і меншою мірою здатні розчинятися під дією фібринолітичного агента [22]. Дані досліджень механічного видалення емболу при церебральній ішемії свідчать про те, що близько 50% хворих, які не досягли реканалізації при проведенні системної ТЛТ і отримали процедуру механічної тромбектомії, страждали на ФП [23]. Також у результаті дослідження із проведенням магнітно-резонансної ангіографії встановлено, що ФП є незалежним прогностичним чинником відсутності реканалізації при виконанні внутрішньовенного тромболізису в осіб з ішемічним інсультом [24].
Своєю чергою вивчення тромбів, витягнутих шляхом механічної тромбекстракції у пацієнтів після ішемічного інсульту, який стався внаслідок кардіальної або артеріо-артеріальної емболії, не виявило відмінностей у структурі тромбів залежно від джерела емболії [24].
Практично у всіх хворих тромби мали подібну структуру і складалися із тромбоцитів/фібрину з нерівномірними лінійними включеннями лейкоцитів та еритроцитів при практично повній відсутності холестерину в їх складі. Так звані червоні тромби, які, відповідно до традиційних уявлень, утворюються в місцях уповільнення кровотоку (найчастіше у лівому передсерді), зустрічалися лише у 2 із 25 досліджуваних, у котрих не було досягнуто повноцінної екстракції тромбу. Автори висловили припущення, що «червоні» тромби формувалися у дистальній постоклюзійній ділянці артерії та на тлі виразного сповільнення кровотоку.
Вплив ФП на клінічний результат системного тромболізису аналізували багато науковців, які, залежно від дизайну дослідження та методу статистичної обробки, дійшли суперечливих висновків. Так, К. Kimura et al. (2011) рідше спостерігали поліпшення стану через сім днів після системного тромболізису в пацієнтів із ФП, а також позитивний результат відповідно до оцінки 0‑1 бал за модифікованою шкалою Ренкіна (mRs) через три місяці після тромболізису, ніж за відсутності ФП [25]. Також менш сприятливі наслідки тромболізису в осіб із ФП відзначали під час досліджень ECASS III та NINDS.
Проте останніми роками у літературі стали з’являтися припущення про те, що ФП не є незалежним прогностичним чинником несприятливого результату тромболізису, а лише виступає в ролі маркера, який характеризує старший вік пацієнтів і виразніший початковий неврологічний дефіцит [22].
Дійсно, після статистичної обробки з корегуванням за початковими показниками віку й тяжкості неврологічного дефіциту (згідно з NIHSS) було встановлено, що наявність ФП не впливає на результат тромболізису. Слід відзначити, що інші дослідники не виявили зростання частоти ВЧК, яка становила 7,3‑8,5%, та симптоматичних ВЧК (1,7‑2,3%) [26].
Артеріальна гіпертензія
Кровопостачання мозку характеризується кількома важливими особливостями, які визначають унікальність зміни церебральної гемодинаміки під впливом підвищеного артеріального тиску (АТ). До них відносяться:
- участь великих артерій у забезпеченні загальної резистивності судинного русла головного мозку та, отже, регуляції мозкового кровотоку;
- взаємодія клітин різного типу (нейронів, астроцитів, перицитів, глії) із судинною стінкою;
- наявність гематоенцефалічного бар’єра (ГЕБ) лише на рівні ендотелію.
Стійка АГ супроводжується збільшенням судинного опору, зменшенням кількості артеріол та капілярів, зниженням церебрального кровотоку та, як наслідок, хронічною церебральною гіпоперфузією. Крім того, наслідком АГ є судинне ремоделювання та зменшення просвіту судин, що є адаптивним процесом. Зміна структури артеріол призводить до порушення функцій ГЕБ, підвищення проникності судинної стінки та набряку тканини мозку, навіть за відсутності критичної ішемії. Порушення скоротливості ремодельованих артерій спричиняє втрату здатності до авторегуляції судинного тонусу, яка у фізіологічних умовах забезпечує однаковий достатній рівень перфузії мозкової тканини у широкому діапазоні коливань середнього АТ від 60 до 150 мм рт. ст. [2, 27].
Перераховані характеристики церебрального кровоносного русла у хворих на АГ, особливо підвищення проникності ГЕБ, забезпечують умови для несприятливих наслідків тромболізису, зокрема полегшують формування реперфузійних крововиливів. Встановлено, що 90,9% пацієнтів із внутрішньомозковими крововиливами після ТЛТ при ішемічному інсульті мали в анамнезі АГ порівняно з 60% без них [28].
Останнім часом у літературі велику увагу приділено питанню регуляції АТ у гострому періоді інсульту, зокрема під час ТЛТ. G. Ntaios et al. (2011) вивчали вплив швидкого чи поступового зниження АТ на результати інсульту залежно від наявності чи відсутності АГ та приймання антигіпертензивних препаратів в анамнезі [29]. Автори встановили, що, на відміну від осіб без АГ, у тих, хто мав її в анамнезі, відзначався менший вплив підвищення або зниження АТ на наслідки гострого періоду інсульту. Крім того, ці хворі краще переносили підвищення систолічного АТ більш як 180/110 мм рт. ст. порівняно з пацієнтами, які раніше не хворіли на АГ.
На додаток, у літературі дискутується вплив підвищення АТ при госпіталізації на наслідки ТЛТ [26]. Було підтверджено, що пацієнти із несприятливим результатом, що визначався як оцінка за шкалою mRs 3‑6 балів через три місяці від поступлення до стаціонара, характеризувалися достовірно вищим систолічним АТ на момент госпіталізації, що становив 159,06 (26,34) мм рт. ст. (р=0,054).
Цукровий діабет
ЦД – незалежний чинник, що у чотири рази підвищує ризик ішемічного інсульту. Встановлено, що для пацієнтів, які страждають на ЦД, характернішим є розвиток невеликих лакунарних інфарктів (розмірами від 0,2 до 15 мм). Це пов’язано з переважною шкідливою дією високого рівня глюкози та продуктів метаболізму на ендотелій мікросудинного русла, клітини якого не здатні підтримувати постійний внутрішньоклітинний вміст глюкози. При цьому спостерігаються активація процесів перекисного окислення ліпідів, надмірне накопичення ізоформ протеїнкінази С, та, як наслідок, наростання атеросклеротичної мікроангіопатії [30]. Таким чином, гіперглікемія призводить до більш раннього розвитку атеросклерозу, переважно дрібних судин, та асоційованих із ним ускладнень.
З іншого боку, відомо, що в умовах хронічної гіперглікемії знижується фібринолітична активність плазми та підвищується рівень інгібітора активатора плазміногену 1-го типу. Це призводить до уповільнення процесу реперфузії та можливого зниження ефективності ТЛТ в осіб із ЦД [31].
M. Ribo et al. вивчали дані 139 пацієнтів з ішемічним інсультом, яким провели системний тромболізис альтеплазою. В усіх хворих було проаналізовано рівень глюкози при поступленні до стаціонара та глікозильованого гемоглобіну протягом 48 год після госпіталізації. Автори встановили, що повної реканалізації (за результатами ультразвукової доплерографії через 2 год після болюсного введення альтеплази) вдалося досяти у 32% пацієнтів, які характеризувалися статистично достовірно нижчим рівнем глюкози на момент госпіталізації (127 і 146 мг/дл; р=0,039). Відмінності у групах хворих, які досягли і не досягли повної реканалізації, за рівнем глікозильованого гемоглобіну були відсутні. Тож на ефективність реперфузії після введення альтеплази більшою мірою впливала гіперглікемія при надходженні пацієнта до стаціонара, ніж хронічна гіперглікемія та наявність ЦД в анамнезі.
Клініко-анамнестичні особливості розвитку ішемічного інсульту
Циркадна періодичність виникнення інсульту
На сьогодні докладно вивчено циркадну періодичність розвитку ішемічного інсульту [32]. Встановлено, що пікова частота виникнення ГПМК як за ішемічним, так і геморагічним типом реєструється в період з 6:00 до 12:00.
Результати метааналізу 31 джерела літератури з описом циркадної періодичності розвитку 11 816 інсультів показали підвищення ймовірності інсульту будь-якого типу в ранкові години (з 6:00 до 12:00) на 79% порівняно з нормалізованим ризиком в інші години. При цьому для нічного часу (із 00:00 до 6:00) характерне зниження ризику ГПМК порівняно з іншими періодами доби на 35%.
Передбачуваними причинами циркадної періодичності розвитку інсультів вважають зміну таких показників у ранкові години:
- підвищення АТ;
- зменшення фібринолітичної активності;
- зниження рівня антитромбіну III;
- підвищення в’язкості крові;
- збільшення агрегації тромбоцитів.
Крім того, висловлюється гіпотеза про ефект зміни вмісту дофаміну в головному мозку на чутливість нейронів до стану ішемії за підвищеного тонусу симпатичної нервової системи в даному періоді. Ці дані можуть вплинути на рішення про проведення ТЛТ за відсутності точного часу початку інсульту в нічні або ранкові години, коли пацієнти прокидаються з неврологічним дефіцитом. Відомо, що кількість таких пацієнтів при ішемічному інсульті становить близько 25% [33]. Було описано досвід застосування ТЛТ поза встановленими протипоказаннями у хворих із розвитком інсульту під час нічного сну.
Автори проаналізували і порівняли три групи пацієнтів з ішемічним інсультом:
- який стався під час нічного сну, із проведенням ТЛТ;
- який стався під час нічного сну, без проведення ТЛТ;
- що були госпіталізовані у проміжку 0‑3 год від початку симптомів, із проведенням ТЛТ.
Хворі, у котрих інсульт розвинувся під час нічного сну, характеризувалися тяжчим неврологічним дефіцитом при поступленні до стаціонара та переважанням інсультів кардіоемболічного ґенезу за класифікацією TOAST. Статистичний аналіз, проведений з урахуванням показників NIHSS, продемонстрував, що для пацієнтів першої групи характерний частіший сприятливий результат лікування порівняно з такими другої. Проте у першій групі мала місце достовірно більша кількість смертельних наслідків (за відсутності таких у другій) через злоякісний синдром середньої мозкової артерії та тромбоз основної артерії, що призводило до великого стовбурового інфаркту, внутрішньомозкового крововиливу (2 випадки) або півкульового інфаркту. При порівнянні першої та третьої груп статистично достовірних відмінностей у частоті успішного результату не виявлено.
Тож з огляду на отримані дані та припущення із приводу того, що у значної частки хворих інсульт розвинувся незадовго до пробудження (з урахуванням циркадної періодичності), необхідний аналіз нових можливостей лікування таких пацієнтів, включно з реперфузійними втручаннями. При цьому, можливо, слід проводити ретельніший клінічний відбір (наприклад, виключення осіб з оцінкою за NIHSS >15 балів), а також радіологічне дослідження часу виникнення інсульту (як-то перфузійна комп’ютерна томографія) [2].
Оцінка за шкалою NIHSS до початку ТЛТ
Найчастіше у клінічній практиці для стандартизації виразності неврологічного дефіциту в пацієнтів з інсультом використовують шкалу NIHSS, показники якої коливаються від 0 (неврологічний дефіцит відсутній) до 42 балів (найтяжчі хворі у стані коми). Спочатку цю шкалу було розроблено для застосування в пілотних дослідженнях з вивчення ефективності альтеплази при ішемічному інсульті та надалі валідизовано. При створенні критеріїв придатності пацієнта щодо проведення системної ТЛТ визначено, що оцінка за шкалою NIHSS ˂5 балів (легкий неврологічний дефіцит) і ˃25 балів (тяжкий неврологічний дефіцит) є протипоказанням для даної процедури [2].
У двох дослідженнях із застосування альтеплази встановлено, що найбільш значущим серед чинників позитивного результату ТЛТ є оцінка за шкалою NIHSS <20 балів [34]. Проте статистично достовірний та незалежний сприятливий вплив тромболізису відзначали також у групі пацієнтів із виразнішим неврологічним дефіцитом.
Пізніше цей факт було підтверджено у дослідженні IST‑3 під час аналізу результатів ТЛТ у підгрупах хворих залежно від початкової виразності неврологічного дефіциту [30]. Встановлено, що для осіб із тяжким інсультом, незалежно від уведення альтеплази, характерні менш сприятливі наслідки хвороби, що, зокрема, пов’язано із підвищенням ризику геморагічної трансформації. Проте застосування ТЛТ приводить до статистично достовірних позитивних результатів лікування щодо функціонального відновлення пацієнта.
Вплив часових факторів надання допомоги хворим у гострому періоді ішемічного інсульту
Отримані протягом більш ніж 20-річного досвіду застосування ТЛТ дані свідчать про виразний вплив часу до початку ТЛТ на результат лікування. На тваринних моделях інсульту підтверджено, що час до відновлення кровотоку в ураженій артерії є основним чинником, який визначає кінцевий об’єм інфаркту [35]. У клінічній практиці застосування нейровізуалізації дозволило встановити, що під час гострого ішемічного процесу об’єм незворотно пошкодженої тканини швидко збільшується з часом, при цьому щохвилини до відновлення перфузії гине близько 2 млн нейронів [36].
Використання ТЛТ у пацієнтів з ішемічним інсультом характеризується доведеною перевагою порівняно із плацебо лише у разі введення тканинного активатора плазміногену до 4,5 год від початку інсульту [36].
J.L. Saver et al. (2010) проаналізували дані 58 353 пацієнтів з ішемічним інсультом, які отримували ТЛТ у 1395 шпиталях США [37]. Середній вік хворих становив 72 роки, середній час на початок ТЛТ – 144 хв (інтерквартильний діапазон – 115‑170 хв). При цьому 9,3% пацієнтів отримали ТЛТ протягом 0‑90 хв від появи симптомів інсульту, 77,2% – 91‑180 хв та 13,6% пацієнтів – 181‑270 хв. Цікаво відзначити, що хворі, госпіталізовані у найбільш ранні терміни від початку інсульту, мала такі особливості:
- виразніший неврологічний дефіцит – середня оцінка за шкалою NIHSS становила 13,2 (7,2) бала порівняно з 11,0 (7,3) у групі госпіталізованих у пізніші терміни;
- звернення по медичну допомогу в робочі години (з понеділка по п’ятницю, із 7:00 до 17:00);
- відсутність ЦД та захворювань периферичних артерій в анамнезі;
- відсутність раніше перенесених інсультів та транзиторних ішемічних атак.
Для пацієнтів, які отримали ТЛТ упродовж 0-90 хв від початку симптомів інсульту порівняно з тими, котрим ТЛТ провели через 181‑270 хв, були характерні сприятливіші результати лікування: нижчі летальність (7,7 vs 8%) і частота виникнення симптоматичних ВЧК (4 vs 5,1%; р=0,004), вища частка хворих, які на момент виписки з лікарні не залежали від сторонньої допомоги у повсякденному житті (35,4 vs 33,8%).
При статистичному аналізі встановлено, що на кожну тисячу пацієнтів, що отримали ТЛТ, зменшення часу до початку введення альтеплази на 15 хв дозволяло ще 8 особам повністю не залежати від сторонньої допомоги при виписці, ще 13 бути готовими до самостійнішого проживання і ще 4 вижили після інсульту. За результатами дослідження, найвиразніший ефект показника часу до початку ТЛТ на наслідки лікування визначався після корегування даних з урахуванням початкового неврологічного дефіциту.
Слід наголосити, що початкова тяжкість інсульту є найважливішим фактором, який чинить вплив на результати лікування ішемічного пошкодження мозку та, зокрема, ускладнює аналіз залежності наслідків терапії від часу початку ТЛТ. Це зумовлено тим, що пацієнтів у тяжчому стані загалом госпіталізують у більш ранні терміни від початку хвороби, а також вони мають найбільш несприятливий прогноз щодо видужання [2].
Значення даних лабораторних та діагностичних досліджень для наслідків інсульту після ТЛТ
Гіперглікемія
Гіперглікемія, яку реєструють у гостру фазу ішемічного інсульту в 60% пацієнтів, є добре відомим феноменом, що негативно впливає на клінічні наслідки інсульту і збільшує ймовірність смерті [38]. Після розподілу даних з урахуванням клінічної тяжкості ішемічного інсульту виявлено пряму пропорційну залежність частоти розвитку несприятливих результатів захворювання від початкового рівня глюкози.
Можливі механізми шкідливого впливу глюкози на мозкову тканину включають:
- розвиток клітинного ацидозу внаслідок активації анаеробного гліколізу;
- збільшення продукції вільних радикалів;
- підвищення проникності ГЕБ;
- порушення функції мітохондрій;
- підвищення внутрішньоклітинного транспорту Ca2+;
- розвиток внутрішньоклітинного набряку.
Проте запропоновані й інші механізми, згідно з якими гіперглікемія може бути проявом гострого дистрес-синдрому, який розвивається у відповідь на активацію осі гіпоталамус-гіпофіз-наднирники і викид кортизолу й катехоламінів та, як наслідок, слугувати індикатором тяжкості пошкодження речовини мозку. Крім того, гіперглікемія інколи виникає в результаті пошкодження або подразнення ділянок головного мозку, які відповідають за регуляцію рівня глюкози у крові, про що свідчить частіший розвиток гіперглікемії на тлі інсультів, що залучають ділянку острівця. Нарешті, гіперглікемія може бути проявом недіагностованого раніше ЦД [2].
Також про наявність різних механізмів впливу глюкози на результат інсульту свідчать неоднозначні результати досліджень агресивного зниження рівня глюкози в гостру фазу інсульту. Наразі відсутні докази того, що забезпечення та підтримка нормоглікемії після інсульту сприяє покращенню його наслідків. Хоча дослідження GIST-UK було припинене передчасно і не мало достатньої потужності, не було виявило відмінностей результатів захворювання в пацієнтів, які були випадково розподілені у групу тривалої інфузії глюкозо-інсуліно-калієвого розчину з метою підтримки глікемії у межах 4‑7 ммоль/л порівняно з тими, хто протягом перших 24 год після інсульту не отримував препаратів для зниження рівня глюкози. Відсутність виразного сприятливого впливу введення гіпоглікемічних засобів могла бути зумовлена відносно пізнім стартом терапії (в середньому через 14 год від початку інсульту) та помірним зниженням концентрації глюкози, якого було досягнуто (0,57 ммоль/л).
Метааналіз даних 55 досліджень (1996‑2012) показав, що рівень глюкози крові у пацієнтів з ішемічним інсультом при надходженні до стаціонара та наявність ЦД в анамнезі асоціювалися зі зниженням частоти сприятливих результатів ТЛТ (оцінка за шкалою mRs 0‑2 бали через 90 днів після інсульту) та збільшенням кількості симптомних ВЧК.
Деякі автори виявляли зниження частоти реканалізації після внутрішньовенного тромболізису, що може бути пояснене зниженням фібринолітичної активності крові в умовах гіперглікемії [39]. На додаток, є дані про те, що в умовах гострої та хронічної гіперглікемії підвищується активність системи згортання крові, тоді як гіперінсулінемія знижує фібринолітичну активність крові за рахунок стимуляції синтезу інгібітора активатора фібриногену [40‑44].
Вплив тромболізис-асоційованих ускладнень гострого ішемічного інсульту на несприятливі наслідки системної ТЛТ
Найпоширенішими клінічними причинами несприятливих результатів тромболізису є повторні ішемічні інсульти, що виникають у ранньому періоді після ТЛТ або пізніше під час госпіталізації пацієнта, внутрішньомозкові крововиливи, набряк/дислокація головного мозку, анафілактичні реакції, позачерепні кровотечі тощо. Серед них важливе значення мають внутрішньомозкові крововиливи, які розвиваються у вогнищі інфаркту або за його межами. За даними дослідження NINDS, частота симптомних геморагічних трансформацій після системної ТЛТ становить 6,4% [45].
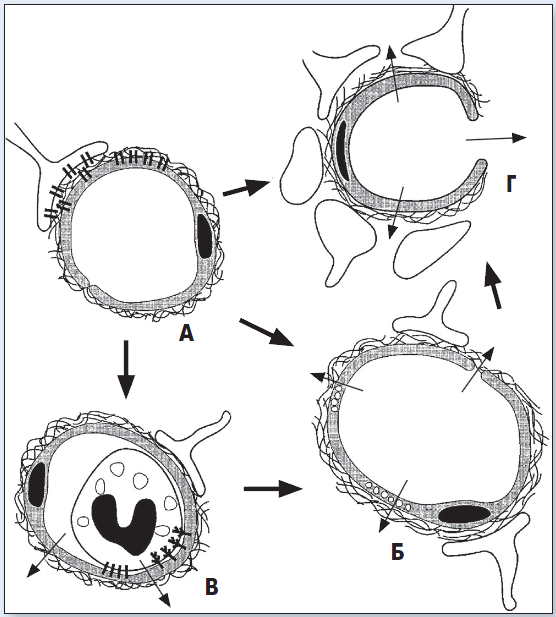
Патофізіологічним механізмом розвитку геморагічної трансформації є підвищення проникності ГЕБ (рис. 1).
A – будова мікросудин головного мозку в нормі; ендотеліальні клітини та астроцити, пов’язані з базальною пластинкою інтегриновими рецепторами адгезії; інтактний ГЕБ. Б – порушення цілісності ГЕБ. В – адгезія лейкоцитів до рецепторів ендотелію; підвищення проникності за допомогою вивільнення вмісту. Г – руйнування базальної пластинки із втратою астроцитарно-ендотеліальних контактів; ГЕБ стає проникним для великих клітин (еритроцитів)
Рис. 1. Вплив ішемії на проникність та цілісність мікросудинної стінки
Адаптовано за G. Del Zoppo et al., 1998
На експериментальних моделях ішемічного інсульту показано, що зниження кровотоку в живильній мозковій артерії та відповідне зменшення оксигенації тканин насамперед впливає на мікросудинне русло. При цьому спостерігається підвищення проникності та часткове руйнування ГЕБ, що складається з ендотеліального шару, базальної пластинки та периваскулярних астроцитів, які являють собою паренхіматозний компонент мікросудинного русла і тісно взаємопов’язані з іншими компонентами ГЕБ. У відповідь на пошкодження в мікросудинному ендотелії підвищується експресія лейкоцитарних рецепторів адгезії, що супроводжується викидом запальних цитокінів (ІЛ‑1β, ФНП-α) та протеолітичних ферментів (металопротеїназ ММР1, ММР2, колагенази, еластази). Це своєю чергою посилює подальше ураження базальної пластинки і призводить до утворення її суттєвіших дефектів, що полегшує проникнення більших формених елементів крові у мозкову тканину.
Введення тканинного активатора плазміногену гальмує процеси відновлення нормальної проникності за рахунок сповільнення утворення комплексів із тромбоцитів/фібрину та прямої розчинної дії на компоненти базальної пластинки ГЕБ [46]. У зв’язку з цим у всіх великих дослідженнях системної ТЛТ (ECASS, NINDS, ATLANTIS) відзначалося підвищення частоти геморагічної трансформації до 6,4% порівняно із групою плацебо.
У літературі описані чинники, які додатково впливають на цілісність мікросудинного русла і спричиняють мікроангіопатії:
- літній вік;
- високий АТ;
- ЦД;
- церебральна амілоїдна ангіопатія;
- об’єм ішемічного пошкодження мозку.
Крім того, на ризик розвитку внутрішньомозкового крововиливу впливають тяжкість інсульту (за шкалою NIHSS) та час до початку тромболізису. З урахуванням того, що перелічені фактори характеризуються виразним взаємозв’язком (наприклад, раніше отримують лікування літні пацієнти, які мають вищу оцінку за NIHSS), науковці розглянули відносний та абсолютний вплив системної ТЛТ альтеплазою в осіб з ішемічним інсультом, згрупованих за виразністю неврологічного дефіциту, віком та часом до ініціювання тромболізису [48].
За даними метааналізу даних дев’яти досліджень, які загалом включали 6756 пацієнтів, імовірність розвитку внутрішньомозкового крововиливу (ВМК) у перші сім днів після ТЛТ зростала у 6‑7 разів порівняно з контрольною групою. Відносне підвищення ризику ВМК не залежало від часу старту терапії, початкової тяжкості інсульту та віку. Автори припускають, що введення альтеплази у перші 4,5 год супроводжується, з одного боку, загрозою розвитку ВМК у перші сім днів після ТЛТ, а з іншого – сприятливою дією щодо функціонального відновлення пацієнта через три місяці за шкалою mRs.
Отже, ТЛТ покращує прогноз самообслуговування у пацієнтів, яким вдалося уникнути ВМК у перші сім діб. Результат внутрішньовенної ТЛТ щодо функціонального відновлення через 3‑6 місяців у різних групах хворих залежно від часу початку терапії та виразності неврологічного дефіциту представлено на рисунку 2.
Рис. 2. Ймовірний клінічний результат лікування через 3-6 місяців після інсульту в різних групах пацієнтів
Адаптовано за W.N. Whiteley et al., 2016
Висновки
Таким чином, в літературі зустрічаються суперечливі дані щодо ролі різних демографічних й анамнестичних чинників на наслідки інсульту після ТЛТ. Зокрема, простежується чіткий вплив на результати лікування деяких клініко-анамнестичних факторів, таких як початковий неврологічний дефіцит (за шкалою NIHSS) та час до ініціювання ТЛТ. При цьому значення інших чинників, як-то супутні захворювання, рівень глюкози у крові тощо, потребує подальшого вивчення та уточнення.
Список літератури знаходиться в редакції.
Тематичний номер «Неврологія, Психіатрія, Психотерапія» № 4 (59) 2021 р.