15 лютого, 2022
Ведення пацієнтів після позасерцевих і неневрологічних операцій: обстеження та лікування для зниження ризику гострого інсульту
Інсульт є можливим серйозним ускладненням у пацієнтів, які перенесли позасерцеві й неневрологічні операції. Американська асоціація серця (АНА) та Американська асоціація з вивчення інсульту (ASA) торік розробили наукову заяву, в якій підсумували встановлені фактори ризику періопераційного інсульту, стратегії для зменшення ймовірності його розвитку перед та під час хірургічного втручання, а також аспекти післяопераційної оцінки й підходи до лікування з метою мінімізації стійкої неврологічної дисфункції у таких хворих. Пропонуємо вам ознайомитись із ключовими положеннями даного документа.
У попередніх настановах АНА/ASA містяться рекомендації щодо оцінки серцево-судинної (СС) системи та ведення пацієнтів, які перенесли позасерцеві операції (Kristensen et al., 2014; Fleisher et al., 2014). Своєю чергою у науковій заяві 2021 р. увагу сфокусовано на цереброваскулярних ускладненнях унаслідок позасерцевих хірургічних втручань та узагальнено поточні дані літератури щодо передопераційної стратифікації неврологічного ризику і менеджменту хворих перед позасерцевими й неневрологічними операціями, інтраопераційних стратегій для зменшення ймовірності інсульту, а також виявлення та лікування осіб, які перенесли періопераційний інсульт.
Передопераційна оцінка для зменшення ймовірності інсульту
Визначення та ризик періопераційного інсульту
Періопераційний інсульт може бути визначений як будь-яка емболічна, тромботична або геморагічна цереброваскулярна подія з розвитком моторної, сенсорної або когнітивної дисфункції тривалістю принаймні 24 год, що виникає під час операції чи протягом 30 днів після неї. Як і при неперіопераційних цереброваскулярних подіях, більшість періопераційних епізодів є ішемічними, а не геморагічними (Ng et al., 2011).
За даними ретроспективних досліджень двох великих баз даних, частота періопераційного інсульту у пацієнтів, які перенесли позасерцеві чи неневрологічні операції, становить від 0,1 до 1% (Mashour et al., 2014; Bateman et al., 2009). У нещодавньому великому проспективному міжнародному випробуванні за участю понад 40 тис. осіб, які перенесли позасерцеві інтервенції, загальна частота випадків періопераційного інсульту становила 0,3%. При цьому вищий ризик корелював із потребою в судинних та нейрохірургічних операціях (Spence et al., 2019). Результати інших робіт продемонстрували нижчий періопераційний ризик інсульту (0,028‑0,075%), але були обмежені клінічним досвідом в окремих медичних установах (Wang et al., 2018; Vasivej et al., 2016).
N. R. Smilowitz et al. (2017) проаналізували національну вибірку пацієнтів у США із 2004 по 2013 рр. Було виявлено, що, незважаючи на загальне зменшення кількості серйозних цереброваскулярних і СС-подій (МАССЕ) після позасерцевих операцій за цей період, частота періопераційного інсульту зросла із 0,52% у 2004 р. до 0,77% у 2013 р. (рисунок). Хоча пацієнти, які перенесли втручання на судинах, мали найвищий ризик МАССЕ, деякі з них, можливо, потребували операції саме внаслідок ішемічного інсульту. Після виключення групи хворих, котрим було виконано хірургічні інтервенції на судинах, збільшення ймовірності періопераційного інсульту зберігалося.
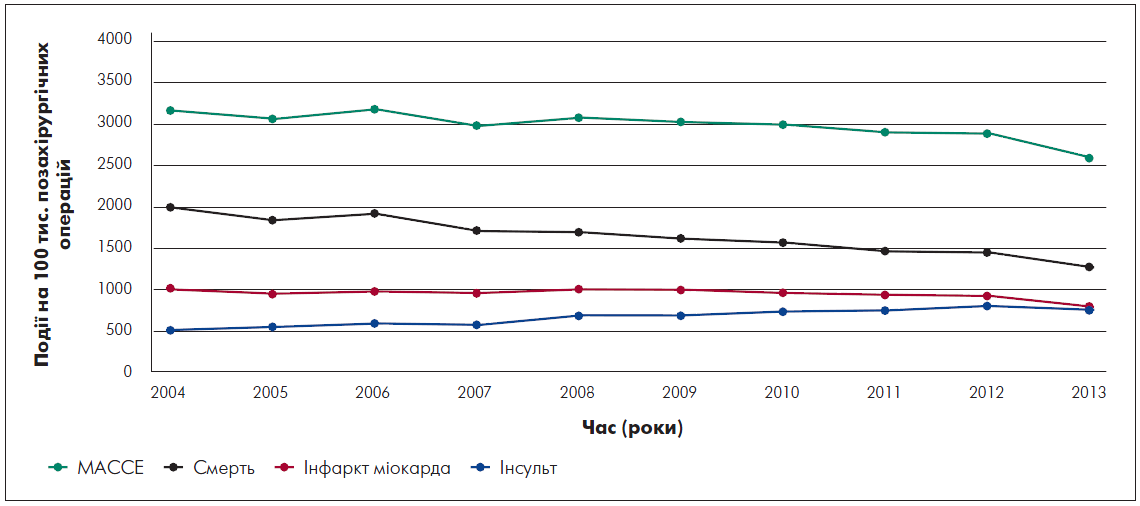 Рисунок. Частота періопераційних MACCE із плином часу
Рисунок. Частота періопераційних MACCE із плином часу
Адаптовано за N. R. Smilowitz et al., 2017
Варто зауважити, що тенденція до зростання ризику розвитку інсульту була очевидною як у чоловіків, так і в жінок, а також серед представників різних рас і етнічних груп (Smilowitz et al., 2017). Проте важливим є те, що не було проведено незалежного клінічного обстеження пацієнтів та не враховано потенційних тимчасових змін результатів магнітно-резонансної томографії (МРТ) для оцінки інсульту. Тож реальна частота розвитку інсульту могла бути вищою або нижчою за отримані дані.
У багатьох дослідженнях стійкими ключовими факторами ризику періопераційного інсульту були визначені (Sharifpour et al., 2013; Wang et al., 2019):
- похилий вік;
- захворювання нирок;
- раніше перенесена транзиторна ішемічна атака (ТІА) / інсульт.
Інші чинники ризику, такі як інфаркт міокарда (ІМ) протягом шести місяців, фібриляція передсердь (ФП), артеріальна гіпертензія (АГ), хронічне обструктивне захворювання легень, поточне куріння, жіноча стать і цукровий діабет, були названі незалежними предикторами, які ще більшою мірою підвищують імовірність періопераційного інсульту (Vasivej et al., 2016). Крім того, було встановлено, що пацієнти, які перенесли невідкладну операцію або певні види хірургічних втручань (торакальні, на голові та шиї, внутрішньочеревні, судинні, трансплантаційні, ортопедичні), також входять до групи підвищеного ризику розвитку періопераційного інсульту (Smilowitz et al., 2017).
Безбольова церебральна ішемія
Безбольові (безимптомні, тихі) інфаркти головного мозку, які також називають прихованими інсультами, являють собою гострі ішемічні події, що не проявляються клінічно. За даними популяційних досліджень, такі інфаркти, що зазвичай виявляють за допомогою візуалізації головного мозку, пов’язані зі зниженням когнітивних функцій, деменцією, підвищенням ризику інсульту та смертності (Bokura et al., 2006; Gupta et al., 2016). Частота періопераційних тихих інфарктів мозку варіює залежно від типу хірургічного втручання та, ймовірно, вища у пацієнтів, які перенесли операцію на судинах чи серці.
Безсимптомна церебральна ішемія після каротидної ендартеректомії (КЕА) зустрічається у 17% хворих. Її частота може сягати 30‑50% у пацієнтів, яким провели стентування сонної артерії (ССА) або кардіохірургічну операцію (Schnaudigel et al., 2008; Barber et al., 2008). Безбольові інфаркти мозку, що спостерігаються після операції на серці, корелюють із підвищеним ризиком повторного інсульту або ТІА (Gensicke et al., 2015).
У дослідженнях за участю пацієнтів, які перенесли хірургічні втручання на серці, частота нових інфарктів, визначених за допомогою МРТ, становила від 25 до 55%. При цьому ризик був найвищим у хворих, котрим проводили відкриту хірургічну заміну клапана, і сягав 90% серед тих, кому виконали транскатетерну заміну аортального клапана (Indja et al., 2019; Giovannetti et al., 2019). Хоча загалом дані неоднозначні, у деяких дослідженнях тиха ішемія головного мозку після операції на серці була пов’язана зі зниженням когнітивних функцій, і вищий ризик корелював із більшою кількістю та об’ємом уражень (Indja et al., 2019; Barber et al., 2008).
Згідно з результатами проспективного багатоцентрового пілотного дослідження із залученням 100 пацієнтів віком >65 років, частота безсимптомних інфарктів мозку після позасерцевих хірургічних втручань, підтверджених післяопераційною МРТ, може становити 10% (Mrkobrada et al., 2016). Також у масштабнішому багатоцентровому проспективному дослідженні за участю 1114 пацієнтів, які перенесли планову позасерцеву операцію, у 7% відзначався тихий інфаркт мозку на основі результатів МРТ, отриманих за період 2‑9 днів після інтервенції (NeuroVISION Investigators, 2019). Крім того, ризик розвитку когнітивного дефіциту протягом одного року спостереження був майже удвічі вищим у пацієнтів із безсимптомним періопераційним інсультом, ніж в осіб без нього. Обширний інсульт і періопераційний делірій також були частішими у групі пацієнтів, які мали періопераційний тихий інфаркт мозку.
Таким чином, отримані висновки підкреслюють необхідність проведення додаткових досліджень для визначення факторів, що призводять до розвитку безбольової церебральної ішемії, а також для зниження цього ризику з метою зменшення частоти потенційних когнітивних порушень у хворих.
Наслідки періопераційного інсульту
Незважаючи на відносно низьку частоту, періопераційний інсульт є значним тягарем для громадського здоров’я. Щорічно у США понад 5 млн пацієнтів віком від 45 років переносять позасерцеві хірургічні втручання та >25 тис. осіб щорічно можуть мати інсульт, пов’язаний із періопераційними причинами (Weiser et al., 2008). Крім того, індивідуальний вплив періопераційного інсульту буває руйнівним. Рівень 30-денної смертності у пацієнтів, які перенесли періопераційний інсульт, у вісім разів вищий, ніж у контрольній групі (Wilcox et al., 2006; Wang et al., 2019).
Патофізіологія періопераційного інсульту
Хоча добре відомо, що переважна більшість періопераційних інсультів ішемічні, а не геморагічні, причини ішемічного інсульту є варіабельними та, ймовірно, пов’язані з низкою різноманітних факторів. У пацієнтів, які перенесли хірургічні втручання на серці, майже дві третини ішемічних інсультів асоційовані з проксимальними джерелами емболії або є наслідком прямих серцевих/артеріальних маніпуляцій чи шунтування під час процедури, а також відстрочених ускладнень, таких як ФП та ІМ (Selim, 2007).
Однак у пацієнтів, які перенесли позасерцеві, несудинні операції, причина інсульту менш очевидна. Позаяк у багатьох проведених дослідженнях не передбачалося виконання розширених діагностичних тестувань, таких як МРТ або візуалізація судин, підтипи інсульту в більшості робіт не були встановлені (Vlisides, Mashour, 2016; Ng et al., 2011).
Наявні спостереження свідчать, що чинники впливу на ризик інсульту в осіб, які перенесли позасерцеві/несудинні операції, відрізняються від таких при інших типах хірургічних втручань та, ймовірно, пов’язані з інтраопераційним та найближчим післяопераційним періодами (Smilowitz et al., 2017; Wang et al., 2019). Потенційні механізми періопераційного інсульту в пацієнтів після позасерцевих чи неневрологічних інтервенцій можуть включати такі, як (Saito et al., 2019; Devereaux et al., 2010):
- гіпотензія / порушення кровотоку;
- раніше не підтверджений стеноз великих артерій;
- гіпоксія тканин, асоційована з анемією;
- тромбоемболія (зокрема, кардіальна та транскардіальна);
- жирова емболія;
- підвищена згортуваність крові / тромбоз на тлі системного запалення;
- ендотеліальна дисфункція;
- нещодавнє припинення приймання антитромботичних препаратів.
Геморагічний інсульт в періопераційному періоді зустрічається рідко – у ≤5% випадків (Ng et al., 2011; Selim, 2007). Неконтрольована АГ та застосування антитромботичних засобів, разом із реперфузійним ураженням та синдромом гіперперфузії, що спостерігаються після КЕА, є потенційними чинниками ризику розвитку періопераційного геморагічного інсульту (Ko, 2018; van Mook et al., 2005).
Стратифікація передопераційного ризику
Із метою прогнозування ускладнень у пацієнтів, які перенесли операцію, було створено низку інструментів для стратифікації СС-ризику, як-то модифікована шкала ризику СС-подій (RCRI), калькулятор ризику ІМ або зупинки серця і калькулятор хірургічного ризику Американської колегії хірургів (ACS) (Lee et al., 1999; Gupta et al., 2011; Bilimoria et al., 2013). Проте ці методики не передбачені для спеціального визначення ймовірності періопераційного інсульту. Для прогнозування річного ризику інсульту в пацієнтів із неклапанною ФП було розроблено шкали CHADS2 і CHA2DS2-VASc (Gage et al., 2001; Lip et al., 2010). Вони також дозволяють прогнозувати періопераційну ймовірність інсульту в осіб, які перенесли кардіохірургічні втручання, навіть за відсутності ФП (van Diepen et al., 2014; Peguero et al., 2015).
Зазначені інструменти стратифікації ризику порівнювали у великій ретроспективній когорті пацієнтів (n=540 717), які перенесли позасерцеві операції, з використанням реєстру Національної програми підвищення якості хірургічного лікування ACS (Wilcox et al., 2019). Загальний ризик інсульту становив 0,27%, причому цей показник був найвищим у хворих, які перенесли судинні або нейрохірургічні втручання. Найліпшу точність прогнозування показали калькулятор хірургічного ризику ACS та калькулятор ризику ІМ або зупинки серця, незважаючи на те, що вони не були розроблені спеціально з цією метою.
Стратегії передопераційної профілактики інсульту
Терміни хірургічного втручання після інсульту
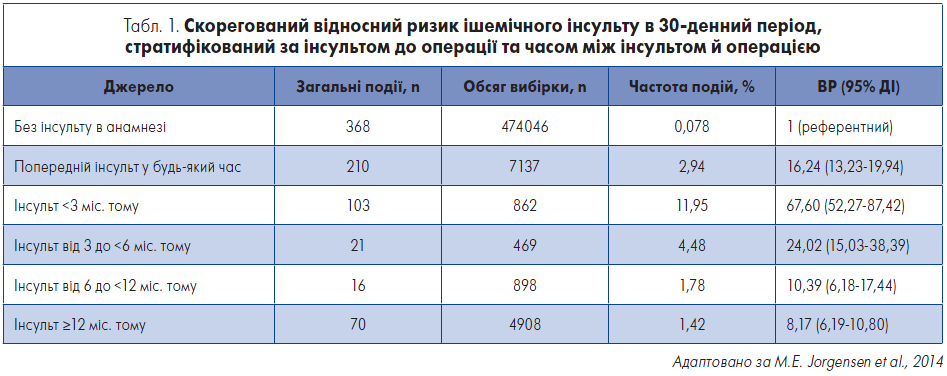
Пацієнти з інсультом в анамнезі мають підвищену ймовірність періопераційного інсульту, і час інтервенції щодо останньої події модулює цей ризик. M. E. Jоrgensen et al. (2014) проаналізували дані великої національної бази даних з охорони здоров’я Данії та визначили, що ризик ішемічного інсульту й інших серйозних СС-подій (як-от ІМ та СС-смерть) був значно вищим у хворих, які перенесли позасерцеві операції після інсульту. При цьому в осіб, котрим провели планове позасерцеве хірургічне втручання протягом трьох місяців після інсульту, спостерігався найвищий ризик розвитку ішемічного інсульту (табл. 1). На основі отриманих даних автори також виявили, що ймовірність інсульту була більш ніж у 20 разів більшою у пацієнтів, які перенесли невідкладну позасерцеву операцію протягом трьох місяців до інсульту (Christiansen et al., 2017).
Таким чином, доцільно розглянути відтермінування планової позасерцевої операції принаймні на шість, а можливо, і дев’ять місяців після перенесеного інсульту, щоб зменшити ймовірність повторної події в періопераційний період у пацієнтів, які перенесли позасерцеве хірургічне втручання. Своєю чергою у хворих після інсульту, які можуть досягти значного поліпшення якості життя за допомогою планової операції, слід відстрочити процедуру лише на шість місяців.
Стеноз екстракраніального сегмента сонної артерії
Згідно з поточними рекомендаціями, у пацієнтів зі стенозом екстракраніального відділу сонної артерії високого ступеня (>70%) та іпсилатеральною обструкцією внаслідок ішемічного інсульту або ТІА протягом останніх шести місяців потрібно настійно розглянути питання щодо реваскуляризації за допомогою КEA або ССА. У симптоматичних хворих із помірним стенозом (50‑69%) також слід розглянути доцільність реваскуляризації за умови, що ризик хірургічного втручання становить <6% (Kernan et al., 2015). Важливо враховувати основні фактори ризику, оскільки ССА асоційована із дещо більшою імовірністю інсульту, а КEA – ІМ (Brott et al., 2010).
Що стосується безсимптомних пацієнтів із підтвердженим стенозом сонної артерії високого ступеня у загальній популяції, згідно з рекомендаціями АНА доцільно (Meschia et al., 2014):
- розглядати їх як кандидатів для КEA, якщо ризик періопераційного інсульту, ІМ та смерті становить <3%;
- розглядати їх як кандидатів для ССА у разі стенозу >70% за даними ультразвукового дослідження або >60% за результатами катетерної ангіографії.
Однак варто зазначити, що це положення ґрунтується на доказах більш ранніх досліджень, які не включали сучасне інтенсивне медикаментозне лікування (Abbott, 2009).
Планову операцію можна відкласти, якщо хворий є кандидатом для проведення реваскуляризації сонної артерії (при симптомному чи безсимптомному каротидному стенозі високого ступеня), але оптимальна тривалість відтермінування точно невідома і переважно залежить від часу останньої цереброваскулярної події. Оптимальний підхід для пацієнтів із симптомним стенозом сонної артерії високого ступеня, які також потребують екстреного хірургічного втручання, такого як аортокоронарне шунтування (АКШ), достеменно не визначений; але він може включати АКШ із подальшою КЕА або одночасне здійснення АКШ та КEA (Selim, 2007; Chaturvedi et al., 2005).
Внутрішньочерепний стеноз
Симптомний внутрішньочерепний стеноз (ВЧС), що становить 50‑99% за даними катетерної ангіографії, пов’язаний із 15% ймовірністю інсульту протягом першого року після виявлення симптомів, але загальний ризик періопераційного інсульту в цій популяції невідомий (Chimowitz et al., 2005). ВЧС зазвичай лікується медикаментозно за допомогою антитромботичної терапії та ретельної модифікації факторів ризику (Derdeyn et al., 2014). Результати стентування ВЧС обмежені окремими випадками, коли інтенсивна фармакотерапія виявилася неефективною, до того ж немає доказів, що підтверджують його профілактичне використання у передопераційних умовах (Banerjee, Chimowitz, 2017). Згідно з даними невеликого ретроспективного дослідження із залученням 38 пацієнтів із тяжким ВЧС хребетної або базилярної артерії, які перенесли хірургічне втручання (на судинах, серці або інше), частота періопераційного інсульту становила 6% (Blacker et al., 2003).
Відкрите овальне вікно
Відкрите овальне вікно (ВОВ) наявне у ~25% населення і в більшості пацієнтів не корелює з якимось захворюванням (Meissner et al., 2006). Проте останні дані трьох клінічних випробувань підтверджують потенційний зв’язок між ВОВ та криптогенним інсультом у хворих віком <60 років і сприятливу роль закриття ВОВ в окремих випадках (Sondergaard et al., 2017; Saver et al., 2017). У масштабному дослідженні за участю пацієнтів національної вибірки стаціонарних хворих, які перенесли тотальне ендопротезування кульшового суглоба, ризик періопераційного інсульту був у 29 разів вищий за наявності дефекту міжпередсердної перегородки / ВОВ порівняно із контрольною групою (7,14 та 0,26% відповідно) (Perfetti et al., 2017).
Необхідні подальші дослідження, щоб краще охарактеризувати зв’язок між ВОВ та періопераційним ризиком інсульту для визначення оптимальних підходів до діагностики та лікування в цій популяції пацієнтів (Kasner, Messe, 2018).
Періопераційне медикаментозне лікування
Бета-блокатори
Було показано, що використання β-блокаторів у періопераційному періоді знижує частоту побічних ефектів із боку серця. Проте, за даними великого рандомізованого контрольованого дослідження, спостерігалося підвищення смертності та частоти інсульту в пацієнтів, які отримували перед втручанням метопролол порівняно із плацебо (Devereaux et al., 2008). За допомогою багатофакторного аналізу також було показано, що гіпотонія – потенційний механізм, через який β-блокатори можуть збільшувати ймовірність інсульту.
G. A. Mashour et al. (2013) повідомили про значне зростання частоти періопераційних інсультів у пацієнтів, які приймали метопролол порівняно з атенололом перед хірургічним втручанням, а також у хворих, що отримували метопролол порівняно з лабеталолом або есмололом в інтраопераційному періоді. Також було продемонстровано, що інтраопераційна гіпотензія асоціювалася з періопераційним ризиком інсульту, але не конкретно з метопрололом. Своєю чергою у подальшому масштабному когортному дослідженні не спостерігалося різниці щодо ризику смерті від усіх причин або серйозних СС-подій між підтипами β-блокаторів (London et al., 2017).
У настанові ACC/AHA (2014) щодо періопераційної оцінки СС-системи та ведення пацієнтів, які перенесли позасерцеві інтервенції, наполегливо рекомендовано продовжувати приймати β-блокатори пацієнтам, які перебувають на тривалому лікуванні (Fleisher et al., 2014). Також у документі зазначено, що початок терапії β-блокаторами може бути доцільним у хворих, які мають високий ризик за результатами передопераційного обстеження або ≥3 фактори СС-ризику відповідно до переглянутого індексу серцевого ризику, але не у день проведення втручання.
Статини
Хворим, які перед позасерцевим хірургічним втручанням вже приймали статини, рекомендовано продовжувати терапію у післяопераційному періоді для зниження ризику СС-подій (Kristensen et al., 2014). У багатьох когортних дослідженнях та нещодавньому метааналізі даних пацієнтів, які перенесли позасерцеві інтервенції (судинні та нейрохірургічні) показано, що періопераційне застосування статинів пов’язане зі значним зниженням різних кінцевих СС-точок, як-то (Ma et al., 2018; Berwanger et al., 2016):
- післяопераційний ІМ;
- смертність від усіх причин;
- новий епізод ФП;
- комбіновані кінцеві точки смерті від будь-яких причин, пошкодження міокарда та інсульту.
Проте у жодній із робіт не було виявлено суттєвого зниження ризику інсульту після хірургічного втручання, асоційованого із періопераційним використанням статинів.
Антитромботична терапія
Пацієнти з факторами ризику цереброваскулярних захворювань часто приймають антитромботичні засоби. У багатьох рекомендаціях розглядається підхід до лікування цими препаратами в пацієнтів, які потребують хірургічного втручання.
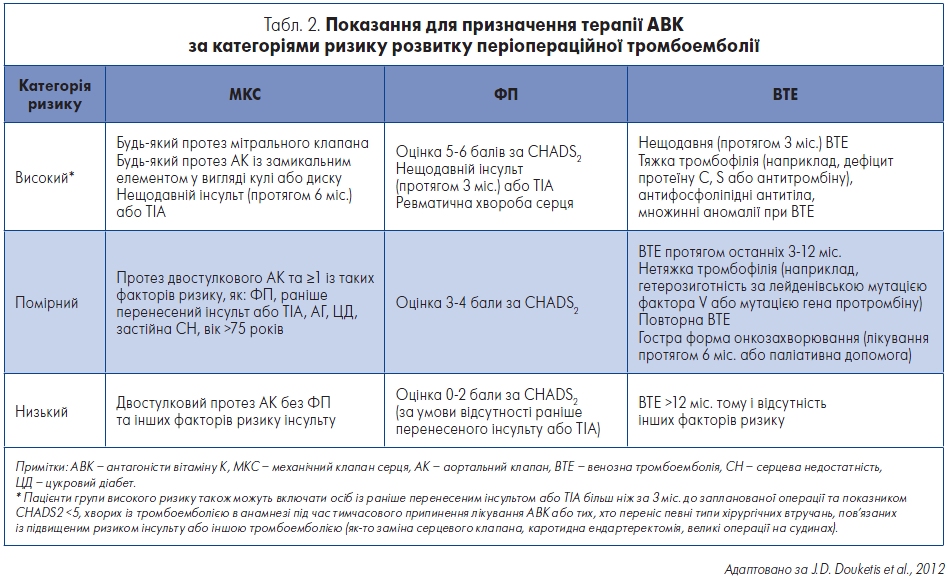
Клініцисти нерідко стикаються із проблемою потенційного підвищення ризику розвитку тромбоемболії при корегуванні/призупиненні антитромботичної терапії у періопераційному періоді, щоб зменшити ймовірність кровотечі (Pisters et al., 2010; Lip et al., 2010). Показання для призначення антикоагулянтної терапії відповідно до ступеня ризику тромбоемболії наведені в таблиці 2.
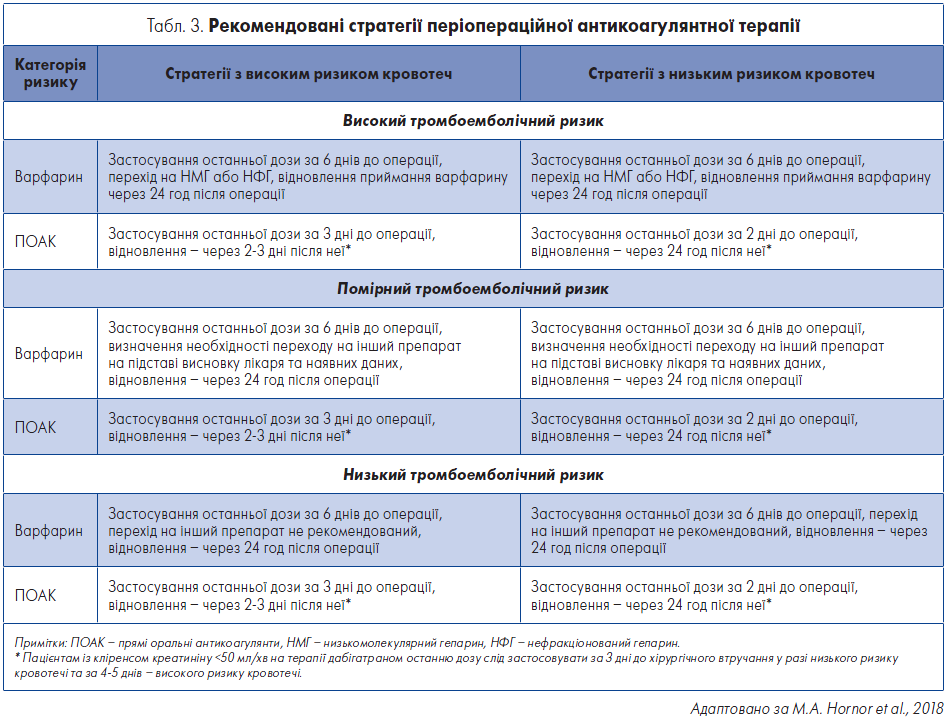
Нещодавно опублікована настанова ACS включає стратегії лікування антикоагулянтами залежно від категорій ризику періопераційної кровотечі (як-от низький, помірний та високий) (табл. 3). Окрім того, в документі вказано на необхідність обмеження використання періопераційної перехідної (bridging) терапії переважно у пацієнтів із високим ризиком тромбоемболії (Hornor et al., 2018; Douketis et al., 2015). До того ж продовження приймання ацетилсаліцилової кислоти (АСК) у низьких дозах хворими, які не перенесли черезшкірне коронарне втручання, можливо, призводить до збільшення ймовірності періопераційної кровотечі без зниження частоти нефатального ІМ або смерті (Devereaux et al., 2014).
Інтраопераційний моніторинг для зниження ризику інсульту
Контроль артеріального тиску
Підтримання адекватної перфузії серця, мозку та інших життєво важливих органів є наріжним каменем анестезіологічного забезпечення. За відсутності можливості безпосередньо виміряти приплив крові до мозку анестезіологи контролюють артеріальний тиск (АТ) як непрямий показник перфузії органів-мішеней. Падіння АТ є дуже поширеним під час операції, при цьому середній АТ (СерАТ) знижується на <20% від вихідного рівня, що спостерігається у 90% випадків (Bijker et al., 2007). Гіпотонія спричинена прямим впливом анестетиків на СС-систему, опосередкованим анестезією зниженням тонусу симпатичного відділу та зміною об’єму серця.
Слід зазначити, що гіпотонія може бути модифікованим фактором ризику розвитку періопераційного інсульту. У великому когортному дослідженні за участю дорослих пацієнтів середнього віку без атеросклеротичних захворювань ортостатична гіпотензія була пов’язана з удвічі більшою ймовірністю ішемічного інсульту (Rawlings et al., 2018). До того ж продовжують накопичуватися дані щодо кореляції інтраопераційної гіпотензії з такими станами, як (van Waes et al., 2016; Sessler et al., 2018):
- пошкодження міокарда;
- хвороба нирок;
- смерть.
Однак більшість доказів, що підтверджують причинно-наслідковий зв’язок між розвитком гіпотензії під час хірургічних інтервенцій та періопераційними інсультами, не дуже переконливі, за винятком результатів дослідження POISE (Devereaux et al., 2008).
Так, автори POISE мали на меті з’ясувати, чи поліпшує періопераційне застосування β-блокаторів СС-наслідки в осіб з атеросклеротичними патологіями. Було несподівано виявлено, що у пацієнтів, які отримували метопролол, спостерігалися вищий ризик летальних випадків та вдвічі більша кількість епізодів інсульту. Зокрема, в осіб із клінічно значущою гіпотензією в періопераційному періоді ймовірність інсульту була в два рази більшою. Це свідчить, що оптимальне регулювання АТ у періопераційному періоді може відігравати важливу роль у профілактиці інсульту (Devereaux et al., 2008).
J. B. Bijker et al. (2012) встановили, що ризик інсульту зростав у 1,14 раза на кожні 10 хв гіпотензії (визначалася як СерАТ, на 30% нижчий за вихідний рівень). J. K. Hsieh et al. (2016) повідомили про відсутність зв’язку між легкою гіпотензією (СерАТ <70 мм рт. ст.) та інсультом. Своєю чергою L. Y. Sun et al. (2018) виявили збільшення ймовірності інсульту при СерАТ <64 мм рт. ст. в 1,13 раза що 10 хв при застосуванні екстракорпорального кровообігу під час операції на серці.
Труднощі з виявленням зв’язку між інсультом та гіпотензією можуть бути пов’язані з низкою факторів, серед яких (Sharifpour et al., 2013):
- низька частота розпізнаних інсультів у хворих, які перенесли позасерцеві операції (0,1‑1%);
- виписка пацієнтів з лікарні до закінчення необхідного післяопераційного періоду (30 днів).
За даними нещодавнього багатоцентрового рандомізованого контрольованого дослідження, застосування стандартизованого підходу до лікування інтраопераційної гіпотензії асоційоване з меншою кількістю ускладнень у пацієнтів, які перенесли переважно абдомінальне хірургічне втручання (Futier et al., 2017). Своєю чергою у нещодавній консенсусній заяві D. I. Sessler et al. (2019) було зроблено висновок, що систолічний АТ <100 мм рт. ст. і СрАТ <60‑70 мм рт. ст. можуть бути пов’язані з ураженням міокарда та нирок.
Багатоцентрове рандомізоване дослідження POISE-III із запланованим залученням 10 тис. учасників буде присвячене вивченню частоти комбінованого ІМ, негеморагічного інсульту, тромбозу периферичних артерій та венозної тромбоемболії у пацієнтів, що отримуватимуть лікування, спрямоване на підвищення інтраопераційного СерАТ ≥80 мм рт. ст. Майбутні результати можуть бути корисними при наданні рекомендацій щодо ведення осіб з інтраопераційною гіпотензією. На додаток, дані запланованого піддослідження щодо зниження когнітивних функцій, пов’язаного з безсимптомними інфарктами мозку, допоможуть у визначенні інтраопераційних порогових значень СерАТ для уникнення пошкодження головного мозку.
Незважаючи на брак даних щодо встановлення точних цільових показників інтраопераційного АТ, клініцистам доцільно розглянути питання про підтримання СерАТ ˃70 мм рт. ст. під час втручання, щоб зменшити ймовірність періопераційного інсульту. Проте слід також уникати розвитку АГ високого ступеня, яка може спровокувати ішемію міокарда, набряк мозку чи інші ураження органів-мішеней.
Періопераційна цілеспрямована терапія
Мета періопераційного контролю гемодинаміки полягає в оптимізації перфузії органів-мішеней і доставки кисню, а не лише досягненні конкретних цільових показників АТ. Через 30 років після фундаментальної роботи W. C. Shoemaker et al. (1988), в якій було вперше описане використання цілеспрямованої терапії для оптимізації глобальної перфузії у хірургічних пацієнтів із високим ризиком, та незважаючи на суперечки навколо її переваг, на даний час ця методика широко використовується у медицині (Gillies et al., 2018).
На жаль, у жодному дослідженні, присвяченому вивченню цілеспрямованої терапії у хворих після перенесених позасерцевих операцій, не було зафіксовано суттєвого зниження частоти інсультів, найімовірніше, через малу кількість епізодів та недостатню статистичну потужність (Pearse et al., 2014; Calvo-Vecino et al., 2018).
Періопераційна трансфузія
Доставка кисню в мозок залежить від мозкового кровотоку, насичення артеріальної крові киснем і рівня гемоглобіну. Зниження останнього призводить до розширення мозкових артерій, збільшення симпатичного відтоку та венозного повернення до серця, а також скоротливої здатності й частоти серцевих скорочень. Разом усе це компенсує зниження вмісту кисню за рахунок збільшення серцевого викиду та мозкового кровотоку (Lelubre et al., 2016). У пацієнтів зі значним ураженням внутрішньої сонної артерії або ВЧС імовірна відсутність можливості збільшення церебральної перфузії з метою компенсації зниження рівня кисню в артерії (Tsai et al., 2010; Yamauchi et al., 2009).
Хоча очікується, що анемія може підвищити ризик розвитку інсульту в періопераційному періоді, у двох великих обсерваційних дослідженнях за участю пацієнтів, які перенесли позасерцеві інтервенції, не спостерігалося зростання частоти несприятливих наслідків із боку центральної нервової системи за наявності передопераційної анемії (Musallam et al., 2011; Saager et al., 2013). Проте в осіб із передопераційною анемією було виявлено значно вищий ризик смерті, респіраторних і СС-ускладнень порівняно з такими без анемії (Wu et al., 2007; Baron et al., 2014). На додачу, K. M. Musallam et al. (2011) встановили, що у пацієнтів із помірною та тяжкою анемією ймовірність летальних випадків більша на 44%, респіраторних і СС-подій – на 52 та 41% відповідно, але різниці щодо ускладнень із боку центральної нервової системи порівняно із хворими без анемії виявлено не було.
Своєю чергою підтверджено, що анемія підвищує ризик інсульту в пацієнтів, у яких не було хірургічного втручання (Panwar et al., 2016). Також анемія пов’язана з вищим ризиком несприятливих функціональних результатів і смерті в осіб із гострим інсультом (Li et al., 2016; Bellwald et al., 2018).
Що стосується стратегій переливання крові, нещодавній метааналіз, оснований на даних 37 рандомізованих контрольованих досліджень із загальною кількістю >19 тис. пацієнтів, показав, що ризик інсульту, ІМ, застійної серцевої, ниркової недостатності й 30-денної смертності істотно не відрізнявся при застосуванні рестриктивної та ліберальної тактики переливання крові (Carson et al., 2018).
У контексті порогового показника для трансфузії чітко визначених рекомендацій на сьогодні немає. Автори поточної настанови радять клініцистам розглянути поріг переливання крові 8 г/дл для більшості пацієнтів із підвищеним ризиком інсульту і 9 г/дл – для осіб із гострим періопераційним інсультом або підтвердженою цереброваскулярною недостатністю, спричиненою виразним стенозом або оклюзією сонної артерії.
Слід зазначити, що наразі планується дослідження LIBERAL, в якому вчені прагнуть оцінити, чи приводить ліберальна/трансфузійна стратегія переливання крові до меншої кількості несприятливих ішемічних результатів, включно з інсультами, у хворих віком ≥70 років, які перенесли позасерцеві операції середнього та високого ризику (Meybohm et al., 2019).
Виявлення та лікування періопераційного інсульту
Розпізнавання інсульту в періопераційному періоді
Від 4 до 17% всіх інсультів трапляються у пацієнтів, які вже госпіталізовані за медичними або хірургічними показаннями (Cumbler et al., 2014; Kimura et al., 2006). У проспективному когортному дослідженні особи із внутрішньолікарняними інсультами (з яких понад 60% – періопераційні) значно рідше отримували тромболітичну терапію і частіше мали затримки у часі до проведення візуалізації головного мозку та початку лікування порівняно з тими, хто потрапив до стаціонара з інсультом (Saltman et al., 2015).
Майже половина всіх періопераційних інсультів виникає протягом перших 24 год після втручання (Vasivej et al., 2016; Wang et al., 2019). Тож виявлення симптомів інсульту в пацієнтів під час періопераційного періоду є складним, якщо інтубація тривала, є залишкові ефекти від анестезії або через використання опіоїдів та інших психоактивних препаратів після процедури.
Характерною ознакою гострого інсульту зазвичай є раптовий початок вогнищевого неврологічного дефіциту. В післяопераційному періоді точну ініціацію симптомів часто неможливо визначити, і клінічна картина буває невогнищевою, наприклад, спостерігаються (Wang et al., 2019; Vlisides, Mashour, 2016):
- зміни психічного статусу, включно із маренням;
- вегетативна нестабільність;
- віддалені наслідки анестезії.
Варто зауважити, що з метою полегшення неврологічної оцінки у пацієнтів із підозрою на інсульт використовувані у періопераційному періоді ліки, які впливають на психічний стан, можна скасувати.
Зокрема, у періопераційному періоді слід розглянути можливість проведення регулярних неврологічних обстежень для раннього виявлення інсульту в пацієнтів із високим ризиком, включно з оцінкою ступеня ажитації, мови та моторних функцій. Скорочені версії шкали оцінки інсульту Національних інститутів охорони здоров’я США (NIHSS) є доступним і швидким варіантом для використання у клінічних дослідженнях та на етапі догоспітального огляду (Sun et al., 2016; Tirschwell et al., 2002). Шкала догоспітального інсульту Цинциннаті – альтернативний інструмент для швидкої та легкої оцінки інсульту в періопераційних умовах (Kothari et al., 1999).
Ведення пацієнтів із гострим інсультом
Ендоваскулярна терапія
Пацієнти з оклюзією великих судин (ОВС), ймовірно, матимуть найбільш руйнівні неврологічні наслідки, якщо її не лікувати. Частота інсульту при ОВС становить >30% в осіб із гострим ішемічним інсультом і 10,9% – із періопераційним ішемічним інсультом після кардіохірургічних інтервенцій (Lakomkin et al., 2019).
Для лікування інсультів при ОВС використовують механічну емболектомію, що не потребує застосування антикоагулянтів і має переваги перед внутрішньовенним (в/в) введенням альтеплази. Тому пацієнтам із підозрою на наявність ОВС слід негайно провести КТ-ангіографію та, ймовірно, КТ-перфузію, щоб визначити, чи є вони кандидатами на механічну тромбектомію додатково до в/в тромболітичної терапії. Для хворих після гострого ішемічного інсульту можна розглянути в/в введення альтеплази, якщо лікування розпочате протягом 4,5 год після появи симптомів, і немає ознак крововиливу за даними КT без контрасту (Powers et al., 2019).
У пацієнтів, які перенесли періопераційний інсульт, часто неможливе в/в введення альтеплази у зв’язку із наявним ризиком виникнення хірургічної кровотечі. Проте для них може бути розглянуте проведення механічної тромбектомії за умови, що вони відповідають критеріям, які базуються на клінічних характеристиках та результатах візуалізації. Рішення щодо проведення механічної емболектомії в періопераційному періоді мають ґрунтуватися на зазначених параметрах, а також на індивідуальній оцінці ризику/користі, включно з поточними захворюваннями, типом нещодавно виконаного втручання тощо. Важливо підкреслити, що механічну тромбектомію при ОВС можна проводити без поточної антикоагулянтної терапії.
Останні докази підтвердили позитивний вплив механічної тромбектомії щодо зниження ступеня інвалідизації в окремих пацієнтів з ОВС упродовж 24 год після появи симптомів інсульту (Goyal et al., 2016; Powers et al., 2019). Поточні рекомендації для хворих, госпіталізованих протягом 6 год після розвитку симптомів, базуються на даних шести рандомізованих випробувань, які продемонстрували значне поліпшення функціональних результатів після перенесеної механічної емболектомії. У дослідженні DAWN пацієнти із виникненням симптомів у період від 6 до 24 год і невідповідністю між клінічними показниками та розміром інфаркту на основі розширеної візуалізації мозку, які перенесли механічну тромбектомію, мали значно ліпші результати через 90 днів порівняно з тими, хто отримував стандартне лікування (Nogueira et al., 2018).
У випробуванні DEFUSE3, присвяченому ендоваскулярній терапії з приводу ішемічного інсульту, пацієнти з оклюзією внутрішньої сонної артерії або проксимального відділу середньої мозкової артерії та сприятливими даними візуалізації головного мозку (невідповідність між вогнищем інфаркту та ішемічною півтінню), які отримували механічну тромбектомію, мали значно нижчий ступінь інвалідизації на 90-й день порівняно з контрольною групою (Albers et al., 2018).
Поточні рекомендації підтримують використання механічної тромбектомії у пацієнтів із появою симптомів у період від 6 до 24 год за умови, що вони відповідають критеріям прийнятності (Powers et al., 2019). Окрім того, додаткові дані метааналізів підтверджують потенційне розширення показань для проведення механічної емболектомії, а саме включення осіб з інсультами тяжчого ступеня або оклюзією дистального сегмента середньої мозкової артерії (Cagnazzo et al., 2020; Menon et al., 2019).
Тромболітична терапія
У пацієнтів з інсультом після великого хірургічного втручання можна розглянути доцільність лікування альтеплазою в/в протягом 4,5 год із часу завершення успішної операції. Зокрема, сукупні дані дозволяють припустити, що у ретельно відібраних хворих, у котрих минуло ˃4,5 год від моменту востаннє зафіксованого нормального стану після перенесеного інсульту, могло спостерігатися поліпшення неврологічного відновлення при в/в введенні альтеплази (Thomalla et al., 2018; Campbell et al., 2019). Абсолютним протипоказанням до в/в введення альтеплази є внутрішньочерепні або інтраспінальні хірургічні інтервенції протягом останніх трьох місяців (Powers et al., 2019).
За даними наявних досліджень, в/в введення альтеплази у хворих, які нещодавно перенесли операцію, слід розглядати після ретельної індивідуальної оцінки й обговорення користі/ризику між клініцистами та пацієнтами. Якщо можливе проведення механічної тромбектомії, вона має бути пріоритетною. Варто також брати до уваги, що у багатьох випадках несприятливі наслідки тяжкого інсульту можуть бути набагато гіршими, ніж ризик великої кровотечі під час хірургічного втручання (Guillan et al., 2012; Voelkel et al., 2017).
Підготувала Олена Коробка
Оригінальний текст документа читайте на сайті www.ahajournals.org
Тематичний номер «Інсульт» № 1 2022 р.