23 лютого, 2021
Нейроінвазія при коронавірусній інфекції: патогенез та перспективи лікування
У січні 2020 року Всесвітня організація охорони здоров’я оголосила про спалах епідемії, пов’язаної з вірусом SARS-CoV‑2, – надзвичайну подію в галузі охорони здоров’я міжнародного значення. Вже 11 березня 2020 р. кількість жертв інфікування даним вірусом дала підстави охарактеризувати ситуацію, що склалася, як пандемію.
Клінічні прояви COVID‑19
Дослідження показали, що SARS-CoV‑2 легко передається від людини до людини. Станом на 08.12.2020 р. у світі зареєстровано 67 956 925 випадків хвороби. При цьому загальна кількість летальних наслідків сягнула 1 550 562 осіб (2,28%) [2].
Відмітною особливістю даного захворювання є його швидка поширюваність. У зв’язку з тим, що на сьогодні інфіковано значну частку населення, вже доступний детальний опис клінічних проявів COVID‑19 [3].
У міру накопичення клінічного досвіду з’являється все більше доступних даних щодо проявів цієї вірусної патології та наслідків, які можуть впливати на зміну клінічної картини, а також якість життя перехворілих на COVID‑19 [3]. Ґрунтуючись на первинних результатах досліджень, отриманих з лікарень м. Ухань (Китай), науковці виявили найпоширеніші симптоми COVID‑19: лихоманку (83‑99% випадків) і сухий кашель (59,4‑82% випадків). Однак найхарактернішим симптомом захворювання є дихальна недостатність (55% випадків). Як повідомили автори досліджень, серед пацієнтів із задишкою більше половини потребували застосування інтенсивної терапії. При цьому приблизно 46‑65% таких хворих за короткий період часу померли через дихальну недостатність [4‑6].
Серед пацієнтів, госпіталізованих до відділення інтенсивної терапії, у 11,1% проводили кисневу терапію з високим потоком, 41,7% отримували неінвазивну вентиляцію легенів та 47,2% були переведені на штучну вентиляцію. Ці дані свідчать те, що більшість (близько 89%) хворих, госпіталізованих до відділення інтенсивної терапії, потребували застосування інтенсивної кисневої підтримки, або допоміжної/інвазивної вентиляції легень [5]. Однак автори робіт не повідомляли про будь-які неврологічні прояви в осіб із COVID‑19.
Уперше неврологічні прояви в інфікованих SARS-CoV‑2 були описані L. Mao et al. (2020), які виявили характерну неврологічну симптоматику в 78 з 214 (36,4%) пацієнтів із лабораторно підтвердженим діагнозом COVID‑19, що перебували у лікарнях в епіцентрі м. Ухань. При цьому у хворих із виразнішою симптоматикою спостерігався вищий відсоток неврологічних симптомів (45,5 vs 30,2%). Цереброваскулярні прояви захворювання також частіше зустрічалися в осіб із тяжчим клінічним перебігом (5,7 vs 0,8%) [7].
Як з’ясувалося пізніше, зміна нюху або смаку є типовою ознакою коронавірусної інфекції. Ретельніше ці клінічні ознаки вивчали G. Spinato et al. (2020), які виявили, що гіпогевзія і гіпосмія зустрічаються у 34% пацієнтів із COVID‑19 [8]. Також слід зазначити, що даний симптом був раннім проявом захворювання в 11,9% інфікованих хворих; у 22,8% він реєструвався одночасно з іншою симптоматикою, а у 26,7% виявлявся у відстроченому періоді, після появи інших симптомів захворювання.
Ці факти стали підставою для детальнішого вивчення нейроінвазивних механізмів інфікування при COVID‑19. Так, P. Chatterjee et al. (2020) описали кілька способів проникнення вірусу SARS-CoV‑2 у центральну нервову систему (ЦНС), які включали трансневральний і гематогенний шляхи інвазії [9]. Як зазначили дослідники, коронавірус досягає центральних мозкових структур через нюхову цибулину та поширюється з цієї точки у ЦНС [9, 10]. Даний шлях є відмітним механізмом досягнення ЦНС для коронавірусів, що потрапляють до організму інтраназально. Нюховий нерв пов’язаний із носовим епітелієм та нюховою цибулиною, яка є анатомічним «входом» вірусу до ЦНС [11].
Підтвердженням даної теорії стали результати дослідження J.R. St-Jean et al. (2004), в якому на експериментальних моделях тварин було показано, що видалення нюхового нерва обмежує нейротропну здатність вірусу в мишей. Також вчені довели, що після інтраназального введення інокуляту вірусу лабораторним тваринам інфекція поширилася у ЦНС менш ніж за сім днів. До того ж при дослідженні гліальних структур було виявлено, що вірус може викликати демієлінізацію нервових волокон [12].
Більш ранні дослідження зразків, взятих у пацієнтів із SARS на початку 2002 і 2003 рр., продемонстрували наявність частинок SARS-CoV у головному мозку, де вони розміщувалися майже виключно у нейронах [13‑15]. Експериментальні досліди на трансгенних мишах показали, що SARS-CoV і MERS-CоV при інтраназальному введенні здатні проникати в мозок, а потім швидко поширюватися у певні його ділянки, включно з таламусом і стовбуром мозку [16, 17]. Примітно, що у мишей, інфікованих низькими дозами інокуляту, частинки вірусу MERS-CоV також були виявлені у головному мозку, що, на думку науковців, і стало причиною високої смертності лабораторних тварин у даній групі [17]. Дослідники підкреслили, що найсильніше при цьому був інфікований і уражений саме стовбур головного мозку [16, 17].
У цьому контексті вельми цікавими є результати роботи M. Ceccarelli et al. (2020), які повідомляють, що вірусні антигени були виявлені у стовбурі мозку, де інфіковані зони включали ядро одинокого шляху та подвійне ядро [18]. Як відомо, еферентні волокна цих ядер забезпечують іннервацію непосмугованих м’язів дихальних шляхів і кровоносних судин. Такі нейроанатомічні кореляції свідчать, що смерть інфікованих тварин або пацієнтів через респіраторну недостатність може бути викликана дисфункцією даних мозкових структур [18].
Слід зазначити багато спільних особливостей у SARS-CoV і SARS-CoV‑2, тож цілком імовірно, що SARS-CoV‑2 має аналогічний потенціал. Дані епідеміологічних досліджень COVID‑19 вказують на те, що середній час від появи перших симптомів захворювання до задишки становить ~5 днів, до госпіталізації – ~7 днів, а розвиток тяжкого ступеня дихальної недостатності визначається через ~8 днів. Якщо при цьому врахувати швидкість коронавірусної нейроінвазії, отриманої у лабораторних тварин (7 днів), то можна припустити, що латентного періоду може бути достатньо, аби вірус проник у нейрони мозкового шару та зруйнував їх [5]. Отже, настороженість щодо потенційної нейроінвазії може мати вирішальне значення при проведенні профілактики й лікування дихальної недостатності, викликаної SARS-CoV‑2 [19].
Повідомлення про тяжчі неврологічних прояви COVID‑19 з’явилися у квітні 2020 р., коли T. Moriguchi et al. (2020) опублікували клінічний випадок менінгіту, пов’язаного із SARS-CoV‑2. Під час обстеження пацієнта було виконано низку досліджень, зокрема магнітно-резонансну томографію головного мозку. Результати показали гіперінтенсивність ділянки вздовж стінки правого бокового шлуночка та гіперінтенсивні зміни у правій скроневій частці й гіпокампі, що вказувало на можливий розвиток менінгіту, викликаного SARS-CoV‑2 [20].
Частота іншого неврологічного прояву, а саме енцефалопатичного делірію при COVID‑19, все ще лишається нез’ясованою. Так, на думку К. Kotfis et al. (2020), дані про зафіксовані випадки його виникнення у 25% пацієнтів із COVID‑19, імовірно, є неповними, адже нерідко делірій важко діагностувати [21]. У низці робіт, присвячених цьому питанню, доведено, що близько 75% випадків делірію не виявляються, якщо тільки не використовувати об’єктивний моніторинг делірію для встановлення цієї форми гострої дисфункції головного мозку [22‑24].
Дійсно, пацієнти із COVID‑19 схильні до підвищеного ризику розвитку делірію через наявність принаймні семи факторів, які включають пряму інвазію ЦНС, індукцію вивільнення медіаторів запалення у ЦНС, вторинне ураження нервової системи, ефект седативних препаратів, подовження часу штучної вентиляції легень, тривалу іммобілізацію та інші несприятливі чинники, як-от соціальна ізоляція тощо [21].
Запальна відповідь ЦНС на вірусну інфекцію, імовірно, є ще однією важливою причиною виникнення неврологічної симптоматики і делірію. Через кілька годин після інфікування SARS-CoV‑2 нейтрофіли й моноцити проникають у ЦНС, та, як стверджують деякі автори, порушують проникність гематоенцефалічного бар’єра [25, 26]. Посмертне дослідження, проведене J. Gu et al. (2005), документально підтвердило масивну інфільтрацію мозку імунними клітинами з розвитком «цитокінового шторму», яка була пов’язана з набряком нейронів головного мозку [27].
Застосування антиоксидантів при COVID‑19
Вірусна інфекція викликає «цитокіновий шторм», включно з викидом хемокінів, інтерферон-індукованого білка 10, інтерферону β й інтерлейкіну‑6 (ІЛ‑6), що призводить до загибелі клітин. Тому найважливішими лікарськими засобами є антиоксиданти, адже активовані форми кисню відіграють вирішальну роль у запальній реакції та «спалаху» цитокінів. Як зазначають Z.-W. Zhang et al. (2015), при гострих захворюваннях, викликаних сплеском вмісту активованих форм кисню, мітохондріальні антиоксиданти слід використовувати вже на ранній стадії [28].
В Японії у пацієнтів із гострим церебральним інфарктом (тромбозом/емболією) схвалене використання поглинача вільних радикалів едаравону, який пригнічує розвиток ішемічних цереброваскулярних розладів, як-то набряк головного мозку і повільна загибель нейронів, шляхом зв’язування вільних радикалів і зменшення окисного пошкодження клітин мозку. Як показали дані дослідження S. Ikeda et al. (2013), едаравон зменшував площу інфаркту головного мозку і сприяв функціональному відновленню геміпарезу при церебральному тромбозі в моделі на лабораторних щурах [30]. На думку S. Hashimoto et al. (2017), доцільність використання даного препарату обґрунтована тим, що кількість вільних радикалів поступово збільшується в зонах, що оточують ділянку ішемії, і також швидко зростає після реперфузії [29].
Більш ранні дослідження дії едаравону на цитокін-індуковану гіперпроникність легеневих мікросудинних ендотеліальних клітин продемонстрували, що при його застосуванні спостерігалося зниження на 45% судинної проникності, яка була порушена внаслідок «цитокінового шторму». При використанні дексаметазону вона знижувалася на 35% [31].
З огляду на дані літератури щодо патогенетичної складової коронавірусної інфекції та властивостей едаравону в плані здатності ефективно впливати на системно-запальні реакції, ми провели пілотне дослідження, спрямоване на вивчення ефективності використання даного препарату в пацієнтів із SARS-CoV‑2.
Матеріали та методи дослідження
У пілотному дослідженні взяли участь 16 пацієнтів (5 чоловіків та 7 жінок віком 60,1±10,6 із масою тіла 65,5±8,7 кг), яких було розподілено на дві зіставні групи:
- І група – пацієнти, в яких терапію проводили відповідно до протоколів МОЗ України з надання медичної допомоги для лікування коронавірусного захворювання COVID‑19 (контрольна група) [32, 33];
- ІІ група – пацієнти, в яких, окрім стандартної терапії, до схеми лікування був доданий препарат едаравон (Ксаврон® виробництва ТОВ «Юрія-Фарм») у дозі 30 мг внутрішньовенно двічі на добу на період 7‑10 днів.
Демографічні характеристики, а також дані щодо лікування, супутніх захворювань, лабораторних показників і клінічних результатів були отримані з історій хвороб пацієнтів. У всіх учасників за допомогою полімеразної ланцюгової реакції був підтверджений діагноз COVID‑19. Середню температуру тіла на початку дослідження фіксували на рівні +37,5±0,52 °C, а насичення артеріальної крові киснем за показниками пульсоксиметрії становило 73,5±7,6%. Сформовані групи не мали статистично достовірних гендерних відмінностей і збігалися за клінічними проявами захворювання.
Критеріями виключення пацієнтів із дослідження були наявність ниркової та печінкової недостатності, супутні тяжкі патології серця, печінки і нирок в анамнезі, вік >70 років, наявність онкологічних захворювань в анамнезі.
Для контролю стану пацієнтів обох груп визначали основні біохімічні показники, що вказували на системну запальну реакцію, такі як вміст С-реактивного білка, фібриногену та ІЛ‑6. Також для встановлення тяжкості стану і прогнозу клінічних наслідків використовували шкалу NEWS‑2 [34]. Даний інструмент враховує частоту дихання (на хв), частоту серцевих скорочень (на хв), систолічний артеріальний тиск (мм рт. ст.), насичення артеріальної крові киснем (%), потребу в кисневій підтримці, температуру тіла (°C), а також рівень свідомості за шкалою AVPU:
- A – Alert (у свідомості, відповідає 15 балам за шкалою ком Глазго);
- V – Voice (реакція на голос);
- P – Pain (реакція на біль);
- U – Unresponsive (немає реакції).
Контрольними точками дослідження були 1, 2, 3‑4, 7, 10 і 14-й дні після початку лікування.
Результати дослідження та обговорення
Як видно з представлених на рисунку 1 даних, між двома групами дослідження не було виявлено різниці щодо балів за шкалою NEWS‑2 на першу добу після початку терапії (р=0,71524). Однак вже на сьому добу в пацієнтів, які використовували едаравон (Ксаврон®), даний показник був на 42,8% нижчим порівняно з контрольною групою (р=0,00137). До кінця періоду спостереження (на 14-ту добу перебування у стаціонарі) параметри оцінки тяжкості стану хворих, які отримували лікування, були на 23,8% меншими відносно контрольної групи (р=0,00241), що було серйозним прогностичним показником застосовуваної терапії.
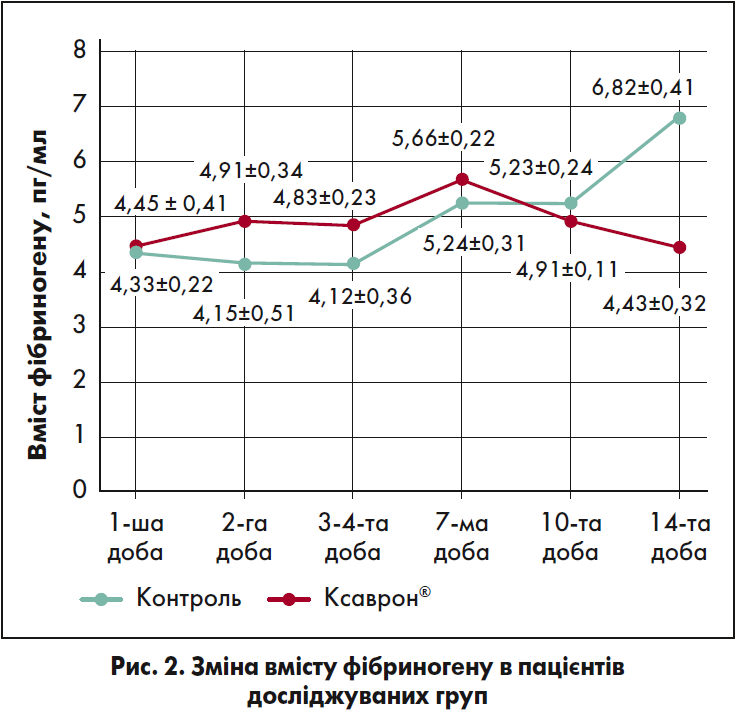
Як було доведено у численних випробуваннях, однією з центральних ланок патогенетичного пошкодження при коронавірусній інфекції є порушення системи коагуляції. У даному дослідженні в контрольній групі рівень фібриногену почав підвищуватися з 10-ї доби, і до 14-го дня різниця з аналогічними значеннями у пацієнтів групи лікування становила в середньому 34,9% (р=0,002147) (рис. 2).
Основним медіатором при розвитку неконтрольованої системної запальної реакції у пацієнтів із SARS-CoV‑2 є рівень ІЛ‑6. Саме тому в процесі дослідження було виконано кількісну оцінку даного показника. На момент госпіталізації до стаціонара в обох групах визначалося підвищення рівня ІЛ‑6 у середньому на 96,3±12,4% від референсних значень (N=0‑4,1 пг/мл). У міру розвитку клінічної симптоматики спостерігалося значне зростання вмісту ІЛ‑6 у контрольній групі та помірне підвищення середніх значень при розподілу до групи терапії едаравоном (Ксаврон®). Рівень ІЛ‑6 мав тенденцію до зниження у групі лікування вже із третьої доби (р<0,05). До 10-ї доби різниця між показниками в обох групах становила в середньому 28,75±2,43%, а до 14-ї – 45,42±4,28%. Причому слід зазначити, що у контрольній групі навіть до 14-ї доби рівень ІЛ‑6 залишався стабільно високим (рис. 3).
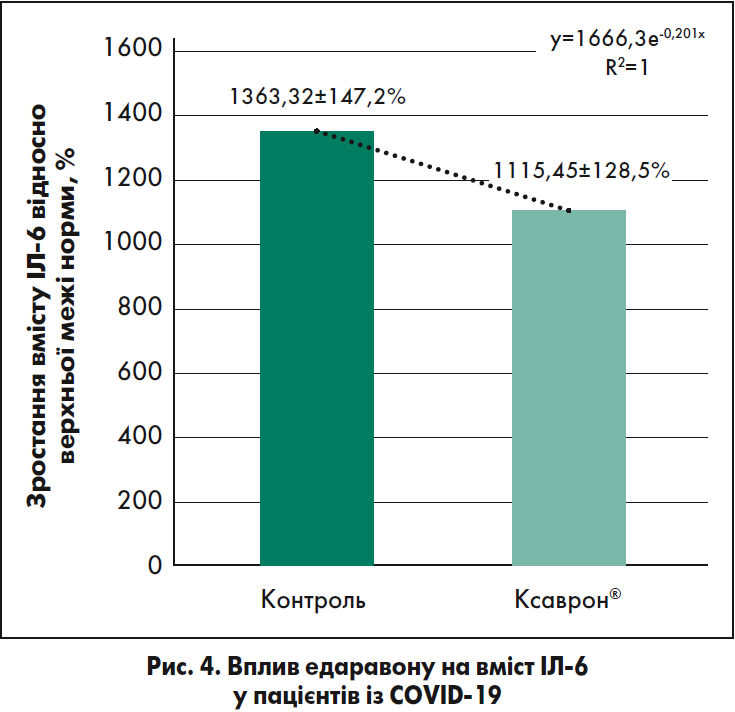
Середні показники ІЛ‑6 у контрольній групі становили 55,896±23,44 пг/мл (від 5,11 до 165,9 пг/мл), що відповідало підвищенню рівня в середньому на 1363,32±147,2% відносно верхніх меж референсних значень (рис. 4). Середні значення ІЛ‑6 у групі терапії едаравоном (Ксаврон®) становили 45,7335±16,21 пг/мл (від 1,77 до 288,4 пг/мл), що відповідало підвищенню рівня в середньому на 1115, 45±128,5% стосовно верхньої межі референсних значень. Це було на 18,2±3,1% менше щодо аналогічних показників, зафіксованих у контрольній групі (див. рис. 4).
При цьому слід зазначити, що у групі терапії едаравоном (Ксаврон®) підвищення рівня ІЛ‑6 в середньому до 68,69±27,3 пг/мл (максимум до 288,4 пг/мл) відзначалося лише у трьох пацієнтів (37,5% випадків). У решті 62,5% випадків зафіксоване помірне зростання вмісту ІЛ‑6, тоді як у контрольній групі підвищення показників ІЛ‑6 (максимум до 165,9 пг/мл) спостерігалося у всіх обстежених хворих (100% випадків). В інших пацієнтів групи лікування збільшення рівня ІЛ‑6 становило в середньому 75,78±12,5% (середнє, максимальне й мінімальне значення – 3,11; 6,72 та 1,77 пг/мл).
Смертність у пацієнтів контрольної групи зареєстровано на рівні 12,5% (1 пацієнт), у групі едаравону (Ксаврон®) летальних випадків не було.
Висновки
Проведений аналіз джерел літератури показав, що вірус SARS-CoV‑2 має тропізм до клітин ЦНС і може викликати розвиток неврологічної симптоматики в інфікованих пацієнтів. У цьому контексті введення до схеми інтенсивної терапії едаравону (препарату Ксаврон® виробництва компанії «Юрія-Фарм») може бути доцільним з огляду на його здатність зменшувати прояви не тільки оксидативного стресу, але й явищ «цитокінового шторму», а саме значущого зменшення вмісту ІЛ‑6. Таким чином, у цих хворих вдається купірувати як неврологічні симптоми, так і рівень системно-запальної відповіді.
Література
- https://www.who.int.
- https://www.worldometers.info/coronavirus.
- Comparative tropism, replication kinetics, and cell damage profiling of SARS-CoV‑2 and SARS-CoV with implications for clinical manifestations, transmissibility, and laboratory studies of COVID‑19: an observational study / H. Chu, J.F. Chan, T.T. Yuen et al. // Lancet Microbe. – 2020. – Vol. 1 (1). – Р. 14‑23.
- Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China / C. Huang, Y. Wang, X. Li et al. // Lancet. – 2020. – Vol. 395 (Issue 10223). – Р. 497‐506.
- Clinical characteristics of 138 hospitalized patients with 2019 novel coronavirus‐infected pneumonia in Wuhan, China / D. Wang, B. Hu, C. Hu et al. // JAMA. – 2020. – Vol. 323 (11). – Р. 1061‑1069.
- Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study / N. Chen, M. Zhou, X. Dong et al. // Lancet. – 2020. – Vol. 395 (10223). – Р. 507‐513.
- Neurological Manifestations of Hospitalized Patients with COVID‑19 in Wuhan, China: a retrospective case series study / Ling Mao, Mengdie Wang, Shanghai Chen, Quanwei He // JAMA Neurol. – 2020. – Vol. 77 (6). – Р. 683‑690.
- 8. Alterations in Smell or Taste in Mildly Symptomatic Outpatients with SARS-CoV‑2 Infection / G. Spinato, C. Fabbris, J. Polesel et al. // JAMA. – 2020. – Vol. 323 (20). – Р. 2089‑2090.
- The 2019 novel coronavirus disease (COVID‑19) pandemic: A review of the current evidence / P. Chatterjee, N. Nagi, A. Agarwal et al. // Indian J Med Res. – 2020. – Vol. 151 (2 & 3). – Р. 147‑159.
- Foley J.E. A review of coronavirus infection in the central nervous system of cats and mice / J.E. Foley, C. Leutenegger // J Vet Intern Med. – 2001. – 15 (5). – Р. 438‑444.
- Effectiveness of olfactory training on different severities of posttraumatic loss of smell / R. Pellegrino, P. Han, N. Reither et al. // Laryngoscope. – 2019. – Vol. 129 (8). – Р. 1737‑1743.
- Human respiratory coronavirus OC43: genetic stability and neuroinvasion / J.R. St-Jean, H. Jacomy, M. Desforges et al. // J Virol. – 2004. – Vol. 78(16). – Р. 8824‑8834.
- Organ distribution of severe acute respiratory syndrome (SARS) associated coronavirus (SARS-CoV) in SARS patients: implications for pathogenesis and virus transmission pathways / Y. Ding, L. He, Q. Zhang et al. // J Pathol. – 2004. – Vol. 203 (2). – Р. 622‑630.
- Multiple organ infection and the pathogenesis of SARS / J. Gu, E. Gong, B. Zhang et al. // J Exp Med. – 2005. – Vol. 202 (3). – Р. 415‑424.
- Detection of severe acute respiratory syndrome coronavirus in the brain: potential role of the chemokine mig in pathogenesis / J. Xu, S. Zhong, J. Liu et al. // Clin Infect Dis. – 2005. – Vol. 41 (8). – Р. 1089‑1096.
- Severe acute respiratory syndrome coronavirus infection causes neuronal death in the absence of encephalitis in mice transgenic for human ACE2 / J. Netland, D.K. Meyerholz, S. Moore et al. // J Virol. – 2008. – Vol. 82 (15). – Р. 7264‑7275.
- Middle East respiratory syndrome coronavirus causes multiple organ damage and lethal disease in mice transgenic for human dipeptidyl peptidase 4 / K. Li, C. Wohlford‐Lenane, S. Perlman et al. // J Infect Dis. – 2016. – Vol. 213 (5) – Р. 712‑722.
- Differences and similarities between Severe Acute Respiratory Syndrome (SARS)- CoronaVirus (CoV) and SARS-CoV‑2. Would a rose by another name smell as sweet? / M. Ceccarelli, M. Berretta, E. Venanzi Rullo et al. // Eur Rev Med Pharmacol Sci. – 2020. – Vol. 24 (5). – Р. 2781‑2783.
- The neuroinvasive potential of SARS-CoV2 may play a role in the respiratory failure of COVID‑19 patients / Y.C. Li, W.Z. Bai, T. Hashikawa // Journal of Medical Virology. – 2020. – Vol. 92 (6). – Р. 552‑555.
- A first case of meningitis/encephalitis associated with SARS-Coronavirus‑2 / T. Moriguchi, N. Harii, J. Goto et al. // Int J Infect Dis. – 2020. – Vol. 94. – Р. 55‑58.
- COVID‑19: ICU delirium management during SARS-CoV‑2 pandemic / K. Kotfis, S. Williams Roberson, J.E. Wilson et al. // Crit Care. – 2020. – Vol. 24 (1). – Р. 176.
- Comparison of delirium assessment tools in a mixed intensive care unit / M.M. van Eijk, R.J. van Marum, I.A. Klijn et al. // Crit Care Med. – 2009. – Vol. 37(6) –Р. 1881‑1885.
- Occurrence of delirium is severely underestimated in the ICU during daily care / P.E. Spronk, B. Riekerk, J. Hofhuis et al. // Intens Care Med. – 2009. – Vol. 35 (7). – Р. 1276‑1280.
- Screening, detection and management of delirium in the emergency department–a pilot study on the feasibility of a new algorithm for use in older emergency department patients: the modified Confusion Assessment Method for the Emergency Department (mCAM-ED) / F.F. Grossmann, W. Hasemann, A. Graber et al. // Scand J Trauma Resusc Emerg Med. – 2014. – Vol. 22. – Р. 19.
- Neutrophils promote mononuclear cell infiltration during viral-induced encephalitis / J. Zhou, S.A. Stohlman., D.R. Hinton et al. // Immunol. – 2003. – Vol. 170 (6). – Р. 3331‑3336.
- Maturation and localization of macrophages and microglia during infection with a neurotropic murine coronavirus / S.P. Templeton, T.S. Kim, K. O’Malley et al. // Brain pathology. – 2008. – Vol. 18 (1). – Р. 40‑51.
- Multiple organ infection and the pathogenesis of SARS / J. Gu, E. Gong, B. Zhang et al. // J Exp Med. – 2005. – Vol. 202 (3). – Р. 415-424.
- Mitochondrion-Permeable Antioxidants to Treat ROS-Burst-Mediated Acute Diseases / Zhong-Wei Zhang, Xiao-Chao Xu, Ting Liu et al. // Oxidative Medicine and Cellular Longevity. – Vol. 2016, Published online 2015.
- The clinical practice guideline for the management of ARDS in Japan / S. Hashimoto, M. Sanui, M. Egi et al. // J Intensive Care. – 2017. – Vol. 5. – Р. 50.
- Effects of edaravone, a free radical scavenger, on photochemically induced cerebral infarction in a rat hemiplegic model / S. Ikeda, K. Harada, A. Ohwatashi et al. // Scientific World Journal. – 2013. – Published online 2013 Jun 17.
- Inhibitory Effects of Edaravone, a Free Radical Scavenger, on Cytokine-induced Hyperpermeability of Human Pulmonary Microvascular Endothelial Cells: A Comparison with Dexamethasone and Nitric Oxide Synthase Inhibitor / Y. Saito, Y. Fujii, M. Yashiro et al. // Acta Med Okayama. – 2015. – Vol. 69 (5). – Р. 279‑90.
- https://moz.gov.ua/uploads/5/26129-dn_2106_17_09_2020_dod_1.pdf.
- https://moz.gov.ua/article/ministry-mandates/nakaz-moz-ukraini-vid‑17092020‑2116pro-vnesennja-zmin-do-protokolu – nadannja-medichnoi-dopomogi-dlja-likuvannja – koronavirusnoi-hvorobi-covid‑19.
- https://www.rcplondon.ac.uk/projects/outputs/national-early-warning-score-news‑2.