19 липня, 2024
Дисомнії, посттравматичний стресовий розлад і метаболічний синдром
 Важливість забезпечення фізіологічного сну зумовлюється необхідністю збереження та підтримання когнітивних функцій мозку, усунення порушень на клітинному і тканинному рівнях; синаптичної пластичності через процес, відомий як pruning, а також детоксикації вільних радикалів. Отже, порушення сну, раптове пробудження від нічних жахіть, скорочення тривалості повноцінного фізіологічного сну внаслідок інсомнії може спричиняти розвиток низки патофізіологічних процесів. Дисбаланс процесів сну є значущим фактором ризику метаболічного синдрому (МС), цукрового діабету (ЦД) 2 типу зі ступенем впливу, схожим на традиційні чинники. Зокрема, труднощі із засинанням збільшують ризик ЦД 2 типу на 55%, а з порушеннями фаз сну – на 74% (Maguire D. G. et al., 2020).
Важливість забезпечення фізіологічного сну зумовлюється необхідністю збереження та підтримання когнітивних функцій мозку, усунення порушень на клітинному і тканинному рівнях; синаптичної пластичності через процес, відомий як pruning, а також детоксикації вільних радикалів. Отже, порушення сну, раптове пробудження від нічних жахіть, скорочення тривалості повноцінного фізіологічного сну внаслідок інсомнії може спричиняти розвиток низки патофізіологічних процесів. Дисбаланс процесів сну є значущим фактором ризику метаболічного синдрому (МС), цукрового діабету (ЦД) 2 типу зі ступенем впливу, схожим на традиційні чинники. Зокрема, труднощі із засинанням збільшують ризик ЦД 2 типу на 55%, а з порушеннями фаз сну – на 74% (Maguire D. G. et al., 2020).
Порушення метаболічного здоров’я та психологічного функціонування знижують якість життя і сприяють розвитку коморбідних станів. Згідно з результатами проспективних досліджень, поширеність поліморбідності становить до 69% у молодих людей, ≈93% – у людей середнього віку, до 98% – у хворих літнього віку. Провідним класом за кількістю комбінацій є хвороби системи кровообігу, на другому місці – патологія ендокринної системи, зокрема МС, ЦД 2 типу та посттравматичний стресовий розлад (ПТСР) становлять значну частку в структурі поліморбідності (GBD 2019 Diseases and Injuries Collaborators, 2019).
ПТСР – це тяжкий психічний розлад, причиною якого зазвичай є травматичні чинники. ПТСР зумовлює хронічні психологічні страждання і часто спричиняє хронічний перебіг, а також інвалідизацію. За класифікацією Діагностичного та статистичного посібника щодо психічних розладів (Diagnostic and Statistical Manual of Mental Disorders, fifth edition, DSM‑5), ПТСР характеризується чотирма кластерами психіатричних симптомів: нав’язуванням (критерій В), уникненням (критерій С), негативними змінами в пізнанні та настрої (критерій D), змінами в збудженні й реактивності (критерій E). Біологічна гетерогенність і мозаїчність симптомів ПТСР свідчать про необхідність опрацювання чутливих біомаркерів, здатних відображати декілька біологічних змінних (Dell’Oste V. et al., 2023).
Поширеність ПТСР протягом життя становить ≈2-8%, але відрізняється за географічним розташуванням і рівнем травматичного впливу, що спостерігається в окремих популяціях. Зокрема, військовослужбовці та працівники екстрених служб зазнають значнішої травматизації, ніж загальне населення, що відображається в показниках поширеності ПТСР у 13,4 і 22%. Отже, ПТСР зумовлює суттєві витрати охорони здоров’я та є значним тягарем для суспільства (Doan S. N. et al., 2023).
МС – поєднання ожиріння / вісцерального ожиріння, інсулінорезистентності (ІР), дисліпопротеїнемії та артеріальної гіпертензії (АГ); це підвищений ризик розвитку ЦД 2 типу й атеросклеротичних серцево-судинних захворювань (АССЗ). Ожиріння часто супроводжується приєднанням гіперінсулінемії, ІР, крім того, спостерігаються зміни у використанні палива між вуглеводами, ліпідами та білками, внаслідок чого порушується стимульоване інсуліном поглинання глюкози м’язами й жировою тканиною. Гіперінсулінемія, ІР сприяють формуванню прозапального середовища в жировій тканині з ектопічним накопиченням жиру й аберантним використанням енергії. Ожиріння (особливо вісцеральне) внаслідок гіперпродукції макрофагами, адипоцитами, преадипоцитами прозапальних цитокінів (С‑реактивного білка – СРБ, інтерлейкіну (ІЛ)-6 та фактора некрозу пухлини – ФНП), адипокінів, як-от лептин, також сприяє розвитку хронічного запалення низької інтенсивності (ХЗНІ). Ці ендокринні ефекти жирової тканини вважаються причиною системної активації ХЗНІ та зумовлюють посилення ІР, розвиток МС (Ziegler D. et al., 2022).
Ожиріння, прозапальна сигнальна трансдукція, ІР, МС здатні утворювати хибне коло порушеного метаболізму зі шкідливими наслідками для здоров’я. ПТСР / симптоми посттравматичного стресу (ПТС) також супроводжуються низкою медичних і психіатричних станів, включаючи метаболічні або АССЗ, когнітивні порушення, розлади настрою, зловживання психоактивними речовинами та порушення сну (Michopoulos V. et al., 2021).
Дисомнія – одна з характерних клінічних особливостей ПТСР. На сьогодні вважається, що посттравматичні порушення циркадного ритму сну – це ядро, а не вторинна особливість ПТСР, яке опосередковує нейробіологічні кореляти розладів унаслідок дисбалансу гомеостазу (Richards A. et al., 2020). ПТСР характеризується значною кількістю симптомів і коморбідної патології, також пов’язаних із недосипанням та циркадними розладами. Це свідчить, що дисомнії здатні бути потенційним загальним нейробіологічним містком між ПТСР і низкою захворювань. Відомо, що циркадний ритм – це біологічний внутрішній годинник, який контролює низку фізіологічних активностей, включаючи метаболізм глюкози. Циркадні цикли можуть порушуватися через нерегулярний графік сну або позмінну роботу тощо, а це здатне спричинити дисбаланс метаболізму глюкози, ІР, підвищений ризик розвитку ЦД 2 типу. Вплив сну на чутливість до інсуліну є одним з основних факторів, що пов’язують його з ожирінням, порушенням толерантності до глюкози (ПТГ), МС і ЦД 2 типу. Зокрема, зниження чутливості до інсуліну може бути наслідком недосипання, особливо хронічного (Darraj A., 2023). Згідно з дослідженням Y. Hashimoto та співавт. (2020), циркадний цикл знижує динамічну та статичну функцію β-клітин. І навпаки, циркадні розбіжності впливають на толерантність до глюкози, що насамперед спричинено зниженням чутливості до інсуліну. Недосипання сприяє також збільшенню продукції кортизолу, що може зумовити ІР, підвищити рівень глюкози в крові.
ПТСР і МС
ПТСР і МС часто є коморбідними захворюваннями та мають спільні нейробіологічні й клінічні ознаки. За результатами метааналізів повідомляють про більшу поширеність МС у пацієнтів із ПТСР порівняно із загальною популяцією. Водночас ПТСР також є відомим чинником ризику МС. Цей збіг можна частково пояснити залученням спільних патогенетичних механізмів, характерних для обох станів (Bartoli F. et al., 2020). До них належать генетичні фактори, ХЗНІ, оксидантний стрес, дисфункція гіпоталамо-гіпофізарно-адреналової вісі (ГГАВ), порушення імунної регуляції (Rosenbaum S. et al., 2021). Отже, до клінічного погіршення ПТСР і розвитку несприятливих серцево-судинних подій, пов’язаних із МС, причетні схожі механізми. Однак вважається, що зовнішні фактори, як-от вплив навколишнього середовища, можуть модулювати вплив біологічних чинників на ступінь вираженості ПТСР і MС, отже, сприяють гетерогенній клінічній картині (Luckhoff H. K. et al., 2023).
Повідомляється, що незалежно від діагнозу психічні розлади (приблизно вдвічі більше, ніж у загальній популяції) корелюють з ризиком ожиріння, МС, ЦД 2 типу, АССЗ. Це пов’язано з низкою модифікованих факторів ризику, включаючи низький рівень фізичної активності та малорухомий спосіб життя. Зокрема, результати перехресного дослідження в пацієнтів із ПТСР, які знаходилися на стаціонарному лікуванні в травматологічному відділенні, продемонстрували значущі зв’язки між тривалістю щоденного перебування в сидячому положенні (коефіцієнт рангової кореляції Спірмена r=0,42; p<0,001) і якістю сну (коефіцієнт рангової кореляції Спірмена r=0,40; p<0,001) із симптомами ПТСР. Обстежені хворі з ПТСР мали досить високі показники ожиріння, низьку фізичну активність, незадовільну кардіореспіраторну підготовку та низьку якість сну. Отже, виявлено позитивний зв’язок між малорухливою поведінкою та вираженістю симптомів ПТСР (Chen A. et al., 2020).
ПТСР тісно пов’язаний з надмірною масою тіла, ожирінням, МС, ЦД 2 типу у взаємозалежний двоспрямований спосіб. Зокрема, ожиріння зумовлює збільшення ймовірності виникнення афективних і тривожних розладів на 25%. Депресія, оцінена за шкалою опитувальника великої депресії (Major Depression Inventory), тобто тесту самооцінки для виявлення і визначення тяжкості депресії, корелює з підвищеним ризиком розвитку ЦД 2 типу, що спостерігається також у популяційних дослідженнях (American Psychiatric Association, 2023). Характерно, що депресивні розлади виявляються навіть на стадії ПТГ, причому серед осіб із депресією демонструється збільшення проспективного ризику розвитку ЦД 2 типу на 37-60%. Зв’язок між депресивними розладами й ІР спостерігається навіть в осіб незалежно від змін показників індексу маси тіла (ІМТ). Зокрема, результати метааналізу свідчать про невеликий (однак значущий) зв’язок між депресією та ІР. Метааналізи, які демонструють кореляцію між симптомами депресивних розладів або загальним дистресом і ЦД 2 типу, виявляються значущими з використанням як діагностичних (наприклад, клінічні записи), так і недіагностичних (шкала депресії центру епідеміологічних досліджень, опитувальник «Стабільність психічного здоров’я») методів вимірювання. Отже, навіть загальний негативний афект (а не діагностована депресія) пов’язаний з метаболічним здоров’ям. Вищий рівень негативного афекту або емоційного дистресу (наприклад, тривоги, депресії, стресу) та нижчий рівень позитивного афекту чи приємних почуттів або емоцій, оцінений за допомогою шкали позитивного й негативного афектів, асоціюється з підвищеним ІМТ. Окрім того, депресивні розлади частіше передують ожирінню, ніж навпаки (Doan S. N. et al., 2023). Медикаментозне лікування афективних розладів також може спричинити збільшення ІМТ, що потенційно здатне посилити ІР і невблаганний цикл афективної та метаболічної дисфункції (Puzhko S. et al., 2020).
Тривала депресія та негативні емоції пов’язані з активацією ГГАВ, симпатоадреналової системи, прозапальних цитокінів. Порушення регуляції у цих системах може індукувати ІР і сприяти підвищенню ризику розвитку ЦД 2 типу. Зокрема, дієта з високим умістом жирів шляхом порушення сигнальних ланцюгів і нейромедіаторних систем у префронтальній корі, пов’язаній з мотивацією, депресією, тривогою, здатна провокувати ІР, а також розвиток ЦД 2 типу. ІР також корелює із втратою мотивації та підвищеним апетитом, що, як вважають, опосередковано відмінностями в передній поясній корі, котра сприяє як депресії, так і ІР (Serhiyenko V. et al., 2023). Повідомляється, що кортизол (кінцевий продукт ГГАВ – однієї з основних систем реагування на стрес) прямо корелює зі збільшенням показників ІМТ і посиленою продукцією прозапальних гормонів та цитокінів (адипокінів) (Luckhoff H. K. et al., 2023). Відомо, що прозапальні цитокіни, зокрема ІЛ‑6 та СРБ, пов’язані як з ІР, так і з ЦД 2 типу. Зміни стану прозапальної сигналізації можуть бути підґрунтям депресії при ожирінні та дисфункціональному метаболізмі. ХЗНІ, що виникає унаслідок збільшення жирової маси та метаболічної дисфункції, ймовірно, пов’язано з депресивними розладами. Зокрема, продемонстровано, що ожиріння зумовлює підвищені шанси розвитку депресивних розладів, тяжкості депресії, погіршення фізіологічного перебігу сну незалежно від генетичної схильності до метаболічної дисфункції (генетичні варіанти ожиріння зі сприятливими чи несприятливими метаболічними профілями холестерину ліпопротеїнів високої щільності (ХС ЛПВЩ), тригліцеридів (ТГ) і ризику ЦД 2 типу) (Casanova F. et al., 2021).
Коморбідність ПТСР із МС, ПТГ і ЦД 2 типу може бути наслідком впливу низки факторів, як-от порушення апетиту, зниження фізичної активності, куріння, вживання алкоголю, нездорове харчування, а також соціально-демографічні чинники ризику тощо. Інший постульований механізм полягає у тому, що ПТСР, МС, ПТГ, ЦД 2 типу тісно пов’язані між собою, крім вищезазначеного, через спільні запальні процеси. Зокрема, продемонстровано, що підвищений рівень ІЛ‑6 та ФНП передує ІР, що може бути пов’язано зі стресовими подіями в анамнезі. Дослідження геномних асоціацій виявило, що поширені генетичні варіанти ІМТ і СРБ перетинаються з варіантами генів, пов’язаними з депресією (Milaneschi Y. et al., 2019). Під час проведення поздовжнього когортного дослідження виявлено, що підвищений рівень ІЛ‑6 у дитинстві пов’язаний з майбутніми депресивними симптомами та діагнозом депресії у віці 18 років. Великий метааналіз доповнив ці дані, в якому цитокіни, включаючи IЛ‑6, були відзначені як частина потенційного профілю хемокінів / цитокінів, пов’язаних із депресією. Висновок про те, що ХЗНІ передує МС, ПТГ, ЦД 2 типу і ПТСР, може свідчити про спільний біологічний шлях, який розпочинається із системної запальної реакції (Perry B. I. et al., 2020).
Хронодеструкція, тривога, депресія, а також розлади харчування – складові патоґенезу ІР, МС і ЦД 2 типу. Дефіцит сну в поєднанні зі зміною циркадних ритмів взаємопов’язаний зі зниженням швидкості обміну речовин у спокої та збільшенням умісту постпрандіальної глюкози. Крім того, порушення якості сну негативно впливає на циркадний ритм метаболічних модифікаторів. Зокрема, рівень лептину знижується, а експресія греліну збільшується, що, своєю чергою, сприяє відчуттю голоду, незважаючи на меншу потребу в енергії для відпочинку. Важливо зауважити, що тяжкість порушення циркадного ритму сну (наприклад, соціальний джетлаг) пов’язана з ожирінням і МС, а лептинорезистентність відіграє важливу роль у розвитку цих станів (Hashimoto Y. et al., 2020). У результаті десинхронізації біологічних ритмів зменшується секреція мелатоніну, який бере участь у патоґенезі ожиріння і ЦД 2 типу. Не менш важливо, що вживання антидепресантів часто пов’язано зі збільшенням ІМТ і ризиком ЦД 2 типу (Darraj A. et al., 2023).
Синдром обструктивного апное (СОА) уві сні може супроводжуватися ПТГ. Американська академія медицини сну (The American Academy of Sleep Medicine) визначає СОА уві сні як повторювані епізоди повної або часткової обструкції верхніх дихальних шляхів під час сну. Ці повні або часткові обструкції спричиняють нетривалі пробудження та зниження насичення крові киснем. Порушення дихання супроводжується частими пробудженнями, що може зумовити втрату сну та схильність до метаболічних порушень. Декомпенсація СОА уві сні також пов’язана з низкою негативних наслідків, зокрема синдромом хронічної втоми, зниженням якості життя, АГ, ЦД, хронічним коронарним синдромом, інсультом, фібриляцією передсердь, застійною серцевою недостатністю та підвищеним ризиком смерті (Alamer W. M. et al., 2020).
Повідомляється, що ожиріння з ІМТ >30 кг/м2 (39,1%), АГ (33,9%), ЦД (20,8%), депресія (4,3%), бронхіальна астма (17,3%), хронічні обструктивні захворювання легень (6,6%) і дисліпопротеїнемії (2,7%) – це стани, які найчастіше пов’язані зі сном <7 год/добу. Інше дослідження показало, що частота виникнення незадовільної якості сну становить 55,4% (95% довірчий інтервал (ДІ) 49,7-60,8), яка корелює з такими соціально-демографічними чинниками, як вік, стать, куріння, ЦД 2 типу або інші супутні захворювання, а також наявність психіатричних симптомів (Khandelwal D. et al., 2020).
Етіологічні чинники захворювань, які виникають унаслідок хронодеструкції, включають також збільшення синтезу сироваткового амілоїду А. Зокрема, обмеження протягом 15 днів або позбавлення сну тварин протягом 72 год супроводжується збільшенням умісту сироваткового амілоїду А, а також метаболічною ендотоксемією. Ці результати свідчать про те, що підвищений рівень сироваткового амілоїду А, ймовірно, є компонентом патофізіологічних змін, що пов’язують інсомнію з низкою захворювань, зокрема МС, ЦД 2 типу (Darraj A. et al., 2023).
ПТСР і дисомнії
Дисомнії – характерна психіатрична ознака ПТСР / симптомів ПТС, здатних сприяти дезадаптивному стресу й емоційним реакціям, які вважаються модифікованими чинниками ризику в пацієнтів із ПТСР. У хворих із ПТСР за допомогою полісомнографії були виявлені дисомнії, однак результати інших випробувань свідчать про розбіжності між суб’єктивними та об’єктивними показниками сну (Zhang J. et al., 2020).
Інсомнія є одним із найчастіших порушень сну, що спостерігаються при ПТСР. Незважаючи на значну кількість доказів, що демонструють зв’язок між безсонням і ПТСР, спостерігається значна неоднорідність у величині кореляцій між цими станами (від 0,12 до 0,84). Існує схожа невідповідність у повідомленнях про частоту інсомнії у разі ПТСР (від 3 до 100%). Взаємозв’язок між безсонням і ПТСР / симптомами ПТС, а також частота симптомів інсомнії у пацієнтів із ПТСР / симптомами ПТС демонструють значну варіативність (Ahmadi R. et al., 2022).
Однак продемонстровано, що ПТСР асоціюється зі скороченням тривалості сну (на основі записів щоденника сну, але не актиграфії) та метаболічними ризиками, включаючи підвищення рівня ТГ (p=0,03), загального холестерину (ЗХС) (p<0,001), холестерину ліпопротеїнів низької щільності (p=0,006), холестерину ліпопротеїнів дуже низької щільності (p=0,002), а також співвідношення ЗХС / ХС ЛПВЩ (p=0,024). Крім того, тривалість сну пов’язувалася з метаболічними ризиками при ПТСР (значущість кореляцій варіювала від r= -0,20 до -0,40) (Talbot L. S. et al., 2019). Проведено ретроспективний аналіз досліджень частоти й особливостей кореляційних взаємозв’язків між інсомнією і ПТСР / симптомами ПТС. Виявлено, що поширеність інсомнії при ПТСР / симптомах ПТС становила 63% (ДІ 45-78%) і залежала від причини травми, а також корелювала з показниками шкали оцінки ПТСР / симптомів ПТС. Установлено кореляцію середнього рівня значущості (сукупний розмір ефекту: 0,52; ДІ 0,47-0,57) з помірним впливом пандемії COVID‑19 та військової служби як причин ПТСР (Ahmadi R. et al., 2022). Результати випробування щодо дослідження особливостей зв’язків між розладами сну, ПТСР, депресією у великій когорті (67 905 студентів, які пережили пандемію COVID‑19) продемонстрували, що дисомнії прогнозують розвиток і персистенцію ПТСР (Wang D. et al., 2022).
Добре відомо, що дисомнія (поведінка, яку можна модифікувати) тісно пов’язана з підвищеним ризиком виникнення проблем із психічним здоров’ям. Однак існує обмежена кількість лонгітюдних випробувань, які вивчали, якою мірою порушення сну прогнозує розвиток ПТСР і депресії. В одному з досліджень вивчали особливості інсомнії та значної сонливості впродовж дня в 102 жертв дорожньо-транспортних пригод і дійшли висновку, що дисомнія значною мірою прогнозує розвиток ПТСР через 12 міс після травми. Однак в іншому випробуванні, проведеному серед 453 нідерландських військовослужбовців, установлений зв’язок лише між нічними жахіттями перед початком воєнних операцій і підвищеним ризиком появи симптомів ПТСР через 6 міс після їхнього завершення. Однорічне проспективне дослідження серед 1573 підлітків, які пережили землетрус, показало, що дисомнії здатні прогнозувати розвиток і персистенцію ПТСР та депресії (Wang D. et al., 2022). Результати цих досліджень свідчать про непослідовний тимчасовий зв’язок між дисомніями та подальшим розвитком ПТСР і депресії, що можна пояснити відмінностями у вибірці, а також якості пережитих травматичних подій.
МС і дисомнії
Епідеміологічні дані свідчать про зв’язок між МС і тривалістю сну. Недостатня тривалість та низька якість сну пов’язані зі збільшенням частоти і прогресуванням МС, ЦД 2 типу, АССЗ, інсульту. Зокрема, результати метааналізу виявили значний перехресний зв’язок між занадто короткою тривалістю сну (<5 год) і МС. Проспективне когортне дослідження продемонструвало незалежний зв’язок між занадто короткою тривалістю сну та підвищеним ризиком МС протягом середнього 2,6-річного спостереження (Kyung Wook Kang et al., 2023). Відомо, що якість та тривалість сну змінюються з віком через зміни макро- і мікроархітектури сну, а вік обернено пропорційно пов’язаний з якістю сну. MС безпосередньо пов’язаний з віком, оскільки поширеність МС збільшується з віком (Huh J. H. et al., 2018). Однак результати епідеміологічних досліджень щодо впливу особливостей сну на розвиток МС досить суперечливі. Зокрема, проводилося дослідження щодо вивчення впливу віку на особливості сну та МС у 4660 осіб. Отримані дані показали значний зв’язок між низькою якістю сну (сума балів Пітсбурзького опитувальника індексу якості сну – The Pittsburgh Sleep Quality Index (PSQI) >5), меншою тривалістю сну (<6 год) і MС лише у віковій групі ≥40 років (після поправки на вік, статус куріння, вживання алкоголю, стать і фізичну активність). Незалежно від віку загальні показники PSQI, тривалість сну були значущо пов’язані з абдомінальним ожирінням (чоловіки ≥90 см, жінки ≥85 см в окружності талії) та ожирінням (ІМТ ≥30 кг/м2). Отже, повноцінний сон у дорослих віком ≥40 років може відігравати вирішальну роль у запобіганні розвитку МС (Huh J. H. et al., 2018). Висновки 11 перехресних і 3 когортних досліджень свідчать про таке: як занадто нетривалий, так і надто довгий сон є станами, які підвищують ризик МС. За результатами іншого метааналізу 10 перехресних і 2 когортних випробувань дійшли висновку, що занадто коротка тривалість сну (на відміну від занадто довгої) пов’язана з розвитком МС. Результати метааналізу 18 перехресних досліджень виявили залежність «доза – відповідь» між занадто короткою тривалістю сну та МС. Однак це не підтверджує гіпотези про те, що занадто тривалий сон пов’язаний із МС (Iftikhar I. H. et al., 2019). Отже, можна дійти висновку, що надто нетривалий сон асоціюється з підвищеним ризиком розвитку МС, але особливості зв’язків між тривалим сном і ризиком розвитку МС усе ще потребують проведення подальших досліджень.
Систематичний огляд і метааналіз 13 когортних випробувань у 300 202 пацієнтів продемонстрував, що занадто нетривалий і надто довгий сон значущо підвищують ризик МС на 15 (сумарний відносний ризик (ВР) 1,15; 95% ДІ 1,09-1,22; р<0,001) і 19% (ВР 1,19; 95% ДІ 1,05-1,35; р<0,001). Крім того, між тривалістю сну та ризиком МС виявлено U‑подібний зв’язок. Занадто нетривалий і надто довгий сон збільшували ризик ожиріння на 14 (ВР 1,14; 95% ДІ 1,07-1,22; p<0,001) і 15 (ВР 1,15; 95% ДІ 1,00-1,30; p=0,04), АГ – на 16 (ВР 1,16; 95% ДІ 1,02-1,31; p=0,03) і 13% (ВР 1,13; 95% ДІ 1,04-1,24; p=0,01) відповідно. Занадто нетривалий сон потенційно може підвищити ризик гіперглікемії у крові на 12% (ВР 1,12; 95% ДІ 1,00-1,15; р=0,05). Отже, отримані результати свідчать про таке: як занадто довга, так і надто коротка тривалість сну пов’язані з підвищеним ризиком розвитку МС (Che T. et al., 2021).
І. Iyegha та співавт. (2019) з метою вивчення зв’язку між дисомніями та метаболізмом глюкози, а також потенційних шляхів, що пов’язують порушення сну із ПТГ, провели перехресне дослідження, в якому взяли участь 155 жінок і чоловіків віком 19-70 років. Установлено, що особи із ПТГ більше страждали через дисомнію, ніж група обстежених із фізіологічним рівнем глюкози (62 і 46%). Параметри перорального глюкозотолерантного тесту корелювали з показниками суми балів PSQI, однак ці асоціації не зберігали статистичної значущості після поправки на стать, вік, ІМТ. Продемонстровано, що рівень СРБ був вищим у пацієнтів із ПТГ, крім того, спостерігалася позитивна кореляція між порушеннями сну та вмістом СРБ (коефіцієнт кореляції r=+0,30; p=0,04). За результатами регресійного аналізу встановлено, що дисомнії прогнозують зміни концентрації СРБ; ці особливості зберігалися навіть після поправки на відповідні коваріати (коефіцієнт регресії β=0,20; p=0,04). Отже, між ПТГ і порушеннями сну існує прямий взаємозв’язок. Імовірно, що підвищення рівня СРБ є потенційним механізмом, який лежить в основі зв’язку між ПТГ і дисомнією.
Процеси, котрі лежать в основі взаємовідносин між сном і MС, можуть відрізнятися для короткочасного (денного) та довготривалого сну. Декілька потенційних патофізіологічних механізмів здатні впливати на зв’язок між занадто короткою тривалістю сну та MС. Гормональні зміни можуть частково пояснити розвиток MС, спричиненого занадто нетривалим сном. Зокрема, надто нетривалий сон сприяє зменшенню вмісту лептину та збільшенню рівня греліну; стимуляції вироблення кортизолу вночі, що може зумовити ІР, розвиток МС, гіперглікемії, АГ (Mosavat M. et al., 2021). Підвищений рівень катехоламінів спричиняє посилення активності симпатичної нервової системи (СНС), дисфункцію ендотеліоцитів, порушення вазодилатації, АГ. Фрагментація сну та переривчаста гіпоксія можуть підвищувати збудливість СНС, що супроводжується метаболічними порушеннями. Занадто нетривалий сон знижує чутливість до інсуліну в адипоцитах і впливає на фосфорилювання серин/треонінкінази (Akt/протеїнкінази В), що здійснюється в інсуліновому сигнальному шляху (Catalano F. et al., 2022). Занадто велика тривалість сну пов’язана з декількома факторами ризику захворюваності на МС, як-от депресія, низька фізична активність. Крім того, сон сприяє забезпеченню імунологічного гомеостазу, впливаючи на різноманітні медіатори запалення, зокрема цитокіни. Тривала дисомнія здатна зумовити розвиток ХЗНІ, отже, приєднання ІР. Продемонстровано, що занадто коротка тривалість сну поєднується з підвищеним запальним навантаженням (рівнями СРБ, ІЛ‑6, ФНП та інтерфероном-γ) (Besedovsky L. et al., 2019).
ПТСР, МС і дисомнії
Циркадна система біологічного годинника людини створює і підтримує клітинну й системну ритмічність шляхом тимчасової організації та координації багатьох фізіологічних, а також транскрипційних процесів в організмі. Центральна циркадна система включає гангліозні клітини сітківки, ретино-гіпоталамічний тракт, супрахіазматичне ядро, верхні вузли шийного симпатичного стовбура, епіфіз (Wong S. D. et al., 2021). Головні ефектори центрального циркадного годинника – епіфіз і його нейрогормон мелатонін. Існують вагомі докази зв’язку між порушенням циркадного годинника та розвитком ожиріння, зокрема постулюється, що мелатонін відіграє певну роль в енергетичному метаболізмі, а також регулюванні маси тіла. Мелатонін і його препарати виявилися ефективними у відновленні циркадного ритму та корекції порушень, пов’язаних з ожирінням. Окрім того, встановлено причетність мелатоніну до хронічної інсомнії та дисомнії (Ahmad S. B. et al., 2023).
Послідовні реакції у ГГАB і вегетативній нервовій системі на повторні й хронічні стреси відіграють значну роль у виникненні, а також прогресуванні ПТСР. При ПТСР спостерігаються зниження активності ГГАB і парасимпатичної нервової системи, а також підвищена активність СНС. Це може зумовити зростання продукції прозапальних цитокінів. Підвищена активність імунної системи здатна спричинити порушення структури та функції деяких ділянок мозку шляхом змін рівня метаболітів серотоніну, безпосередніх нейротоксичних ефектів цитокінів, оксидантного стресу, зниження рівня специфічних нейротрофінів. Окрім того, прозапальні цитокіни, поява яких зумовлена стресом і впливом травматичних подій, також залучені до посилення регуляції індоламін‑2,3-діоксигенази 2, яка бере участь в обміні триптофану кінуреніновим шляхом. Активація індоламін‑2,3-діоксигенази 2 може спричинити зниження концентрації серотоніну та погіршення метаболізму триптофану, в т. ч. через шляхи, пов’язані з кінуреніном. Останні залучені до нейротрансмісії N‑метил-D‑аспартату та можливої нейротоксичності. Нейротрофічні фактори (НТФ), зокрема НТФ мозку, фактор росту нервів, ендотеліальний фактор росту судин, – ключові регулятори центральної нервової системи (ЦНС), необхідні для підтримки синаптичної пластичності. Відомо, що за допомогою синаптичної пластичності реалізується нейропластичність. У хворих із ПТСР, а також при депресії спостерігаються зміни рівнів НТФ, однак їхнє функціональне значення залишається остаточно невизначеним. Цікавим є питання про взаємозв’язок між НТФ і особливостями сну. Зокрема, НТФ мозку, який стимулює і підтримує розвиток нейронів, може належати центральна роль у гомеостазі сну, особливо психічної активності у фазі повільного сну. Отже, НТФ можуть слугувати шунтом між ПТСР, МС, ЦД 2 типу (Agorastos A. et al., 2020).
На рисунку наведено основні психологічні та нейрокогнітивні фактори, які двоспрямовано пов’язують порушення сну і розлади, суміжні з тривогою (Richards A. et al., 2020).
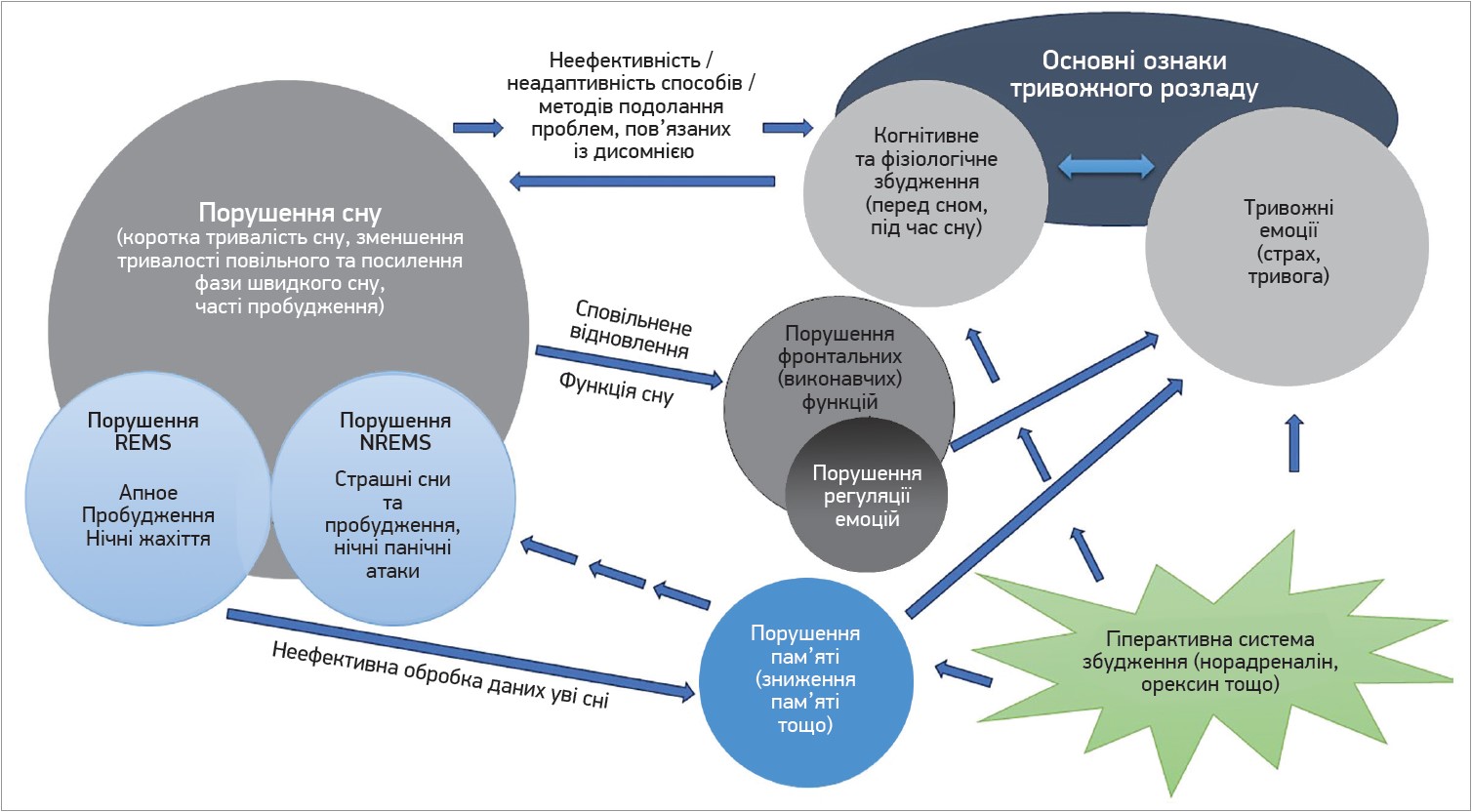
Рис. Психологічні та нейрокогнітивні фактори, які двоспрямовано пов’язують порушення сну і розлади, суміжні з тривогою (Richards A. et al., 2020)
Примітки: NREMS – сон без REM (non rapid eye movement sleep); REMS – фаза швидкого сну (rapid eye movement sleep).
Дисомнія (незалежно від причини) може сприяти неадекватній компенсаторній поведінці, пов’язаній зі сном, що супроводжується десинхронізацією з періодом бадьорості, отже, і з часом пробудження. Це зумовлює гіперактивність під час сну (когнітивну, емоційну), що сприяє розвитку хибного кола: дисомнія – неадекватна компенсаторна поведінка – гіперактивне когнітивне сприйняття – тривожні емоції. Дисомнія внаслідок недостатнього відновлення нейронних субстратів, які виконують ці функції під час неспання, шкідливо впливає на когнітивні функції, а це зумовлює поширений дефіцит, у т. ч. регуляції емоцій (зниження здатності модулювати тривожні емоції). Дисомнія порушує процеси, котрі, як вважається, відбуваються під час сну, зокрема функції адаптивної пам’яті (наприклад, утримання страху, навчання безпеці), що підтримує емоції тривоги / страху. Тривожні емоції та когнітивне збудження взаємно посилюють одне одного і повертаються в цикл дисомнії.
Відомо, що у фізіологічній структурі сну виокремлюють 2 фази: фаза швидкого сну (зі швидкими рухами очей, фаза парадоксального сну – rapid eye movement, REM) і сон без REM (non rapid eye movement, NREM). Сон зазвичай розпочинається із фази NREM (NREM‑сон, NREMS, синхронізований сон), за якою спостерігається REM‑фаза. Специфічна роль REMS і NREMS у відновленні та процесах, залежних від сну, є предметом інтенсивних досліджень. Характер механістичних зв’язків між подіями, асоційованими із тривогою (нічними жахіттями, панічними пробудженнями), а також процесами, що залежать від швидкого або повільного сну, належить продемонструвати за допомогою емпіричних доказів. З огляду на внесок дисомній у ці процеси генерації можна припустити, що вони сприяють когнітивному збудженню і тривожним емоціям.
На функціональний стан циклу «сон – неспання» також впливають норадреналін, ацетилхолін, серотонін – нейротрансмітери, котрі вивільняються нейронами ретикулярної активувальної системи. При підготовці до сну стан неспання змінюється на спокій. Періоду неспання відповідає активна робота норадреналін-, серотонін-, ацетилхолін- і гістамінергічних нейронів, однак за переходу в стан спокою і з настанням сну спостерігається їхнє пригнічення. Одним із найважливіших медіаторів головного мозку є γ-аміномасляна кислота (ГАМК) – головний гальмівний нейротрансмітер. Гальмування в ЦНС – активний процес, що потребує енергії, отже, за переходу зі стану неспання в сон ГАМК‑ергічні нейрони активуються. Орексин, нейропептид, який виробляється в гіпоталамусі, відіграє важливу роль у підтримці неспання. Вважається, що ефекти орексину змінюють активність нейромедіаторів, що беруть участь у регулюванні станів сон/інсомнія. Нейромодулювальне середовище, яке включає посилення сигналів збудження, зокрема за допомогою норадреналіну та/або орексинів, є рушійною силою і лежить в основі цього взаємозв’язку (Richards A. et al., 2020).
Дисфункція внутрішнього годинника та мелатонінергічної системи здатна сприяти змінам експресії генів, отже, численним фізичним і психічним розладам. Окрім впливу циклу «світло – темрява», додаткові зовнішні та внутрішні чинники також можуть спричинити поступові порушення або повний десинхроз циркадної системи. Зокрема, гострий / хронічний фізичний, психологічний, запальний, метаболічний стрес можуть впливати на стан циркадної системи. З іншого боку, хронічне порушення циркадних ритмів здатне поступово змінювати фундаментальні властивості систем мозку, що (як і хронічний стрес) регулюють нейроендокринну, імунну, вегетативну стрес-системи. Отже, хронодеструкція може підвищувати чутливість людей до стресу й уразливість до розладів, пов’язаних зі стресом (Agorastos A. et al., 2020). Продемонстровано, що в хворих із ПТСР спостерігається знижена фаза швидкого сну (повільних коливань, активність <1 Гц) і підвищена фаза повільного сну (активність 1-3 Гц). Множинні лінійні регресії показали, що рівень мелатоніну в ранковій сечі корелював із глибшим сном. Отримані результати підтверджують наявність дефіциту фази швидкого сну в пацієнтів із ПТСР, а також свідчать про те, що мелатонін може бути потенційним терапевтичним засобом для його усунення (Onton J. et al., 2021).
Отже, дисомнії та дисрегуляції циркадної системи належить причинно-патофізіологічна роль у розвитку ПТСР. Зокрема, повідомляється, що зміна рівня мелатоніну протягом перших 48 год після травматичної стресової події пов’язана з підвищеним ризиком розвитку ПТСР (Karanikas E. et al., 2021). У цьому контексті регулювання процесів сну та циркадних ритмів за допомогою екзогенного циркадного втручання (наприклад, використання мелатонінергічних лікарських засобів), імовірно, може відігравати центральну роль у профілактиці та лікуванні дисомній при коморбідних ПТСР, МС.
Висновки
Все більше доказів свідчать про зв’язок ПТСР із дисомніями, ІР і МС як взаємопов’язаної мережі, котра може стати непримиренною і двоспрямованою. Негативний вплив і стрес схиляють людей до емоційних реакцій, водночас погіршуючи здатність до самоконтролю, що зумовлює збільшення споживання їжі, а також щоразу більшу малорухливу поведінку. Така поведінка із часом може спричинити зниження функціонування в різних сферах життя, зберігаючи та, ймовірно, посилюючи депресію. МС, включаючи ІР, пов’язаний зі збільшенням афективних розладів, що свідчить про конвергентність ефектів. Зокрема, підвищений ІМТ знижує ефективність антидепресантів, а ПТСР прогнозує несприятливі результати в низці втручань для зниження показників ІМТ, а також незадовільну підтримку втрати маси тіла.
Дисомнії належать до цільових симптомів ПТСР, які в разі успішного лікування не лише мають потенціал для зниження симптоматики ПТСР і поліпшення якості життя, а й можуть знизити смертність у хворих із ПТРС, МС. Знання механізмів дисрегуляції циркадних ритмів та їхньої ролі в патоґенезі ПТСР і МС може розширити можливості психохронобіологічного лікування, а також профілактичних стратегій.
Ад’ювантна мелатонінергічна терапія потенційно здатна забезпечити перспективну стратегію лікування з корисними ефектами при лікуванні ПТСР і коморбідних захворювань, як-от МС. Ця теоретична концепція заслуговує на ретельне подальше дослідження за допомогою рандомізованих клінічних випробувань, які мають оцінити ефективність мелатонінергічного лікування в профілактиці та терапії коморбідних ПТСР і МС.
Медична газета «Здоров’я України 21 сторіччя» № 11-12 (572-573), 2024 р



 Сергієнко В.О.
Сергієнко В.О.
