30 жовтня, 2021
Таліглюцераза альфа: безпека й ефективність у 6 клінічних дослідженнях у дорослих і дітей із хворобою Гоше
Таліглюцераза альфа – засіб для ферментозамісної терапії (ФЗТ), схвалений для лікування дорослих і дітей із хворобою Гоше (ХГ) 1 типу. У цій роботі представлені результати 6 ключових клінічних досліджень, присвячених таліглюцеразі альфа. В основному дослідженні тривалістю 9 міс 33 дорослих пацієнти, які раніше не одержували лікування, були рандомізовані у групи таліглюцерази альфа у дозі 30 або 60 ОД/кг маси тіла. Після цього пацієнти, які відповідали критеріям включення, продовжили участь у двох послідовних розширених дослідженнях; 17 дорослих пацієнтів, які раніше не одержували лікування, завершили лікування таліглюцеразою альфа протягом загального періоду 5 років. У дослідженні ФЗТ, присвяченому винятково дітям з ХГ, 11 дітей, які раніше не одержували лікування, були рандомізовані у групи таліглюцерази альфа 30 або 60 ОД/кг у 12-місячному дослідженні; 9 дітей завершили лікування в спеціальному дитячому розширеному дослідженні протягом загального періоду 3 роки. Ефект переходу пацієнтів з лікування іміглюцеразою на лікування таліглюцеразою альфа також вивчали в окремому 9-місячному дослідженні, що включало 26 дорослих і 5 дітей. У розширених дослідженнях лікування таліглюцеразою альфа завершили 10 дорослих за 3 роки і 2 дитини за 2,75 року. У всіх дослідженнях оцінювали безпеку лікування, а також об’єм селезінки, печінки, рівень тромбоцитів, гемоглобіну і біомаркери як показники ефективності.
Хвороба Гоше – рідкісне порушення лізосомного накопичення, викликане аутосомно-рецесивними мутаціями в гені, що кодує β-глюкоцереброзидазу, – лізосомний фермент, необхідний для деградації глюкоцереброзиду [1]. Мутації спричиняють дефіцит активності β-глюкоцереброзидази, що призводить до накопичення в лізосомах макрофагів субстрату глюкоцереброзиду та появи клітин Гоше, зумовлюючи мультисистемні пошкодження в органах і тканинах, а також несприятливий вплив на селезінку, печінку, кістки, рівень тромбоцитів і гемоглобіну [1].
Виділяють три основних типи ХГ [2, 3]: 1 – найбільш поширений – ненейропатичний тип, який може проявитися в будь-якому віці; 2 – гострий і 3 – підгострий – є нейропатичними.
Протягом більш ніж двох десятиліть ФЗТ є основою лікування пацієнтів з ХГ 1 типу [2, 4], вона також високоефективна в усуненні вісцеральних і гематологічних проявів захворювання [4]. У США і багатьох країнах Європейського Союзу для ФЗТ при ХГ 1 типу затверджені три лікарські засоби: таліглюцераза альфа, велаглюцераза альфа та іміглюцераза. Всі три препарати є рекомбінантними активними формами β-глюкоцереброзидази і вводяться шляхом внутрішньовенної інфузії [5-8]. Таліглюцераза альфа була вперше схвалена Управлінням з контролю якості харчових продуктів і лікарських препаратів США (FDA) у 2012 р. як препарат для ФЗТ у дорослих пацієнтів з ХГ 1 типу [8]. Як у дорослих, так і у дітей із ХГ 1 типу таліглюцераза альфа була схвалена для застосування в багатьох країнах. Незважаючи на позитивну оцінку ризику/користі препарату, у 2012 р. Європейське агентство з лікарських засобів виступило проти надання дозволу на продаж таліглюцерази альфа, оскільки велаглюцераза альфа отримала ексклюзивне право на ринку препаратів для лікування орфанних захворювань у Європейському Союзі для лікування ХГ 1 типу [13].
Таліглюцераза альфа продукується в клітинній лінії моркви. Це перший рекомбінантний білок для лікування, що виробляється у клітинній експресійній системі рослин, який був схвалений FDA для використання у людини [14]. Нові та унікальні особливості процесу виробництва таліглюцерази альфа мають потенційні переваги щодо відсутності компонентів ссавців (наприклад, забезпечення природного захисту від інфекційних векторів ссавців), масштабованості та економічної вигоди, пов’язаної з одноразовими біореакторами, і відсутністю необхідності в додаткових кроках для забезпечення правильного глікозилювання з метою ефективного поглинання клітинами. Мета цього огляду – описати загальні результати клінічних досліджень таліглюцерази альфа III фази у дорослих і дітей із ХГ.
Огляд клінічних досліджень III фази таліглюцерази альфа
До клінічних досліджень III фази таліглюцерази альфа залучали дорослих віком від 18 років і дітей від 2 до 18 років (загалом 73 особи), які або раніше не одержували лікування (31 дорослий; 11 дітей), або перейшли з іміглюцерази на таліглюцеразу альфа (26 дорослих; 5 дітей). Хід цих досліджень коротко представлений на рисунку.
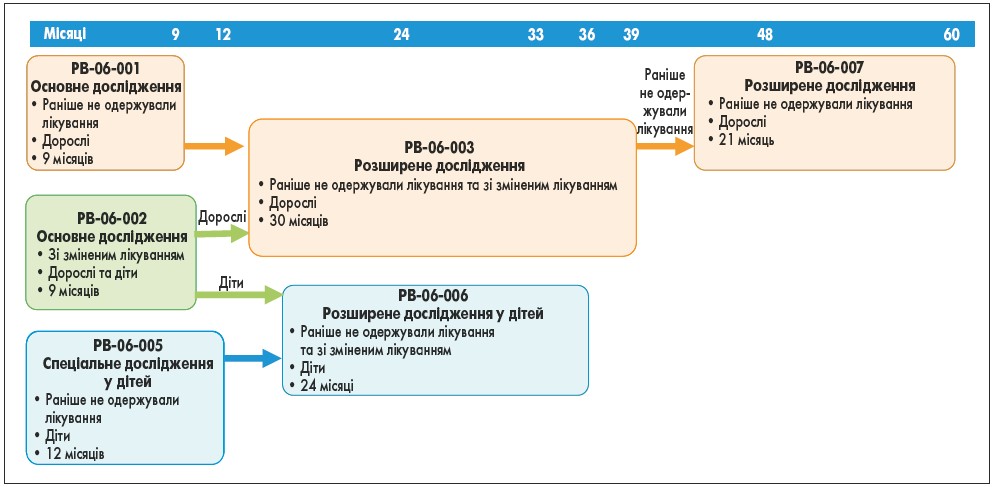 Рис. Клінічні дослідження III фази щодо лікування таліглюцеразою альфа
Рис. Клінічні дослідження III фази щодо лікування таліглюцеразою альфа
Первинні та вторинні кінцеві точки ефективності включали вісцеральні (об’єм печінки та селезінки), гематологічні (рівень гемоглобіну, тромбоцитів) і пов’язані з біомаркерами (активність хітотріозидази та/або рівень хемокінового ліганда CCL18) параметри. Кінцевими точками для оцінювання ефективності терапії у дорослих пацієнтів були зміни мінеральної щільності кісткової тканини за даними двоенергетичної рентгенівської абсорбціометрії та вимірювання жирової фракції кісткового мозку методом кількісної візуалізації хімічного зсуву (quantitative chemical shift imaging) [15, 21]. Кінцеві точки ефективності у дітей включали зміни росту, маси тіла, швидкості росту, статевого дозрівання та кісткового віку на основі рентгенограм лівої кисті і зап’ястя, а також виникнення кісткових подій (у тому числі кісткові кризи в рамках аналізу небажаних явищ – НЯ), якість життя з використанням 28 пунктів опитувальника здоров’я дітей (Child Health Questionnaire), опитувальника зі слів батьків для пацієнтів віком від 5 до 18 років і сексуальний розвиток, що оцінювали за шкалою Таннера [17, 20].
Ефективність
Дорослі пацієнти з ХГ зі зміненим лікуванням
Загалом наприкінці 9-місячного лікування в дослідженні PB-06-002 показники захворювання залишалися стабільними у пацієнтів, які раніше одержували іміглюцеразу і перейшли на таку саму дозу таліглюцерази альфа. Спостерігалося зменшення об’єму селезінки (7,6%), печінки (3,5%), зниження активності хітотріозидази (21,3%) та концентрації CCL18 (значення не повідомлялося) порівняно з початковими [16]. У дорослих пацієнтів зі зміненим лікуванням, які раніше брали участь у дослідженні PB-06-002, загалом спостерігали клінічну стабільність протягом 36 місяців у розширеному дослідженні PB-06-003, про що свідчать незмінені показники гемоглобіну, тромбоцитів та об’єму печінки, а також зменшення об’єму селезінки (19,8%), активності хітотріозидази (51,5%) та концентрації CCL18 (36,5%) порівняно з початковими у дослідженні PB-06-001 [19].
Діти з ХГ зі зміненим лікуванням
Наприкінці 9-місячного лікування у рамках дослідження PB-06-002 всі 5 дітей залишалися клінічно стабільними після переходу з іміглюцерази на таку саму дозу таліглюцерази альфа. Концентрація гемоглобіну і кількість тромбоцитів не змінювалися, спостерігалися зменшення об’єму селезінки (6,6%), печінки та активності хітотріозидази (29,7%) порівняно з початковими [16]. Діти зі зміненим лікуванням з дослідження PB-06-002, які продовжили лікування таліглюцеразою альфа в дослідженні PB-06-006, залишалися клінічно стабільними. Від початкового рівня до 33 місяців показники об’єму селезінки, печінки, концентрація гемоглобіну, кількість тромбоцитів, активність хітотріозидази і концентрація CCL18 залишалися стабільними або покращувалися [20]. У дітей, яким змінили лікування, показники росту і маси тіла збільшилися на 5,0 та 18,2% відповідно, а швидкість росту збільшилася на 2,5 см/рік [20]. Кістковий вік збільшився на 2,3 року. Якість життя у дітей зі зміненим лікуванням не оцінювали [20].
Безпека й імуногенність
Дорослі пацієнти, які раніше не одержували лікування, та дорослі пацієнти зі зміненим лікуванням
У дослідженні PB-06-001 (дорослі пацієнти, які раніше не одержували лікування) не спостерігалося жодних серйозних НЯ. Найбільш поширеними НЯ в розширеному дослідженні PB-06-003 (дорослі пацієнти, які раніше не одержували лікування) були артралгія, головний біль, інфекції верхніх дихальних шляхів, біль у кінцівках, назофарингіт і гіпертензія. Більшість (98,5%) НЯ і всі пов’язані з лікуванням НЯ були легкого або помірного ступеня тяжкості та минущими.
У розширеному дослідженні PB-06-007 (дорослі пацієнти, які раніше не одержували лікування) таліглюцераза альфа добре переносилася. Найбільш поширеними НЯ були назофарингіт і артралгія. Жодне з НЯ не було пов’язане з лікуванням та не призвело до виходу з дослідження; і 97,3% НЯ були легкого або помірного ступеня тяжкості.
У дослідженні PB-06-002 (дорослі пацієнти, котрим змінили лікування) найчастішими НЯ, про які повідомлялося, були реакція, пов’язана з інфузією, і назофарингіт. Жодне з тяжких або серйозних НЯ не було пов’язане з лікуванням. У жодному випадку припинення лікування не було викликано НЯ, пов’язаними з лікуванням, і всі НЯ, пов’язані з лікуванням, були легкого або помірного ступеня тяжкості та минущими.
Діти, які раніше не одержували лікування, та діти зі зміненим лікуванням
У дослідженні PB-06-005 (діти, які раніше не одержували лікування), більшість НЯ були легкого або помірного ступеня тяжкості, минущими і не пов’язаними з лікуванням. Всі НЯ у дослідженні PB-06-002 (діти, яким змінили лікування) вважалися легкого або помірного ступеня і не пов’язаними з лікуванням. У дітей не було зареєстровано жодного тяжкого НЯ, жодна дитина не припиняла дослідження через пов’язані з лікуванням НЯ. У розширеному дослідженні PB-06-006, що включало дітей, які раніше не одержували лікування, з дослідження PB-06-005 і дітей зі зміненим лікуванням з дослідження PB-06-002, всі НЯ були легкого або помірного ступеня тяжкості, жодне з них не призвело до зміни дози таліглюцерази альфа або припинення участі у дослідженні.
Висновки
Лікування таліглюцеразою альфа забезпечувало довгострокове покращення (у пацієнтів, які раніше не одержували лікування) або стабільність (у пацієнтів, які перейшли з лікування іміглюцеразою) вісцеральних, гематологічних і біомаркерних параметрів. Таліглюцераза альфа добре переносилася, а НЯ, як правило, були легкого або помірного ступеня тяжкості та минущого характеру. Представлені сукупні дані підтримують застосування таліглюцерази альфа у дорослих пацієнтів і дітей з ХГ 1 типу, які раніше не одержували ФЗТ або одержували лікування іміглюцеразою.
За матеріалами А. Zimran et al. Taliglucerase alfa: safety and efficacy across 6 clinical studies in adults and children with Gaucher disease. Orphanet Journal of Rare Diseases. 2018. 13: 36. https://doi.org/10.1186/s13023-018-0776-8.
Тематичний номер «Онкологія, Гематологія, Хіміотерапія» № 4 (71) 2021 р.



