24 липня, 2021
Світові стандарти діагностики та лікування дифузної B-великоклітинної лімфоми та можливості їх впровадження в Україні
Актуальність теми вдосконалення чинних стандартів діагностики та лікування дифузної B-великоклітинної лімфоми (ДВКЛ) у світі зумовлена тим, що ДВКЛ є найпоширенішим варіантом неходжкінських лімфом, при яких у 30-40% пацієнтів відмічається розвиток рецидивів чи рефрактерності до 1-ї лінії терапії.
З метою ознайомлення онкологічної спільноти з останніми тенденціями ведення пацієнтів з ДВКЛ та оновленими рекомендаціями застосування комбінації полатузумабу ведотину з бендамустином і ритуксимабом (Pola-BR) 3 червня було проведено науковий онлайн майстер-клас «Практичні аспекти ведення пацієнтів з рецидивуючою чи рефрактерною ДВКЛ: загальні принципи та індивідуальний підхід».
.jpg) Про зміни у лікуванні ДВКЛ протягом року у світі та в Україні розповіла керівниця науково-дослідного відділення хіміотерапії гемобластозів та ад’ювантних методів лікування Національного інституту раку (м. Київ), доктор медичних наук, професор Ірина Анатоліївна Крячок.
Про зміни у лікуванні ДВКЛ протягом року у світі та в Україні розповіла керівниця науково-дослідного відділення хіміотерапії гемобластозів та ад’ювантних методів лікування Національного інституту раку (м. Київ), доктор медичних наук, професор Ірина Анатоліївна Крячок.
– Протягом тривалого часу золотим стандартом терапії ДВКЛ вважалася схема R-CHOP (циклофосфамід + доксорубіцин + вінкристин + преднізолон + ритуксимаб), при застосуванні якої 60% хворих одужували, однак у 20-30% пацієнтів відмічалися рецидиви, а у 10% – первинна рефрактерність до хіміотерапії (R. Fisher et al., 1993; B. Coiffier 2010). При виникненні у пацієнта рецидиву чи рефрактерності після 1-ї лінії лікування слід розглянути проведення 2-ї лінії терапії та подальшої аутологічної трансплантації гемопоетичних стовбурових клітин (аутоТГСК). Однак і в цьому випадку одужання настає тільки у 50% пацієнтів, що пов’язано з ризиком розвитку рецидиву після аутоТГСК. При цьому слід враховувати той факт, що не всім пацієнтам первинно показана аутоТГСК через певні обмеження за віком, наявність супутніх захворювань та відповіді на 2-гу лінію терапії.
Найбільш несприятливим є прогноз у хворих, яким із певних причин не може бути проведена аутоТГСК, що зумовлює потребу пошуку нових опцій лікування. Сьогодні увагу привертає полатузумаб ведотин. Механізм дії останнього зумовлений зв’язуванням моноклонального антитіла (одного з компонентів препарату) з рецептором CD79b, який експресується на злоякісних B-клітинах. Проникнення лікарського засобу в клітину супроводжується вивільненням цитотоксичного агента (монометилауристатину Е – ММАЕ), який руйнує мікротрубочки клітини, призводячи до її загибелі через пригнічення поділу й індукцію апоптозу. Згідно з настановами Національної онкологічної мережі США (NCCN, 2020), рекомендовано застосовувати схему Pola-BR у пацієнтів із рецидивуючою чи рефрактерною (р/р) ДВКЛ або В-клітинною лімфомою високого ступеня злоякісності та транслокаціями MYC і BCL2 чи BCL6 після проходження більше ніж 2 попередніх курсів лікування. Через 5 міс настанови NCCN були оновлені з розширенням показань до призначення Pola-BR як 2-ї та 3-ї ліній терапії ДВКЛ (NCCN, 4.2021). Крім того, сьогодні активно вивчається застосування полатузумабу ведотину як 1-ї лінії терапії, а також при р/р ДВКЛ і при периферичній Т-клітинній лімфомі, плазмоклітинних неоплазіях, хронічному лімфолейкозі.
Первинні результати вивчення полатузумабу ведотину у пацієнтів із р/р ДВКЛ у рамках дослідження Ib та II фази свідчили про його ефективність, що стало поштовхом до проведення рандомізованого дослідження II фази GO 29365. У ньому порівнювали ефективність Pola-BR та комбінації бендамустин + ритуксимаб (BR). Медіана виживаності без прогресування (ВБП) за оцінкою незалежного комітету (IRC) у групі Pola-BR склала 9,5 міс, а у групі BR – 3,7 міс (відношення ризиків – ВР – 0,36; 95% довірчий інтервал – ДІ – 0,21-0,63; p<0,0002), що свідчить про зростання ВБП у 2,5 разу при додаванні полатузумабу ведотину до комбінації BR (рис. 1; L.H. Sehn et al., 2019). За даними позитронно-емісійної томографії (ПЕТ) у разі використання Pola-BR відмічалося значне покращення повної відповіді до 40% (p=0,012) порівняно з BR – 17,5%. Крім того, у групі Pola-BR виявлено зростання загальної виживаності (ЗВ) у 2,5 разу порівняно з такою у пацієнтів, яким призначали комбінацію BR: медіана ЗВ складала 12,4 проти 4,7 міс (ВР 0,42; 95% ДІ 0,24-0,75; p=0,0023).
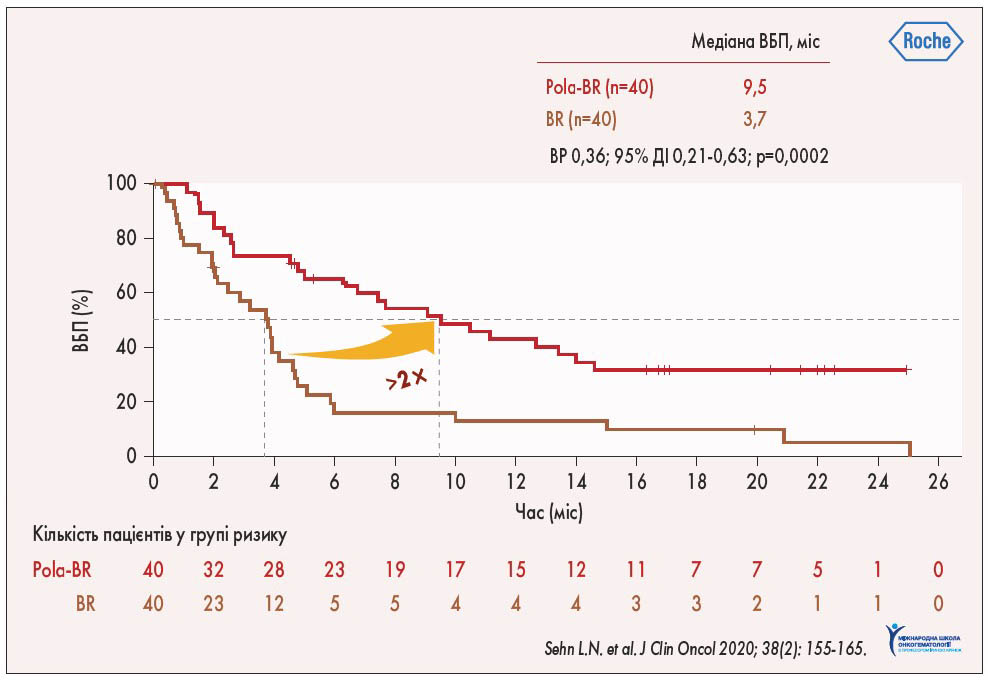 Рис. 1. Порівняння ВБП у групах Pola-BR та BR
Рис. 1. Порівняння ВБП у групах Pola-BR та BR
Крім того, при ПЕТ-оцінюванні повної відповіді було продемонстровано вищу ефективність комбінації Pola-BR у 2-й лінії терапії, ніж у 3-й лінії у хворих, які приймали BR. Це свідчить про перевагу розгляду цієї схеми як 2-ї лінії терапії у пацієнтів з р/р ДВКЛ, які не є кандидатами на аутоТГСК (рис. 2; L.H. Sehn et al., 2018).
 Рис. 2. Об’єктивна та повна відповідь на лікування у групах Pola-BR і BR при ПЕТ-оцінюванні
Рис. 2. Об’єктивна та повна відповідь на лікування у групах Pola-BR і BR при ПЕТ-оцінюванні
Застосування Pola-BR виявилося ефективним при усіх підтипах ДВКЛ, особливо при несприятливому підтипі ABC. При оцінюванні профілю безпеки схеми Pola‑BR було встановлено дещо вищий вплив цих препаратів на гематологічні показники та частоту розвитку периферичної нейропатії, однак вищезазначені несприятливі явища (НЯ) були контрольованими. На основі результатів дослідження GO 29365, полатузумаб ведотин отримав статус «прорив у терапії» від Управління з контролю якості харчових продуктів і лікарських препаратів США (FDA) та був включений до препаратів програми пріоритетної терапії (Priority medicine, PRIME) від Європейського агентства з лікарських засобів (EMA) для лікування осіб із р/р ДВКЛ.
Сьогодні активно вивчають й інші перспективні напрями терапії р/р ДВКЛ, до яких належать поєднання полатузумабу ведотину з R-GemOx (гемцитабін + оксаліплатин + ритуксимаб), застосування нових біспецифічних моноклональних антитіл, нових моноклональних антитіл у комбінації з імуномодуляторами, CAR-T-клітинної терапії та малих молекул. Прикладом біспецифічних препаратів є мозунетузумаб – анти-CD20/анти-CD3 біспецифічне моноклональне антитіло, дія якого спрямована на створення імунного синапсу між Т- та B-клітинами мішенями для подальшого запуску апоптозу пухлинних B-клітин.
У рамках III фази клінічних досліджень продовжують вивчати ефективність комбінації полатузумабу ведотину з R-GemOx та R-ICE (іфосфамід + карбоплатин + етопозид + ритуксимаб), CAR-T-клітинну терапію з залученням CD19- та CD22-антитіл і таргетну терапію малими молекулами (селінексор).
Сучасний принцип ведення хворих на р/р ДВКЛ полягає в першочерговому з’ясуванні можливості виконання аутоТГСК. Якщо у пацієнта наявні протипоказання до аутоТГСК, слід розглядати призначення Pola-BR або ритуксимабу в поєднанні з хіміотерапією чи участь у клінічних дослідженнях. У групі пацієнтів із рецидивом після трансплантації можна визначити можливість подальшої CAR-T-cell терапії (в Україні не доступна) чи використання комбінації Pola-BR. У разі неефективності CAR-T-cell терапії слід рекомендувати застосування схеми Pola-BR, паліативну допомогу чи участь у клінічних дослідженнях.
Таким чином, більшість пацієнтів з ДВКЛ одужують, однак слід пам’ятати й про хворих на р/р ДВКЛ, терапія яких сьогодні потребує особливої уваги.
.jpg) Експерт МОЗ України за спеціальністю «Гематологія», завідувач відділу медичної генетики ДУ «Національний науковий центр радіаційної медицини НАМН України», завідувач кафедри клінічної лабораторної діагностики Національного університету охорони здоров’я України імені П.Л. Шупика, доктор медичних наук, професор Сергій Вікторович Клименко виступив з доповіддю «Чи є зміни в діагностиці ДВКЛ протягом року у світі та Україні?».
Експерт МОЗ України за спеціальністю «Гематологія», завідувач відділу медичної генетики ДУ «Національний науковий центр радіаційної медицини НАМН України», завідувач кафедри клінічної лабораторної діагностики Національного університету охорони здоров’я України імені П.Л. Шупика, доктор медичних наук, професор Сергій Вікторович Клименко виступив з доповіддю «Чи є зміни в діагностиці ДВКЛ протягом року у світі та Україні?».
– ДВКЛ – гетерогенна група лімфопроліферативних захворювань, при яких виживаність і клінічний перебіг у частини пацієнтів може бути прогностично сприятливим, а в іншої – навпаки, що зумовлює потребу виділення підтипів ДВКЛ для прогнозування перебігу захворювання та вибору подальшої тактики лікування. Найкращим методом діагностики для визначення варіанта ДВКЛ є молекулярно-генетичне профілювання, однак цей метод дорогий, що обмежує його широке застосування. Доступнішим методом виділення підтипів ДВКЛ є імуногістологічне дослідження. За даними C. Visco та співавт. (2012), у пацієнтів з GCB-варіантом, яких лікували за схемою R-CHOP, відповідь на терапію була кращою порівняно з не‑GCB підтипами. При порівнянні даних молекулярно-генетичного профілювання та імуногістохімії було встановлено, що похибка останньої є дещо вищою, це зумовлює певні обмеження у прогнозуванні перебігу захворювання.
У сучасній класифікації Всесвітньої організації охорони здоров’я (2016) також виділена B-клітинна лімфома з високим ступенем злоякісності та перебудовою генів MYC, BCL2 та/або BCL6. При цьому, якщо методом флуоресцентної гібридизації in situ (FISH) було встановлено наявність реаранжування генів MYC чи BCL2 або MYC та BCL6, лімфому класифікують як double-hit, а при перебудові всіх трьох генів – MYC, BCL2, BCL6 – як triple-hit. При виявленні експресії MYC та BCL2 та/або BCL6 методом імуногістохімії виділяють double-expressor лімфоми. Кращий прогноз спостерігається при відсутності перебудови генів MYC, BCL2, BCL6, дещо гірший – при double-expressor лімфомах і найбільш несприятливий – при double-hit і triple-hit лімфомах (рис. 3).
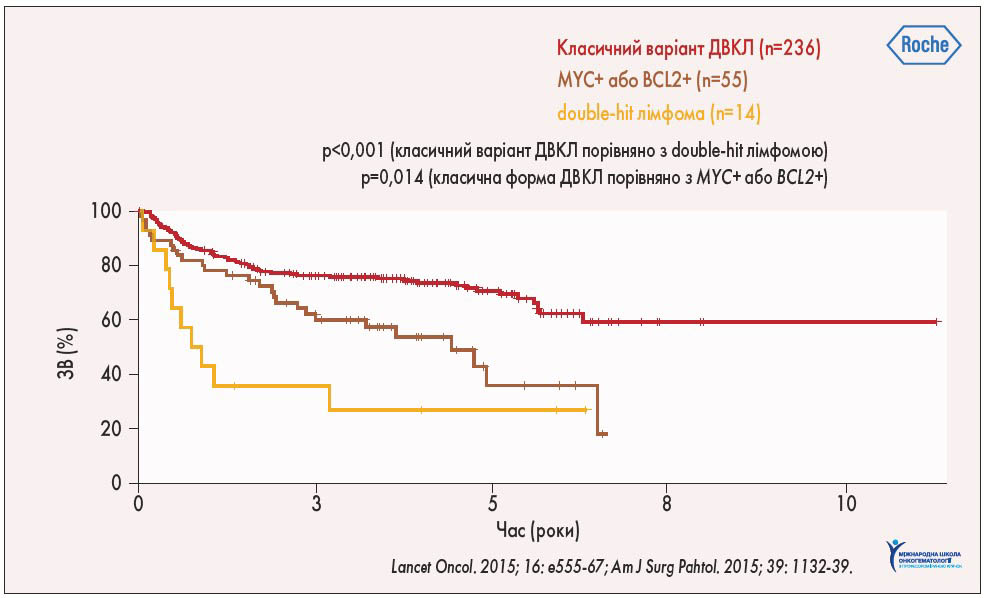 Рис. 3. Прогнозування виживаності при ДВКЛ
Рис. 3. Прогнозування виживаності при ДВКЛ
Для оптимізації коштів первинну діагностику ДВКЛ слід починати з імуногістологічного дослідження з подальшим оцінюванням імовірності виявлення double-hit і triple-hit лімфом та потреби у застосуванні FISH-методу.
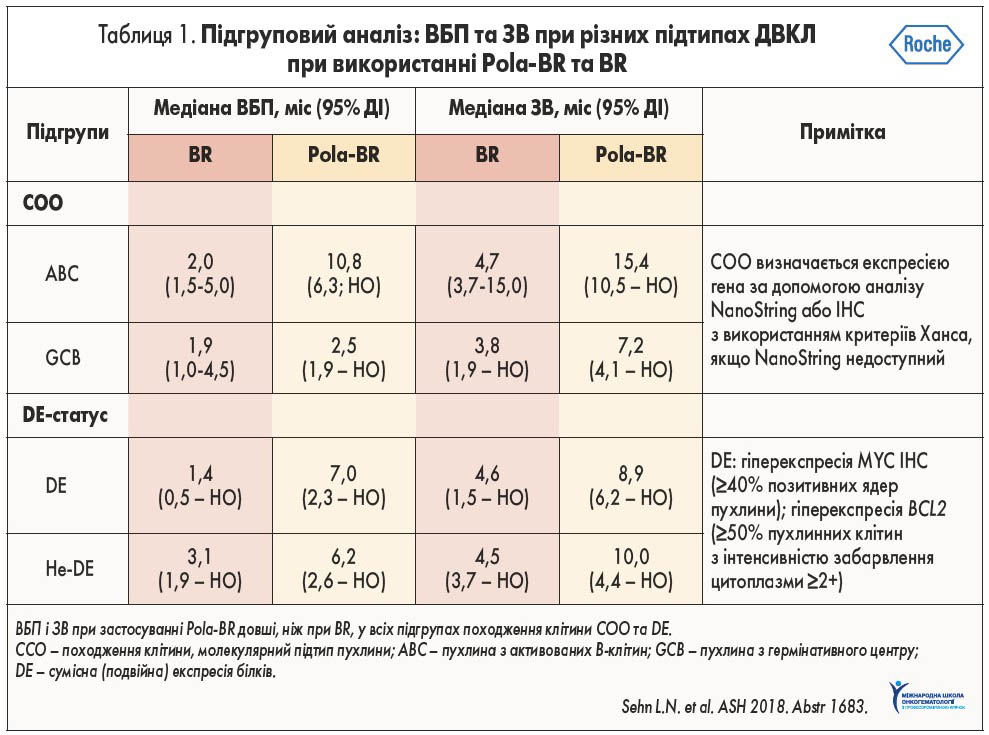
Вивчення молекулярних аномалій при ДВКЛ призвело до потреби у розробленні у рамках клінічних досліджень нових молекул для підвищення ефективності лікування цих пацієнтів. Однією з комбінацій лікарських засобів, яку активно вивчають, є Pola‑BR. У літературі сьогодні наводять дані про те, що застосування цієї схеми збільшує медіану ВБП і ЗВ при всіх молекулярних підтипах (табл. 1). Це свідчить про широкі терапевтичні можливості такого поєднання лікарських засобів (L.H. Sehn et al., 2018).
Активне представлення й обговорення нових даних щодо ефективності та безпеки комбінації Pola-BR у розширеній когорті пацієнтів з р/р ДВКЛ у дослідженні GO 29365 проводилося за участю провідних експертів з Канади (доцент Центру раку Британської Колумбії та Університету Британської Колумбії, доктор медицини Лорі Сейн), США (онкогематолог Меморіального онкологічного центру ім. Слоуна – Кеттерінга в Нью-Йорку Метью Матасар), Великобританії (лікар-гематолог центру клінічної гематології Ноттінгемської університетської клініки Ендрю Мак-Міллан), Німеччини (лікар-гематолог Гейдельберзької університетської клініки Саша Дітріх).
 Засідання панелі експертів розпочала Лорі Сейн, яка висвітлила нещодавно представлені у рамках конференції Американської асоціації гематології (American Society of Hematology, ASH) дані дослідження GO 29365.
Засідання панелі експертів розпочала Лорі Сейн, яка висвітлила нещодавно представлені у рамках конференції Американської асоціації гематології (American Society of Hematology, ASH) дані дослідження GO 29365.
– Згідно з даними досліджень C. Sarkozy та співавт. (2019) і M. Crump та співавт. (2017), проблемну групу хворих на ДВКЛ складають пацієнти з р/р ДВКЛ, оскільки медіана їх виживаності є короткою. У зв’язку з цим сьогодні триває активне вивчення антитіла-імунокон’югату полатузумабу ведотину, терапевтичною мішенню якого є CD79b.
Після опрацювання даних у розширеній когорті пацієнтів дослідження GO 29365 не з’явилися нові застереження щодо безпеки та НЯ. Загалом у хворих, які приймали комбінацію Pola-BR, відзначали більш виражену гематологічну токсичність і вищий ступінь нейтропенії, що в цілому не відобразилося на зростанні потреби у проведенні додаткових інфузій. Однак варто пам’ятати й про ризик розвитку периферичної нейропатії при прийомі Pola-BR.
Частота повної відповіді на терапію у розширеній когорті хворих складала 38,7%, а загальної відповіді – 41,5%, що збігається з попередньо отриманими результатами у початковій рандомізованій групі цього дослідження. Дворічна ВБП складала 28,4%, а дворічна ЗВ – 38,2%, при цьому 1/4 пацієнтів не потребували подальшої терапії та залишались у фазі тривалої ремісії більше 2 років (рис. 4).
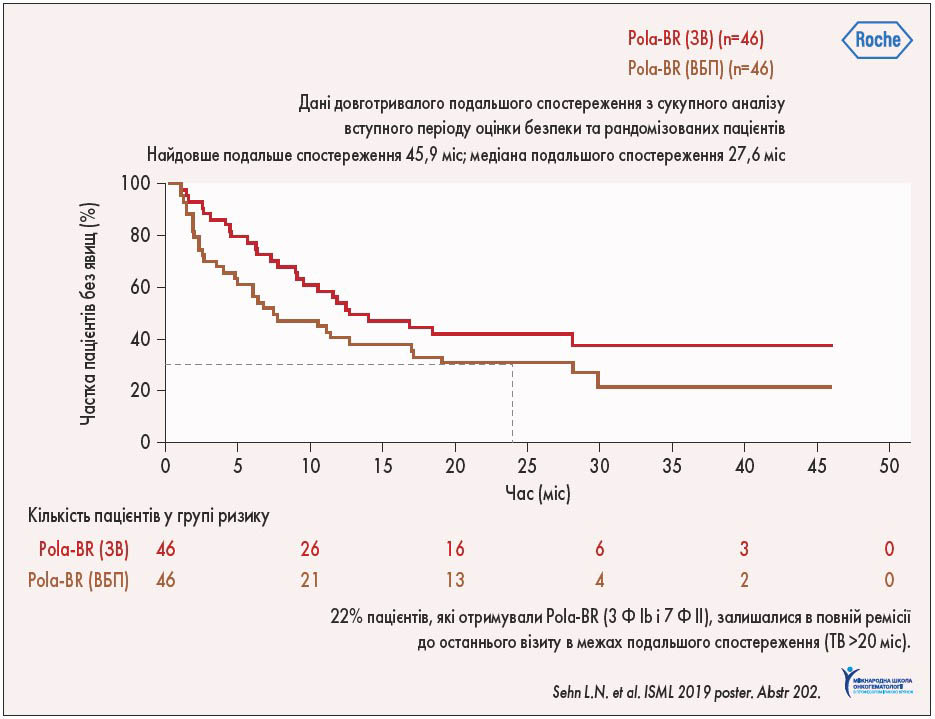 Рис. 4. Довготривала виживаність пацієнтів при лікуванні Pola-BR
Рис. 4. Довготривала виживаність пацієнтів при лікуванні Pola-BR
Ефект від терапії у цих хворих відмічався незалежно від лінії терапії чи статусу рефрактерності, однак результат лікування виявився найбільш вираженим при застосуванні Pola-BR у 2-й лінії терапії та у хворих із відсутністю рефрактерності до лікування.
Таким чином, результати аналізу у розширеній когорті учасників дослідження GO 29365 свідчать про отримання зіставних даних щодо ВБП, ЗВ і безпеки з попередніми даними меншої когорти учасників.
 Після презентації нових результатів дослідження GO 29365 у рамках панелі експертів провідні фахівці відповідали на питання учасників заходу. Одне з питань стосувалося розгляду можливостей застосування Pola-BR у хворих із легкою формою периферичної нейропатії. У відповідь на це запитання Метью Матасар зазначив, що Pola-BR можна застосовувати у цих пацієнтів, однак при прогресуванні нейропатії слід припинити лікування до зменшення її вираженості з подальшим відновленням прийому полатузумабу ведотину у меншій дозі.
Після презентації нових результатів дослідження GO 29365 у рамках панелі експертів провідні фахівці відповідали на питання учасників заходу. Одне з питань стосувалося розгляду можливостей застосування Pola-BR у хворих із легкою формою периферичної нейропатії. У відповідь на це запитання Метью Матасар зазначив, що Pola-BR можна застосовувати у цих пацієнтів, однак при прогресуванні нейропатії слід припинити лікування до зменшення її вираженості з подальшим відновленням прийому полатузумабу ведотину у меншій дозі.
 Під час обговорення вражаючих результатів, які забезпечило застосування комбінації Pola-BR, Ендрю Мак-Міллан прокоментував високу якість дослідження, інформативність і відповідність результатів, що відображені належним чином у кривих Каплана – Меєра.
Під час обговорення вражаючих результатів, які забезпечило застосування комбінації Pola-BR, Ендрю Мак-Міллан прокоментував високу якість дослідження, інформативність і відповідність результатів, що відображені належним чином у кривих Каплана – Меєра.
Саша Дітріх у відповіді на запитання про можливість поєднання колонієстимулюючих факторів росту з Pola-BR зазначив, що з метою підтримки функції кісткового мозку ці групи лікарських засобів поєднувати можна.
Учасників заходу особливо цікавило виявлення певних предикторів, які б свідчили про ефективність застосування цих препаратів у деякої групи пацієнтів. Лорі Сейн розповіла, що не було визначено жодного предиктора, який дозволив би спрогнозувати відповідь на терапію у хворих на р/р ДВКЛ, а також відмітила, що ефект від застосування Pola-BR помітний через невеликий проміжок часу. Це дозволяє зробити висновок про необхідність подальшого застосування цієї комбінації.
Щодо призначення Pola-BR перед проведенням CAR-T-клітинної терапії Ендрю Мак-Міллан зазначив, що ця комбінація затверджена у Великобританії, однак варто з обережністю призначати бендамустин перед аферезом через його вплив на зменшення кількості T-клітин.
 Про перспективи та спроби підвищити ефективність 1-ї лінії терапії пацієнтів з ДВКЛ розповіла професор кафедри гематології та трансфузіології Національного університету охорони здоров’я України імені П.Л. Шупика (м. Київ), доктор медичних наук Тетяна Петрівна Перехрестенко.
Про перспективи та спроби підвищити ефективність 1-ї лінії терапії пацієнтів з ДВКЛ розповіла професор кафедри гематології та трансфузіології Національного університету охорони здоров’я України імені П.Л. Шупика (м. Київ), доктор медичних наук Тетяна Петрівна Перехрестенко.
– Як відомо, найкраща ЗВ та ВБП досягається при проведенні 1-ї лінії терапії, а з кожним наступним рецидивом ДВКЛ шанс на одужання зменшується. Тому протягом останніх років тема підвищення ефективності терапії ДВКЛ у 1-й лінії активно розробляється. При порівнянні у клінічному дослідженні III фази режимів R-CHOP та DA-EPOCH-R (етопозид + преднізолон + вінкристин + циклофосфамід + доксорубіцин + ритуксимаб) у 1-й лінії терапії ДВКЛ виявлено, що у пацієнтів, які отримували DA-EPOCH-R, не було покращення ВБП при паралельному зростанні токсичності (W.H. Wilson et al., 2016; N.L. Bartlett et al., 2019). Застосування більш інтенсивної хіміотерапії (режимів R-CHOP‑14 та R-CHOP‑21) у 1-й лінії не супроводжувалося зростанням ЗВ (D. Cunningham et al., 2013). Однак деяке збільшення ЗВ відмічалося у хворих, які лікувалися за схемою R-ACVBP (ритуксимаб + доксорубіцин + віндезин + блеоміцин + преднізолон), порівняно з особами, яким призначали R-CHOP‑21 (C. Recher et al., 2011).
У дослідженні III фази REMARC при вивченні леналідоміду як підтримуючої терапії у пацієнтів похилого віку з ДВКЛ, у яких досягнута повна чи часткова відповідь на R-CHOP, через 2 роки його застосування було встановлено зростання ВБП, однак змін щодо ЗВ не виявлено (C. Thieblemont et al., 2016).
У дослідженні III фази PHOENIX застосування ібрутинібу у поєднанні з R-CHOP порівняно з призначенням R-CHOP та плацебо у пацієнтів молодших 60 років сприяло покращенню виживаності без подій (ВР 0,579), ВБП (ВР 0,556) і ЗВ (ВР 0,33), однак зумовлювало незначне збільшення серйозних НЯ (35,7 проти 28,6%). При порівнянні цих двох комбінацій у хворих старше 60 років не було переваг від додавання ібрутинібу до схеми R-CHOP щодо виживаності без подій, ВБП, ЗВ, проте зростав ризик виникнення серйозних НЯ (63,4 проти 38,2%) та зменшилася частка пацієнтів, які отримували не менше 6 циклів R-CHOP (73,7 проти 88,8%; A. Younes et al., 2019). Таким чином, було багато спроб підвищити ефективність лікування пацієнтів з ДВКЛ у 1-й лінії, однак більшість із них виявилися невдалими.
На основі обнадійливих результатів дослідження GO 29365 було проведено дослідження II фази GO 29044, в якому порівнювали ефективність Pola + R-CHP (ритуксимаб + циклофосфамід + доксорубіцин + преднізолон) та Pola + G-CHP (обінутузумаб + циклофосфамід + доксорубіцин + преднізолон). При застосуванні Pola + R/G-CHP відмічалася дещо вища гематологічна токсичність, ніж при R-CHP, однак слід враховувати, що більшість пацієнтів, які брали участь у дослідженні, входили до групи високого ризику. Частота об’єктивної відповіді та повної відповіді, підтвердженої методом ПЕТ-КТ, після закінчення терапії за схемою Pola + R-CHP складали 91 та 78%, а після Pola + R/G-CHP – 89 та 77% відповідно. Таким чином, призначення Pola + R/G-CHP демонструвало клінічну ефективність у 1-й лінії ДВКЛ, при цьому 12-місячна ВБП складала 91%, а ЗВ – 94% (H. Tilly et al., 2019).
Роль полатузумабу ведотину в 1-й лінії терапії буде встановлена у III фазі дослідження POLARIX, в якому порівнюється ефективність поєднання Pola + R-CHP та R-CHOP з подальшим призначенням 6 курсів ритуксимабу після закінчення лікування у двох групах (H. Tilly et al., 2019).
За даними конгресу Європейського товариства медичної онкології (2020), подібні до R-CHOP режими все ще залишаються стандартами 1-ї лінії терапії ДВКЛ, а застосування ібрутинібу має певний потенціал у молодих пацієнтів. Проведення дослідження III фази POLARIX, можливо, допоможе підвищити ефективність 1-ї лінії терапії, однак схему Pola + R-CHP, напевно, варто розглядати у пацієнтів молодого віку з високим ризиком прогресування, що допоможе знизити необхідність використання наступних ліній терапії (рис. 5).
 Рис. 5. Стратегія покращення у 1-й лінії терапії ДВКЛ у перспективі
Рис. 5. Стратегія покращення у 1-й лінії терапії ДВКЛ у перспективі
 Про практичні аспекти ведення пацієнтів з р/р ДВКЛ і режим Pola-BR на прикладі протоколу Великої Британії розповіла доцент кафедри внутрішньої медицини Національного медичного університету імені О.О. Богомольця (м. Київ), кандидат медичних наук Оксана Андріївна Карнабеда.
Про практичні аспекти ведення пацієнтів з р/р ДВКЛ і режим Pola-BR на прикладі протоколу Великої Британії розповіла доцент кафедри внутрішньої медицини Національного медичного університету імені О.О. Богомольця (м. Київ), кандидат медичних наук Оксана Андріївна Карнабеда.
– У затвердженому протоколі Великобританії зазначено про широку панель застосування Pola-BR при ДВКЛ. Однак існують обмеження щодо використання цієї схеми при первинній лімфомі центральної нервової системи, лімфомі Беркітта, плазмобластній лімфомі. Показаннями до застосування цієї схеми є наявність рецидиву чи рефрактерності після 1-ї лінії терапії ДВКЛ, або після попередньої ауто- чи алоТГСК, після CAR-T-терапії та у 2-й і 3-й лініях терапії ДВКЛ. Активно обговорюються дані щодо застосування зазначеної схеми як переходу до CAR-T-терапії, а також у пацієнтів, котрі не є кандидатами на ТГСК. Можливість проведення ТГСК оцінюють на консиліумі за участю фахівців різних спеціальностей та представників центру ТГСК з урахуванням фізичного стану пацієнта, наявності супутніх захворювань, відповіді на сальвадж-хіміотерапію. Одним з обмежень протоколу є те, що первинно він був розроблений з метою застосування при статусі за ECOG від 0 до 2.
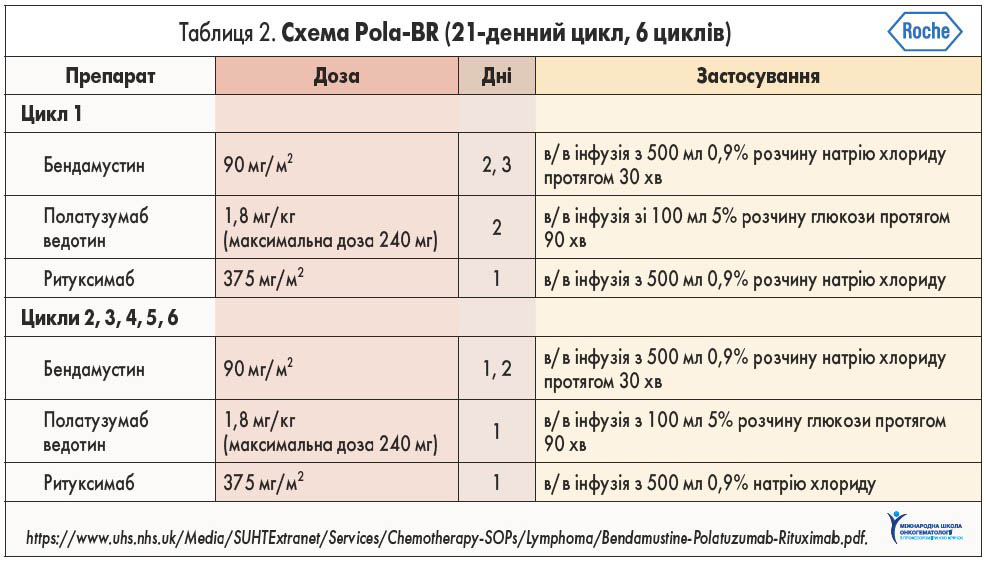
Застосування Pola-BR у першому та наступних циклах дещо відрізняється (табл. 2). У перший день першого циклу призначають тільки ритуксимаб, а наступного дня – бендамустин у поєднанні з ритуксимабом. Для уникнення трансфузійних реакцій за 30 хв до застосування полатузумабу ведотину та ритуксимабу слід проводити премедикацію. На другий день за 30 хв до введення полатузумабу ведотину та ритуксимабу варто попередньо застосувати хлорфенамін, парацетамол. Інфузію полатузумабу ведотину потрібно проводити протягом 90 хв, 1,5 год після чого пацієнт має перебувати під наглядом. Згодом проводиться премедикація ондансетроном за 15-30 хв до введення бендамустину. На третій день немає потреби у підтримуючій терапії, за винятком введення ондансетрону за 15-30 хв до бендамустину.
У перший день другого та наступних циклів терапії премедикація не відрізняється від такої першого циклу: спочатку вводять ритуксимаб, полатузумаб ведотин та ондансетрон перед застосуванням бендамустину. У другий день другого та подальших циклів хіміотерапія не відрізняється від такої у другий день першого циклу. Додаткова терапія може бути призначена при розвитку трансфузійних реакцій (зокрема, гідрокортизон, сальбутамол, петидин при інфузійній лихоманці та алопуринол у пацієнтів із високим ризиком виникнення синдрому лізису пухлини з урахуванням можливостей розвитку синдрому Стівенса – Джонсона та токсичного епідермального некролізу, що може виникнути при одночасному застосуванні алопуринолу та бендамустину).
При використанні цього протоколу можуть виникнути певні НЯ. Пацієнти, які отримували бендамустин, протягом життя мають ризик розвитку трансфузійної реакції трансплантат проти хазяїна, тому таким хворим протягом життя повинні призначатися тільки опромінені препарати крові. При введенні полатузумабу ведотину та ритуксимабу однією з найгірше контрольованих реакцій є прогресуюча мультифокальна лейкоенцефалопатія.
У разі виникнення гематологічних змін, порушення функції печінки, нирок та деяких видів специфічної медикаментозної токсичності варто проводити модифікацію дози. При розвитку периферичної нейропатії 2 та 3 ступеня за шкалою NCI-CTC (оцінюючою шкалою загальних критеріїв токсичності Національного інституту раку) слід припинити застосування полатузумабу ведотину до зменшення вираженості нейропатії (до 1 ступеня за шкалою NCI-CTC). У разі підозри на прогресуючу мультифокальну лейкоецефалопатію слід припинити введення як полатузумабу ведотину, так і бендамустину.
У пацієнтів, яких лікують за схемою PolaBR, слід проводити моніторинг показників загального аналізу крові, функціональних печінкових проб, сечової кислоти та електролітів до першого дня лікування, перевірити наявність гепатиту B до початку лікування ритуксимабом та забезпечити контроль рівня калію в осіб із серцевими розладами.
На завершення підсумки заходу підбили І.А. Крячок, С.В. Клименко та Т.П. Перехрестенко. С.В. Клименко відзначив доступність методик діагностики ДВКЛ не тільки у світі, а й в Україні. Т.П. Перехрестенко розповіла про можливість заміни ритуксимабу обінутузумабом при рефрактерності до ритуксимабу, яку потрібно розглядати у кожному випадку індивідуально. І.А. Крячок відзначила важливі зміни у лікуванні ДВКЛ у світі, пов’язані з появою можливості застосовувати Pola‑BR як у 3-й, так і у 2-й лініях терапії.
Таким чином, діагностика підтипів ДВКЛ сьогодні доступна і в Україні. Це створює можливості для індивідуалізації підходів до лікування, використання сучасних режимів хіміотерапії та розроблення перспективних методів лікування ДВКЛ.
Підготувала Ірина Неміш
Матеріал підготовлено за підтримки ТОВ «Рош Україна».
Для розміщення в спеціалізованих виданнях, призначених для медичних закладів або спеціалістів охорони здоров’я.
Інформація для професійної діяльності медичних і фармацевтичних працівників. Для демонстрації в рамках семінарів, конференцій, симпозіумів на медичну тематику.
Деякі схеми лікування можуть включати лікарські засоби, застосовані за межами їхніх показань та/або не зареєстровані в Україні.
Запит медичної інформації про продукти ТОВ «Рош Україна» ви можете надіслати на електронну адресу: ukraine.medinfo@roche.com.
ТОВ «Рош Україна». Київ, 04070, вул. П. Сагайдачного, 33. Тел.: +380 (44) 354 30 40, факс: +380 (44) 354 30 41. www.roche.ua
Повідомити про побічні явища під час лікування препаратом ТОВ «Рош Україна» або поскаржитись на якість препарату ви можете за контактними реквізитами офісу або на електронну адресу: ukraine.safety@roche.com.
M-UA-00000440
Тематичний номер «Онкологія, Гематологія, Хіміотерапія» № 3 (70) 2021 р