30 березня, 2021
Роль кабозантинібу у терапії гепатоцелюлярної карциноми
У квітні 2020 р. було зареєстровано нове показання до застосування препарату Кабометикс® (ІPSEN PHARMA) – гепатоцелюлярна карцинома (ГЦК) у дорослих пацієнтів, яких раніше лікували сорафенібом (реєстраційне посвідчення № UA/16766/01/03). Для обговорення цієї вагомої події було проведено круглий стіл, до роботи якого запрошено провідних експертів у галузі онкології й онкохірургії.
.jpg) Керівник центру хірургії печінки та підшлункової залози Медичного центру «Універсальна клініка «Оберіг», доктор медичних наук, професор Олег Геннадійович Котенко розповів про сучасні методи хірургічного лікування при ГЦК.
Керівник центру хірургії печінки та підшлункової залози Медичного центру «Універсальна клініка «Оберіг», доктор медичних наук, професор Олег Геннадійович Котенко розповів про сучасні методи хірургічного лікування при ГЦК.
– ГЦК – найчастіша злоякісна пухлина печінки, яка характеризується вкрай агресивним перебігом і низькою виживаністю хворих (рівень 5-річної виживаності не перевищує 15%; R. Siegel et al., 2014). Сьогодні результати лікування ГЦК незадовільні, що визначає актуальність цієї проблеми, необхідність удосконалення наявних і пошуку нових методів діагностики та лікування.
ГЦК найчастіше розвивається на тлі цирозу печінки або хронічного гепатиту будь-якої етіології. Морфологічними особливостями ГЦК є часте формування пухлинного тромбозу ворітної вени (ВВ), пухлинна інвазія ВВ, паренхіми печінки, а також інвазія жовчних проток, яка є причиною розвитку жовтяниці. Характерним для ГЦК є переважне поширення метастазів через систему ВВ у паренхіму печінки, формування пухлинних мікросателітів і здатність до інкапсуляції. У процесі росту злоякісне новоутворення може ускладнюватись розвитком некрозів і крововиливів у пухлину. Пухлинна інвазія стінки ВВ і тромбоз ВВ, за різними даними, зустрічаються у 12,5-39,7% пацієнтів із ГЦК та є визначальними факторами несприятливого прогнозу ГЦК (N. Portolani et al., 2006). Переважне поширення пухлинних тромбів портальною системою зумовлене особливостями печінкової гемодинаміки. Збільшуючись у розмірах, пухлина порушує відтік крові перитуморозними гілками печінкових вен, що призводить до реверсного кровотоку у ВВ. Із ретроградним потоком крові пухлинний тромб може досягати гілок ВВ та її стовбура, порушуючи надходження крові по ВВ, внаслідок чого зменшується печінковий кровотік та доставляння у печінку гепатотрофічних факторів. Це супроводжується наростанням печінкової недостатності та портальної гіпертензії з варикозним розширенням вен стравоходу і їх подальшими розривами та кровотечею. Хірургічний метод є єдиним можливим і радикальним методом лікування ГЦК з пухлинним тромбозом ВВ. Враховуючи серйозність цього стану, у провідних онкологічних клініках світу лікування ГЦК, як правило, проводиться із залученням великої мультидисциплінарної команди, до якої входять хірурги-гепатологи, трансплантологи, хіміотерапевти, рентгенологи, інтервенційні радіологи та морфологи.
В Україні ГЦК часто виявляють вже на пізній стадії, при значному поширенні пухлинного процесу та виражених порушеннях функції печінки, що обмежує терапевтичні можливості із використанням сучасних методів. Тому вагоме значення для успішного лікування має активне виявлення ГЦК на ранніх стадіях, коли ще можливе радикальне хірургічне лікування, а саме резекція, трансплантація або абляція.
Сучасні підходи до хірургії при ГЦК полягають у виконанні передопераційної біліарної декомпресії при пухлинному тромбозі жовчних проток, передопераційної емболізації гілок ВВ, використанні Pringle-маневру, перетискання нижньої порожнистої вени, тотальної васкулярної ексклюзії, резекції вісцеральних судин при пухлинному тромбозі чи інвазії, виконанні біопсії печінки, лімфаденектомії, проведенні трансплантації та використанні трансплантаційних технологій, сучасного анестезіологічного забезпечення й таргетної терапії. При хронічному вірусному гепатиті В проводять противірусну терапію аналогами нуклеотидів. Резекція – метод вибору для пацієнтів з поодинокими пухлинними вогнищами та збереженою функцією печінки (клас А за Child – Pugh – CP; EASL, 2018). З метою уникнення розвитку рецидивів у післяопераційний період сьогодні виконують лише анатомічну резекцію печінки. Сучасні тенденції у виконанні резекції печінки при ГЦК демонструють нижчий рівень інтраопераційної крововтрати, виконання резекції вісцеральних судин, збільшення кількості великих резекцій і використання переднього доступу. Віддалена 5-річна виживаність хворих, яким проводили резекцію печінки з приводу ГЦК, сягає 35-45%, а при макроваскулярній інвазії – лише 5-8% (І. Ikai et al., 2007).
Трансплантація печінки, згідно з рекомендаціями EASL (2018), є методом вибору при ранній ГЦК (стадія А за модифікованою Барселонською класифікацією – BCLC), при виявленні декількох внутрішньопечінкових вузлів <3 см та збереженій функції печінки. Показаннями до трансплантації у нових рекомендаціях ESMO є стадії ГЦК 0, А та В за BCLC (ESMO, 2019). Доведено, що вища 5-річна виживаність після трансплантації печінки спостерігається в осіб із меншим розміром пухлини. Так, у групі хворих із менше ніж 2 пухлинними вогнищами (<2 см кожне) 5-річна виживаність склала 89,5% (S. Hwang, 2011).
За відсутності ознак інвазії та тромбозу магістральних печінкових судин і позапечінкових проявів захворювання як паліативне лікування хворих із неоперабельною ГЦК, перед трансплантацією, при ізольованому внутрішньопечінковому прогресуванні після оперативного лікування та абляції може бути проведена трансартеріальна хіміоемболізація у комбінації з іншими методами локального та системного лікування.
Сьогодні відомо, що ГЦК є хіміорезистентною пухлиною, тому системна хіміотерапія не проводиться. У деяких випадках можлива внутрішньоартеріальна хіміотерапія із введенням хіміопрепаратів безпосередньо в артеріальну систему печінки.
Таким чином, запорукою ефективного лікування при ГЦК є своєчасне встановлення діагнозу із визначенням стадії захворювання. Найпоширенішою системою стадіювання ГЦК залишається класифікація BCLC. Крім прогностично значущих характеристик пухлинного процесу, об’єктивного стану хворого та ступеня вираженості цирозу (клас за CP) вона також включає рекомендації щодо тактики лікування залежно від стадії хвороби. В останній редакції класифікації (2018 р.) визначення «класи цирозу A-B за CP» було замінено на «збережена функція печінки». На вибір методу лікування також впливає рівень білірубіну, наявність чи відсутність портальної гіпертензії, наявність асоційованих із пухлиною симптомів та об’єктивний стан хворого (шкала ECOG). За шкалою BCLC виділяють 5 стадій ГЦК: стадія 0 – дуже рання, А – рання, В – проміжна, С – поширена та D – термінальна ГЦК. Резекція та трансплантація печінки є терапією вибору для хворих із стадією А зі збереженою функцією печінки, а очікувана виживаність таких пацієнтів становить >5 років. У хворих із проміжною стадією (В) із порушеною функцією печінки рекомендоване проведення хіміоемболізації, при цьому очікувана тривалість життя становить >2,5 року. Для лікування пацієнтів зі стадією захворювання С при портальній інвазії, позапечінковому метастазуванні, збереженій функції печінки та оцінкою об’єктивного стану 1-2 бали за шкалою ECOG рекомендована системна медикаментозна терапія із використанням таргетних препаратів (EASL Guideline, 2018). Згідно з рекомендаціями EASL (2018) та NCCN (2019), препаратами вибору для застосування у першій лінії терапії при поширеній ГЦК є сорафеніб і ленватиніб (в Україні не зареєстрований), а препаратами другої лінії – регорафеніб, кабозантиніб (Кабометикс®, ІPSEN PHARMA) та рамуцирумаб (рекомендований лише при рівні альфа-фетопротеїну (АФП) ≥400 нг/мл, в Україні не зареєстрований).
Отже, оптимальним методом лікування ГЦК з пухлинним тромбозом ВВ є резекція печінки в комбінації з резекцією та пластикою ВВ. Використання сучасних трансплантаційних технологій з резекцією і реконструкцією нижньої порожнистої вени розширює спектр сучасних можливостей хірургічного лікування хворих з інвазією ГЦК в нижню порожнисту вену, а трансплантація є оптимальним методом лікування при ГЦК на фоні цирозу печінки.
.jpg) Аспекти сучасної терапії ГЦК висвітлила завідувачка відділення хіміотерапії № 1 Київського міського клінічного онкологічного центру, доцент кафедри онкології Національного університету охорони здоров’я України імені П.Л. Шупика, кандидат медичних наук Ольга Володимирівна Пономарьова.
Аспекти сучасної терапії ГЦК висвітлила завідувачка відділення хіміотерапії № 1 Київського міського клінічного онкологічного центру, доцент кафедри онкології Національного університету охорони здоров’я України імені П.Л. Шупика, кандидат медичних наук Ольга Володимирівна Пономарьова.
– Рак печінки у світі посідає 5-те місце за рівнем захворюваності серед усіх злоякісних новоутворень у чоловіків та є другою за частотою причиною канцерспецифічної смертності (S. Mittal et al., 2013). Близько 90% усіх випадків первинного раку печінки припадає саме на ГЦК (F. Ahmed, 2008).
ГЦК є комплексною патологією із гетерогенною етіологією, складним молекулярним канцерогенезом, здатністю до судинної інвазії а також наявністю численних систем стадіювання й прогнозу (E.P. Weledji et al., 2014). До групи ризику розвитку ГЦК належать пацієнти із цирозом печінки будь-якої етіології та вірусним гепатитом. Проте останнім часом хворобу все частіше виявляють в осіб без ознак цирозу печінки.
Запровадження сучасних методів діагностики та скринінгових програм у групах ризику в економічно розвинутих країнах світу сприяє підвищенню частоти виявлення ГЦК на ранній стадії та дозволяє збільшити кількість хворих, які є кандидатами на радикальне лікування. В Україні захворювання часто виявляють вже на пізніх стадіях, при значному поширенні пухлинного процесу, коли проведення радикального лікування неможливе.
Наразі накопичений певний досвід лікування ГЦК та, що не менш важливо, останнім часом розширився вибір активних протипухлинних препаратів, які можна використовувати для терапії хворих із ГЦК у різних лініях. Відомо, що на прогноз та вибір тактики ведення хворого впливають такі фактори, як анатомічна поширеність пухлинного процесу, біологічна агресивність (ступінь диференціювання та рівень АФП), вираженість цирозу, наявність супутньої патології та функціональний стан пацієнта.
Для стадіювання ГЦК обов’язкове проведення мультифазової комп’ютерної томографії (КТ) або магнітно-резонансної томографії (МРТ) органів черевної порожнини, КТ органів грудної порожнини та остеосцинтиграфії. Важливою залишається оцінка функціонального стану печінки за шкалою CP.
Системна терапія при ГЦК застосовується у разі неможливості використання локальних методів (резекції, трансплантації тощо) для лікування пацієнтів із локалізованою формою раку. Як терапія очікування перед трансплантацією печінки bridge-терапія може поєднуватись із різними методами локальної терапії при позапечінковому метастазуванні або внутрішньопечінковому прогресуванні процесу після локального лікування. За класифікацією BCLC, до цієї категорії належать пацієнти із стадією не вище С (EASL Guideline, 2018). Для проведення медикаментозної терапії необхідною умовою є попередня морфологічна (цитологічна/патоморфологічна) верифікація онкологічного процесу, крім випадку, коли у пацієнтів із попередньо встановленим цирозом печінки при виконанні двох незалежних досліджень (КТ і МРТ) із контрастуванням виявляють типову для ГЦК рентгенологічну картину гіперваскулярної пухлини печінки з вимиванням контрастної речовини у венозну фазу. Крім цього, необхідними умовами є задовільний загальний стан хворого (0-2 бали за ECOG), збережена функція печінки за шкалою CP (клас А/В, 5-7 балів), відсутність декомпенсованої супутньої патології та виражених змін лабораторних показників крові, а саме: рівень загального білірубіну <51 мкмоль/л, співвідношення аспартат- і аланінамінотрансферази <5 значень верхньої межі норми (ВМН), міжнародне нормалізоване відношення <1,7, кількість тромбоцитів >50×109/л, рівень креатиніну <1,5 значення ВМН, альбуміну >28 г/л і відсутність електролітних порушень (В.В. Бредер та співавт., 2019).
Що стосується ад’ювантної терапії (АТ), то її проведення при ГЦК не рекомендоване, про що, зокрема, свідчать результати оцінювання загальної виживаності (ЗВ) при проведенні АТ після резекції чи абляції ГЦК, отримані у дослідженні ІІІ фази STORМ (J. Bruix et al., 2015).
ГЦК вважається хіміорезистентною пухлиною. Монохіміотерапія ефективна у <10% випадків, незалежно від засобів та їх механізму дії, а поліхіміотерапія – приблизно у 15-30%, проте не впливає на ЗВ.
Сьогодні, згідно з EASL Guideline (2018), до першої лінії терапії при поширеній ГЦК належать мультикіназні інгібітори сорафеніб та ленватиніб (не зареєстрований в Україні), а оновлені клінічні рекомендації NCCN разом із сорафенібом і ленватинібом включають також терапію атезолізумабом у комбінації із бевацизумабом, проте із нижчим рівнем доказовості (NCCN, 2020).
ЗВ хворих, які отримували сорафеніб, вивчали у рандомізованих контрольованих дослідженнях ІІІ фази. Так, у дослідженні SHARP медіана ЗВ склала 10,7 міс (J.M. Llovet, 2008), а у дослідженні CheckMate‑459, у якому порівнювали ефективність сорафенібу та імунотерапевтичного препарату ніволумабу, – 14,7 міс (Yau et al., 2019).
Більше опцій розглядається для другої лінії терапії. Сьогодні рекомендоване застосування мультикіназних інгібіторів із різними молекулярними мішенями – регорафенібу та кабозантинібу (Кабометикс®, ІPSEN PHARMA), а також моноклонального антитіла до рецептора судинного ендотеліального фактора росту 2 типу – рамуцирумабу. Проте загалом середня ЗВ, якої нині вдається досягти за допомогою лікарських препаратів, не перевищує 15 міс. Це свідчить про актуальність проблеми пошуку оптимальних варіантів терапії для пацієнтів із прогресуючою ГЦК.
Першим препаратом, рекомендованим до застосування у другій лінії лікування при ГЦК, був регорафеніб. Регорафеніб продемонстрував свою ефективність при рефрактерній до сорафенібу ГЦК у плацебо-контрольованому дослідженні III фази RESORCE. У ньому він забезпечував достовірне збільшення медіани ЗВ на 2,8 міс порівняно із плацебо (10,6 vs 7,8 міс; J. Bruix et al., 2017; N. Personeni et al., 2018).
Наступним препаратом став кабозантиніб (Кабометикс®) – низькомолекулярний інгібітор різних рецепторів тирозинкінази, таких як MET, AXL, RET та VEGFR‑1, -2, -3, що забезпечує багатоцільовий (multi-targeted) підхід при лікуванні ГЦК. Кабометикс® призначений для перорального прийому. Ефективність і безпеку застосування кабозантинібу (Кабометикс®) для лікування пацієнтів із поширеною ГЦК після прогресування на тлі терапії сорафенібом вивчали у великому рандомізованому плацебо-контрольованому клінічному дослідженні ІІІ фази CELESTIAL. Згідно із дизайном, у дослідження було включено та рандомізовано у співвідношенні 2:1 на дві групи 707 хворих із поширеною нерезектабельною ГЦК із класом А за шкалою CP, які попередньо отримували терапію сорафенібом та ≤2 лінії системної терапії з приводу поширеної ГЦК. Кабозантиніб призначали у дозі 60 мг 1 раз на добу. Первинною кінцевою точкою була медіана ЗВ, вторинними – медіана виживаності без прогресування (ВБП) та частота об’єктивної відповіді (ОВ). Лікування кабозантинібом продовжували до втрати клінічного ефекту або до появи ознак вираженої токсичності. Медіана ЗВ у групі кабозантинібу (n=470) сягала 10,2 міс (95% довірчий інтервал – ДІ – 9,1-12,0) та була достовірно більшою порівняно з групою плацебо (n=237) – 8,0 міс (95% ДІ 6,8-9,4; рис. 1А). Медіана ВБП у групі кабозантинібу становила 5,2 проти 1,9 міс у групі плацебо (рис. 1Б), а частота контролю захворювання (часткова відповідь + стабілізація захворювання) – 64 (300 пацієнтів) та 33% (79 пацієнтів) відповідно. Найчастішими побічними реакціями 3-4 ступеня при терапії кабозантинібом були долонно-підошвовий синдром (17%), періодичне підвищення артеріального тиску (16%), підвищення рівня амінотрансфераз (12%), втомлюваність (10%) та періодична діарея (10%; G.K. Abou-Alfa, 2018).
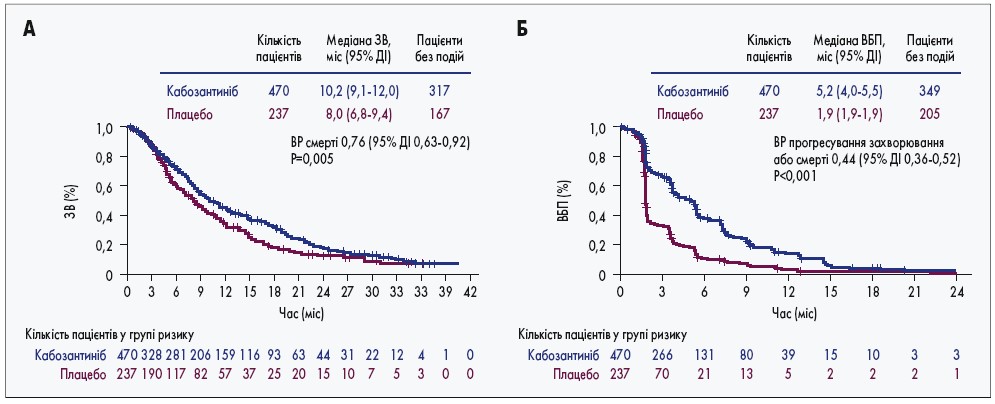 Рис. 1. Медіана ЗВ (А) та ВБП (Б) при терапії кабозантинібом порівняно з плацебо у дослідженні ІІІ фази CELESTIAL
Рис. 1. Медіана ЗВ (А) та ВБП (Б) при терапії кабозантинібом порівняно з плацебо у дослідженні ІІІ фази CELESTIAL
Будь-яке зменшення розміру пухлинних вогнищ частіше реєстрували на фоні прийому кабозантинібу (47%) порівняно з плацебо (11%; рис. 2). У 109 (23%) із 470 пацієнтів у групі кабозантинібу та 13 (5%) із 237 у групі плацебо зафіксовано зниження рівня АФП ≥50% порівняно з початковим (P. Merle et al., 2018). Клінічна ефективність кабозантинібу була продемонстрована у всіх підгрупах хворих із ГЦК. При цьому у підгрупі пацієнтів, які попередньо отримували лише сорафеніб, медіана ЗВ сягала 11,3 міс у групі кабозантинібу та 7,2 міс у групі плацебо (відносний ризик – ВР – 0,70; 95% ДІ 0,55-0,88), а медіана ВБП – 5,5 та 1,9 міс відповідно (ВР 0,70; 95% ДІ 0,55-0,88).
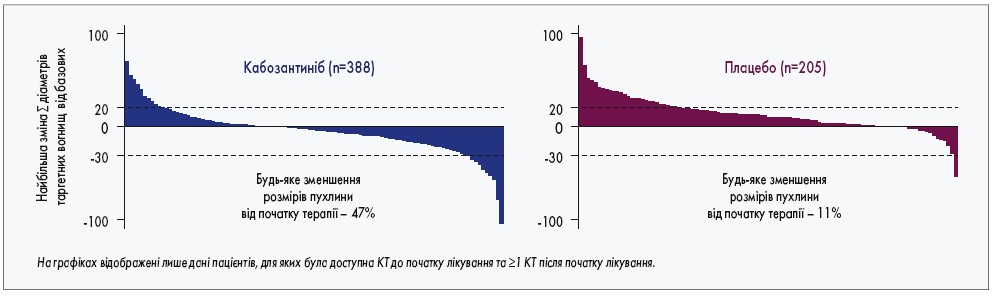 Рис. 2. Зменшення розміру пухлини при терапії кабозантинібом порівняно з плацебо у дослідженні ІІІ фази CELESTIAL
Рис. 2. Зменшення розміру пухлини при терапії кабозантинібом порівняно з плацебо у дослідженні ІІІ фази CELESTIAL
Медіана тривалості терапії кабозантинібом становила 3,8 міс, плацебо – 2 міс. Зниження дози потребували 62% пацієнтів у групі кабозантинібу та 13% у групі плацебо, а медіана середньої добової дози склала 35,8 та 58,9 мг відповідно (G.K. Abou-Alfa et al., 2018).
На підставі отриманих у дослідженні CELESTIAL даних кабозантиніб (Кабометикс®) було схвалено Європейським агентством з лікарських засобів у листопаді 2018 р. та Управлінням з контролю якості харчових продуктів і лікарських препаратів США у січні 2019 р. для другої лінії лікування пацієнтів із поширеною ГЦК після терапії сорафенібом.
Критеріями включення у дослідження RESORCE були пацієнти із прогресуванням хвороби на фоні прийому сорафенібу в першій лінії лікування; хворі із непереносимістю сорафенібу були виключені. У дослідження CELESTIAL було включено пацієнтів із прогресуванням захворювання на тлі першої та другої ліній терапії, однією з яких був сорафеніб, а також хворі з непереносимістю сорафенібу. Медіана ЗВ та ВБП були вищими у групі пацієнтів, які отримували кабозантиніб (11,3 та 5,5 міс відповідно), ніж у тих, яким проводили терапію регорафенібом (10,6 та 3,1 міс відповідно; рис. 3, 4). Частота ОВ та контролю захворювання у цих дослідженнях істотно не відрізнялися (J. Bruix et al., 2016; R.K. Kelley et al., 2018).
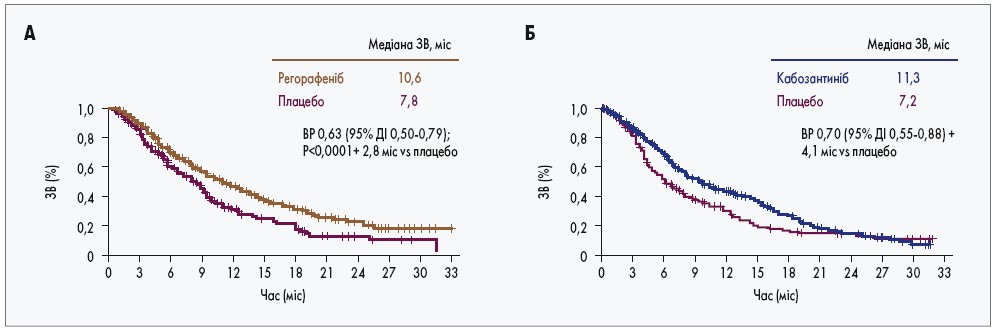 Рис. 3. Порівняння ЗВ у дослідженнях RESORCE (А) та CELESTIAL (Б)
Рис. 3. Порівняння ЗВ у дослідженнях RESORCE (А) та CELESTIAL (Б)
 Рис. 4. Порівняння ВБП у дослідженнях RESORCE (А) та CELESTIAL (Б)
Рис. 4. Порівняння ВБП у дослідженнях RESORCE (А) та CELESTIAL (Б)
Рамуцирумаб не забезпечував значного підвищення ЗВ у плацебо-контрольованому дослідженні ІІІ фази REACH при ГЦК з рефрактерністю до сорафенібу. Медіана ЗВ склала 9,2 міс для групи рамуцирумабу (95% ДІ 8,0-10,6) та 7,6 міс (95% ДІ 6,0-9,3) у групі плацебо (p=0,14; A.X. Zhu, 2015). Проте він виявився ефективнішим у дослідженні REACH‑2, у яке були включені лише хворі із високим рівнем АФП (≥400 нг/мл). При терапії рамуцирумабом вдалося досягти медіани ЗВ 8,5 міс проти 7,3 міс у групі плацебо (P=0,0199); 12-місячна ЗВ склала 36,8% а 18-місячна лише 24,5% у порівнянні із 30,3 та 11,3% відповідно у групі плацебо (A.X. Zhu, 2018).
Перспективними є дослідження із застосуванням інгібіторів контрольних точок ніволумабу та пембролізумабу, дія яких полягає у стимуляції протипухлинного імунітету (A.B. El-Khoueiry et al., 2017; R. Finn et al., 2019). Проте побічні явища 3-4 ступеня при використанні імунотерапії переважно представлені аутоімунними реакціями, що робить неможливим їх застосування у хворих із трансплантацією печінки. Призначення навіть 1 дози імунних препаратів пацієнтам із прогресуванням ГЦК після трансплантації печінки може нівелювати ефект імуносупресії та у 50% випадків спричинити втрату трансплантата (Gassmann et al., 2018). Згідно із настановами NCCN (2020) ніволумаб рекомендований пацієнтам із високим рівнем експресії ліганда PD‑L1 (рrogrammed cell death pathway) при неможливості призначення інгібіторів тирозинкінази чи інших антиангіогенних засобів (рівень доказовості 2В).
Після виступів спікерів учасники круглого столу обговорили низку питань, що стосуються вітчизняної клінічної практики. Зокрема, професор О.Г. Котенко наголосив на важливості такого критерію, як функція печінки, у визначенні стратегії ведення пацієнта з ГЦК.
Спікери неодноразово наголошували на тому, що ГЦК – це патологія, яка потребує мультидисциплінарного підходу за участю фахівців різних спеціальностей, у тому числі з діагностики. Забезпечення ефективного діалогу між лікарями первинної ланки, гепатологами, радіологами, патоморфологами, хірургами дозволить своєчасно виявити хворобу та призначити найбільш ефективне лікування у кожному конкретному випадку.
Отже, кабозантиніб (Кабометикс®) забезпечував достовірне збільшення ЗВ, ВБП і частоти ОВ порівняно з плацебо у пацієнтів із поширеною ГЦК після попередньої терапії сорафенібом. Лікування кабозантинібом слід продовжувати до припинення отримання пацієнтом клінічних переваг від терапії або до появи непереносимої токсичності.
Підготувала Ольга Нестеровська
Тематичний номер «Онкологія, Гематологія, Хіміотерапія» № 1 (68) 2021 р.



