23 січня, 2023
Резніковські читання 2022: сучасні медичні технології в педіатричній науці, практиці, сімейній медицині та освіті
24-25 листопада в онлайн-форматі відбулася науково-практична конференція з міжнародною участю «Сучасні медичні технології в педіатричній науці, практиці, сімейній медицині та освіті», присвячена пам’яті академіка АМН України Б.Я. Резніка. У рамках заходу провідні вчені, практичні лікарі-педіатри, неонатологи та сімейні лікарі з усіх регіонів України, а також іноземні фахівці з Австралії та Молдови поділилися своїм професійним доробком при лікуванні педіатричних пацієнтів.
.jpg) На початку конференції зі вступним словом до учасників звернувся член-кореспондент НАМН України, доктор медичних наук, професор, завідувач кафедри педіатрії № 1, неонатології та біоетики Одеського національного медичного університету, доктор медичних наук, професор Микола Леонідович Аряєв:
На початку конференції зі вступним словом до учасників звернувся член-кореспондент НАМН України, доктор медичних наук, професор, завідувач кафедри педіатрії № 1, неонатології та біоетики Одеського національного медичного університету, доктор медичних наук, професор Микола Леонідович Аряєв:
– Сьогоднішня конференція присвячена пам’яті видатного вченого, академіка АМН України, лауреата двох державних премій України в галузі науки і техніки Бориса Яковича Резніка, який створював та розвивав педіатричну службу в нашій країні. Метою заходу стало продовження справи видатного педіатра – популяризація та поширення актуальних знань, підвищення обізнаності та професіоналізму педіатрів. Предметом Резніковських читань є прикладні аспекти сучасної педіатрії та іноваційні аспекти педіатричної практики.
 До слів привітання долучилася доктор медичних наук, професор, проректор з науково-педагогічної роботи Одеського національного медичного університету Валерія Геннадіївна Марічереда:
До слів привітання долучилася доктор медичних наук, професор, проректор з науково-педагогічної роботи Одеського національного медичного університету Валерія Геннадіївна Марічереда:
– Тема сьогоднішньої конференції набуває ще більшого значення, оскільки стосується надзвичайно важливого питання для всієї України, а саме – оптимізації педіатричної допомоги в сучасних реаліях воєнного стану. Медична сфера традиційно є сферою концентрації важливих інтересів як держави, так і її населення, проте її подальший розвиток, без сумніву, неможливий без запровадження та оптимізації сучасних інноваційних методів діагностики і лікування. В рамках конференції провідні фахівці галузі педіатрії та сімейної медицини презентують фахові доповіді, нові ідеї та погляди, а також сучасні концепції менеджменту педіатричних пацієнтів, які учасники заходу в подальшому зможуть реалізувати у своїй клінічній практиці.
 Доктор медичних наук, професор, завідувачка кафедри педіатрії № 1 Вінницького національного медичного університету ім. М.І. Пирогова Ольга Степанівна Яблонь презентувала доповідь «Секрети неонатальної жовтяниці», в якій акцентувала увагу на сучасних аспектах менеджменту новонароджених з жовтяницею:
Доктор медичних наук, професор, завідувачка кафедри педіатрії № 1 Вінницького національного медичного університету ім. М.І. Пирогова Ольга Степанівна Яблонь презентувала доповідь «Секрети неонатальної жовтяниці», в якій акцентувала увагу на сучасних аспектах менеджменту новонароджених з жовтяницею:
– Відомо, що гіпербілірубінемія у новонароджених виникає при наявності дисбалансу між продукцією білірубіну, його кон’югацією та елімінацією. Особливості метаболізму білірубіну є ключовим чинником розвитку гіпербілірубінемії у новонароджених і включають: фізіологічний гемоліз, низьку здатність альбуміну до зв’язування, низьку активність глюкуронілтрансферази та посилену ентерогепатичну циркуляцію білірубіну [1]. За даними, упродовж першого тижня життя жовтяниця розвивається приблизно у 60% доношених і 80% передчасно народжених дітей. Проте не у всіх новонароджених із гіпербілірубінемією розвивається жовтяниця, оскільки жовтяничне забарвлення з’являється у доношених при рівні сироваткового білірубіну >60 мкмоль/л, а у недоношених при ще вищих показниках (відсутня підшкірна основа).
При цьому важливо враховувати, що неонатальна жовтяниця є транзиторним станом, що зазвичай не потребує лікування. Дитина, яка має фізіологічний перебіг адаптації та добре засвоює їжу, потребує менше досліджень, ніж та, яка має клінічні ознаки порушення адаптації. Червоні прапорці при неонатальній жовтяниці:
- втрата маси тіла або її збільшення за місяць менше ніж на 500 г;
- незвично великий живіт;
- незвичайний колір шкіри або її відтінок на тлі жовтяниці;
- гостра або наростаюча сонливість, млявість;
- поява жовтяниці у дитини на штучному вигодовуванні;
- поява жовтяниці після декількох тижнів її відсутності;
- переважання в біохімічному аналізі крові прямої фракції білірубіну;
- знебарвлення випорожнення та/або інтенсивне забарвлення сечі [2].
Основні принципи ведення новонароджених включають профілактику, виявлення й обстеження у дітей із ризиком розвитку гіпербілірубінемії та застосування фототерапії або, за показаннями, замінного переливання крові. Ведення дітей із гіпербілірубінемією передбачає інтерпретацію рівнів загального білірубіну сироватки та/або рівня транскутанного білірубіну за допомогою номограм з урахуванням гестаційного віку дитини, віку та маси тіла при народженні.
Ключовим методом боротьби з гіпербілірубінемією у новонароджених є фототерапія [3]. Цей метод заснований на ефекті фотодеградації (руйнування) непрямого білірубіну під дією видимого спектра світла. Вперше застосування фототерапії було запропоновано в Англії після спостережень за дітьми, шкіра яких була більш світлою при перебуванні на сонці порівняно з тими дітьми, що не були піддані сонячному опроміненню.
 Питанню антибіотикотерапії при неонатальній інфекції була присвячена доповідь доцента кафедри педіатрії, неонатології та перинатальної медицини Буковинського державного медичного університету, доктора медичних наук Анастасії Геннадіївни Бабінцевої:
Питанню антибіотикотерапії при неонатальній інфекції була присвячена доповідь доцента кафедри педіатрії, неонатології та перинатальної медицини Буковинського державного медичного університету, доктора медичних наук Анастасії Геннадіївни Бабінцевої:
– Неонатальні бактеріальні інфекції є однією з основних причин смертності та захворюваності серед новонароджених. Різноманітна етіологія та однотипність симптомів ускладнюють клінічну діагностику і лікування дітей. Неонатальна інфекція може розвинутися в будь-який час до народження як результат явної або прихованої материнської інфекції. Наслідки залежать від виду збудника і тривалості інфекції під час вагітності та включають мимовільний аборт, внутрішньоутробну затримку росту, передчасні пологи, мертвонародження тощо. Враховуючи тяжкість наслідків неонатального інфікування плода, постає питання щодо необхідності попередження інфікування, що можна досягти за допомогою запровадження профілактичних програм для вагітних жінок [4].
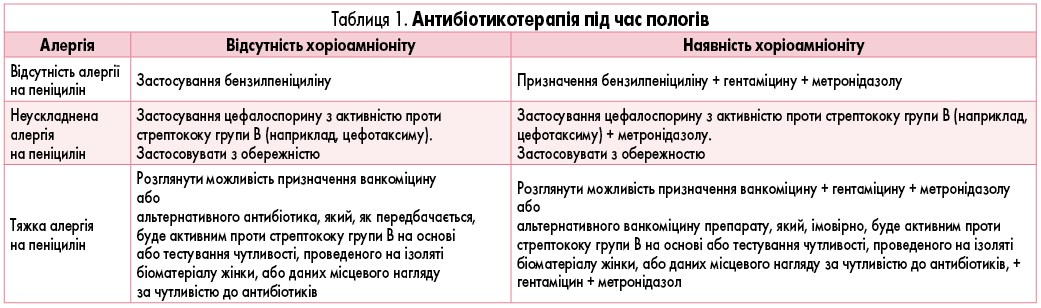
Профілактика раннього неонатального інфікування до народження включає застосування антибактеріальних препаратів під час пологів. Відповідно до рекомендацій Національного інституту охорони здоров’я та удосконалення медичної допомоги (National Institute for Health and Care Excellence, NICE) за 2021 р., пропонувати антибіотики під час пологів необхідно жінкам, які мають хоча б один з перерахованих факторів:
- передчасні пологи;
- підтверджену інфекцію, викликану стрептококом групи В, бактеріурію або інфекцію під час цієї вагітності;
- підтверджену інфекцію, викликану стрептококом групи В, бактеріурію або інфекцію під час попередньої вагітності і не мали негативного тесту на стрептокок групи В шляхом збагачення культури або за допомогою полімеразної ланцюгової реакції (ПЛР) на зразках ректовагінального мазка, зібраних між 35-37-ими тижнями вагітності або за 3-5 тиж до передбачуваної дати пологів при цій вагітності;
- старшу дитину з інвазивною стрептококовою інфекцією групи В;
- клінічний діагноз хоріоамніоніт [4].
Антибіотики, показані з метою профілактики неонатальних інфекцій під час пологів, визначають з урахуванням індивідуальної чутливості вагітної, а також наявності/відсутності хоріоамніоніту (табл. 1). При цьому, відповідно до сучасних гайдлайнів, першу дозу антибіотиків необхідно призначити якомога швидше після початку пологів (або як тільки виникне підозра на інфікування, у разі хоріоамніоніту), продовжуючи застосування до моменту народження дитини. Індукція пологів або кесарів розтин показані жінкам із гестаційним терміном 34-37 тиж вагітності, які мають тривалий передчасний розрив оболонок та інфіковані стрептококом групи В або мають бактеріурію чи явища інфекційного процесу в будь-який час даної вагітності.
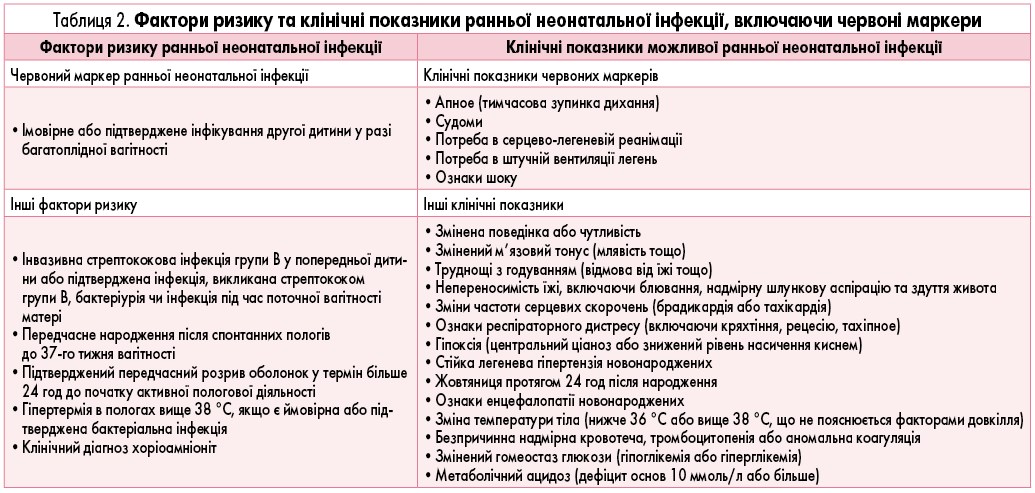
Червоним маркером ранньої неонатальної інфекції є підозрювана або підтверджена інфекція іншої дитини у випадку багатоплідної вагітності. Інші фактори наведені в таблиці 2. Наявність у дитини факторів ризику неонатальної інфекції визначає подальший менеджмент, у тому числі і необхідність призначення антибіотикотерапії. Перед призначенням першої дози антибактеріального препарату у немовлят із можливим розвитком ранньої неонатальної інфекції необхідним є проведення бактеріального посіву крові та визначення вихідного рівня С-реактивного протеїну. У випадку наявності у новонародженого менінгеальних ознак рекомендовано також виконати люмбальну пункцію для отримання зразка ліквору.
Що стосується менеджменту локальних інфекцій, то важливо враховувати, що, хоча незначний кон’юнктивіт може бути частим і зазвичай доброякісним захворюванням, гнійні виділення можуть вказувати на наявність у новонародженого серйозних інфекцій (наприклад, хламідіозу, інфікування гонококом). Так, у новонароджених із гнійними виділеннями з очей терміново рекомендовано взяти мазки на мікробіологічне дослідження, використовуючи методи, що дозволяють ідентифікувати гонококову інфекцію та хламідіоз, та розпочинати системну антибіотикотерапію за можливої гонококової інфекції, очікуючи на результати мікробіологічного дослідження мазка. У немовлят із клінічними ознаками омфаліту, такими як гнійні виділення або ознаки стрептококової інфекції (наприклад, гіперемія, місцева гіпертермія шкіри або набряк), рекомендовано виконати посів крові, взяти зразок мазка для мікроскопії та посіву і розпочати антибіотикотерапію з внутрішньовенного призначення флуклоксациліну та гентаміцину.
 Доктор медичних наук, професор кафедри дитячої хірургії НМАПО ім. П.Л. Шупика Василь Федорович Рибальченко презентував доповідь «Запори у дітей: з чого починати?»:
Доктор медичних наук, професор кафедри дитячої хірургії НМАПО ім. П.Л. Шупика Василь Федорович Рибальченко презентував доповідь «Запори у дітей: з чого починати?»:
– На сьогоднішній день запор є другим за поширеністю розладом травної системи у дітей. Частота цієї патології серед дітей достатньо велика та сягає 30%, причому за наявності супутніх захворювань шлунково-кишкового тракту (ШКТ) вона зростає до 70%. Відповідно до даних J.E. Everhart та C.E. Ruhl (2009), за останнє десятиріччя частота запорів серед дітей збільшилася у 4 рази, найчастіше цим страждають діти віком <15 років [5]. За даними США, діагноз хронічний запор щорічно вперше ставиться у 6,3 млн випадків амбулаторних відвідувань. Разом зі збільшенням поширеності хронічних запорів у популяції значно зросли і фінансові державні витрати. Так, у 2004 р. в США прямі та непрямі капіталовкладення, пов’язані з хронічними запорами, оцінюються в 1,6 млрд доларів [6].
Згідно із сучасним визначенням, дефекація – це складний нервово-рефлекторний акт, який зумовлює просування та евакуацію калових мас. Отже, запор являє собою патологічний стан (синдром), що виражається у тривалій, більш ніж 48-годинній затримці фекальних мас у кишечнику, а також в утрудненому спорожненні останнього, викликаного різними етіологічними чинниками як функціонального, так і органічного характеру. Згідно із сучасними даними, однією з ключових причин розвитку запорів є неадекватно підібране харчування, а саме – недостатня кількість води та волокон, що призводить до формування надто твердих та об’ємних мас, через що дефекація стає болючою та травматичною. Вищезазначені чинники призводять до розвитку у дитини проектогенного больового синдрому – страху перед актом дефекації або, у більш складних випадках, до травматизації (анальних тріщин, геморою).
Відповідно, первинним етапом менеджменту дитини із запором є модифікація харчових звичок, а саме – збалансоване харчування. Також доцільним є додавання до раціону харчових продуктів, які покращують спорожнення кишечнику (кефіру, буряка, чорносливу тощо). Другий етап ведення включає режим туалету. Як відомо, адекватне випорожнення кишечнику у дитини залежить від декількох факторів: зручності приміщення, комфорту під час сидіння, відсутності відволікаючих моментів, положення ніг при сидінні на унітазі, а також відсутності сторонніх сильних шумів, які можуть злякати чи відволікти дитину.
 У рамках конференції була представлена доповідь завідувача кафедри факультетської педіатрії № 1 та медичної генетики ДЗ «Дніпропетровська медична академія Міністерства охорони здоров’я України», доктора медичних наук, професора Олександра Євгеновича Абатурова і доцента кафедри факультетської педіатрії № 1 та медичної генетики ДЗ «Дніпропетровська медична академія Міністерства охорони здоров’я України», кандидата медичних наук Володимира Олександровича Дитятковського, в якій ключовий аспект було зміщено на предиктори ризику розвитку моно- та поліорганних фенотипів атопічних захворювань (АЗ) у дітей:
У рамках конференції була представлена доповідь завідувача кафедри факультетської педіатрії № 1 та медичної генетики ДЗ «Дніпропетровська медична академія Міністерства охорони здоров’я України», доктора медичних наук, професора Олександра Євгеновича Абатурова і доцента кафедри факультетської педіатрії № 1 та медичної генетики ДЗ «Дніпропетровська медична академія Міністерства охорони здоров’я України», кандидата медичних наук Володимира Олександровича Дитятковського, в якій ключовий аспект було зміщено на предиктори ризику розвитку моно- та поліорганних фенотипів атопічних захворювань (АЗ) у дітей:
– Загальновідомо, що АЗ у педіатричних пацієнтів з віком мають тенденцію до прогресії з моно- до поліорганних клінічних фенотипів [7]. Зокрема, у дослідженні L. Yang та співавт. (2020) було визначено, що АЗ мають тенденцію до поширення по вісі «шкіра – слизові оболонки – респіраторний тракт/очі» [8]. При цьому сучасні дані свідчать, що, наприклад, на виникнення та прогресію атопічного дерматиту в алергічний риніт/алергічний ринокон’юнктивіт та бронхіальну астму найбільший вплив мають генотип людини та його патологічні зміни [9]. Дані попередніх клінічних досліджень продемонстрували фундаментальну роль у розвитку всіх основних топографічних форм АЗ у моно- або поліорганних сполучень фаліргіну (FLG), тимічного стромального лімфопоетину (TSLP) та орсомукоїду-1-подібного білка 3 (ORMDL3) [10-11]. У 2021 р. були презентовані результати вітчизняного дослідження, в якому доведено роль однонуклеотидних варіантів (SNV) rs_7927894 гену FLG, rs_7216389 гену TSLP та rs_11466749 гену ORMDL3 [12].
У рамках доповіді спікер презентував результати власного дослідження, в якому оцінювалася роль генотипних комбінацій SNV rs_7927894 FLG, rs_7216389 TSLP та rs_11466749 ORMDL3 у ризику розвитку фенотипів АЗ у дітей. Загалом до дослідження було включено 398 дітей з АЗ (від 3 до 18 років), яких рандомізували на 2 групи: перша (основна) включала 293 дитини, друга (контрольна) – 105 дітей. Критеріями включення до основної групи були встановлений діагноз АЗ у моно- та поліорганних фенотипах. Критеріями виключення були відсутність встановленого діагнозу АЗ, вік <3 або >18 років. Усім пацієнтам було зроблено генотипування на SNV С/С, С/Т, Т/Т FLG rs_7927894, А/А, A/G, G/G TSLP rs_11466749 та С/С, С/Т, Т/Т ORMDL3 rs_7216389. Згідно з отриманими результатами, генотипні комбінації С/Т rs_7927894 FLG + Т/Т rs_7216389 ORMDL3, С/Т rs_7927894 FLG + Т/Т rs_7216389 ORMDL3 та С/Т rs_7927894 FLG + A/A TSLP rs_11466749 є достовірними предиктивними панелями щодо розвитку моно- та поліорганних фенотипів АЗ у дітей. Тобто отримані результати визначили, що впровадження предиктивних генотип-панелей у клінічну практику покращить персоналізацію прогнозу прогресії фенотипів АЗ у дітей.
 Завідувачка кафедри медичної генетики, доцент кафедри медичної генетики Харківського національного медичного університету, доктор медичних наук, лауреат державної премії в галузі науки і техніки Президента України для молодих науковців, президент благодійного фонду «Україна – дітям Харківщини» Юлія Борисівна Гречаніна презентувала доповідь «Клінічні ознаки, діагностика, терапія та профілактика хвороби Канавана у дітей»:
Завідувачка кафедри медичної генетики, доцент кафедри медичної генетики Харківського національного медичного університету, доктор медичних наук, лауреат державної премії в галузі науки і техніки Президента України для молодих науковців, президент благодійного фонду «Україна – дітям Харківщини» Юлія Борисівна Гречаніна презентувала доповідь «Клінічні ознаки, діагностика, терапія та профілактика хвороби Канавана у дітей»:
– Хвороба Канавана ван Богарта-Бертранда, відома також як спонгіозна дегенерація головного мозку, недостатність аспартоацилази, являє собою прогресуюче спадкове нейродегенеративне захворювання (відноситься до групи лейкодистрофій) з аутосомно-рецесивним типом успадкування. Перебіг хвороби тяжкий за рахунок вираженої неврологічної симптоматики. Вперше хвороба описана в 1931 р. американським нейропатологом Міртел Мей Кеневен, яка опублікувала патологічну картину захворювання у шістнадцятимісячної дитини. Однак дефектний ген, що її провокує, був виділений тільки в 1991 р. американським професором педіатрії Рубеном Маталоном.
Хвороба Канавана провокується порушенням діяльності ASPA геному, розташованого у 17-й хромосомі. Як наслідок даного генетичного відхилення, знижується синтез ферменту аспартоацилази, ферменту, що сприяє розщепленню N-ацетил-аспарагінової кислоти (NAA) на аспартат та ацетат. Відповідно, зниження аспартоацилази призводить до неконтрольованого накопичення NAA і дефіциту ацетату та аспартату. NAA широко поширена у головному мозку, гідроліз аспартоацилазою допомагає підтримувати білу речовину. Таким чином, патогенез захворювання пов’язаний із дефіцитом аспартату, ацетату і накопичення в ЦНС NAA, що призводить до формування набряку і губчастої дегенерації білої та сірої речовини головного мозку.
Сьогодні виділяють 2 форми хвороби Канавана залежно від типу мутації: типову (класичну) та атипову, що виникає при наявності компаунд-гетерозиготності (на гомологічних хромосомах присутні в одному і тому ж локусі 2 різних мутантних алеля). Атипова форма клінічно супроводжується відсутністю грубих рухових порушень та тяжкої затримки розвитку, а також більш тривалим життям. Окрім того, виокремлюють клінічні форми хвороби залежно від віку початку захворювання: неонатальну, ювенільну та пізню. У більшості випадків спостерігається саме неонатальна форма хвороби Канавана. Діти народжуються клінічно здоровими, після чого триває період благополуччя, однак у віці 3-5 місяців починають розвиватися клінічні симптоми, які включають мікроцефалію, атрофію зорових нервів, епісиндром, гіпотонію, гіпертонус тощо.
Що стосується лікування хвороби Канавана, наразі розробляються новітні підходи до терапії цієї патології. Зокрема, одним із перспективних методів лікування є генотерапія, яка полягає у клонуванні здорового гена (здатного замінити дефектний ген) і впровадження його в організм хворого. Стандартні підходи до лікування педіатричних пацієнтів цієї групи включають застосування цитрату літію, ацетату кальцію та сукцинату натрію, а також замісну терапію гліцерилацетатом. Також цій групі пацієнтів показана біохімічна корекція метаболічного фону.
 Завідувач кафедри клінічної фармакології та клінічної фармації Національного медичного університету ім. О.О. Богомольця (Київ), доктор медичних наук, професор Микола Валентинович Хайтович звернув увагу учасників конференції на питання адміністрування антимікробних препаратів у дітей:
Завідувач кафедри клінічної фармакології та клінічної фармації Національного медичного університету ім. О.О. Богомольця (Київ), доктор медичних наук, професор Микола Валентинович Хайтович звернув увагу учасників конференції на питання адміністрування антимікробних препаратів у дітей:
– Говорячи про лікарські засоби, важливо зазначити, що окрім користі, вони можуть нести і ряд шкідливих впливів. Сучасні дані свідчать, що внаслідок лікарських помилок, зокрема неправильного призначення лікарських засобів, тільки в США щорічно страждає близько 1,3 млн осіб. За частотою летальних випадків неправильне застосування ліків забирає життя 1 особи щодня. Враховуючи актуальність проблеми, Всесвітня організація охорони здоров’я (ВООЗ) у 2017 р. поставила амбітне завдання – за 5 років вдвічі зменшити смертність внаслідок неправильного застосування ліків [13].
Однією з глобальних проблем, які існують у сфері застосування лікарських засобів, є питання нераціональної антибіотикотерапії, що має пряму асоціацію зі зростанням резистентності збудників до антимікробних засобів. У 2022 р. були оприлюднені результати систематичного аналізу Глобального тягаря резистентності бактерій до антимікробних препаратів за 2019 р. [14]. На основі отриманих у систематичному аналізі прогностичних статистичних моделей було зафіксовано 4,95 млн смертей, пов’язаних із резистентністю бактерій до антимікробних агентів. Шість провідних патогенів, пов’язаних із резистентністю (Escherichia coli, Staphylococcus aureus, Klebsiella pneumoniae, Streptococcus pneumoniae, Acinetobacter baumannii та Pseudomonas aeruginosa), спричинили 929 000 (660 000-1 270 000) смертей. Згідно з отриманими даними, проблема антибіотикорезистентності наявна в усіх куточках світу. У 2020 р. І.Г. Березняков опублікував дослідження щодо оцінки стану АБР в Україні, порівнюючи вітчизняні дані з даними європейських країн [15]. Результати дослідження визначили, що в Україні поширеність резистетності в десятки разів вища, ніж у сусідніх європейських державах, у тому числі Польщі, Угорщині та Румунії. Тому питання впровадження раціонального використання антимікробних засобів з метою боротьби із АБР є вкрай актуальним у нашій країні [16, 17].
Список літератури знаходиться в редакції.
Підготувала Анна Хиць
Тематичний номер «Педіатрія» № 5 (66) 2022 р.