28 лютого, 2024
Застосування арипіпразолу в лікуванні резистентної депресії
 Депресія – це тяжка й поширена хвороба, яка уражає понад 300 млн осіб у всьому світі та вважається однією з найвагоміших проблем громадського здоров’я у ХХІ столітті (WHO, 2017). Інвалідизувальна природа депресії призводить до низки професійних, економічних, соціальних та особистих несприятливих наслідків (Thompson C., 2010). Протягом останніх років кількість випадків депресії значно зросла, перевантажуючи систему охорони здоров’я (Cipriani A. et al., 2018).
Депресія – це тяжка й поширена хвороба, яка уражає понад 300 млн осіб у всьому світі та вважається однією з найвагоміших проблем громадського здоров’я у ХХІ столітті (WHO, 2017). Інвалідизувальна природа депресії призводить до низки професійних, економічних, соціальних та особистих несприятливих наслідків (Thompson C., 2010). Протягом останніх років кількість випадків депресії значно зросла, перевантажуючи систему охорони здоров’я (Cipriani A. et al., 2018).
Проблема резистентної депресії
Існує кілька класів антидепресантів (АД): селективні інгібітори зворотного захоплення серотоніну (СІЗЗС), селективні інгібітори зворотного захоплення серотоніну та норадреналіну (СІЗЗСН), трициклічні антидепресанти (ТЦА), норадренергічні та серотонінергічні АД, інгібітори моноамінооксидази (ІМАО) (Taylor D. M. et al., 2018). Однак, незважаючи на такий широкий арсенал засобів, лише третина пацієнтів досягає ремісії після лікування СІЗЗС і 25-27% – після подальшого призначення АД іншого класу. Отже, значна частина пацієнтів – близько 40% – належить до осіб із резистентною до лікування депресією (РД) (Rush A. J. et al., 2009). Незадовільна відповідь на лікування депресії асоціюється з підвищенням ризику звільнення з роботи, ізоляції від соціуму та самогубств (Nemeroff C. B., 2007).
РД супроводжується достовірно вищими витратами на лікування, щонайменше на 12% частішими амбулаторними візитами, в 1,4-3 рази більшою кількістю необхідних психотропних препаратів і вдвічі вищим ризиком госпіталізації порівняно з нерезистентними до фармакотерапії депресивними розладами. Сумарні медичні витрати на лікування госпіталізованих осіб із РД перевищують показники для нерезистентної депресії вшестеро, а загальні медичні витрати протягом життя – в 19 разів. За даними польських дослідників, частка випадків РД серед усіх дорослих пацієнтів із наявним натепер епізодом депресії становить 25,2%. Автори зазначають, що таким пацієнтам зазвичай призначають монотерапію АД і лише після третьої невдачі розпочинають рекомендувати комбінації препаратів (Galecki P. et al., 2022).
Чинниками ризику РД виступають ранній вік початку депресії, велика кількість депресивних епізодів протягом життя, більша тривалість депресивних епізодів, наявність психотичних симптомів і анамнез психіатричних госпіталізацій. Відсутність відповіді на перший призначений АД підвищує ризик розвитку РД протягом життя у 3,3 раза, а наявність коморбідних тривожних розладів, передусім панічних розладів і соціофобії, – в 4,2 раза (Bennabi D. et al., 2015). Із РД також асоціюються психіатричні коморбідні стани (посттравматичний стресовий розлад, розлади особистості та зловживання речовинами) й фонові соматичні хвороби (больовий синдром, ендокринопатії, серцево-судинні захворювання, неврологічні хвороби та вітамінодефіцити), а також різноманітні порушення сну (обструктивне апное сну, безсоння, синдром неспокійних ніг). Для успішного лікування РД має ключове значення повторний перегляд діагнозу з метою виключення розладів біполярного спектра, а також одночасна терапія всіх наявних у пацієнта психіатричних і соматичних патологій (Chopra A. et al., 2023).
Для адекватної оцінки РД потрібне правильне розуміння всіх споріднених із цим поняттям термінів (табл. 1).
|
Таблиця 1. Термінологія для визначення РД |
|
|
Відсутність терапевтичної відповіді |
Недостатня терапевтична відповідь зі значними залишковими симптомами; потрібна зміна плану лікування (<50% редукції симптомів депресії за шкалою HAM-D) |
|
Терапевтична |
Відповідь, що є досить значною; не потребує зміни плану лікування (≥50% редукції симптомів депресії за шкалою HAM-D) |
|
Ремісія |
Досягнення практично безсимптомного стану (HAM-D ≤7 балів) протягом принаймні 2 тиж поспіль |
|
Видужання |
Ремісія протягом 6 міс поспіль |
|
Відносна резистентність до лікування |
Відсутність відповіді на адекватну дозу потенційно ефективних ліків протягом достатнього періоду часу |
|
Абсолютна резистентність до лікування |
Відсутність відповіді на максимальній дозі одного препарату тривалий період часу |
|
Лікування РД |
Відсутність терапевтичної відповіді (збереження значних депресивних симптомів), |
|
Адекватна доза |
Пероральна доза, яка близька до рекомендованої максимальної дози відповідно |
|
Адекватна |
Щонайменше 4 тиж лікування поспіль, коли пацієнт приймав адекватну дозу протягом принаймні 3 тиж |
|
Непереносимість АД |
Неможливість досягнення або підтримання адекватної терапевтичної дози АД через |
|
Примітка: HAM-D – шкала оцінки депресії Гамільтона. |
|
Позиція Українського уніфікованого клінічного протоколу «Депресія» щодо неповної відповіді на лікування чи її відсутності
Зазвичай антидепресивний ефект фармакотерапії розвивається на 2-4-му тижні або пізніше, причому більш рання (1-2-й тиждень) відповідь на терапію корелює з повнішим досягненням ремісії. У пацієнтів, у яких виявляють незначне покращення (на <20% за шкалою оцінки депресії) після 2 тиж прийому АД, варто вносити зміни до терапії, наприклад підвищувати дозу препарату.
Досягнення та підтримка симптоматичної ремісії – перший необхідний крок на шляху до функціонального одужання, проте майже у ⅔ пацієнтів після прийому першого АД повна ремісія не настає. Якщо після підвищення дози АД покращення відсутнє, першим кроком має бути перегляд діагнозу (оцінка біполярності, підтипу депресії, супутніх розладів, зловживання психоактивними речовинами) та лікування (прихильності, побічних реакцій, суїцидальних намірів).
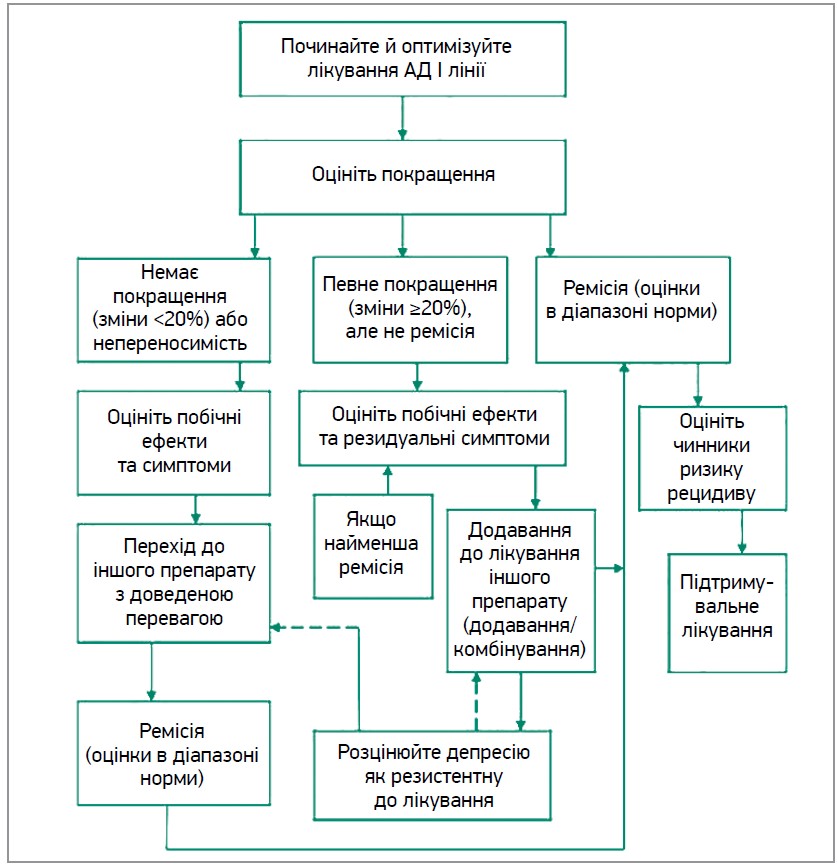
Зважаючи на відсутність загальновизнаної дефініції РД, найчастіше використовується така: невдалий результат після адекватних спроб терапії ≥2 АД. Варіанти терапії РД включають додавання психотерапії з доведеною ефективністю, перехід до нейростимулювального лікування (електроконвульсивної терапії чи транскраніальної магнітної стимуляції) та низку фармакологічних стратегій. До найпоширеніших з останніх належить переведення на монотерапію іншим АД або додавання інших препаратів до першого АД (рис. 1). Слід зауважити, що термін «додавання» («потенціювання», «аугментація») стосується включення в комплексну терапію медикаментів, які не є АД (літій, атипові антипсихотики, тиреоїдні гормони), натомість термін «комбінація» передбачає додавання іншого АД до першого.
Рис. 1. Алгоритм ведення пацієнта з недостатньою відповіддю на лікування АД І лінії
Стратегії лікування РД
Стандартний підхід до лікування РД відсутній, тому пацієнт із таким станом потребує індивідуалізованого плану лікування. Під час ведення пацієнтів із РД потрібно дотримуватися таких етапів:
- визначити точний діагноз, у тому числі підтип депресії (тривожна, тужлива, меланхолійна тощо);
- оцінити супутні психічні та соматичні захворювання;
- визначити значущі соціально-психологічні стресорні чинники, а також ступінь соціальної та сімейної підтримки;
- забезпечити адекватну дозу та тривалість лікування;
- проводити моніторинг і лікування побічних ефектів;
- провести психоосвіту пацієнта щодо депресії та дії АД;
- забезпечити терапевтичний альянс із пацієнтом, прагнучи досягти ремісії.
Існує 5 основних стратегій ведення пацієнтів із РД (табл. 2), які використовуються для подолання часткової терапевтичної відповіді або відсутності відповіді на терапію АД, а саме: оптимізація лікування, заміна АД, поєднання двох АД, аугментація лікування та немедикаментозна терапія. Комплексний підхід передбачає різні комбінації перелічених стратегій (Хаустова О., 2017).
|
Таблиця 2. Стратегії лікування РД |
|
|
Оптимізація АД |
Фактично підтверджена терапія в максимальній дозі протягом достатнього часу, верифікована рівнем концентрації цього АД в сироватці крові |
|
Заміна АД |
Перехід від одного АД, що виявився неефективним, до інших препаратів того самого класу або до АД іншого класу; із СІЗЗС/СІЗЗСН до ТЦА, ІМАО й атипових нейролептиків з антидепресивними властивостями |
|
Поєднання АД |
Додавання ще одного АД з різних класів, наприклад ТЦА + ІМАО, СІЗЗС + ТЦА, СІЗЗС + атиповий АД, СІЗЗС + буспірон тощо |
|
Аугментація (додавання відмінного від АД препарату) |
Додавання другого препарату, який не є АД, але може посилити антидепресивний ефект АД, наприклад літій, гормони щитоподібної залози, піндолол, психостимулятори, атипові антипсихотичні препарати, статеві гормони, протисудомні / стабілізатори настрою, агоністи допаміну |
|
Немедикаментозна терапія |
Електросудомна терапія, стимуляція блукального нерва, транскраніальна магнітна стимуляція, глибока стимуляція мозку |
|
Комплексний підхід |
Застосування АД разом з іншими видами лікування, що включають психотерапію, стратегії управління ризиками, зміни способу життя, як-от фізичні вправи й активний відпочинок |
|
Підхід із додатковими засобами |
Використання додаткових препаратів для зменшення побічної дії АД, а також для підвищення загальної ефективності терапії |
|
Нейрохірургічні |
При окремих особливо тяжких випадках РД |
Обираючи стратегію лікування РД, варто враховувати такі чинники:
- відповідь пацієнта на попередній курс лікування (часткова, відсутня);
- особливості клінічної симптоматики;
- вираженість побічних ефектів на певний клас АД;
- спектр нейрохімічної активності та побічні ефекти лікарських засобів, які планується застосувати;
- рівень доказовості даних щодо їхньої ефективності;
- прихильність хворого до терапії;
- наявність супутньої патології (Хаустова О., 2017).
Особливу увагу лікарів привертає саме стратегія аугментації, важливою перевагою якої є відсутність періоду переходу з одного АД на інший і можливість зберегти хоча б часткову відповідь, отриману на перший АД (Fleurence R. et al., 2009). Окрім того, порівняно із заміною стартового АД аугментація забезпечує швидший результат. Найпотужнішу доказову базу за відсутності відповіді на СІЗЗС чи СІЗЗСН має аугментація атиповими антипсихотиками (арипіпразол, брекспіпразол, оланзапін, кветіапін). Оптимальний препарат слід обирати на підставі скарг і анамнезу пацієнта: наприклад, арипіпразол найкраще підходить для осіб з ангедонією та відсутністю мотивації (Cowen P., 2017).
Наразі найпопулярнішими препаратами для аугментації виступають сульпірид, кветіапін і арипіпразол. Сульпірид широко застосовують для корекції поєднаних тривожно-депресивних розладів, але його вплив саме на депресивну симптоматику й іпохондричні прояви (ознаки маскованої депресії) є суперечливим. Окрім того, сульпірид здатен провокувати збудження, дискінезії, артеріальну гіпотензію, сонливість, інсомнію, запаморочення, диспепсичні розлади, ендокринні та метаболічні порушення. У зв’язку із цим призначення сульпіриду для аугментації лікування депресій потребує ретельної оцінки співвідношення ризику й користі та не показане певним категоріям пацієнтів (із хворобою Паркінсона, гіперкінезами, судомними розладами, метаболічним синдромом, артеріальною гіпер- і гіпотензією), а також особам похилого та старечого віку. Своєю чергою, кветіапін використовується переважно за наявності поєднаних тривожних та інсомнічних порушень, але більшість доказової бази ефективності цього препарату ґрунтується на короткострокових дослідженнях. У разі використання кветіапіну часто спостерігається відмова від лікування через виражені побічні ефекти (надмірну седацію, сонливість, головний біль, сухість у роті, затримку сечовипускання, порушення когнітивних функцій тощо). Загалом кветіапін спрямований переважно на корекцію тривожності, ажитації, порушень сну, а не власне на депресію, тому його роль у стратегії аугментації, особливо при довготривалому застосуванні, є спірною. Отже, на провідну позицію серед інструментів аугментації антидепресивної терапії виходить арипіпразол (Бурчинський С. Г., 2020).
Портрет пацієнта, для котрого буде оптимальною аугментація арипіпразолом, є таким: поточний епізод тривалістю понад 3 міс тужливої, меланхолійної депресії з апатією, зниженням життєвого тонусу та щоденної активності без значущих тривожних ознак у пацієнта, зокрема похилого віку з можливими соматичними захворюваннями (серцево-судинними, метаболічними, неврологічними) (Хаустова О. О., 2017).
Арипіпразол у лікуванні РД
Арипіпразол являє собою атиповий антипсихотичний препарат із високою афінністю до дофамінових рецепторів D2 та D3, а також до серотонінових рецепторів 5-HT1A, 5-HT2 та 5-HT2B (Leysen J. E. et al., 2003). Унікальний механізм дії арипіпразолу полягає в тому, що як частковий допаміновий агоніст цей препарат діє як агоніст у разі низького рівня допаміну та як антагоніст у разі високого рівня, таким чином підтримуючи функціонування допамінозалежних систем мозку на оптимальному рівні незалежно від вихідних умов (Rege S., 2017).
Завдяки описаній вище частковій агоністичній активності арипіпразолу стосовно D2-рецепторів цьому препарату притаманна менша ймовірність розвитку екстрапірамідних симптомів. Унікальний механізм дії дає арипіпразолу змогу мати не лише малу ймовірність індукції гіперпролактинемії, а й здатність нормалізувати підвищені внаслідок прийому інших антипсихотиків рівні пролактину. Арипіпразол є ефективним за тривожності, депресії, а також когнітивних і негативних симптомів (завдяки антагонізму до 5-HT2-рецепторів). Натомість афінність арипіпразолу до ацетилхолінових мускаринових рецепторів є низькою, що зумовлює низький потенціал виникнення когнітивної дисфункції, закрепів і ксеростомії. Арипіпразол також не має потужного седативного ефекту у зв’язку з незначним антагоністичним ефектом щодо H1-гістамінових рецепторів (Veznedaroglu B. et al., 2018).
Арипіпразол здатен ефективно підсилити лікування в разі незадовільної відповіді на АД. У порівняльному дослідженні арипіпразолу з’ясувалося, що цей препарат забезпечує пацієнтам із депресією кращу якість життя порівняно з іншими антипсихотичними засобами II покоління (Kalsekar I. et al., 2012). Проспективне багатоцентрове дослідження показало, що додавання арипіпразолу до АД зменшувало середню оцінку за шкалою оцінки депресії Монтгомері – Асберг (MADRS) в осіб із великими депресивними розладами та неадекватною відповіддю на АД на 14,0 пункту. Частка відповіді на лікування на тлі додавання арипіпразолу зростала на 52,3%, а частота досягнення ремісії – на 39,8% (Jon D. I. et al., 2013).
За даними кокранівського огляду, ефективність арипіпразолу відповідає показникам клозапіну, кветіапіну, рисперидону, зипрасидону й оланзапіну. Застосування арипіпразолу асоціюється з меншою частотою екстрапірамідних симптомів порівняно з іншими антипсихотиками та рідше спричиняє набір ваги й передчасне припинення лікування, ніж оланзапін (Khanna P. et al., 2014). C. Han і співавт. (2014) порівняли три стратегії лікування великих депресивних розладів, які не відповідали на терапію АД: додавання арипіпразолу, призначення комбінації АД та зміну АД. Додавання арипіпразолу виявилося найефективнішою стратегією (Han C. et al., 2014).
Метааналіз 8 рандомізованих клінічних досліджень (n=2260) продемонстрував, що додавання арипіпразолу до комплексної терапії РД асоціювалося з достовірно частішим досягненням ремісії (відношення шансів 1,64; 95% довірчий інтервал 1,42-1,89; р<0,001) та часткою відповіді (відношення шансів 1,45; 95% довірчий інтервал 1,13-1,87; р=0,004), ніж інші види лікування. Крім того, включення в лікування арипіпразолу забезпечувало покращення стану пацієнтів за низкою оціночних шкал: MADRS, шкалою глобального клінічного враження (Clinical Global Impression, субшкали тяжкості захворювання та покращення стану пацієнта), шкалою депресії Гамільтона (HAM-D17), шкалою інвалідності Шихана (SDS) та опитувальником депресивної симптоматики для самостійного заповнення (IDS-SR) (Luan S. et al., 2018).
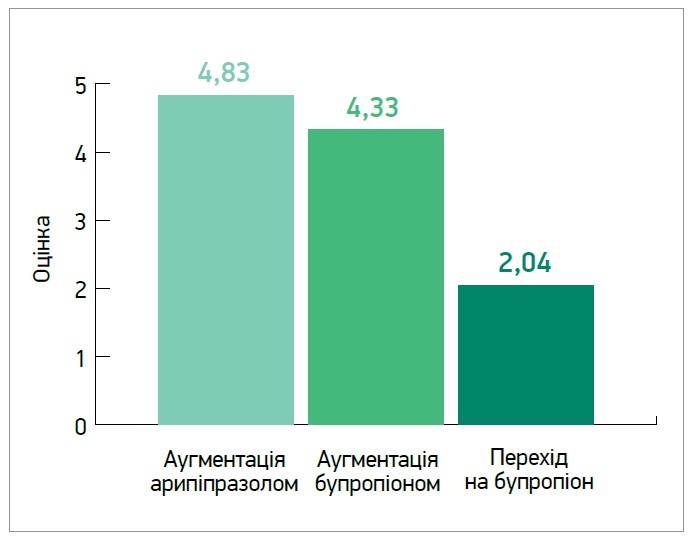
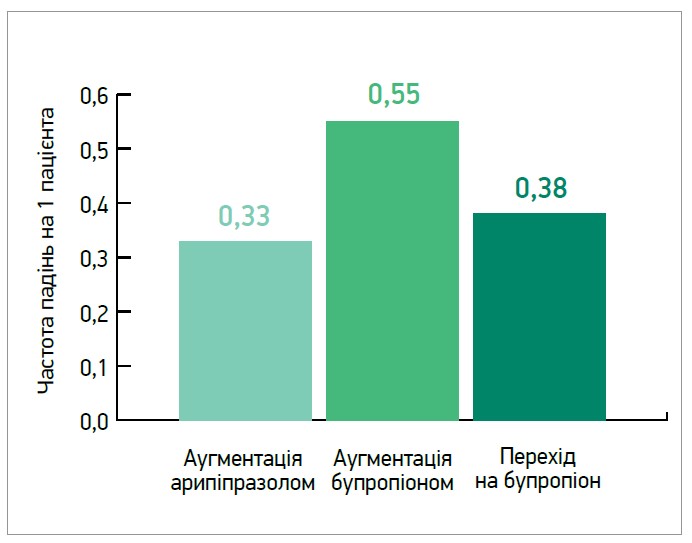
Арипіпразол відіграє особливо важливу роль у лікуванні геріатричної депресії. Зокрема, в дослідженні E. J. Lenze та співавт. (2023) дорослих пацієнтів віком ≥60 років із РД рандомізували в три групи: аугментації поточного лікування АД арипіпразолом, аугментації бупропіоном або заміни поточного АД на бупропіон. У результаті цих змін показники хорошого самопочуття зросли на 4,83; 4,33 та 2,04 пункту відповідно (рис. 2). Ремісії вдалося досягти у 28,9% пацієнтів групи аугментації арипіпразолом, у 28,2% осіб групи аугментації бупропіоном і в 19,3% учасників групи переходу на бупропіон. Частота такого значущого в цій віковій групі побічного ефекту, як падіння, була найвищою в групі аугментації бупропіоном, а найменшою – в групі аугментації арипіпразолом (рис. 3). Автори дійшли висновку, що в осіб похилого віку з РД аугментація поточного лікування АД вираженіше покращувала самопочуття та частіше забезпечувала ремісію, ніж перехід на бупропіон (Lenze E. J. et al., 2023).
Рис. 2. Покращення психічного самопочуття на тлі різної тактики лікування
Рис. 3. Частота падінь на тлі різної тактики лікування
Застосування арипіпразолу в умовах незадовільної відповіді на АД
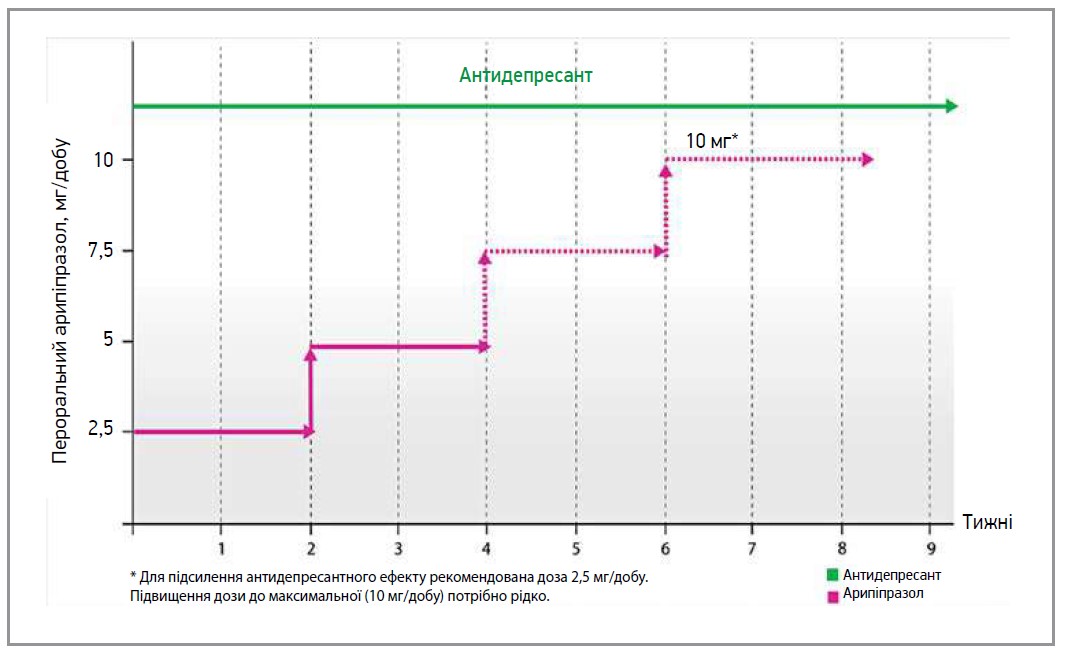
Мультидисциплінарна робоча група, присвячена застосуванню арипіпразолу та переходу на цей препарат з інших антипсихотиків, сформулювала низку рекомендацій із цих питань у різних клінічних ситуаціях. Алгоритм уведення арипіпразолу в комплексне лікування депресії представлено на рисунку 4. Якщо відповідь на терапію АД є незадовільною, додавання атипового антипсихотичного засобу (арипіпразолу, кветіапіну або оланзапіну) вважається найпоширенішою та найефективнішою стратегією. При додаванні арипіпразолу слід обирати дозу 2,5-10 мг/добу. Розпочинати потрібно з 2,5 мг/добу (на додачу до АД), а за потреби підвищити до 10 мг/добу шляхом підвищенням на 2,5 мг що 2 тиж (Veznedaroglu B. et al., 2018).
Рис. 4. Схема додавання арипіпразолу в разі незадовільної відповіді на АД
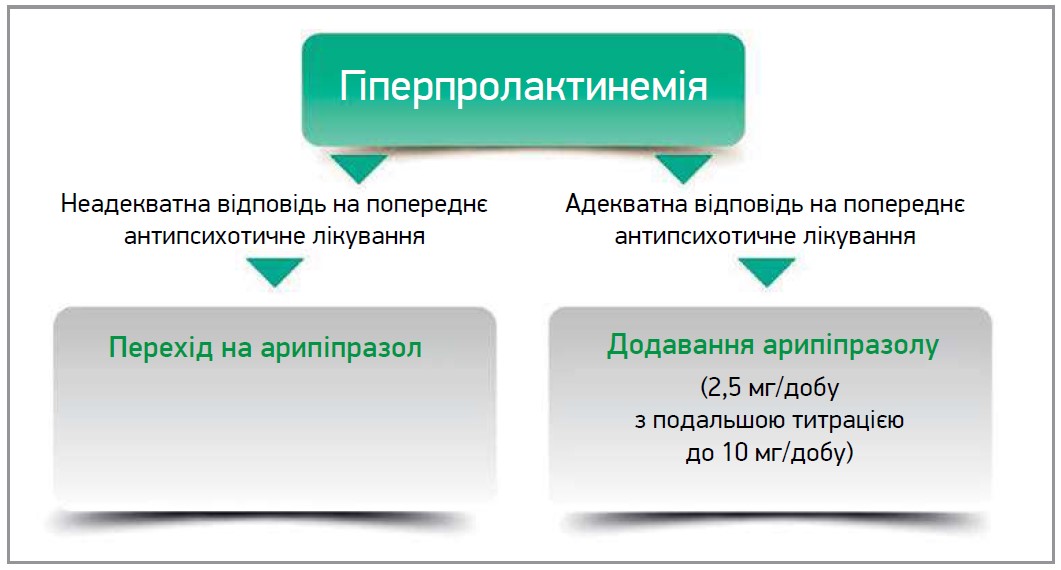
Частим побічним ефектом антипсихотичних засобів II покоління є гіперпролактинемія, котра може призводити до аменореї та галактореї в жінок і гінекомастії в чоловіків, а також спричиняти побічні ефекти в сексуальній сфері й остеопороз у обох статей. У разі гіперпролактинемії на тлі прийому антипсихотиків слід розглянути перехід на арипіпразол або додавання цього препарату. Доцільним є додавання низьких доз арипіпразолу (2,5 мг/добу) з підвищенням (за потреби) до 10 мг/добу (рис. 5).
Рис. 5. Застосування арипіпразолу при гіперпролактинемії, асоційованій із прийомом антипсихотиків
Загалом арипіпразолу притаманний найсприятливіший профіль щодо метаболічного тла. Цей препарат також вважається безпечним з погляду кардіоваскулярної безпеки, оскільки має найнижчий ризик подовження корегованого інтервалу QT і розвитку ішемічної хвороби серця. Серед усіх антипсихотиків арипіпразол асоціюється з найнижчою частотою побічних ефектів із боку статевої сфери та, як уже було сказано, не спричиняє когнітивних і негативних симптомів, не чинить седативної дії. У зв’язку з позитивним профілем безпеки арипіпразол часто є гідною альтернативою в разі виникнення побічних ефектів терапії іншими АД, зокрема метаболічних (збільшення маси тіла, дисліпідемія, порушення толерантності до глюкози) та когнітивних (Veznedaroglu B. et al., 2018).
Оптимальна доза арипіпразолу для аугментації терапії РД
Тож уже не викликає сумнівів, що аугментація арипіпразолом є успішною та безпечною стратегією ведення пацієнтів із РД. Що стосується оптимальної дози, то метааналіз 10 рандомізованих контрольованих досліджень (n=2625) виявив, що оптимальна крива залежності «доза – ефективність» спостерігалася для доз у діапазоні від 2 до 5 мг. Для більших доз (до 20 мг) зростання ефективності при збільшенні дози зафіксовано не було. Аналогічна тенденція спостерігалася й для переносимості: найкращою вона була для доз 2-5 мг. Отже, застосування арипіпразолу в низьких дозах дає змогу досягти оптимального балансу між ефективністю та переносимістю (Furukawa Y. et al., 2021).
Аналогічного погляду дотримується й наведений вище консенсус, у якому вказується, що аугментація арипіпразолом передбачає дозовий діапазон 2,5-10 мг/добу зі стартом із 2,5 мг/добу та підвищенням до 10 мг/добу (за потреби) шляхом збільшення на 2,5 мг що 2 тиж (Veznedaroglu B. et al., 2018).
Висновки
1. Резистентна до лікування депресія – поширена та вагома проблема. Для її вирішення рекомендована ціла низка стратегій: збільшення дози АД, заміна АД, додавання до лікування іншого АД або препарату іншого класу, немедикаментозна терапія тощо.
2. Стратегія аугментації (підсилення) лікування препаратом іншого класу продемонструвала переваги в клінічних дослідженнях. Із цією метою може застосовуватися атиповий антипсихотичний препарат арипіпразол, якому притаманні висока ефективність і відмінний профіль безпеки.
3. При включенні до комплексного лікування РД арипіпразолу цей препарат призначається в дозі 2,5 мг/добу, за потреби дозу підвищують на 2,5 мг/добу 1 раз на 2 тиж до досягнення дози 10 мг/добу.