17 квітня, 2021
Перші результати міжнародного багатоцентрового клінічного дослідження RheoSTAT-CP0698 щодо ефективності та безпеки інфузійного розчину Реосорбілакт® у комплексній терапії пневмонії
Незважаючи на значні успіхи в діагностиці та лікуванні, показники летальності від пневмонії за останні 30 років істотно не змінилися [1]. Від 5 до 15% госпіталізованих пацієнтів помирають упродовж 30 днів [2], а у відділеннях інтенсивної терапії (ВІТ) смертність сягає 17-48% [3]. Адекватне й ефективне лікування пневмонії тяжкого перебігу особливо актуальне в умовах сьогодення, при цьому найпроблемнішими є питання інфузійної терапії.
Здебільшого лихоманка й інтенсивніша перспірація успішно корегуються оральним введенням рідини, проте за тяжкого стану пацієнта це не завжди можливо, що спричиняє гіповолемію. На додаток у відповідь на бактеріальні екзо- й ендотоксини, а також під впливом ендогенних цитокінів і гістаміну з’являється вазоплегічна вазодилатація, що зумовлює артеріальну гіпотензію та септичний шок, адже пневмонія – це найчастіша причина сепсису [4]. За даними нещодавнього багатоцентрового дослідження, сепсис і септичний шок ускладнюють перебіг у ⅓ пацієнтів, госпіталізованих щодо пневмонії [5]. Системну гіповолемію спричиняє також феномен «витоку з капілярів», зумовлений дисфункцією ендотелію та підвищеною проникністю судинної стінки через ушкодження глікокаліксу. Ендотеліальний глікокалікс – це матриця зв’язаних із мембраною глікопротеїнів і протеогліканів на внутрішній поверхні ендотеліоцитів розміром від 0,2 до 8 мкм, що утримує (як губка) від 700 до 1500 мл внутрішньосудинної рідини [6]. У капілярах глікокаліксний шар відіграє роль напівпроникного бар’єра, що запобігає проникненню великих молекул, зокрема альбуміну, через щілини між ендотеліальними клітинами. Саме глікокалікс відповідає за встановлення онкотичного градієнта, котрий чинить опір гідростатичному тиску. Відповідно до перегляду принципу Старлінга з урахуванням моделі ендотеліального глікокаліксу, підвищення онкотичного тиску плазми протидіє фільтрації рідини з внутрішньосудинного до інтерстиційного простору, але не спричиняє повернення рідини назад до судини [7]. Здебільшого вода з позаклітинного матриксу повертається у внутрішньосудинний простір через лімфатичну систему [8]. У разі тяжких інфекцій і сепсису фактор некрозу пухлини зумовлює активацію ядерного чинника κB та ушкодження ендотелію, а ліпополісахариди за механізмом окисного стресу ушкоджують глікокалікс [9, 10]. Ушкодження глікокаліксу можливе в разі низки хронічних захворювань, зокрема при цукровому діабеті [11], а коморбідність, як відомо, є одним із позалегеневих чинників, які визначають тяжкість пневмонії.
Отже, рідка частина крові переміщується в інтерстиційний позаклітинний простір. На цьому етапі запускається хибне коло: порушується транспорт кисню в самих легенях, зумовлюючи або поглиблюючи респіраторний дистрес, посилюються гіповолемія та гіпоперфузія органів і тканин, що спричиняє чи підсилює поліорганну недостатність [7, 12, 13]. На додачу внутрішньоклітинний набряк порушує низку біохімічних процесів, як-от метаболізм глюкози, скоротливість кардіоміоцитів, запальні реакції, ендогенну протимікробну активність плазми тощо [7].
За цих умов основою патогенетичного лікування є внутрішньовенна інфузійна терапія. У настановах здебільшого акцентується увага на етіотропному лікуванні пневмонії, тоді як питання патогенетичної терапії висвітлені лише концептуально. Зазначено, що інфузії слід поєднувати з ранньою респіраторною підтримкою та суворим моніторингом клініко-лабораторних показників – середнього артеріального тиску, центрального венозного тиску (ЦВТ) і сатурації центральної венозної крові в умовах ВІТ. За септичної гіпотензії рекомендовано нетривалу початкову рідинну ресусцитацію з переважним застосуванням збалансованих кристалоїдних розчинів і раннє призначення низьких або середніх доз вазопресорів – адреналін початковою дозою 0,2-0,5 мкг/кг/хв, у разі серцевої недостатності – норадреналін або добутамін [14]. Цей принцип, відомий як «рання цілеспрямована терапія» (early goal-directed therapy, EGDT), було запроваджено в клінічну практику ще 2001 р. після того, як E. Rivers і співавт. продемонстрували, що оптимізація гемодинаміки в пацієнтів із септичним шоком (серед них 39% із пневмонією) зменшує лікарняну смертність на 16% [15].
Як критерії ініціації EGDT запропоновано такі:
1) неможливість утримання середнього артеріального тиску ≥65 мм рт. ст. без вазопресорів;
2) рівень лактату в сироватці крові ≥2 ммоль/л (18 мг/дл) за відсутності гіповолемії;
3) ≥2 балів за шкалою quick SOFA, тобто наявність щонайменше двох із таких ознак: частота дихання ≥22 р/хв, систолічний артеріальний тиск ≤100 мм рт. ст., порушення свідомості на рівні ≤14 балів за шкалою коми Глазго [16].
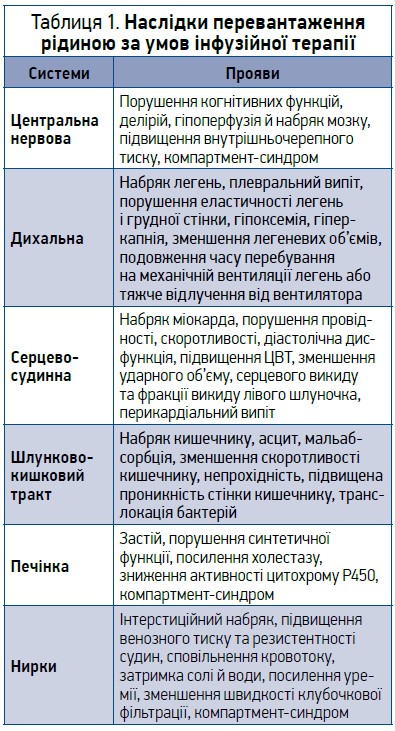 Після стабілізації гемодинамічних показників (тобто досягнення рівня середнього артеріального тиску в межах від 65 до 90 мм рт. ст.) або за відсутності шоку рекомендовано застосовувати рестриктивний тип інфузійної терапії [14], адже надмірний об’єм інфузії може посилити набряк легень і гіпоксемію, асоціюється з подовженням часу перебування у ВІТ або на механічній вентиляції легень і значно вищим ризиком смерті [17-19]. Доведено також, що об’єм внутрішньовенних рідин, які вводяться шляхом інфузії, незалежно пов’язаний зі ступенем деградації глікокаліксу, що вказує на можливість ятрогенного ушкодження ендотелію за неправильної стратегії інфузійної терапії [10]. Дослідники висловлюють гіпотезу, що рідина, котра вводиться внутрішньовенно, здатна спричинити пряме ушкодження та злущування ендотелію (незалежно від балансу рідини) [10]. За наявності медіаторів запалення раптове розтягнення судин від рідинних болюсів стимулює ендотеліальну експресію металопротеїназ і сприяє активації катепсину L та ендотеліальної гепаранази, котрі зумовлюють злущування глікокаліксу. Введення ізотонічних розчинів сприяє активації циркулювальних лейкоцитів і виділенню ними еластази, що також може ушкоджувати глікокалікс [10]. Окрім того, перевантаження рідиною спричиняє внутрішньочеревну гіпертензію з явищами стискання внутрішніх органів, що зумовлює їхню дисфункцію [18, 20], а також сповільнює відновлення функції нирок або збільшує ризик їхнього гострого ушкодження [21-23]. Усі негативні впливи наведено в таблиці 1 [7, 12, 13].
Після стабілізації гемодинамічних показників (тобто досягнення рівня середнього артеріального тиску в межах від 65 до 90 мм рт. ст.) або за відсутності шоку рекомендовано застосовувати рестриктивний тип інфузійної терапії [14], адже надмірний об’єм інфузії може посилити набряк легень і гіпоксемію, асоціюється з подовженням часу перебування у ВІТ або на механічній вентиляції легень і значно вищим ризиком смерті [17-19]. Доведено також, що об’єм внутрішньовенних рідин, які вводяться шляхом інфузії, незалежно пов’язаний зі ступенем деградації глікокаліксу, що вказує на можливість ятрогенного ушкодження ендотелію за неправильної стратегії інфузійної терапії [10]. Дослідники висловлюють гіпотезу, що рідина, котра вводиться внутрішньовенно, здатна спричинити пряме ушкодження та злущування ендотелію (незалежно від балансу рідини) [10]. За наявності медіаторів запалення раптове розтягнення судин від рідинних болюсів стимулює ендотеліальну експресію металопротеїназ і сприяє активації катепсину L та ендотеліальної гепаранази, котрі зумовлюють злущування глікокаліксу. Введення ізотонічних розчинів сприяє активації циркулювальних лейкоцитів і виділенню ними еластази, що також може ушкоджувати глікокалікс [10]. Окрім того, перевантаження рідиною спричиняє внутрішньочеревну гіпертензію з явищами стискання внутрішніх органів, що зумовлює їхню дисфункцію [18, 20], а також сповільнює відновлення функції нирок або збільшує ризик їхнього гострого ушкодження [21-23]. Усі негативні впливи наведено в таблиці 1 [7, 12, 13].
Як клініцистам балансувати між користю та шкодою? Як обрати адекватний інфузійний розчин? Яка доказовість стратегії та тактики інфузійної терапії в пацієнтів із тяжким перебігом пневмонії? Ці запитання аргументують доцільність нашого дослідження, що мало на меті з’ясувати доказовість щодо інфузійної терапії за тяжкої пневмонії.
Матеріали та методи
Проведено електронний пошук у базах даних PubMed, MEDLINE та Cochrane Library за останні 20 років, використовуючи чутливу стратегію без мовних обмежень за такими ключовими словами: «пневмонія», «сепсис», «септичний шок», «гострий респіраторний дистрес-синдром», «гіпоксемія», «смертність», «рання цілеспрямована терапія», «рідинна терапія», «рідинна ресусцитація», «рестриктивний тип інфузійної терапії», «вибір інфузійного розчину», «рандомізоване контрольоване дослідження», «огляд», «метааналіз». Для даних щодо сепсису, септичного шоку та гострого респіраторного дистрес-синдрому з’ясовувалася частка пацієнтів із пневмонією та включалися лише ті дослідження, де не менше ⅓ пацієнтів мали пневмонію.
Проведено також огляд результатів нещодавно завершеного міжнародного багатоцентрового відкритого із засліпленою оцінкою кінцевих точок ефективності рандомізованого контрольованого дослідження (РКД) III-IV фази RheoSTAT на підставі звіту, наданого компанією «Юрія-Фарм».
Дослідження тривало з 01.09.2017 до 28.02.2020, здійснювалося контрактною дослідницькою організацією відповідно до принципів Належної клінічної практики (ICH GCP), етичних норм Гельсінкської декларації Всесвітньої медичної асоціації та національних стандартів і внесене до Кокранівської бібліотеки [24] – однієї з найавторитетніших електронних баз даних із доказової медицини, що вказує на високий рівень доказовості.
Загалом РКД RheoSTAT включало 628 пацієнтів із сепсисом, перитонітом, опіковою хворобою та пневмонією, котрі лікувалися в 44 клінічних центрах 7 країн. У субдослідженні RheoSTAT-CP0698 брали участь 150 пацієнтів із 12 клінічних центрів 6 країн – України, Молдови, Грузії, Узбекистану, Казахстану та В’єтнаму.
Обов’язкові критерії включення до субдослідження RheoSTAT-CP0698 – вік 18-60 років, підтверджений діагноз негоспітальної пневмонії з класом ризику ІV або вище за індексом PSI/PORT за умови, що період від початку антибактеріальної терапії не перевищував 48 год; підписана пацієнтом інформована згода на участь у дослідженні; початкова оцінка за шкалою SOFA ≥2 балів; рівень рН крові <7,45, рівень калію крові <5,1 ммоль/л і рівень натрію крові <145 ммоль/л.
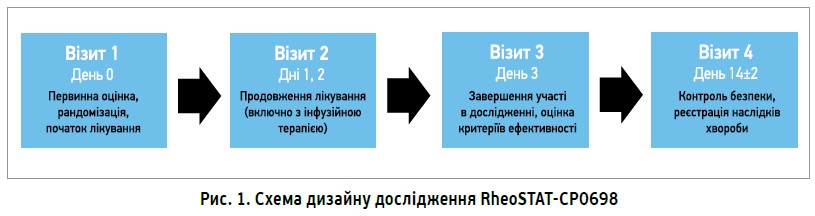
Середній вік учасників дослідження становив 41,3 року (62% – чоловіки), серед них 33% мали супутні хвороби (12% – артеріальну гіпертензію, 21% – інші). Пацієнти були рандомізовані в основну групу (n=78) та групу контролю (n=72). Учасники основної групи впродовж 3 днів отримували інфузійний розчин Реосорбілакт® шляхом внутрішньовенної інфузії дозою 200-400 мл/добу. На 3-й день у них оцінювали критерії ефективності, а через 14±2 дні контролювали безпеку та наслідки хвороби (рис. 1).
Варто відзначити ретельну й об’єктивну оцінку ефективності та безпеки досліджуваного препарату, котра здійснювалася на підставі численних оцінювальних шкал і клініко-лабораторних показників, зазначених у таблиці 2.
Результати й обговорення
 Існують два основні класи інфузійних засобів – колоїди та кристалоїди. До колоїдів належать альбумін, гідроксиетилкрохмаль і желатин. Завдяки онкотичній активності колоїди теоретично мали би сповільнювати капілярний витік. Однак у пацієнтів із тяжкою інфекцією цей ефект доволі нетривалий через ушкодження глікокаліксу [8, 13]. Порівняно з кристалоїдами колоїди мають дещо довший період напіввиведення з внутрішньосудинного простору, хоча капілярний витік впливає на обидва класи [25]. Інші гіпотетичні переваги колоїдів включають протизапальний ефект і здатність до поглинання оксиду азоту, але це стосується тільки альбуміну [26]. На сьогодні немає жодного великого РКД, яке доводило би чітку різницю в смертності між інфузійною терапією за допомогою кристалоїдів або колоїдів у разі пневмонії чи сепсису. Доволі великим було РКД SAFE, яке включало критично хворих дорослих і порівнювало 0,9% розчин хлориду натрію й альбумін як засоби рідинної ресусцитації. Незважаючи на відсутність значущої різниці у 28-денній смертності в загальній групі, спостерігалися кращі результати при використанні альбуміну в пацієнтів із тяжким сепсисом і гострим респіраторним дистрес-синдромом, але гірші – в пацієнтів із тяжким травматичним ураженням мозку [27, 28]. Розчини гідроксиетилкрохмалю пов’язують із гострим ушкодженням нирок у критично хворих осіб, у зв’язку з чим їх визнано небезпечними в США та Європі [29, 30]. В останніх міжнародних настановах щодо ведення сепсису не рекомендують використовувати колоїди як початковий розчин для рідинної ресусцитації через відсутність переваг і надмірні витрати [31].
Існують два основні класи інфузійних засобів – колоїди та кристалоїди. До колоїдів належать альбумін, гідроксиетилкрохмаль і желатин. Завдяки онкотичній активності колоїди теоретично мали би сповільнювати капілярний витік. Однак у пацієнтів із тяжкою інфекцією цей ефект доволі нетривалий через ушкодження глікокаліксу [8, 13]. Порівняно з кристалоїдами колоїди мають дещо довший період напіввиведення з внутрішньосудинного простору, хоча капілярний витік впливає на обидва класи [25]. Інші гіпотетичні переваги колоїдів включають протизапальний ефект і здатність до поглинання оксиду азоту, але це стосується тільки альбуміну [26]. На сьогодні немає жодного великого РКД, яке доводило би чітку різницю в смертності між інфузійною терапією за допомогою кристалоїдів або колоїдів у разі пневмонії чи сепсису. Доволі великим було РКД SAFE, яке включало критично хворих дорослих і порівнювало 0,9% розчин хлориду натрію й альбумін як засоби рідинної ресусцитації. Незважаючи на відсутність значущої різниці у 28-денній смертності в загальній групі, спостерігалися кращі результати при використанні альбуміну в пацієнтів із тяжким сепсисом і гострим респіраторним дистрес-синдромом, але гірші – в пацієнтів із тяжким травматичним ураженням мозку [27, 28]. Розчини гідроксиетилкрохмалю пов’язують із гострим ушкодженням нирок у критично хворих осіб, у зв’язку з чим їх визнано небезпечними в США та Європі [29, 30]. В останніх міжнародних настановах щодо ведення сепсису не рекомендують використовувати колоїди як початковий розчин для рідинної ресусцитації через відсутність переваг і надмірні витрати [31].
Серед кристалоїдів можна виокремити небуферні розчини (ізотонічний розчин натрію хлориду) та буферні мультиелектролітні розчини, що різняться за своїм складом, концентрацією хлоридів, рН та осмолярністю, але більш наближені до плазми, ніж ізотонічний розчин хлориду натрію. Ресусцитація із застосуванням 0,9% розчину хлориду натрію пов’язана з виникненням гіперхлоремічного метаболічного ацидозу, гострого ушкодження нирок і небезпечних функціональних порушень із боку життєво важливих органів [32-35]. Незважаючи на це, ізотонічний розчин хлориду натрію на сьогодні залишається найуживанішим кристалоїдним розчином [36], який також найчастіше використовують як розчинник для внутрішньовенного введення різних лікарських засобів [33]. Два нещодавні РКД SALT-ED і SMART вказують на явні переваги збалансованих буферних розчинів над ізотонічним розчином натрію хлориду. Хоча різниці в короткотривалій смертності не було, введення 0,9% розчину хлориду натрію асоціювалося з вищим ризиком гострого ушкодження нирок, включно зі смертю, потребою в діалізі чи тривалим порушенням функції нирок [34, 35].
На особливу увагу заслуговують інфузійні розчини, що містять багатоатомні спирти, насамперед сорбітол, який має низку переваг:
1) завдяки повільнішому перетворенню на моносахариди утилізується краще, ніж глюкоза, й не спричиняє вуглеводного перевантаження;
2) після введення швидко включається в загальний метаболізм (80% утилізується печінкою, 5% відкладається в тканинах мозку, міокарді та скелетних м’язах, решта виділяється із сечею чи використовується для невідкладних енергетичних потреб);
3) усуває зумовлений ацетилхоліном спазм кишечнику, стимулює перистальтику без різкого її посилення, що обґрунтовує його використання в післяопераційному періоді;
4) в гіпертонічній концентрації має значну протинабрякову дію, зокрема сприяє зворотному розвитку набряку легень, характеризується осмотичним діуретичним ефектом, що важливо за олігоанурії та гострого ушкодження нирок;
5) завдяки потужній холецистокінетичній і холеретичній дії сприяє відновленню нормальної функції травної системи, має доведений терапевтичний ефект у разі гострих і хронічних гепатитів, а також токсичних уражень печінки;
6) в ізотонічній концентрації діє як дезагрегант, покращуючи мікроциркуляцію та перфузію тканин.
Серед сорбітоловмісних засобів варто виокремити комплексний інфузійний препарат поліфункціональної дії Реосорбілакт® виробництва компанії «Юрія-Фарм» (Україна). Крім сорбітолу він містить інші важливі електроліти – калій, кальцій і магній, але вміст хлоридів у ньому лише 112,7 ммоль/л, що зменшує ризик гіперхлоремічного ацидозу. Іншим важливим компонентом Реосорбілакту є натрію лактат, який забезпечує олужнювальний вплив, підвищує резервну й титровану лужність крові, корегує метаболічний ацидоз, який часто ускладнює тяжкі інфекції, сепсис, перитоніт, кишкову непрохідність, ниркову недостатність, опіки, шок, хронічну гіпоксію тощо; позитивно впливає на роботу серця, регенерацію та дихальну функцію крові, стимулює функції системи мононуклеарних фагоцитів, має дезінтоксикаційну дію, посилює діурез, покращує роботу нирок і печінки. Концентрація натрію лактату в Реосорбілакті в 5-6 разів вища (160-180 ммоль/л), ніж у більшості інфузійних розчинів, що забезпечує потужний лікувальний ефект.
Наявність у складі Реосорбілакту двох середників із синергічною дезінтоксикаційною дією та здатністю корекції кислотно-лужного й водно-електролітного балансу ставить цей препарат в один ряд із найпотужнішими дезінтоксикаційними засобами [37]. Успішний досвід застосування Реосорбілакту для дезінтоксикації та нормалізації реології крові в пацієнтів із такими тяжкими гнійно-запальними хворобами, як перитоніт [38], деструктивний панкреатит [39], синдром діабетичної стопи [40], дає змогу припускати покращення клінічних наслідків у разі пневмонії. На додачу в одному з клінічних досліджень установлено, що введення Реосорбілакту хворим на пневмонію сприяє ранній нормалізації температури тіла, зникненню проявів астеновегетативного синдрому та скороченню середньої тривалості госпіталізації, стабілізації кислотно-основного стану й показників коагулограми [41].
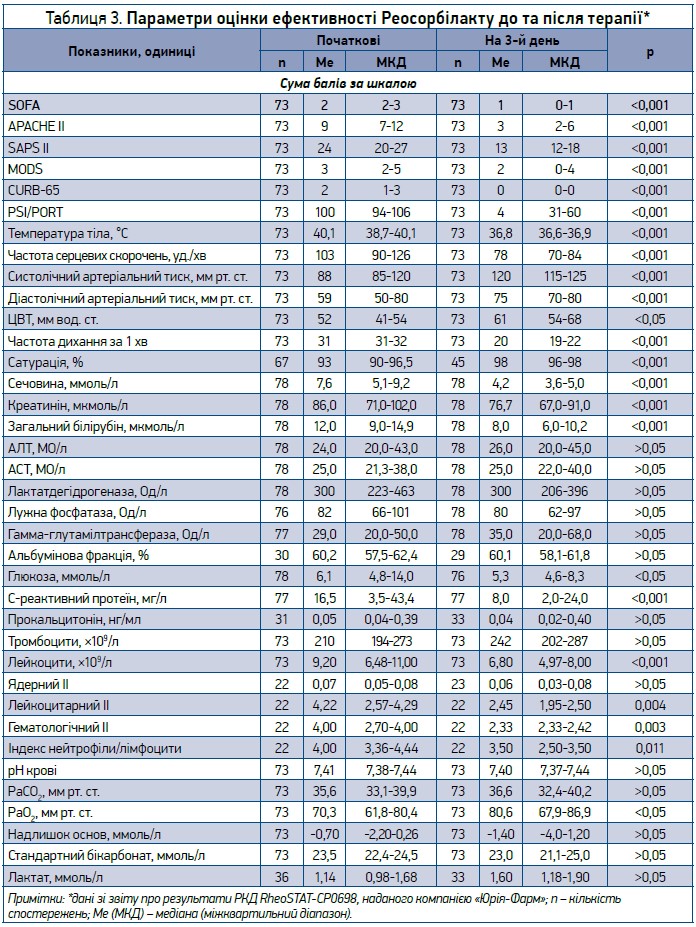
Крім того, Реосорбілакт® пройшов випробування в РКД RheoSTAT-CP0698, що забезпечує високий рівень доказовості саме в пацієнтів із пневмонією. За результатами дослідження, введення Реосорбілакту шляхом внутрішньовенної інфузії дозою 200-400 мл/добу ефективно покращує загальний стан, зменшує прояви (полі-) органної недостатності й ендогенної інтоксикації за більшістю аналізованих показників. Уже на 3-й день терапії в більшості пацієнтів спостерігалася нормалізація температури тіла, частоти дихання, показників сатурації та газового складу крові, функції нирок, що суттєво покращувало оцінку за всіма шкалами оцінки тяжкості пневмонії та критичних станів, які використовувалися в дослідженні (табл. 3).
Малооб’ємна інфузійна терапія розчином Реосорбілакт забезпечує збільшення об’єму циркулювальної крові, на що вказують істотне підвищення ЦВТ і стабілізація показників артеріального тиску й частоти серцевих скорочень. З іншого боку, після 3-денного курсу інфузій показники ЦВТ не підвищилися до критично високих рівнів, які, згідно з даними досліджень, асоціюються з несприятливим прогнозом і вищим ризиком смерті [42]. Такий режим терапії дає змогу зменшити загальний обсяг інфузії, необхідної для досягнення терапевтичного ефекту без ризику гіпергідратації та перевантаження рідиною, що особливо важливо в пацієнтів старшого віку з коморбідністю чи при критичних станах, які мають особливо несприятливий прогноз у разі пневмонії [1, 7, 12, 13].
Введення Реосорбілакту в комплексній терапії сприяло істотному зниженню рівня лейкоцитів, лейкоцитарного та гематологічного ІІ й нормалізації співвідношення нейтрофіли/лімфоцити, що вказує на здатність зменшувати прояви ендогенної інтоксикації на тлі інфекції. Спостерігалися також істотне зменшення С-реактивного протеїну та певне покращення показників кислотно-лужної рівноваги.
Що стосується профілю безпеки, то в основній групі загалом зареєстровано 296 НЯ в 43,6% пацієнтів, що статистично не відрізнялося від групи контролю (304 НЯ в 50,0% пацієнтів). Більшість відхилень не мали клінічної значимості, серйозних небажаних ефектів у дослідженні не зареєстровано. Нових сигналів щодо безпеки досліджуваного препарату не одержано. Відповідно до результатів аналізу препарат Реосорбілакт® має сприятливий профіль безпеки.
Екзогенний лактат у складі розчину Реосорбілакт не впливає на рівень ендогенного лактату, підвищення котрого асоціюється з несприятливим прогнозом у разі сепсису та пневмонії [16, 43]. Це доводить безпечність застосування розчину в пацієнтів із пневмонією.
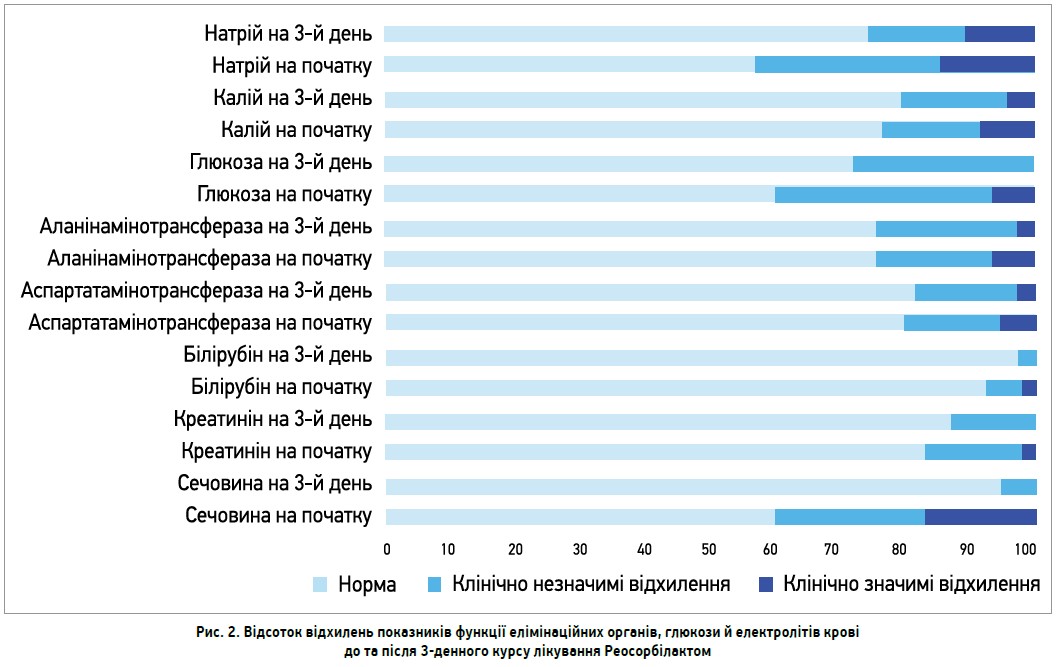
Потрібно зауважити, що вже на 3-й день терапії в учасників основної групи виявлено зменшення відсотка відхилень лабораторних показників функції елімінаційних органів, рівнів глюкози й електролітів крові, в т. ч. клінічно значимих (рис. 2).
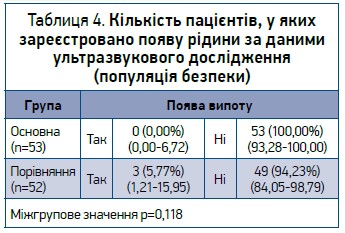
У пацієнтів основної групи не виявлено жодного випадку набряку легень або появи плеврального випоту після проведення інфузійної терапії (табл. 4).
Наявна на сьогодні доказова база та сучасні настанови віддають перевагу збалансованим кристалоїдним інфузійним розчинам як патогенетичній терапії тяжкої пневмонії та сепсису. Склад Реосорбілакту забезпечує суттєві переваги в пацієнтів із тяжкими інфекціями, в т. ч. інфекціями дихальних шляхів. Як свідчать результати відкритого із засліпленою оцінкою РКД RheoSTAT-CP0698, уведення пацієнтам із пневмонією Реосорбілакту шляхом внутрішньовенної інфузії дозою 200-400 мл/добу впродовж 3 днів значно покращує клінічний стан, зменшує прояви (полі-) органної недостатності й ендогенної інтоксикації. Малооб’ємна інфузійна терапія сприяє швидкій нормалізації об’єму циркулювальної крові, стабілізації показників гемодинаміки, кислотно-лужного, електролітного й газового складу крові, суттєво покращує сатурацію та зменшує тахіпное. Встановлено позитивний вплив терапії на показники функції нирок і прояви запалення. Введення препарату в такому режимі має сприятливий профіль безпеки: не спричиняє перевантаження рідиною, набряку легень, плеврального випоту чи інших серйозних небажаних ефектів, а також не зумовлює клінічно значимого підвищення ендогенного лактату крові. Дослідження RheoSTAT-CP0698 обґрунтовує доцільність застосування препарату Реосорбілакт® у комплексній терапії пневмонії.
Література
1. GBD2016 Lower Respiratory Infections Collaborators. Estimates of the global, regional, and national morbidity, mortality, and aetiologies of lower respiratory infections in 195 countries, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Infect. Dis. 2018 Nov; 18 (11): 1191-1210. doi: 10.1016/S1473-3099(18)30310-4.
2. Chalmers J., Campling J., Ellsbury G., Hawkey P., Madhava H., Slack M. Community-acquired pneumonia in the United Kingdom: a call to action. Pneumonia (Nathan). 2017 Oct 5; 9: 15.
3. Phua J., Dean N. C., Guo Q., Kuan W. S., Lim H. F., Lim T. K. Severe community-acquired pneumonia: timely management measures in the first 24 hours. Crit. Care. 2016; 20 (1): 237. Published 2016 Aug 28. doi: 10.1186/s13054-016-1414-2.
4. Angus D. C., Linde-Zwirble W.T., Lidicker J., Clermont G., Carcillo J., Pinsky M. R. Epidemiology of severe sepsis in the United States: analysis of incidence, outcome, and associated costs of care. Crit. Care Med. 2001; 29: 1303-1310. doi: 10.1097/00003246-200107000-00002.
5. Montull B., Menendez R., Torres A., Reyes S., Mendez R., Zalacain R. et al. Predictors of severe sepsis among patients hospitalized for community-acquired pneumonia. PLoS One. 2016; 11: e0145929. doi: 10.1371/journal.pone.0145929.
6. Woodcock T. E., Woodcock T. M. Revised Starling equation and the glycocalyx model of transvascular fluid exchange: an improved paradigm for prescribing intravenous fluid therapy. Br. J. Anaesth. 2012; 108 (3): 384-394.
7. Chang R., Holcomb J. Choice of fluid therapy in the initial management of sepsis, severe sepsis, and septic shock. Shock. 2016 Jul; 46 (1): 17-26. doi: 10.1097/SHK.0000000000000577.
8. Best M. W., Jabaley C. S. Fluid management in septic shock: a review of physiology, goal-directed therapy, fluid dose, and selection. Curr. Anesthesiol. Rep. 2019; 9: 151-157. https://doi.org/10.1007/s40140-019-00330-3.
9. Liang Y., Li X., Zhang X., Li Z., Wang L., Sun Y., Liu Z., Ma X. Elevated levels of plasma TNF-α are associated with microvascular endothelial dysfunction in patients with sepsis through activating the NF-κB and p38 mitogen-activated protein kinase in endothelial cells. Shock. 2014; 41 (4): 275-281.
10. Hippensteel J. A., Uchimido R., Tyler P. D., Burke R. C., Han X., Zhang F. et al. Intravenous fluid resuscitation is associated with septic endothelial glycocalyx degradation. Crit. Care. 2019; 23 (259). https://doi.org/10.1186/s13054-019-2534-2.
11. Nieuwdorp M., Mooij H. L., Kroon J., Atasever B., Spaan J. A., Ince C., Holleman F., Diamant M., Heine R. J., Hoekstra J. B. et al. Endothelial glycocalyx damage coincides with microalbuminuria in type 1 diabetes. Diabetes. 2006; 55 (4): 1127-1132.
12. Malbrain M. L.N.G., Van Regenmortel N., Saugel B., De Tavernier B., Van Gaal P. J., Joannes-Boyau O., Teboul J. L., Rice T. W., Mythen M., Monnet X. Principles of fluid management and stewardship in septic shock: it is time to consider the four D’s and the four phases of fluid therapy. Ann. Intensive Care. 2018 May 22; 8 (1): 66. doi: 10.1186/s13613-018-0402-x.
13. Marik P., Bellomo R. A rational approach to fluid therapy in sepsis. Br. J. Anaesth. 2016; 116 (3): 339.
14. Адаптована клінічна настанова, заснована на доказах. Негоспітальна пневмонія у дорослих осіб: етіологія, патогенез, класифікація, діагностика, антимікробна терапія та профілактика. Укладачі: Фещенко Ю. І., Белослудцева К. О., Голубовська О.А та ін. – К.: НАМН України, 2019.– 94 с.
15. Rivers E., Nguyen B., Havstad S., Ressler J., Muzzin A., Knoblich B. et al. Early goal-directed therapy in the treatment of severe sepsis and septic shock. N. Engl. J. Med. 2001; 345: 1368-1377. doi: 10.1056/NEJMoa010307.
16. Singer M., Deutschman C. S., Seymour C. W., Shankar-Hari M., Annane D., Bauer M. et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis‑3). JAMA. 2016; 315: 801-10.
17. Koonrangsesomboon W., Khwannimit B. Impact of positive fluid balance on mortality and length of stay in septic shock patients. Indian J. Crit. Care Med. 2015 Dec; 19 (12): 708-13.
18. Cordemans C., De Laet I., Van Regenmortel N., Schoonheydt K., Dits H., Huber W. et al. Fluid management in critically ill patients: the role of extravascular lung water, abdominal hypertension, capillary leak, and fluid balance. Ann. Intensive Care. 2012; 2: S1.
19. National Heart, Lung, and Blood Institute Acute Respiratory Distress Syndrome (ARDS) Clinical Trials Network. Wiedemann H. P., Wheeler A. P., Bernard G. R. et al. Comparison of two fluid-management strategies in acute lung injury. N. Engl. J. Med. 2006; 354: 2564-75.
20. Malbrain M. L., Marik P. E., Witters I., Cordemans C., Kirkpatrick A. W., Roberts D. J. et al. Fluid overload, de-resuscitation, and outcomes in critically ill or injured patients: a systematic review with suggestions for clinical practice. Anaesthesiol. Intensive Ther. 2014; 46: 361-80.
21. Heung M., Wolfgram D. F., Kommareddi M., Hu Y., Song P. X., Ojo A. O. Fluid overload at initiation of renal replacement therapy is associated with lack of renal recovery in patients with acute kidney injury. Nephrol. Dial Transplant. 2012; 27: 956-61.
22. Bouchard J., Soroko S. B., Chertow G. M., Himmelfarb J., Ikizler T. A., Paganini E. P. et al. Fluid accumulation, survival and recovery of kidney function in critically ill patients with acute kidney injury. Kidney Int. 2009; 76: 422-7.
23. Stein A., de Souza L. V., Belettini C. R., Menegazzo W. R., Viégas J. R., Costa Pereira E. M. et al. Fluid overload and changes in serum creatinine after cardiac surgery: predictors of mortality and longer intensive care stay. A prospective cohort study. Crit. Care. 2012; 16: R99.
24. Efficacy and Safety of Rheosorbilact® Solution for Infusion, in a Complex Therapy of Pneumonia. NCT03824457. Cochrane Central Register of Controlled Trials (CENTRAL). 2019. Issue 3. Available at: https://clinicaltrials.gov/show/NCT03824457.
25. Hahn R. G., Lyons G. The half-life of infusion fluids: an educational review. Eur. J. Anaesthesiol. 2016; 33 (7): 475-82.
26. Caironi P., Tognoni G., Masson S., Fumagalli R., Pesenti A., Romero M. et al. Albumin replacement in patients with severe sepsis or septic shock. N. Engl. J. Med. 2014; 370 (15): 1412-21.
27. Finfer S., Bellomo R., Boyce N., French J., Myburgh J., Norton R. et al. A comparison of albumin and saline for fluid resuscitation in the intensive care unit. N. Engl. J. Med. 2004; 350 (22): 2247-56.
28. SAFE Study Investigators; Australian and New Zealand Intensive Care Society Clinical Trials Group; Australian Red Cross Blood Service; George Institute for International Health, Myburgh J., Cooper D., Finfer S., Bellomo R., Norton R., Bishop N., Kai Lo S., Vallance S. Saline or albumin for fluid resuscitation in patients with traumatic brain injury. N. Engl. J. Med. 2007 Aug 30; 357 (9): 874-84. doi: 10.1056/NEJMoa067514.
29. Myburgh J. A., Finfer S., Bellomo R., Billot L., Cass A., Gattas D. et al. Hydroxyethyl starch or saline for fluid resuscitation in intensive care. N. Engl. J. Med. 2012; 367 (20): 1901-11.
30. Perner A., Haase N., Guttormsen A. B., Tenhunen J., Klemenzson G., Åneman A. et al. Hydroxyethyl starch 130/0.42 versus Ringer’s acetate in severe sepsis. N. Engl. J. Med. 2012; 367 (2): 124-34.
31. Rhodes A., Evans L. E., Alhazzani W., Levy M. M., Antonelli M., Ferrer R. et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock: 2016. Crit. Care Med. 2017; 45 (3): 486-552.
32. MacDonald N., Pearse R. Are we close to the ideal intravenous fluid? Br. J. Anaesth. 2017; 119 (suppl. 1): i63-71.
33. Magee C. A., Bastin M. L.T., Laine M. E., Bissell B. D., Howington G. T., Moran P. R. et al. Insidious harm of medication diluents as a contributor to cumulative volume and hyperchloremia: a prospective, open-label, sequential period pilot study. Crit. Care Med. 2018; 46 (8): 1217-23.
34. Self W. H., Semler M. W., Wanderer J. P., Wang L., Byrne D. W., Collins S. P. et al. Balanced crystalloids versus saline in noncritically ill adults. N. Engl. J. Med. 2018; 378 (9): 819-28.
35. Semler M. W., Self W. H., Wanderer J. P., Ehrenfeld J. M., Wang L., Byrne D. W. et al. Balanced crystalloids versus saline in critically ill adults. N. Engl. J. Med. 2018; 378 (9): 829-39.
36. Dalton C. Why did sterile salt water become the IV fluid of choice? NPR. 2018. Available at: https://www.npr.org/sections/health-shots/2018/03/31/597666140/why-did-sterile-salt-water-become-the-iv-fluid-of-choice. accessed 2/4/2018.
37. Кондрацкий Б., Новак В. Опыт применения в клинической практике комплексного инфузионного препарата Реосорбилакта. Мистецтво лiкування. 2006; № 1: с. 34-36.
38. Хамидов Д. Б., Косимов З. К., Хомидов Д. Д., Киямов С. Э. Комплексный полифункциональный раствор Реосорбилакт в интенсивной терапии эндогенной интоксикации у больных острым перитонитом. Научно-практический журнал ТИППМК. 2011; № 2: с. 77-79.
39. Алиев Н. А., Бобиев А. Б., Хамидов Д. Б., Баротов Э. Д., Буриев Т. Н., Курбанов Д. А. и др. Реосорбилакт и Латрен в коррекции эндогенной интоксикации и оксидантного стресса у больных острым деструктивным панкреатитом. Медицина неотложных состояний. 2015; том 64, № 1: с. 57-59.
40. Проничев В., Стяжкина С., Михайлов А. Эффективность лечения Реосорбилактом пациентов с синдромом диабетической стопы. Здоровье, демография, экология финно-угорских народов. 2016; № 2: с. 30-32.
41. Рижко О. О. Інфузійна терапія Реосорбілактом. Укр. пульмонологічний журнал. 2002; № 1: с. 94-96.
42. Semler M. W., Wheeler A. P., Thompson B. T. et al. Impact of initial central venous pressure on outcomes of conservative versus liberal fluid management in acute respiratory distress syndrome. Crit. Care Med. 2016; 44 (4): 782-789.
43. Demirel B. Lactate levels and pneumonia severity index are good predictors of in-hospital mortality in pneumonia. Clin. Respir. J. 2018 Mar; 12 (3): 991-995.