6 квітня, 2023
Нотатки ревматолога-практика
За матеріалами Науково-практичної конференції «Різдвяна зустріч професіоналів», 22 грудня 2022 року
На щорічному конгресі Американського коледжу ревматології (АСR) зазвичай фахівці діляться своїми практичними секретами та «перлинами». Але чи є актуальною в епоху рандомізованих клінічних досліджень (РКД) така інформація? Так, особливо коли бракує відповідних РКД, або наявні не відповідають на конкретне запитання. Водночас таку інформацію слід критично оцінювати й переглядати, а також остерігатися «чорних перлин». Лікарка-ревматологиня КНП Харківської обласної ради «Обласна клінічна лікарня», експертка з ревматології ДОЗ ХОДА, к.мед.н., доцентка Світлана Анатоліївна Трипілка розглянула деякі дискусійні питання сучасної ревматологічної допомоги та поділилася цікавими клінічними випадками з власної практики.
Ревматологічна допомога і лабораторні показники
Американський коледж ревматології (ACR) 2015 р. мав на меті спрогнозувати попит і пропозицію на клінічну ревматологічну допомогу на 2015‑2030 рр. Як передбачається, до 2025 р. бракуватиме 3269 ревматологів. Нині чимало пацієнтів, які перебувають за кордоном, звертаються по онлайн-допомогу, оскільки мають труднощі із записом на консультацію до лікаря-ревматолога. Серед головних причин такої ситуації, як вважає професійна спільнота, є великий попит на лабораторні дослідження за власною ініціативою пацієнтів. Тому часто до ревматолога звертаються пацієнти без клінічних ознак захворювання, але з відхиленнями лабораторних показників.
Визначення антинуклеарних антитіл (АНА) – простий тест першої лінії, що має високу чутливість і може допомогти діагностувати різні автоімунні захворювання. З іншого боку, якщо його замовити в неналежний спосіб, це може призвести до плутанини й непотрібного занепокоєння як пацієнтів, так і постачальників послуг. Отже, перш ніж виконувати аналіз на АНА, потрібно переконатися у високій імовірності автоімунного захворювання.
АНА може мати одночасно і позитивні, і негативні наслідки. Поширеність виявлення АНА останніми роками значно зросла, особливо серед підлітків. Завдяки Національній програмі перевірки здоров’я та харчування США (NHANES) було оцінено АНА у 13 519 учасників віком ≥12 років.
Як було встановлено, зростання частоти їх виявлення з 11% за 1988‑1991 рр. до 16% – 2011‑2012 рр. може свідчити про почастішання автоімунних захворювань у майбутньому. Така тенденція може бути пов’язана з тим, що за останні 30 років відбулися значні зміни в режимі харчування, способі життя, моделях поведінки та сну, взаємодії з електронними пристроями, структурі інфекційних захворювань, кліматі, а також із більшим рівнем стресу.
Доклінічний ревматоїдний артрит: лікувати чи ні?
Центральне питання так званих великих дебатів конгресу ACR (2022) полягало в тому, чи потрібно лікувати доклінічний ревматоїдний артрит (РА). Власне, як саме слід класифікувати доклінічний РА? Чи цей діагноз стосується осіб із позитивними антитілами до РА, чи осіб із позитивними антитілами і деяким болем у суглобах, але без запалення? Чи є достатньо даних, щоб призначати пацієнту, який перебуває у стані «передхвороби», наявні нині методи лікування з невеликим шансом, що в нього ніколи не розвинеться РА?
З іншого боку, своєчасне призначення лікування може запобігти прогресуванню хвороби в майбутньому.
Відповідно до проміжного аналізу дослідження StopRA застосування гідроксихлорохіну не запобігає майбутньому розвитку РА в популяції із вхідним високим рівнем антитіл до циклічного цитрулінованого пептиду (АЦЦП) та відсутністю запального артриту (Fleischer et al., 2022). Було досліджено 144 учасники з високими рівнями АЦЦП, РА розвинувся у 41 учасника. Отже, неможливо знати, у кого з осіб із високим рівнем АЦЦП стан прогресуватиме до клінічного РА, а в кого – ні.
Натомість результати рандомізованого подвійного сліпого контрольованого плацебо дослідження TREAT EARLIER свідчать на користь доцільності лікування ранньої артралгії, щоб повернути назад або обмежити загострення РА, яке насувається (Krijbolder et al., 2022).
Як зазначають дослідники, дорослі пацієнти віком від 18 років з артралгією, клінічно підозрюваною на прогресування РА, і субклінічним запаленням суглобів, виявленим за допомогою магнітно-резонансної томографії (МРТ), були у випадковий спосіб розподілені (1:1) на одне внутрішньом’язове введення ін’єкції глюкокортикоїдів (метилпреднізолон, 120 мг) та 1-річний курс перорального метотрексату (до 25 мг/тиждень) або плацебо (одна ін’єкція і таблетки протягом року). Спостереження тривало впродовж року після закінчення 1-річного курсу лікування. Первинною кінцевою точкою був розвиток клінічного артриту (відповідає критеріям класифікації РА 2010 р. або залучає два або більше суглобів), який тривав щонайменше 2 тижні. Фізичне функціонування, симптоми та продуктивність роботи, про які повідомляли пацієнти, були вторинними кінцевими точками, їх визначали що 4 місяці. Додатково вивчали перебіг запалення, виявленого на МРТ.
Через 2 роки частота первинної кінцевої точки була подібною між групами: 23 (19%) із 119 учасників у групі лікування проти 21 (18%) із 117 у групі плацебо. Фізичне функціонування упродовж перших 4 міс. поліпшилося більше в групі лікування і залишалося кращим, ніж у групі плацебо. Так само було продемонстровано стійке полегшення болю, ранкової скутості суглобів, запалення суглобів, виявленого за допомогою МРТ, у групі лікування проти групи плацебо. Кількість серйозних побічних явищ була однаковою в обох групах; небажані ефекти відповідали відомому профілю безпеки метотрексату. Тобто терапія метотрексатом, який є «наріжним каменем» лікування РА, розпочата на стадії передартритних симптомів і субклінічного запалення, не запобігла розвитку клінічного артриту, але змінила перебіг захворювання, а саме зменшила зі стійким ефектом ознаки запалення, виявленого за допомогою МРТ, а також поліпшила симптоми порівняно з плацебо.
Отже, протилежна експертна думка полягає в тому, що лікар має спробувати запобігти розвитку РА або хоча б полегшити його перебіг завдяки терапії автоімунних процесів, що йому передують. Терапія на стадії, коли ще немає запального артриту, може забезпечити такі переваги, як зменшення болю або втоми. Але загалом це питання лишається дискусійним і потребує персоніфікованого підходу.
Клінічний випадок
Біль за грудниною у молодих пацієнтів і псоріаз
Як розповіла пані Трипілка, 2022 р. по допомогу звернувся хлопець віком 20 років із болем за грудниною без зв’язку з фізичним навантаженням. Пляму на основній фаланзі великого пальця кисті пацієнт вважав ознакою алергії. Кардіоваскулярні чинники ризику відсутні, кардіоваскулярної патології на момент огляду не виявлено. Біль за грудниною в молодих може бути дебютом псоріатичного артриту (ПсА).
Тож насамперед слід з’ясувати, чи немає пацієнт проблем зі шкірою, і призначити дослідження швидкості осідання еритроцитів (ШОЕ), рівня С-реактивного білка (СРБ) та ревматоїдного фактора (РФ). Крім того, у пацієнта було виявлено псоріатичну бляшку в ділянці ахілового сухожилка, що попередньо пацієнт розцінив як наслідок носіння незручного взуття.
У низці випадків, як зазначила Світлана Анатоліївна, ентезит є першим симптомом захворювання, що клінічно виявляється у вигляді больових відчуттів, іноді набряку в точках ентезисів. Типова локалізація – місце прикріплення ахілового сухожилка та підошовного апоневрозу до п’ясткової кістки, крила клубової кістки, трохантера, а також остисті відростки тіл хребців. Але в деяких клінічних випадках запалення в ділянці груднинно-ключичного зчленування може симулювати серцевий напад.
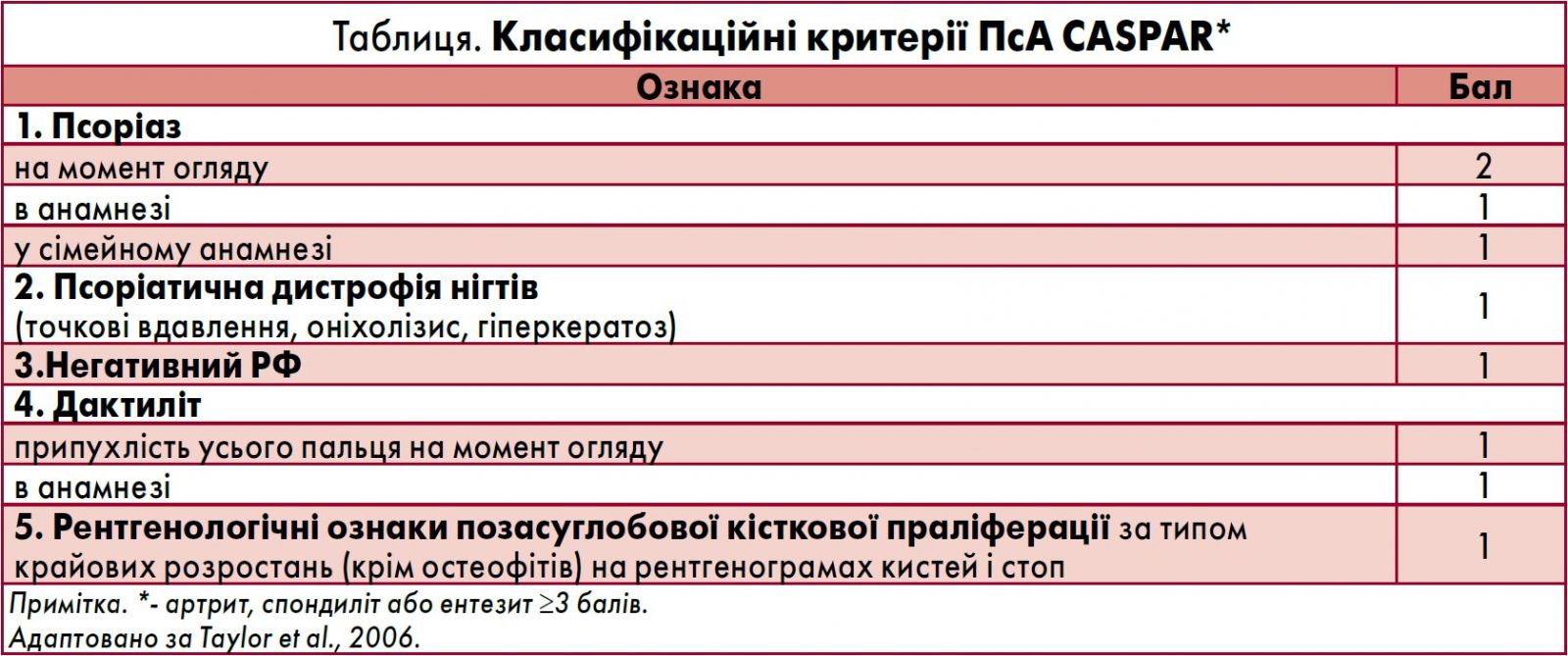
Застосування класифікаційних критеріїв ПсА за шкалою CASPAR (псоріаз на момент огляду – 2 бали і негативний РФ – 1 бал) допомогло встановити діагноз ПсА і розпочати лікування на першому етапі за допомогою нестероїдних протизапальних засобів (НПЗЗ) (табл.).
Пацієнту призначено препарат Диклоберл, що є збалансованим інгібітором циклоогсигенази (ЦОГ); йому притаманна більша ефективність, ніж у селективних інгібіторів ЦОГ‑2. За переносимістю він не поступається сучасним селективним інгібіторам ЦОГ‑2 і не чинить вплив на метаболізм хряща, отже, безпечний у разі тривалого застосування.
Диклоберл представлений у всіх лікарських формах та є єдиним із НПЗЗ, що довів високу гастроінтестинальну безпеку в комбінації з ацетилсаліциловою кислотою, що є додатковою перевагою для застосування у літніх пацієнтів. Діюча речовина препарату – диклофенак, максимально ефективно пригнічує синтез прозапальних простагландинів (PGE2). Лікування диклофенаком знижує рівень PGE2 на 93%, що значно (майже на 20%) ефективніше аналогічних показників як ЦОГ‑2-селективних (рофекоксибу, мелоксикаму), так і неселективних (ібупрофену, напроксену) препаратів.
Своєю чергою, максимально швидкий початок дії іншого ефективного НПЗЗ – Німесилу (німесулід), визначає його призначення в разі гострого больового синдрому (зокрема, під час подагричних нападів). Уже через 30 хв після перорального застосування досягається значна концентрація препарату в крові, яка становить ≥25% максимальної, а знеболювальну і протизапальну дію препарат повністю реалізує через 1‑3 год після приймання (Kress et al., 2016).
Німесил дуже швидко всмоктується в травному каналі, при цьому наявність їжі в шлунку не зменшує його абсорбцію. Метаболізується препарат з утворенням з’єднань, що виводяться через нирки і кишечник. Він має короткий період напіввиведення і вплив на ЦОГ‑1. Фармакологічний профіль препарату не залежить від віку пацієнта, його добре переносять пацієнти літнього віку. Крім того, Німесил має хондропротекторний вплив, а також антигістамінну й антиоксиданту активність.
Рівень активності ревматологічних захворювань
Нині оцінювання активності ревматологічних захворювань також є дуже актуальною проблемою. Якщо раніше таку активність поділяли на І, ІІ, ІІІ ступені на підставі тривалості ранкової скутості та рівнів лабораторних показників (ШОЕ, СРБ), то зараз – на низьку, середню, високу активність ревматологічних захворювань, яку визначають на підставі спеціальних індексів, притаманних для кожної хвороби, поєднуючи число болючих суглобів (ЧБС), число набряклих суглобів (ЧНС), оцінку болю за візуальною аналоговою шкалою (ВАШ) пацієнтом і лікарем, оцінку ранкової скутості тощо (DAS28, ASDAS, BASDAI, DAPSA).
При цьому варто користуватися спеціальними мобільними застосунками / калькуляторами на мобільних пристроях. Наприклад, ШОЕ 40 мм/год за ЧБС=0, ЧНС=0, ВАШ=1 свідчить про низьку активність захворювання за ASDAS – 1,97 або DAS28 –3,14. Натомість ШОЕ 4 мм/год за наявності ЧБС=14, ЧНС=10, ВАШ=10 відповідає високій активності захворювання за ASDAS – 1,97 або DAS28 –3,14.
Отже, не принижуючи значення лабораторних показників, не слід переоцінювати їхнє значення, оскільки тільке комплексне оцінювання, зокрема за допомогою сучасних індексів, є об’єктивним.
Хвороба Лайма може виникати не лише влітку
Як відомо, близько 50% пацієнтів із хворобою Лайма (ХЛ) не пам’ятають про укуси комах. Наприклад, пацієнт, що звернувся по допомогу з болем у колінному суглобі, навіть не звертав уваги на мігрувальну еритему. Частіше артрит Лайма виникає влітку, але може появлятися у будь-яку пору року. Своєю чергою, Лайм-бореліоз може виступати тригером автоімунних захворювань.
ХЛ (також відома як бореліоз Лайма) належить до зоонозних захворювань, збудником якого є грамнегативні бактерії Borrelia burgdorferi sensu lato родини Spirochaetaceae. Відрізнити ХЛ від інших системних розладів, які супроводжуються симптомами з боку опорно-рухового апарату, досить складно, а наявність антитіл до борелій у загальній популяції може скерувати до неправильного діагнозу. Крім того, тривалий вплив спірохет на імунну систему хазяїна може призвести до розвитку хронічного автоімунного захворювання de novo. Зокрема, повідомлялося про 35-річну жінку з поєднанням ХЛ і системного червоного вовчака (СЧВ). У цьому клінічному випадку ХЛ була найімовірнішим тригером розвитку СЧВ (Yehudina and Trypilka, 2021).
Висновки
Підсумовуючи, Світлана Анатоліївна зауважила, що своєчасне призначення лікування в разі доклінічного РА може запобігти прогресуванню захворювання у майбутньому. Завдяки лікуванню автоімунних процесів, які передують РА, варто спробувати запобігти або полегшити клінічний перебіг цього захворювання. Терапія на стадії, коли ще немає запального артриту, може забезпечити такі переваги, як зменшення болю або втоми. При цьому потрібен персоніфікований підхід.
Біль за грудниною у молодих може бути дебютом ПсА. На початкових етапах ревматологічних захворювань, зокрема ПсА, доцільним є застосування НПЗЗ. Лайм-бореліоз може виступати тригером автоімунних захворювань.
Як зазначила спікерка, оцінювання активності ревматологічної патології потребує комплексного підходу із застосуванням як лабораторних показників, так і специфічних індексів.
Підготувала Олександра Демецька